3. Kết quả
3.1. Tải lượng IHHNV trong các đoạn giun theo chiều dọc
Perinereis helleri được lựa chọn từ các luống PASF cung cấp nước thải từ các ao nuôi P. monodon được xác định là có nhiễm IHHNV tải lượng cao với tỷ lệ hiện mắc cao (Ao 1) hoặc nhiễm IHHNV tải lượng thấp với tỷ lệ hiện mắc tăng chậm hơn (Ao 2) đã được thử nghiệm để xác định xem có thể phát hiện DNA IHHNV hay không và nếu có, tính đồng nhất mà tải lượng được phân phối giữa các đầu gần, vùng giữa thân và chóp đuôi của sâu (Hình 2, Bảng 1). Nồng độ TNA được chiết xuất từ mỗi mẫu đã được chuẩn hóa và thử nghiệm bằng qPCR, ban đầu là các bản sao kỹ thuật 3×5 μL (dữ liệu không được hiển thị), và sau đó là một phản ứng 20 μL duy nhất để giúp cải thiện độ tin cậy và độ chính xác của dữ liệu (Bảng 1). Các giá trị CT được phát hiện bằng một trong hai phương pháp thử nghiệm thường có mối tương quan tốt khi xem xét rằng nhiều giá trị cao (phạm vi Ct 29.2–39.2) và đạt đến giới hạn độ nhạy phát hiện của xét nghiệm qPCR (Cowley và cộng sự, 2018). Trong số 18 con giun từ các luống PASF được cung cấp nước thải từ Ao 1 tải lượng cao IHHNV, DNA IHHNV được phát hiện ở ít nhất 2 trong số 3 phần mô từ 17 (94%) và trong 1 phần mô của con giun còn lại. Ngược lại, DNA IHHNV chỉ được phát hiện ở ít nhất 2 trong số 3 phần mô từ 3 trong số 12 (25%) và trong 1 phần mô từ 2 con giun khác từ các luống được cung cấp nước thải từ Ao IHHNV 2 tải lượng thấp (Bảng 1). Giá trị qPCR Ct cho các vùng mô khác nhau của 5 con giun dương tính với IHHNV này cũng cao hơn so với giá trị thường được phát hiện ở hầu hết các loài giun từ các luống được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao. Hơn nữa, không có vùng mô nào nổi bật để luôn sở hữu tải lượng DNA IHHNV cao nhất (giá trị Ct thấp nhất) cả trong và giữa giun. Dựa trên những dữ liệu này và kỳ vọng rằng phần gần đầu sẽ sở hữu vật chất được tiêu hóa gần đây nhất ít có khả năng đã trải qua quá trình phân hủy tiêu hóa, phần giun này đã được chọn để sử dụng trong tất cả các phân tích qPCR tiếp theo.
3.2. Tải lượng IHHNV và tỷ lệ nhiễm ở Perinereis helleri
Đối với P. helleri được lấy mẫu vào Ngày thứ 91 của hoạt động PASF, cả tỷ lệ nhiễm và tải lượng DNA IHHNV được phát hiện ở những con giun được nuôi trong các luống PASF được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao đều cao hơn đáng kể (P < .001) so với những con được phát hiện trong giun từ các luống cung cấp nước thải từ Ao 2 tải lượng IHHNV thấp. Để cho thấy sự khác biệt rõ ràng hơn (Hình 3, Bảng 2), các giá trị Ct đã được chuyển đổi thành các đoạn DNA IHHNV 200/ ng TNA bằng cách lắp chúng vào một đường cong tiêu chuẩn được tạo ra cho chuỗi pha loãng 10 lần của dsDNA IHHNV tuyến tính tổng hợp của số đoạn gen được xác định chính xác. Trong 3 luống PASF (2, 6, 10) nước thải được cung cấp từ ao 1, DNA IHHNV được phát hiện ở 35 trong số 36 (97%) con giun ở tải lượng từ 0,8 đến 878 đoạn DNA IHHNV/ 200 ng TNA (geomean cho mỗi luống = 45 đến 66 đoạn DNA IHHNV/ 200 ng TNA). Trong 3 luống PASF (4, 7, 8) nước thải được cung cấp từ Ao 2, DNA IHHNV chỉ được phát hiện ở 5 trong số 36 (14%) con giun ở mức thấp (< 3 đoạn DNA IHHNV/ 200 ng TNA) tải lượng gần giới hạn độ nhạy phát hiện của xét nghiệm qPCR.
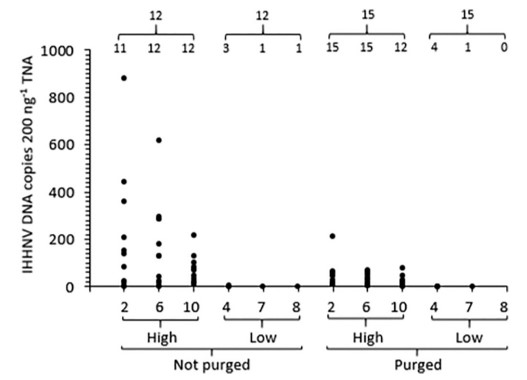
Hình 3. Dữ liệu qPCR về tỷ lệ nhiễm và tải lượng của DNA IHHNV (đoạn DNA IHHNV/ 200 ng TNA) trong Perinereis helleri lấy mẫu từ các luống PASF được cung cấp nước thải từ ao 1 tải lượng IHHNV 1 (luống 2, 6, 10) hoặc Ao 2 tải lượng IHHNV thấp (luống 4, 7, 8). Dữ liệu trên mỗi luống PASF được hiển thị cho giun chỉ được làm sạch (không được thanh lọc) hoặc được làm sạch và thanh lọc đường ruột của chúng trong nước biển sạch trong 2 ngày. Số lượng giun được thử nghiệm từ mỗi luống PASF (n = 12 hoặc 15) và trong đó DNA IHHNV được phát hiện được hiển thị.
Bảng 2. Tỷ lệ trung bình của Perinereis helleri trong đó DNA IHHNV được phát hiện bởi qPCR và geomeans của các đoạn DNA IHHNV/ 200 ng TNA được phát hiện trong số những con xét nghiệm dương tính với qPCR ở mỗi trong số 3 luống PASF lặp lại được cung cấp nước thải từ ao 1 tải lượng IHHNV cao (Luống 2, 6, 10) hoặc Ao 2 tải lượng IHHNV thấp (luống 4, 7, 8) sau khi chỉ được làm sạch (không được thanh lọc) hoặc làm sạch và thanh lọc đường ruột trong nước biển sạch trong 2 ngày.
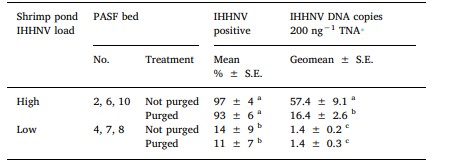
S.E. = lỗi tiêu chuẩn. Các phương tiện hoặc geomeans theo sau bởi các chữ cái khác nhau là khác nhau đáng kể (P < .05). ⁎ Phân tích có điều kiện IHHNV được phát hiện trong một con giun (tức là qPCR chỉ dương tính với IHHNV).
Sau khi được thanh lọc hàm lượng đường ruột của chúng trong 2 ngày trong nước biển sạch, DNA IHHNV vẫn có thể phát hiện được ở hầu hết các loài giun (42 trong số 45 = 93%) được thu thập từ PASF luống 2, 6 và 10 nhưng với tải lượng giảm nhiều, từ 2 đến 213 đoạn DNA IHHNV/ 200 ng TNA (geomean cho mỗi luống = 10 đến 23 đoạn DNA IHHNV/ 200 ng TNA; hình 3, Bảng 2). Tải lượng DNA IHHNV rất thấp được phát hiện ở giun được thu thập từ luống PASF 4, 7 và 8, vẫn ở mức thấp tương tự (≤ 2 đoạn DNA IHHNV/ 200 ng TNA) sau khi thanh lọc ở một vài con giun đó (5 trong số 45 = 11%) trong đó DNA IHHNV vẫn có thể phát hiện được. Vận hành các luống PASF thêm 8 tuần với nước biển sạch (Hoạt động PASF Ngày 91 đến 147) làm giảm đáng kể tỷ lệ nhiễm (P < .05) và tải lượng (P < .001) DNA IHHNV được phát hiện bởi qPCR (Hình 4, Bảng 3). Thật vậy, DNA IHHNV chỉ được phát hiện ở 20 trong số 45 (44%) con giun được thử nghiệm sau giai đoạn này ở tải lượng cực thấp (< 4 đoạn DNA IHHNV/ 200 ng TNA) gần với giới hạn độ nhạy phát hiện của xét nghiệm qPCR.
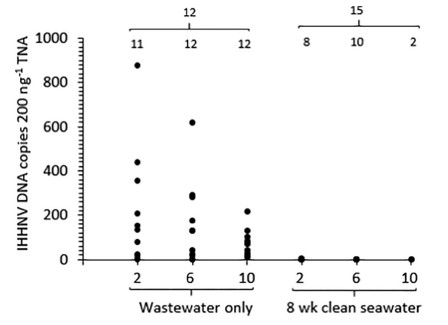
Hình 4. Dữ liệu qPCR về tỷ lệ nhiễm và tải lượng IHHNV DNA (đoạn IHHNV DNA/ 200 ng TNA) trong Perinereis helleri lấy mẫu từ luống PASF 2, 6 và 10 được cung cấp nước thải từ ao 1 tải lượng IHHNV cao. Dữ liệu về mỗi luống PASF được hiển thị ngay trước (chỉ nước thải) và sau khi các luống PASF được cung cấp nước biển sạch trong 8 tuần. Số lượng giun được xét nghiệm từ mỗi luống PASF (n = 12 hoặc 15) và trong đó DNA IHHNV được phát hiện được hiển thị.
Bảng 3. Tỷ lệ trung bình của Perinereis helleri trong đó DNA IHHNV được phát hiện bởi qPCR và geomeans của các đoạn DNA IHHNV/ 200 ng TNA được phát hiện trong số con xét nghiệm dương tính với qPCR ở mỗi trong số 3 luống PASF lặp lại được cung cấp nước thải từ ao 1 tải lượng IHHNV cao (luống 2, 6, 10) và lấy mẫu ngay trước (không có) hoặc sau khi được cung cấp nước biển sạch trong 8 tuần.
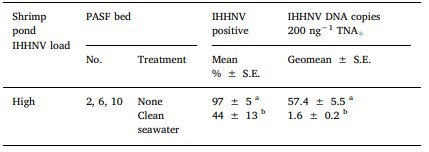
S.E. = lỗi tiêu chuẩn. Các phương tiện hoặc geomeans theo sau bởi các chữ cái khác nhau là khác nhau đáng kể (P < .05).
⁎ Phân tích có điều kiện IHHNV được phát hiện trong một con giun (tức là qPCR chỉ dương tính với IHHNV).
Vào ngày hoạt động của PASF 147, giun cũng được lấy mẫu từ các luống PASF (1, 5 và 9) được xử lý hàng ngày bằng chế phẩm sinh học PondToss™ thương mại trong khoảng thời gian 4 tuần cuối cùng, chúng được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao. Ở một số loài giun này, xét nghiệm qPCR một lần nữa phát hiện tải lượng DNA IHHNV thấp gần với giới hạn độ nhạy phát hiện của xét nghiệm qPCR. Không có sự khác biệt đáng kể nào được tìm thấy giữa tỷ lệ trung bình của các phát hiện dương tính (P = .708) hoặc tải lượng DNA của IHHNV (P = .206) ở những con giun được lấy mẫu trong cùng một ngày từ các luống PASF với (1, 5 và 9) và không có (2, 6 và 10) các ứng dụng chế phẩm sinh học (Hình 5, Bảng 4).
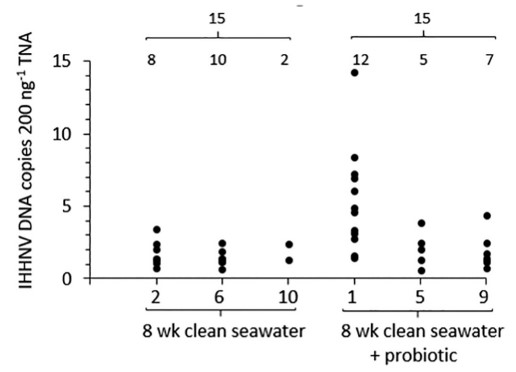
Hình 5. Dữ liệu qPCR về tỷ lệ hiện mắc và tải lượng của IHHNV DNA (đoạn DNA IHHNV/ 200 ng TNA) trong Perinereis helleri lấy mẫu từ luống PASF 2, 6 và 10 và luống 1, 5 và 9 cung cấp nước biển sạch trong 8 tuần sau khi được cung cấp nước thải từ ao 1 tải lượng IHHNV cao. Đối với luống PASF 1, 5 và 9, men vi sinh PondToss™ được sử dụng hàng ngày trong khoảng thời gian 4 tuần cuối cùng, chúng được cung cấp nước thải ao nuôi tôm. Số lượng giun được thử nghiệm từ mỗi luống PASF (n = 15) trong đó DNA IHHNV được phát hiện được hiển thị.
Bảng 4. Tỷ lệ trung bình của Perinereis helleri trong đó DNA IHHNV được phát hiện bởi qPCR và địa chất của các đoạn DNA IHHNV/ 200 ng TNA được phát hiện trong số con xét nghiệm dương tính với qPCR ở mỗi trong số 3 luống PASF lặp lại được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao sau khi được cung cấp nước biển sạch trong 8 tuần hoặc không có (luống 2, 6, 10) hoặc với việc áp dụng chế phẩm sinh học PondToss™ (luống 1, 5, 9) như được mô tả trong Vật liệu và phương pháp.
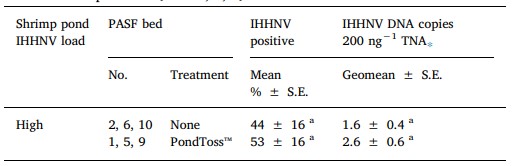
S.E. = lỗi tiêu chuẩn. Các phương tiện hoặc geomeans theo sau bởi các chữ cái khác nhau là khác nhau đáng kể (P < .05).
⁎ Phân tích có điều kiện IHHNV được phát hiện trong một con giun (tức là qPCR chỉ dương tính với IHHNV).
Tỷ lệ thấm nước qua các luống này cũng không bị ảnh hưởng đáng kể (P = .60) bằng cách bổ sung men vi sinh vào bề mặt luống cát. Sử dụng đầu 60 cm, tốc độ xả nước trung bình (± S.E., n = 3 hoặc 4) từ các luống PASF được xử lý bằng chế phẩm sinh học (1, 5 và 9) là 87,0 ± 2,7 L/ phút và tương tự như của Luống 2, 6 và 10 (90,2 ± 6,6 L/ phút) được cung cấp nước thải từ cùng một ao (Ao 1) mà không cần xử lý men vi sinh và Luống 3, 4, 7, 8 (92,6 ± 1,5 L/ phút) được cung cấp nước thải từ ao 2 tải lượng IHHNV thấp.
5. Thảo luận
Tại đây, khả năng tích tụ IHHNV của giun cát (Perinereis helleri) đã được nghiên cứu từ chất hữu cơ ở các luống PASF bị ngập nước thải từ các ao nuôi tôm sú Penaeus monodon 2 lần mỗi ngày với tỷ lệ nhiễm IHHNV và tải lượng nhiễm trùng khác nhau (Sellars và cộng sự, 2019). DNA IHHNV được phát hiện rõ ràng bằng thử nghiệm qPCR thời gian thực trong các phần mô có chứa đường ruột ở hầu hết (35 trên 36) P. helleri lấy mẫu từ 3 luống PASF được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao. Ngược lại, nó chỉ được phát hiện ở các tải lượng gần đạt đến giới hạn độ nhạy phát hiện IHHNV của xét nghiệm qPCR ở một số (5 trong số 36) con giun được thử nghiệm từ 3 luống được cung cấp nước thải từ ao 2 nuôi P. monodon tải lượng thấp hơn nhiều với tỷ lệ nhiễm IHHNV (> 104 lần) (Sellars và cộng sự, 2019). Đối với các luống PASF được cung cấp nước thải từ Ao 1 tải lượng IHHNV cao, giun đã thanh lọc đường ruột của chúng bằng cách thả trong nước biển sạch trong 2 ngày có lượng DNA IHHNV giảm rõ rệt. Thậm chí còn giảm rõ rệt hơn về tỷ lệ nhiễm và tải lượng DNA của IHHNV đã được tìm thấy ở giun từ các luống PASF được cung cấp nước biển sạch trong 8 tuần trước khi thu hoạch.
Mặc dù đã có một số thành công trong việc thuần hóa và nhân giống có chọn lọc tôm bố mẹ P. monodon ở Queensland (Preston và cộng sự, 2009, 2010; Norman-Lόpez và cộng sự, 2015), nhưng sự xuất hiện của bệnh đốm trắng (WSD) ở vùng nuôi trồng thủy sản sông Logan vào tháng 2016 năm 2018 (Oakey và Smith, 2018) đã dẫn đến sự tàn phá nghiêm trọng các quần thể sinh sản tiên tiến nhất. Một phần do điều này và dự kiến mở rộng trong việc nuôi loài này ở Úc, đã làm dấy lên những mối lo ngại về an ninh trong việc cung cấp tôm bố mẹ hoang dã và nguy cơ an toàn sinh học tiềm ẩn. Trong khi thúc đẩy động lực mới trong các trang trại lớn hơn để thiết lập các dòng giống P. monodon mới, sự quan tâm đang được sụt giảm bởi những khó khăn đã biết trong việc nhân giống loài này trong điều kiện nuôi nhốt (Preston và cộng sự, 2009, 2010). Mấu chốt cho những khó khăn này là khả năng sinh sản kém của các thế hệ đầu tiên của tôm bố mẹ P. monodon nuôi nhốt được cho là do môi trường nuôi không tự nhiên và các yếu tố khẩu phần ăn. Để khắc phục tình trạng thiếu hụt khẩu phần ăn, thành phần protein và lipid của thức ăn tươi như động vật thân mềm và mực, và đặc biệt là thức ăn sống như giun annelid (giun nhiều tơ), đã được coi là cần thiết cho tuyến sinh dục bố mẹ trưởng thành (Meunpol và cộng sự, 2005, Coman và cộng sự, 2007, xem đánh giá Chimsung, 2014). Mặc dù chưa xác định được thành phần dinh dưỡng lý tưởng cho P. monodon, các loài Perinereis khác nhau có chứa mức progesterone (E2) và 17-alpha hydroxyprogesterone rất quan trọng trong quá trình trưởng thành noãn bào tôm (Meunpol và cộng sự, 2007, 2010). Điều này hỗ trợ việc sử dụng khẩu phần ăn mà không cần đông lạnh hoặc sấy khô có thể ảnh hưởng đến các chất kích thích nội tiết.
Tuy nhiên, mặc dù ghi nhận những lợi ích về giun nhiều tơ, nhưng vẫn có những nhược điểm rõ ràng khi cho ăn các chất bổ sung thức ăn tươi và sống như giun nhiều tơ cho tôm bố mẹ. Điều quan trọng trong số này, và đặc biệt là đối với các dòng giống tôm được chọn là không có mầm bệnh cụ thể (SPF), là nguy cơ mang và truyền mầm bệnh tiềm ẩn (Vijayan và cộng sự, 2005; Haditomo và Chilmawati, 2012; Desrina và cộng sự, 2013; Desrina, 2014; Haryadi và cộng sự, 2014; Chimsung, 2014). Việc phát hiện DNA IHHNV ở P. helleri được nuôi trong hệ thống PASF cho thấy nhược điểm này, và cần các thử nghiệm cảm nhiễm tôm để đánh giá mức độ lây nhiễm của IHHNV khi nó lây qua đường tiêu hóa P. helleri. Đối với việc cải thiện nguy cơ lây truyền vi-rút, việc thanh lọc đường ruột giun bằng cách cho chúng tiếp xúc với nước biển sạch trong 2 ngày làm giảm đáng kể tải lượng DNA IHHNV. Việc duy trì các luống PASF bằng nước biển sạch trong 8 tuần sau khi ngừng cung cấp nước thải ao tôm chứa đầy chất hữu cơ dẫn đến DNA IHHNV thậm chí còn ít được phát hiện hơn. Mặc dù không giảm thiểu hoàn toàn khả năng lây truyền mầm bệnh như trong các giun nhiều tơ SPF đang phát triển trong các hệ thống an toàn sinh học (Poltana và cộng sự, 2007), những dữ liệu này cho thấy IHHNV không lây nhiễm và lan rộng ở P. helleri. Mặc dù các giun nhiều tơ đã được thanh lọc có thể được sử dụng như một chất bổ sung khẩu phần ăn cho tôm bố mẹ, nhưng việc thực hiện nghiêm ngặt hơn các quy trình loại bỏ vi rút sẽ cần được đánh giá về khả năng giảm thiểu tất cả các nguy cơ lây nhiễm.
Bằng chứng cho thấy các giun nhiều tơ như P. helleri chỉ đơn giản là vật mang virus thụ động đặc hiệu với động vật giáp xác, các loài giun nhiều tơ liên quan Perinereis nuntia không bị ảnh hưởng xấu từ việc ăn mô tôm có chứa tải lượng lớn WSSV truyền nhiễm (Laoaroon và cộng sự, 2005). Mặc dù DNA WSSV được phát hiện rõ ràng trong P. nuntia bằng thử nghiệm PCR, P. monodon được nuôi dưỡng bằng giun nhiều tơ không cho thấy bằng chứng nhiễm trùng. Không có khả năng lây nhiễm WSSV trong một khoảng thời gian ngắn cũng đã được ghi nhận ở một loài liên quan khác mà perinereis cultrifera đã kiểm tra tại thời điểm họ thử nghiệm PCR dương tính để tìm DNA WSSV sau khi ăn phải mô bị nhiễm WSSV (Shalini và cộng sự, 2016). Tuy nhiên, việc giun nhiều tơ này không có khả năng lây truyền WSSV; hay là do tải lượng vi-rút quá thấp để gây nhiễm trùng; hay khả năng lây nhiễm của vi-rút bị tổn hại bởi các yếu tố đường tiêu hóa của giun vẫn chưa được xác định.
Mặc dù những dữ liệu này về WSSV được trình bày ở đây trên IHHNV cho thấy giun nhiều tơ là vật mang virus thụ động có khả năng ảnh hưởng đến khả năng lây nhiễm vi rút, nhưng có ý kiến cho rằng P. cultrifera hoang dã nên được giữ tối đa một tuần trong nước biển sạch để đảm bảo rằng đường tiêu hóa đã được thanh lọc hoàn toàn trước khi sử dụng trong khẩu phần ăn của tôm trưởng thành (Shalini và cộng sự, 2016). Đối với P. helleri nuôi cấy PASF, quá trình thanh lọc ruột có khả năng kéo dài trong nhiều tháng, nếu cần bằng cách sử dụng nước biển sạch kết hợp với khẩu phần ăn dựa trên bột cá vô trùng (Palmer và cộng sự, 2014). Do giá trị cao của giun nhiều tơ sống làm mồi hoặc bổ sung thức ăn tôm bố mẹ và số lượng giun cao có thể được nuôi bằng hệ thống PASF (Palmer và cộng sự, 2016), bất kỳ chi phí bổ sung nào của việc thanh lọc ruột kéo dài sẽ không quan trọng.
Perinereis helleri rất thích hợp để nuôi trong các hệ thống PASF được cung cấp nước thải ao nuôi tôm. Điều này là do khả năng chịu đựng của loài này đối với nhiều loại trầm tích và chất nền chứa đầy chất hữu cơ phân hủy trong môi trường sống nhiệt đới và cận nhiệt đới tự nhiên cũng như sự thay đổi độ mặn vừa phải trong các luống cát trên đất liền bị ảnh hưởng không liên tục bởi lượng mưa. Giun có tập tính ăn bừa bãi nên cũng có hiệu quả trong việc phân hủy sinh khối thực vật, động vật hoặc vi khuẩn, nếu không sẽ nhanh chóng làm tắc nghẽn ma trận luống cát, và do đó hỗ trợ giảm tải lượng mầm bệnh tồn tại trong sinh khối này. P. helleri được nuôi trên luống PASF được báo cáo ở đây duy trì các thông số hoạt động dự kiến bất kể IHHNV tích lũy. Tuy nhiên, ít được mong đợi hơn là dữ liệu qPCR cho thấy sự hiện diện của DNA IHHNV, đôi khi với số lượng tương tự như vùng gần đầu chứa sinh vật mới ăn vào, bán rắn và do đó ít tiêu hóa hơn, ở phần giữa thân và đuôi của giun nơi nội dung đường tiêu hóa đã hóa lỏng. Điều này cho thấy rằng các hạt IHHNV có thể chịu đựng được môi trường đường tiêu hóa P. helleri. Ngoài ra, vì qPCR IHHNV chỉ khuếch đại một đoạn 98 nt của bộ gen DNA IHHNV (Cowley và cộng sự, 2018), nó có khả năng phát hiện DNA bán suy thoái với hiệu quả tương tự như DNA gen không bị thoái hóa được bảo vệ trong các hạt virus. Do đó, cần có các thử nghiệm cảm nhiễm tôm để đánh giá khả năng lây nhiễm của IHHNV được phát hiện bởi qPCR ở các khu vực phía trước và phía sau của đường tiêu hóa P. helleri.
Chưa có bằng chứng nào thu được cho việc áp dụng chế phẩm sinh học PondToss™ trong 4 tuần để giảm thêm tải lượng DNA IHHNV được phát hiện ở P. helleri được lấy mẫu từ các luống PASF sau đó được cung cấp nước biển sạch trong 8 tuần hoặc tăng tỷ lệ thấm nước qua các luống PASF. Các lý do tiềm năng cho điều này rất nhiều và đa dạng và sẽ yêu cầu các cuộc điều tra chi tiết và có mục tiêu hơn để xác định.
Tổng hợp lại, dữ liệu được trình bày ở đây chỉ ra rằng vật chất chứa IHHNV thải ra trong nước thải ao nuôi tôm có thể tích tụ thụ động ở mức thấp ở Perinereis helleri được nuôi trong các luống PASF. Họ cũng cho thấy IHHNV được thải ra khỏi giun nhanh chóng sau khi tiếp xúc với nước biển sạch trong 2 ngày để thanh lọc đường ruột. Mặc dù đầy triển vọng nhưng cần thực hiện thêm các thử nghiệm cảm nhiễm tôm để xác định sự nghiêm ngặt cho quá trình thanh lọc ruột cần thiết để cung cấp một phương tiện an toàn để sản xuất giun không có vi rút. Cho đến lúc đó, các luống cát nuôi P. helleri SPF theo khẩu phần ăn vô trùng hoặc nước giàu chất dinh dưỡng từ các hệ thống ao/ bể an toàn sinh học tạo ra tôm bố mẹ SPF (Palmer và cộng sự, 2016) hoặc các chất bổ sung thức ăn dựa trên biofloc như Novacq™ (Anand và cộng sự, 2014; Glencross và cộng sự, 2014), ví dụ, sẽ được kỳ vọng sẽ cải thiện nguy cơ lây truyền vi rút và đẩy nhanh việc sử dụng giun nhiều tơ sống như một chất bổ sung khẩu phần ăn để thúc đẩy khả năng sinh sản ở tôm bố mẹ P. monodon nuôi.
Theo Siyi Liu, Min Rao, Jeff A. Cowley, Jess A.T. Morgan, Andrew C. Barnes, Paul J. Palmer
Nguồn: https://sci-hub.hkvisa.net/10.1016/j.aquaculture.2020.735560
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Hệ Vi Sinh Vật Đường Ruột Của Tôm Thẻ Chân Trắng, Litopenaeus vannamei, Được Cho Ăn Khẩu Phần Ăn Có Chứa Bột Đậu Nành Lên Men Chứa Bacillus subtilis E20 (FSBM) Hoặc Một Peptide Kháng Khuẩn Có Nguồn Gốc Từ B. subtilis E20 FSBM
- Cải Thiện Sức Khỏe Và Khả Năng Kháng Nấm Fusarium Của Tôm Thẻ Chân Trắng Thông Qua Việc Thức Ăn Bổ Sung
- An Toàn Sinh Học Và Vai Trò Của Nó Trong Việc Giảm Thiểu Tác Động Của Dịch Bệnh Tại Các Cơ Sở Sản Xuất Tôm Giống

 English
English