Tóm tắt
Các bệnh do mầm bệnh truyền nhiễm gây ra thường phổ biến trong nuôi tôm thương phẩm. Sự xuất hiện cùng lúc của hai bệnh tôm gồm virus gây bệnh hoại tử cơ (IMNV) và nhiễm vi bào tử trùng Enterocytozoon hepatopenaei (EHP) đã gây ra thiệt hại kinh tế đáng kể cho người nuôi tôm ở Ấn Độ. Dựa trên các báo cáo trước đây về sự bùng phát dịch bệnh IMNV trong một nhóm trại quy mô nhỏ, người ta đã tiến hành nghiên cứu sự lây lan theo chiều ngang của bệnh này dọc theo bờ biển phía đông của Ấn Độ, bằng cách giám sát tích cực tại bốn quận của Andhra Pradesh và Tamil Nadu. Điều tra hiện tại báo cáo các trường hợp đồng nhiễm IMNV và EHP trong các trang trại nuôi tôm Tôm thẻ chân trắng ở Ấn Độ. Trong số 12 ao được điều tra, tôm ở 04 ao chỉ bị nhiễm IMNV; 01 ao duy nhất bị nhiễm EHP và 07 ao có tôm chứa cả hai mầm bệnh. Tôm nhiễm IMNV có các đoạn cơ bụng màu trắng. Ao dương tính với EHP không có bất kỳ dấu hiệu lâm sàng rõ ràng nào. Tôm đồng nhiễm bệnh có biểu hiện tổn thương lâm sàng của cả IMNV và EHP. Bên cạnh dấu hiệu tăng trưởng chậm, mô bệnh học cho thấy trong gan tụy của tôm, các giai đoạn phát triển tế bào chất của EHP trong tế bào biểu mô ống và các tế bào nhiễm bệnh bị bong tróc, giải phóng bào tử trong lòng ống, trong khi tôm nhiễm IMNV đã bị xé nhỏ sợi cơ, hoại tử đông tụ với xung huyết trong cơ và phì đại tổ chức lympho (LO). Cả hai trường hợp nhiễm trùng đều được xác nhận thêm bằng PCR cũng như giải trình tự.
Từ khoá: Sự đồng nhiễm, Enterocytozoon hepatopenaei (EHP), mô bệnh học, virus gây hoại tử cơ, PCR, Tôm thẻ chân trắng.
1/ GIỚI THIỆU CHUNG
Nghề tôm là một lĩnh vực nuôi trồng thủy sản có năng suất cao, đóng góp đáng kể vào doanh thu xuất khẩu ở nhiều nước Châu Á. Hiện tại, ngành tôm toàn cầu chủ yếu là tôm thẻ chân trắng, với tổng sản lượng 4,8 triệu tấn (FAO, 2018). Việc mở rộng nuôi thẻ chân trắng trên toàn thế giới có thể là do sự sẵn có của các dòng sạch bệnh (SPF) phát triển nhanh và đặc hiệu được cung cấp chủ yếu từ các chương trình nhân giống chọn lọc.
Ở Ấn Độ chủ yếu nuôi tôm sú P. monodon cho đến năm 2009, sau đó tôm thẻ chân trắng đã xâm nhập vào theo quy luật chung thay cho sú, do nguồn tôm bố mẹ thẻ SPF sẵn có cho người nuôi tôm và người vận hành trại giống (Remany và cộng sự, 2010). Việc chuyển đổi canh tác từ tôm sú sang tôm thẻ chân trắng đã tạo nên các mối lo ngại về dịch bệnh trên toàn thế giới, bao gồm cả việc nuôi tôm ở Ấn Độ (Tandel và cộng sự., 2017).
Nuôi tôm ở Ấn Độ có hai vụ chính, vụ hè (tháng 3 – tháng 4 đến tháng 6 – tháng 7) và vụ thu đông (tháng 7 – tháng 8 đến tháng 11 – tháng 12). Vụ hè thu gần 60% sản lượng tôm và là vụ chính với các vấn đề dịch bệnh vốn có. Cho đến nay, virus hội chứng đốm trắng (WSSV) vẫn tiếp tục là mối nguy hại nhất đối với cả hai loài ở Ấn Độ, cũng đối với ngành nuôi tôm trên thế giới. Các tác nhân gây bệnh do virus khác như virus gây bệnh teo gan tụy (HPV), virus Monodon Baculovirus (MBV) và virus hoại tử cơ tạo máu và cơ quan biểu mô (IHHNV) là những tác nhân gây bệnh truyền nhiễm đáng kể trên P. monodon. Tuy nhiên, những mầm bệnh virus bản địa này hầu như không đáng kể hoặc không xảy ra trong các trang trại nuôi tôm nuôi Thẻ chân trắng (CIBA, 2019; Jagadeesan và cộng sự., 2017; Remany và cộng sự., 2016). Gần đây, nhiều mầm bệnh mới xuất hiện đe dọa loài nuôi mới du nhập này ở vùng biển Ấn Độ. Một loại vi bào tử trùng mới nổi, Enterocytozoon hepatopenaei (EHP) đã tấn công ngành tôm gây tình trạng chậm phát triển nghiêm trọng dẫn đến thiệt hại kinh tế lớn cho người nuôi kể từ năm 2014 (Biju và cộng sự, 2016; CIBA, 2015; Rajendran và cộng sự, 2016). Tương tự như vậy, một virus kỳ lạ có tên là virus gây hoại tử cơ trên tôm (IMNV) cũng đã xuất hiện và thỉnh thoảng gây chết ở các trại nuôi tôm thương phẩm kể từ khi có báo cáo đầu tiên ở Ấn Độ vào giữa năm 2016 (Hameed và cộng sự, 2017).
IMNV là một loại virus mới nổi gây ra thiệt hại kinh tế nghiêm trọng trong nuôi trồng tôm He (Prasad và cộng sự., 2017). Ban đầu nó được báo cáo ở Brazil vào năm 2002 (Nunes và cộng sự, 2004). Sự bùng phát đầu tiên ở khu vực Châu Á – Thái Bình Dương được báo cáo từ Indonesia vào năm 2006 (Senapin và cộng sự, 2011) và sau đó ở một số nước Châu Á (OIE, 2019; Tang và cộng sự, 2019). Các phân lập IMNV đại diện cho các kiểu gen mới được phát hiện có liên quan đến các đợt bùng phát dịch bệnh gần đây ở các trang trại nuôi tôm Thẻ chân trắng ở Indonesia (Mai và cộng sự, 2019). Bệnh gây ra các tổn thương tại một điểm, sau đó lan ra thành hoại tử trên cơ diện rộng, đặc biệt là ở các đoạn bụng và đuôi quạt; và một số con có cơ thịt chuyển đỏ. Virus lây nhiễm vào tất cả các giai đoạn sống của tôm, bao gồm giai đoạn hậu ấu trùng, con non và giai đoạn trưởng thành. Tỷ lệ chết tích lũy dao động từ 40% đến 70% ở con non và con trưởng thành với cơ thịt như bị nấu chín (Nunes và cộng sự., 2004; Poulos và cộng sự., 2006). Cho đến gần đây, căn bệnh này chỉ giới hạn ở Brazil tại Nam Mỹ (Lightner và cộng sự, 2004; Melena và cộng sự, 2012) và Indonesia ở châu Á (Mai và cộng sự, 2019; Senapin và cộng sự, 2007; Taukhid & Nuraini , 2009). Tuy nhiên, cuối cùng, thiệt hại kinh tế do căn bệnh kỳ lạ này gây ra ở các vùng phía bắc của Ấn Độ (Hameed và cộng sự., 2017) đã thành một mối quan tâm nghiêm trọng.
Enterocytozoon hepatopenaei được báo cáo là gây ra bệnh vi bào tử trùng ở tôm He ở các nước châu Á như Trung Quốc, Indonesia, Malaysia, Việt Nam, Thái Lan, Ấn Độ và gần đây là ở Venezuela (Rajendran và cộng sự, 2016; Tang và cộng sự, 2017; Thitamadee và cộng sự ., 2016). Dấu hiệu đặc trưng là sự chậm phát triển, thay đổi kích thước ở tôm và thường liên quan đến hội chứng phân trắng với tổng sản lượng nông sản khi thu hoạch giảm từ 10% – 20%. Shinn và cộng sự. (2018) ước tính thiệt hại 232 triệu USD mỗi năm do chỉ riêng EHP ở Thái Lan, trong khi ở Ấn Độ, thiệt hại sản xuất 0,77 triệu tấn tương ứng với thiệt hại kinh tế 567,62 triệu USD mỗi năm (Patil và cộng sự, 2021). Một số lượng lớn các trang trại nuôi tôm ở Ấn Độ đang được giám sát dịch bệnh nghiêm ngặt theo Chương trình Giám sát Quốc gia về dịch bệnh động vật thủy sản. Tại Ấn Độ, những dịch bệnh đáng sợ nhất trên tôm là WSSV (virus hội chứng đốm trắng) và bệnh nhiễm vi bào tử trùng do Enterocytozoon hepatopenaei gây ra, dẫn đến thiệt hại kinh tế nghiêm trọng cho người nuôi. EHP phổ biến ở nhiều vùng nuôi tôm của Ấn Độ, với các dấu hiệu lâm sàng là chậm lớn và đôi khi gây chết. Mục tiêu của nghiên cứu này là điều tra tỷ lệ chết ở mức độ thấp liên quan đến hội chứng cơ trắng đang bị nghi ngờ ở các hệ thống nuôi tôm thẻ chân trắng ở hai bang của Ấn Độ (Andhra Pradesh và Tamil Nadu – những vùng nuôi tôm thẻ chân trắng lớn nhất). Nghiên cứu này báo cáo sự xuất hiện lẻ tẻ của sự đồng nhiễm IMNV và EHP trong nuôi thương phẩm thẻ chân trắng. Ngoài các dấu hiệu lâm sàng, các xét nghiệm PCR lồng, phân tích trình tự và phân tích mô bệnh học đã được thực hiện để xác nhận nguyên nhân của sự bùng phát dịch bệnh.
Điểm nổi bật
- Ba thách thức dịch bệnh hàng đầu trên tôm ở Ấn Độ là WSSV (virus gây hội chứng đốm trắng), EHP (Enterocytozoon hepatopenaei) và IMNV (virus gây bệnh hoại tử cơ) gây thiệt hại nặng nề về kinh tế cho người nuôi.
- Sự đồng nhiễm của virus gây bệnh hoại tử cơ (IMNV) và ký sinh trùng Enterocytozoon hepatopanaei (EHP) đã được điều tra tại các trang trại nuôi tôm Thẻ chân trắng dọc theo bờ biển phía đông của Ấn Độ với sự phân bố địa lý rộng hơn.
- Sự lây nhiễm được xác nhận bằng các dấu hiệu lâm sàng, mô bệnh học, PCR và phân tích giải trình tự.
- Giám sát dựa trên rủi ro đối với các bệnh động vật thủy sản là cần thiết khi tuân thủ các Thực hành Quản lý Tốt nhất (BMPS) trong các trại sản xuất giống, sàng lọc hậu ấu trùng (PLs) chống lại IMNV để chống lại sự lây truyền dọc, các biện pháp an toàn sinh học, thu hoạch khẩn cấp và xử lý đúng cách biện pháp hạn chế sự lây lan theo chiều ngang của dịch bệnh
2/ VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1 Khu vực nghiên cứu
Nghiên cứu được thực hiện ở 12 ao nuôi tôm có biểu hiện là các đoạn bụng đổi màu trắng, đuôi đỏ và tỷ lệ chết thấp trong giai đoạn nuôi thương phẩm (Hình 1a). Ở Andhra Pradesh, ba trang trại, bao gồm năm ao (55 đến 90 ngày nuôi DOC) từ hai huyện (Tây Godavari và Nellore), và ở Tamil Nadu, bảy ao (15 đến 67 ngày nuôi) từ năm trang trại nằm ở hai huyện (Nagapattinam và Thiruvarur) nuôi tôm thẻ chân trắng đã được điều tra (Bảng 1).
2.2 Lịch sử bệnh ở các trại
Các dấu hiệu lâm sàng của tôm khác nhau ở các trại khác nhau. Từ Tamil Nadu, hai trang trại đang được nghiên cứu tại Nagapattinam trong năm 2017, đã báo cáo các triệu chứng thay đổi kích thước (5– 10 g, 53 DOC) và cơ trắng. Hai trang trại khác đã được điều tra vào năm 2019 cho thấy tôm từ một ao (56 DOC) biểu hiện hội chứng phân trắng (WFS) với tốc độ tăng trưởng còi cọc, trong khi ở ao thứ hai (15 DOC) tôm khỏe mạnh. Trong số hai trang trại được khảo sát ở Thiruvarur, tôm trong một ao ở 64 DOC và một ao khác ở 67 DOC, không có dấu hiệu lâm sàng của IMNV hoặc EHP. Các trang trại từ các huyện West Godavari và Nellore của Andhra Pradesh có tôm có các dấu hiệu lâm sàng như lờ đờ, chậm lớn với sự thay đổi về kích thước, cơ bụng màu trắng, cơ bị co và ruột đầy với FCR cao (2,2). Các thông số chất lượng nước được theo dõi và ghi lại thường xuyên.
2.3 Thu thập mẫu
Từ mỗi trang trại (ao), ba mươi mẫu tôm được thu thập và mang đến phòng thí nghiệm. Hai hồ chứa khoảng 10–12 mẫu tôm thẻ chân trắng, (0,1–12 g) được thu thập từ các ao bị ảnh hưởng. Các mô / cơ quan cụ thể như chân bơi, mang, gan tụy và cơ bụng sau gần vùng đuôi từ mỗi bể được cắt và bảo quản trong 95% ethanol và RNALater cho PCR và RT-PCR, tương ứng. Một vài (5 đến 6) mẫu tôm tươi từ mỗi ao đã được tiêm chất cố định của Davidson để nghiên cứu mô bệnh học. Để phân tích hệ vi sinh, haemolymph từ tôm, nước ao và trầm tích đã được thu thập để kiểm tra.
2.4 Vi khuẩn học
Nước ao và trầm tích được thu thập trong các thùng chứa vô trùng để phân tích vi khuẩn học. Haemolymph được thu thập vô trùng bằng cách sử dụng một ống tiêm vô trùng (1 ml) và 100 µl được quét đĩa để tìm vi khuẩn. Thạch TCBS được sử dụng để xác định Vibrio tổng số (TVC) và sau đó, Zobell Marine Agar (ZMA) được sử dụng để xác định tổng số vi sinh vật hiếu khí (TPC) theo Biswas và cộng sự. (2012).
2.5 Mô bệnh học
Các mẫu được cố định trong chất cố định Davidson và được giữ ở nhiệt độ phòng trong 48 giờ để tạo điều kiện cho sự xâm nhập của nó, sau đó nó được chuyển sang cồn 70% và được xử lý cho các nghiên cứu mô bệnh học như Bell và Lightner (1988) đã mô tả. Các mô nhúng parafin được cắt thành các đoạn có độ dày 5 µm bằng máy cắt lát tiêu bản (Leica, Đức) và được nhuộm bằng cách sử dụng thuốc nhuộm Haematoxylin và Eosin (H&E). Cuối cùng, các phần mẫu được kiểm tra với DPX (Sigma, Hoa Kỳ). Các trang trình bày được vẽ bằng đồ thị vi mô và hình ảnh kỹ thuật số được chụp bằng máy ảnh Nikon.
2.6 Chẩn đoán phân tử
2.6.1. Tách chiết DNA và RNA
Các mô gan tụy được bảo quản trong cồn etylic 95% được sử dụng để chiết xuất DNA tổng số theo quy trình thông thường được mô tả trước đó (Rajendran và cộng sự, 2016). DNA chiết xuất được bảo quản ở -20°C cho đến khi sử dụng tiếp. Chất lượng của DNA được đánh giá bằng máy đo Nanophotometer (Thực hiện, Đức), ở bước sóng 260 nm. Các mô (mang, gân và cơ) được bảo quản trong RNA. Sau đó được sử dụng để tách chiết RNA bằng phương pháp TRIzol (Invitrogen, USA) theo hướng dẫn của nhà sản xuất. Chất lượng và số lượng của RNA chiết tách được đánh giá bằng cách đo độ hấp thụ ở bước sóng 260 nm và tỷ lệ OD 260 nm / OD 280 nm được đánh giá bằng máy đo Nanophotometer.
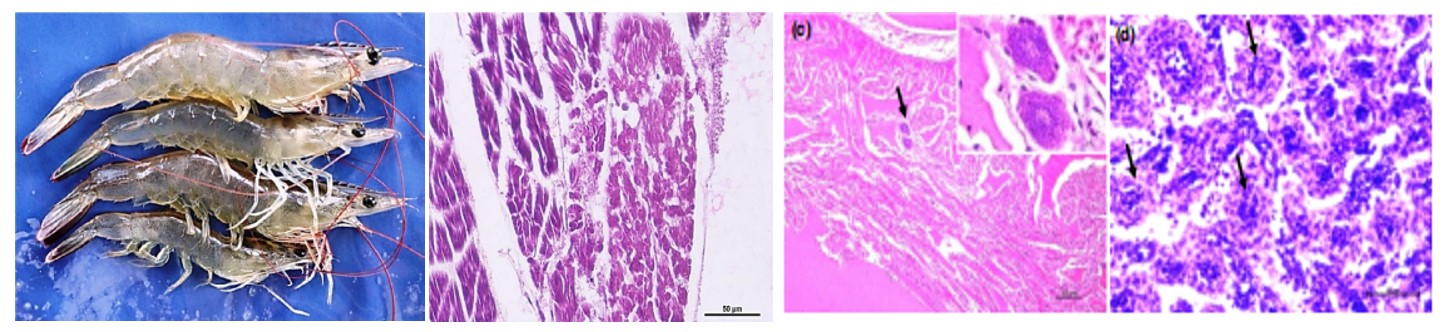
Hình 1(a) tôm nhiễm IMNV- & EHP-: Tăng trưởng chậm, tôm so le, cơ bụng trắng (mũi tên), co cứng cơ và đầy ruột. (b) Nhiễm IMNV: cơ vân có biểu hiện hoại tử đông máu với xung huyết (mũi tên). ANH TA. Thanh chia độ: 50 µm. (c) Tim bị nhiễm IMNV: Hình cầu tổ chức lympho (LOS) (mũi tên) trong ống cơ tim (hình trong – Thanh tỷ lệ: 10 µm). ANH TA. Thanh chia độ: 100 µm. (d) Cơ quan lympho bị nhiễm IMNV: phì đại LO thiếu lumen giữa, được bao quanh bởi mô liên kết dạng sợi, suy giảm tế bào lympho với nhiều tế bào chất ưa bazơ hơn (mũi tên) H&E. Thanh tỷ lệ: 50 µm.
Bảng 1 Chi tiết sàng lọc PCR trên các mẫu Thẻ chân trắng từ các trại nuôi khác nhau.
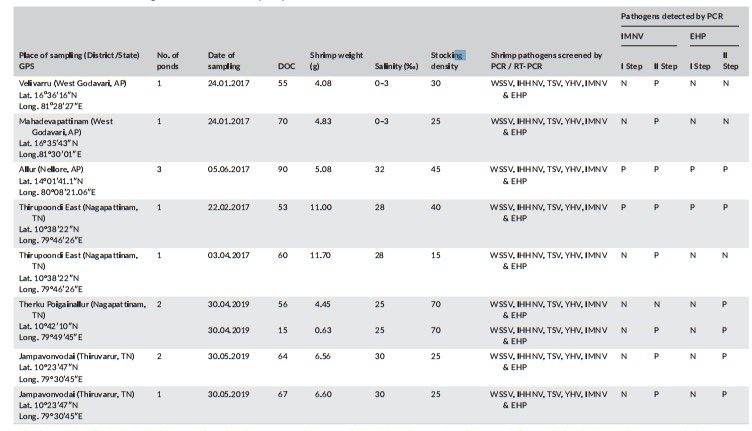
Viết tắt: AP – Andhra Pradesh; DOC – số ngày nuôi; EHP – Enterocytozoon hepatopenaei; IHHNV – virus hoại tử cơ quan tạo máu và cơ quan biểu mô; IMNV – virus gây hoại tử cơ; N – âm; P – dương; TN – Tamil Nadu; TSV – virus gây hội chứng Taura, WSSV – virus gây bệnh đốm trắng; YHV – virus gây bệnh đầu vàng.
2.6.2 PCR và RT-PCR
Việc phát hiện EHP bằng PCR lồng được thực hiện bằng cách sử dụng các đoạn mồi nhắm vào gen SWP đặc trưng cho loài theo Jaroenlak và cộng sự. (2016). PCR được thực hiện trong thể tích phản ứng 25 µl bằng cách sử dụng 12,5 µl 2 × Master Mix (Ampliqon, Đan Mạch), 1 µl (0,2 μM) mỗi mồi đối và mồi ngược, 9,5 µl nước không chứa nuclease và 1µl (100 ng) Mẫu DNA sử dụng Hệ thống PCR ProFlex 3 × 32 khối (Hệ thống sinh học ứng dụng , Singapore). Các sản phẩm PCR từ bước đầu tiên và nested-PCR được phân giải trên gel agarose-Tris-acetate-EDTA (TAE) 1,5% có chứa 0,5 μg/ml ethidium bromide và sử dụng thang DNA (100 bp hoặc 1 kb) từ New England Biolabs, Hoa Kỳ . Các gel được xem và ghi lại bằng hệ thống hình ảnh Gel Doc XR + (Bio- Rad, USA).
Việc sàng lọc RT-PCR cho IMNV được thực hiện theo mô tả của OIE (2019) bằng cách sử dụng các đoạn mồi được mô tả bởi Poulos và Lightner (2006). Hỗn hợp phản ứng PCR 25 µl bao gồm 1µl khuôn mẫu cDNA, 10 picomoles của mồi thuận và nghịch và 12,5 µl Taq DNA polymerase Master Mix RED (Ampliqon, Đan Mạch). Các sản phẩm PCR khuếch đại được phân tích như mô tả ở trên.
Các mẫu mô cũng được kiểm tra bằng PCR như một phương pháp thực hành thường quy đối với các bệnh tôm phổ biến khác nhau do virus DNA (virus gây hội chứng đốm trắng và virus hoại tử cơ quan tạo máu và cơ quan lập mô) và virus RNA (virus hội chứng Taura và virus đầu vàng) gây ra, theo các quy trình chẩn đoán đã báo cáo trước đó (Kimura và cộng sự, 1996; Nunan và cộng sự, 1998; Otta và cộng sự, 2014; Tang và cộng sự, 2007).
2.6.3. Phân tích giải trình tự
Các sản phẩm RT-PCR từ IMNV (328 bp theo bước đầu tiên và 139 bp theo nested-PCR) được tinh chế bằng cách sử dụng bộ chiết gel GenElute ™ (Sigma, Hoa Kỳ) theo hướng dẫn của nhà sản xuất và được giải trình tự theo cả hai hướng (Cơ sở thứ nhất, Malaysia) để xác nhận. Tương tự, sản phẩm PCR bước đầu tiên (514 bp) đối với EHP cũng được xử lý và trình tự ~ 498 bp được căn chỉnh với trình tự protein vách bào tử của microsporidian được lấy từ NCBI-GenBank.
3/ KẾT QUẢ
3.1 Các quan sát tổng thể trong các ao nuôi tôm
Các trang trại nuôi tôm có các thông số môi trường khác nhau, với độ mặn từ độ mặn thấp (0 ‰ – 3 ‰) đến lợ (32 ‰), ngày nuôi (DOC) trong khoảng 15 đến 90 và mật độ thả nuôi 25–70 con/ m2 (Bảng 1). Ở một số trại, tôm có các vùng hoại tử màu trắng trên diện rộng ở các cơ vân, đỏ ở đuôi, đặc biệt là ở phần bụng và đuôi, và gan tụy nhợt nhạt (Hình 1a). Kiểm tra lại sau một tuần cho thấy một số lượng tôm với các cơ chuyển màu trắng (khi kiểm tra trên khay kiểm tra) và tôm chết nổi trên các mặt của ao. Trong một số ao, tôm có biểu hiện tăng trưởng chậm nghiêm trọng (~ 4–8g tại 70 DOC) so với mức tăng trưởng dự kiến trong khoảng 9–12 g, với cơ bụng màu trắng, chuột rút và FCR cao (2,2). Tỷ lệ chết trong các ao nước ngọt dao động từ 15% trên 70 DOC và tăng lên 40% trên 79 DOC, trước khi thu hoạch gấp. Ngược lại, ở các ao nước lợ, tỷ lệ chết dao động từ mức thấp đến trung bình (5% – 10%) trong thời gian dài hơn. Tăng trưởng không bị ảnh hưởng (tăng 1g mỗi tuần) ngoại trừ các ao nuôi tôm có biểu hiện hội chứng phân trắng. Không có dấu hiệu lâm sàng nào khác đặc trưng cho WSSV, IHHNV hoặc các bệnh khác được quan sát thấy ở tôm bị ảnh hưởng. Trong tất cả các trang trại, các thông số chất lượng nước như nhiệt độ, pH, độ mặn và oxy hòa tan lần lượt nằm trong khoảng từ 28 đến 32°C, 7 đến 8, 0 ‰ đến 28 ‰ và 5 đến 6 mg/L.
3.2 Vi khuẩn học
Ước tính tải lượng vi sinh vật trong bùn đáy ao, nước và haemolymph của tôm bị ảnh hưởng cho thấy tổng số vi khuẩn hiếu khí (TPC) là 6,4 ± 0,8 × 10 3 x 2,8 ± 0,8 × 10 3 và 0,7 ± 0,5 × 10 2 cfu / g hoặc ml trong khi đó Tổng số vi khuẩn sống (TVC) tương ứng là 5,7 ± 0,8 × 10 2 , 2,6 ± 0,6 × 10 2 , 0,4 ± 0,1 × 10 2 cfu/g hoặc ml.
3.3 Mô bệnh học
Tôm nhiễm IMNV có biểu hiện phù nề, các sợi cơ xơ, hoại tử đông máu với xung huyết trong cơ, phì đại cơ quan lympho (LO) và tổ chức lympho (LOS) ở cơ tim (Hình 1b- d). Ở tôm bị ảnh hưởng bởi IMNV, có thể quan sát thấy các giai đoạn phát triển của EHP và bào tử trong tế bào biểu mô của ống gan tụy . Sự lây nhiễm đơn lẻ của tôm bị nhiễm EHP cũng cho thấy thể bao tế bào chất và tế bào ưa bazơ trong các giai đoạn phát triển của plasmodia (Hình 2a). Sự thoái hóa và hoại tử của các ống gan tụy, các tế bào biểu mô ống bị bong tróc và sự hiện diện của các bào tử microsporidian trưởng thành trong lòng ống đã được quan sát thấy trong các mô gan tụy của tôm bị nhiễm bệnh nặng (Hình 2b).
3,4 Chẩn đoán phân tử
3.4.1 PCR và RT-PCR
Phương pháp nested-RT-PCR để phát hiện IMNV sử dụng hai bộ mồi PCR tạo ra amplicon một bước 328 bp và amplicon hai bước 139 bp . Trong số mười hai ao, mỗi ao ở Andhra Pradesh và Tamil Nadu bị ảnh hưởng bởi IMNV, trong khi tôm từ một ao duy nhất của Tamil Nadu chỉ bị ảnh hưởng bởi EHP. Tôm trong bảy ao còn lại đồng nhiễm IMNV và EHP. Kết quả cho thấy tôm ở 11 trong số 12 ao dương tính với IMNV theo PCR bước đầu tiên hoặc lồng ghép (Bảng 1, Hình 3).
Tôm trong các ao được phát hiện dương tính bằng PCR bước đầu tiên, có các dấu hiệu lâm sàng đặc trưng của IMNV, cho thấy mức độ nghiêm trọng của bệnh. Trong trường hợp tôm dương tính với IMNV, không phải tất cả các mẫu gộp chung đều dương tính nhất quán, cho thấy mức độ nhiễm bệnh thấp. Mặc dù kích thước mẫu hạn chế trong nghiên cứu này, chúng tôi đã quan sát thấy nhiều trường hợp IMNV hơn trong vụ hè so với vụ đông. Một quan sát thú vị khác là sự hiện diện của EHP đồng nhiễm ở 2/3 số ao nuôi tôm trong nghiên cứu này, với các dấu hiệu lâm sàng liên quan đến sự tăng trưởng còi cọc với sự thay đổi kích thước tại các thời điểm. Trong trường hợp EHP, PCR đã khuếch đại kích thước amplicon dự kiến là 514 bp và 148 bp theo bước đầu tiên và PCR lồng, tương ứng (Bảng 1, Hình 4). Tất cả các virus DNA (WSSV, IHHNV) và RNA khác được liệt kê trong OIE (YHV, TSV) đều vắng mặt khi kiểm tra PCR.
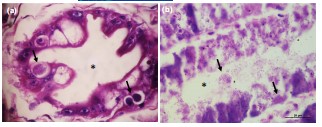
Hình 2 (a) Gan tụy của Tôm thẻ chân trắng cho thấy các giai đoạn phát triển của E. hepatopenaei trong tế bào biểu mô hình ống; (b) Các ống thoái hóa, hoại tử với các bào tử EHP trong lòng ống (dấu sao) của mô gan tụy. H&E. Thanh tỷ lệ: 20 µm
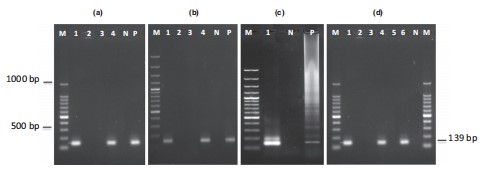
Hình 3 Phát hiện IMNV bằng RT- PCR lồng sử dụng mồi OIE tại các địa điểm khác nhau ở Ấn Độ (a- West Godavari, b- Nellore; c- Nagapattinam, d- Thiruvarur). Lane M- 100 bp DNA Ladder; Các làn từ 1 đến 6 cho biết các mẫu Tôm thẻ chân trắng gộp lại được xét nghiệm từ mỗi trại nuôi tôm; Làn đường N- đối chứng âm tính; Làn đường P- đối chứng dương tính.
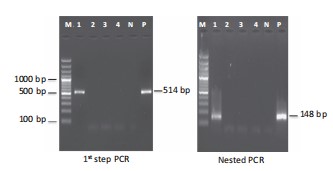
Hình 4 Phát hiện của EHP bằng PCR (Nellore, AP). Ngõ M- 100 bp thang DNA; Làn 1 đến 4 chỉ ra các mẫu tổng hợp của Tôm thẻ chân trắng; Làn đường N- Kiểm soát âm; Làn đường P-Kiểm soát tích cực [Lưu ý: Mẫu 1 dương tính với EHP theo PCR bước đầu tiên và lồng].
3.4.2 Phân tích trình tự
Sản phẩm RT-PCR được khuếch đại bằng cách sử dụng bộ mồi khuyến nghị của OIE cho IMNV đã tạo ra ~ 327 và 134 phân đoạn nucleotide cơ sở ở PCR bước đầu tiên và lồng và tương ứng. Trình tự từng phần (GenBank gia nhập số KY930468) cho thấy sự tương đồng với các gen protein cấu trúc IMNV được báo cáo từ Ấn Độ và các nước khác. Giải trình tự sản phẩm PCR (514 bp) của gen protein vách bào tử (SWP) của EHP đã tạo ra trình tự nucleotide ~ 498 bp. Nó cho thấy danh tính 100% với các trình tự tương tự (dữ liệu không được hiển thị) được gửi trong NCBI từ Ấn Độ và Thái Lan (số gia nhập GenBank. KY483639 và KX258197).
4/ THẢO LUẬN
Ngành nuôi tôm Ấn Độ đóng góp 17,5% lượng tôm nuôi toàn cầu với sản lượng hơn 690.000 tấn trong giai đoạn 2017– 2018. Sự gia tăng phi thường này chủ yếu là do sự ra đời của tôm thẻ chân trắng Thái Bình Dương, Thẻ chân trắng vào năm 2009, thực hành sàng lọc tôm bố mẹ nhập khẩu. và sản xuất tôm giống sạch bệnh (PL) để thả giống. Kể từ đó, sản lượng tôm thẻ chân trắng đã tăng ổn định và đạt 622.000 tấn với kim ngạch xuất khẩu 5 tỷ USD (MPEDA, 2019). Bất chấp những nỗ lực này, các bệnh truyền nhiễm do virus, vi khuẩn và ký sinh trùng vẫn tiếp tục gây ra thiệt hại kinh tế cho người nuôi tôm. Trong những ngày nuôi tôm sú, virus gây bệnh chủ yếu nhất là WSSV, IHHNV, MBV và HPV; các mầm bệnh xuất hiện thường xuyên ngày nay trong nuôi tôm thẻ chân trắng bao gồm WSSV, sau đó là một loại ký sinh trùng microsporidian ở tôm mới xuất hiện gần đây, E. hepatopenaei. Các thiệt hại kinh tế do EHP được cho là do tốc độ tăng trưởng chậm bất thường trong giai đoạn đầu của quá trình nuôi, dẫn đến giảm kích cỡ thu hoạch, dẫn đến thiệt hại về sản lượng nói chung. Bệnh hoại tử cơ do IMNV là một bệnh do virus gây ra ở tôm thẻ chân trắng với tỷ lệ chết từ 40% đến 70% trong các ao bị ảnh hưởng và thiệt hại kinh tế hơn 1,0 tỷ đô la cho ngành tôm toàn cầu kể từ năm 2002 (Tang và cộng sự., 2019). IMN với các dấu hiệu lâm sàng như hoại tử từ cục bộ đến lan rộng, màu trắng đục và đỏ ở cơ bụng cũng gây ra dịch bệnh trong thập kỷ qua ở nhiều nước Đông Nam Á bao gồm Indonesia (2006) và gần đây nhất là ở Ấn Độ (2016), Malaysia (2018) và Indonesia (2018). Tại Ấn Độ, báo cáo xác nhận đầu tiên về sự xuất hiện của bệnh virus kỳ lạ này đã được ghi nhận ở một số trại nuôi tôm ở Tây Bengal (Hameed và cộng sự., 2017). Trong nghiên cứu này, chúng tôi đã cố gắng giám sát tích cực dựa trên báo cáo triệu chứng của IMNV ở hai huyện được chọn, mỗi huyện ở Andhra Pradesh và Tamil Nadu, trung tâm nuôi tôm chính ở Ấn Độ.
Các phân tích RT-PCR xác nhận sự hiện diện của IMNV trong các ao nuôi tôm bị ảnh hưởng được lấy mẫu từ các huyện Nellore và Tây Godavari ở Andhra Pradesh, bên cạnh các huyện Nagapattinam và Thiruvarur ở Tamil Nadu. Tuy nhiên, kết quả PCR khác nhau ở các trang trại khác nhau về mức độ nghiêm trọng. Mỗi trang trại ở Nellore và Nagapattinam cho thấy bước đầu tiên dương tính với cả IMNV và EHP là đồng nhiễm, trong khi hầu hết các mẫu trang trại khác đều có PCR lồng dương tính với một hoặc cả hai mầm bệnh này. Nghiên cứu hiện tại chỉ ra rằng IMNV gây ra tỷ lệ chết dần dần và mức độ thấp với các triệu chứng biến màu trắng của cơ bụng ở các trại nuôi Thẻ chân trắng nằm trong các túi riêng biệt và thường bị bỏ qua. Hơn nữa, các trường hợp lâm sàng thường bị nhầm lẫn với sự thay đổi kích thước và tăng trưởng chậm trong trường hợp đồng nhiễm IMNV và EHP, bệnh sau này là một bệnh phổ biến trong điều kiện đồng ruộng. Trong trường hợp tôm có biểu hiện thay đổi về tăng trưởng, gan tụy của tôm bị ảnh hưởng cho thấy những thay đổi về mô học tương tự như trường hợp nhiễm EHP như đã báo cáo trước đó (Tourtip và cộng sự, 2009), đây là một xét nghiệm xác nhận bệnh vi khuẩn gan tụy do EHP gây ra. Tỷ lệ chết cũng dao động từ 15% đến 40% tùy thuộc vào các điều kiện phổ biến trong ao nuôi thương phẩm, bao gồm mật độ thả cao, độ mặn, nhiệt độ nước và các biện pháp an toàn sinh học không đầy đủ.
EHP, một vấn đề phổ biến trong những năm gần đây, làm tổn thương gan tụy trong quá trình chuyển hóa chất dinh dưỡng bị suy giảm dẫn đến các dấu hiệu lâm sàng như thay đổi kích thước, chậm phát triển, nhiễm vi khuẩn thứ cấp và gây chết ở mức độ nhẹ (Biju và cộng sự, 2016). Hệ vi sinh vật của trầm tích và nước ao không đại diện cho bất kỳ loài trực khuẩn ưu thế nào, bằng chứng là TPC và TVC đều nằm trong khoảng thấp hơn cho thấy có sự xáo trộn trong môi trường nuôi. Một lượng lớn nước ao chứa mầm bệnh lại được xả ra môi trường sau đợt bùng phát dịch. Các bào tử EHP có khả năng chống chịu cao với các điều kiện môi trường khắc nghiệt, tồn tại trong môi trường nước lợ ít nhất 1 năm rưỡi và do đó có thể tồn tại trong ao nuôi tôm (CIBA, 2019) để lây nhiễm sang vụ sau. Mặc dù thực hiện các quy trình quản lý tốt hơn giúp ngăn chặn sự lây lan của dịch bệnh, chất lượng con giống kém do một số trại sản xuất giống cung cấp và người nuôi không tuân thủ các kiểm tra nghiêm ngặt về mầm bệnh được cho là nguyên nhân gây ra mức độ nghiêm trọng của dịch bệnh trong nước.
Tôm nhiễm IMNV có thể bị đồng nhiễm với các mầm bệnh khác như WSSV ở Brazil (Feijo và cộng sự, 2013) và Bệnh đục cơ trên tôm càng xanh (MrNV) ở Indonesia (Senapin và cộng sự, 2013). Tương tự, lây nhiễm kép EHP với TSV (Tang và cộng sự., 2017), WSSV (Thamizhvanan và cộng sự., 2019) và các bệnh trực khuẩn khác do Vibrio spp. (Aranguren và cộng sự, 2017; Han và cộng sự, 2020) đã được báo cáo ở tôm thẻ chân trắng. Hơn nữa, tôm nhiễm EHP đã được báo cáo là dễ bị bệnh hoại tử gan tụy cấp tính (AHPND) và hoại tử gan tụy (SHPN) trong điều kiện đồng ruộng (Aranguren và cộng sự, 2017; Biju và cộng sự, 2016; Han và cộng sự, năm 2020). Tại Ấn Độ, một cuộc khảo sát ngẫu nhiên đối với tôm giống được thực hiện để sàng lọc dịch bệnh. Nó cho thấy 1/4 số tôm giống được gửi có kết quả xét nghiệm dương tính với EHP qua phương pháp nested-PCR, ngay cả ở những ấu trùng có vẻ khỏe mạnh. Do đó, nguyên nhân dẫn đến việc không cung cấp được con giống không nhiễm EHP cho nông dân cần được xác định, giải quyết và khắc phục để ngăn chặn sự lây lan trên diện rộng theo địa lý, ngay cả ở các vùng nội địa trong nước. Sự thay đổi của động thái dịch bệnh, sự phụ thuộc quá mức vào một loài nuôi duy nhất làm dấy lên những lo ngại nghiêm trọng, mặc dù tôm bố mẹ SPF được nhập khẩu từ nhiều quốc gia khác nhau (Remany và cộng sự, 2010) để sản xuất tôm giống sạch bệnh.
Do đó, nguồn lây nhiễm IMNV trong các trang trại nuôi tôm ở Ấn Độ không được rõ ràng trong nghiên cứu này và các nghiên cứu tiếp theo được đảm bảo về tác động hiệp đồng của việc đồng nhiễm IMNV với các mầm bệnh lưu hành khác, đặc biệt là WSSV và EHP, những nguyên nhân tạo nên các vấn đề dịch bệnh chính ở Ấn Độ. Cho đến gần đây, IMNV chưa được báo cáo trên tôm penaeid nuôi tại các trang trại ở Ấn Độ. Hameed và cộng sự. (2017) xác nhận dịch IMNV bùng phát với tỷ lệ chết từ 20% – 50% ở các trang trại nuôi tôm nằm ở Quận Purba Medinipur của Tây Bengal, Ấn Độ.
Nghiên cứu này cũng cho thấy sự lan rộng theo chiều ngang dọc theo bờ biển phía đông của Ấn Độ đến một khu vực địa lý rộng lớn hơn gây ra thiệt hại về mặt kinh tế cho người nông dân. Sự hiện diện của IMNV trong tôm sú P. monodon trưởng thành hoang dã được thu thập từ Ấn Độ Dương vào tháng 4 năm 2018 đã được xác nhận bằng RT-PCR lồng nhau với độ giống nhau về trình tự 99% – 100% (NACA, 2020). Phát hiện này rất có ý nghĩa, vì một tỷ lệ nhỏ các trang trại ở Ấn Độ vẫn đang nuôi tôm sú P. monodon ở các vùng khác nhau của đất nước bằng cách sử dụng tôm bố mẹ có nguồn gốc từ tự nhiên. Những con tôm đánh bắt tự nhiên như vậy, có vẻ như khỏe mạnh, có thể được coi là những ổ chứa môi trường và mang mầm bệnh cũng có thể gây ra nguy cơ ô nhiễm lớn trong các trại sản xuất giống. Có thể, IMNV có thể bắt nguồn từ các trại giống bị ô nhiễm như vậy thông qua tôm giống được thả trong các ao có tiền sử nhiễm EHP trong lần nuôi trước đó.
Quản lý dịch bệnh chủ yếu dựa vào việc tuân thủ nghiêm ngặt việc thả tôm giống sạch bệnh theo các biện pháp an toàn sinh học để ngăn ngừa nhiễm bệnh trong quá trình nuôi thương phẩm (Lightner, 2005). Tại Ấn Độ, tôm bố mẹ SPF nhập khẩu từ các nhà cung cấp ở nước ngoài được kiểm duyệt tại Cơ sở Kiểm dịch Nuôi trồng Thủy sản (AQF), Chennai để đảm bảo rằng chúng không có mầm bệnh được OIE liệt kê trước khi đưa vào các cơ sở sản xuất giống. Do đó, để ngăn chặn việc xâm nhập của các mầm bệnh ngoại lai vào trại giống, nên mua đàn giống SPF có kết quả xét nghiệm âm tính với bệnh tật và cho chúng ăn các loại giun nhiều tơ, nghêu đông lạnh hoặc tiệt trùng, v.v. Việc xâm nhập của các nguồn nhiễm vào trại giống có thể tránh được bằng cách thực hành các kỹ thuật chuẩn bị ao nuôi khoa học, sau đó chỉ thả tôm giống sạch bệnh. Nghiên cứu sâu hơn được đảm bảo để tăng cường quản lý an toàn sinh học của các trang trại và các biện pháp an toàn sinh học nghiêm ngặt đối với thực hành sản xuất ở cấp trại giống. Cần có các biện pháp can thiệp cụ thể thông qua chuỗi sản xuất bao gồm sàng lọc tôm bố mẹ, chuẩn bị ao nuôi, quản lý trang trại và xả nước từ các ao bị ảnh hưởng để đảm bảo không có nguồn nhiễm.
5/ KẾT LUẬN
Nghiên cứu này đã khảo sát sự xuất hiện của IMNV trên tôm của Ấn Độ. Sự phát triển của các dấu hiệu lâm sàng điển hình với mức độ cơ trắng khác nhau và tỷ lệ chết ở mức độ thấp, sự hiện diện của các tổn thương mô bệnh học đặc trưng ở cơ và cơ quan lympho, phát hiện RNA của virus trong các mô và trình tự tương đồng, IMNV đã được xác nhận ở các trang trại nuôi tôm dọc theo bờ biển phía đông. Tuy nhiên, phần lớn các trang trại có tôm bị nhiễm EHP, một số trong số đó có biểu hiện thay đổi về kích thước. Báo cáo này là một trong những nghiên cứu rất hạn chế về sự xuất hiện của IMNV như một vấn đề sức khỏe mới nổi ở các trang trại nuôi tôm ở tiểu lục địa Ấn Độ. Sự xuất hiện đồng thời của nhiễm IMNV và EHP sẽ thực sự có tác động đáng kể đến sản xuất tôm nếu nó lây lan sang các trang trại khác. Các biện pháp kiểm soát và phòng ngừa lây nhiễm IMNV bao gồm áp dụng Thực hành Quản lý Tốt nhất (BMP) trong trại giống, sàng lọc tôm giống (PL) để tìm IMNV để chống lại sự lây truyền dọc, các biện pháp an toàn sinh học, thu hoạch khẩn cấp và các phép đo kiểm dịch thích hợp để ngăn chặn và ngăn chặn sự lây lan theo chiều ngang của bệnh. Do đó, giám sát dựa trên rủi ro đối với dịch bệnh động vật thủy sản là nhu cầu hàng ngày để thực hiện một hệ thống cảnh báo sớm và chiến lược phản ứng nhanh để kiểm soát dịch bệnh.
Nhóm tác giả: Karingalakkandy Poochirian Jithendran | Areekkal Navaneeth Krishnan |Vengatesan Jagadeesan | Ramalingam Anandaraja | Peter Ezhil Praveena | Sivakumar Anushya | Chandrasekaran Bala Amarnath | Thangavelu Bhuvaneswari.
Biên dịch: Trầm Minh Nhựt – Tôm giống gia hoá Bình Minh
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Cơ Quan Quản Lý Ở Châu Âu Xem Xét Lại Độ An Toàn Của Ethoxyquin
- Liệu Salicornia Có Thể Xử Lý Hiệu Quả Nước Thải Trong Nuôi Trồng Thủy Sản Không?
- Các Nhà Nghiên Cứu Lo Ngại Về Độ An Toàn Của Chế Phẩm Sinh Học Trong Nuôi Trồng Thủy Sản

 English
English 中文 (中国)
中文 (中国)