Tóm tắt
Một nghiên cứu đã được thực hiện để đánh giá tác dụng của chế phẩm sinh học Bacillus amyloliquefaciens đối với hệ thống biofloc trong nuôi tôm thẻ chân trắng Litopenaeus vannamei. Hai liều men vi sinh đã được thử nghiệm: 103 cfu/mL và 104 cfu/mL. Kết quả cho thấy, men vi sinh có tác động tích cực đến hệ thống miễn dịch của tôm, đặc biệt là trong giai đoạn biofloc trưởng thành. Trong giai đoạn này, điều kiện môi trường bất lợi hơn cho tôm phát triển do sự tích tụ nitrit. Vì vậy, tác dụng của men vi sinh đặc biệt quan trọng trong giai đoạn này khi tôm bị căng thẳng và dễ mắc bệnh hơn. Tuy nhiên, men vi sinh không làm tăng lợi ích của hệ thống biofloc về hoạt động của vi sinh vật, chất lượng nước và sự phát triển của tôm.
1. Giới thiệu
Công nghệ biofloc (BFT) là một hệ thống sản xuất nuôi trồng thủy sản bền vững, sử dụng vi sinh vật để duy trì chất lượng nước và tăng năng suất. Trong các hệ thống BFT, chúng ta có thể tìm thấy các vi sinh vật khác nhau, chẳng hạn như vi khuẩn, thực vật phù du, luân trùng, động vật nguyên sinh và động vật giáp xác chân chèo, chúng tương tác với các chất dinh dưỡng và chất hữu cơ có trong nước và tạo thành biofloc. Biofloc được hình thành do các chất hữu cơ (thức ăn thừa, sinh vật chết, bộ xương cũ của tôm, v.v.) và các vi sinh vật (vi khuẩn, thực vật phù du, luân trùng, v.v.) có xu hướng kết tụ. Vi khuẩn phổ biến nhất trong các hệ thống nuôi trồng thủy sản là vi khuẩn dị dưỡng và tự dưỡng.
Một mặt, vi khuẩn dị dưỡng loại bỏ các hợp chất nitơ hòa tan trong nước hiệu quả hơn vi khuẩn tự dưỡng. Các hợp chất nitơ được chuyển đổi thành protein vi sinh vật có thể được các loài nuôi trồng tiêu thụ, chẳng hạn như tôm. Mặt khác, vi khuẩn tự dưỡng oxy hóa các hợp chất nitơ. Quá trình trưởng thành của hệ thống BFT có hai giai đoạn. Đầu tiên, giai đoạn chưa trưởng thành được đặc trưng bởi không có cộng đồng vi khuẩn và sự tích tụ amoni và nitrit. Thứ hai, khi cộng đồng vi khuẩn phát triển, hệ thống đã trưởng thành và amoni và nitrit bị oxy hóa nhanh chóng. Lợi ích của hệ thống BFT bao gồm: Loại bỏ các hợp chất nitơ, về cơ bản là amoniac và nitrit, là lý do chính tại sao hệ thống BFT được coi là một kỹ thuật nuôi trồng thủy sản thân thiện với môi trường. Vi khuẩn trong hệ thống BFT cạnh tranh nguồn tài nguyên và không gian với các mầm bệnh và có tác dụng sinh học đối với tôm. Hệ thống BFT cũng cho phép tăng mật độ nuôi, mang lại năng suất cao hơn các hệ thống nuôi trồng thủy sản truyền thống.
Probiotic là các vi sinh vật sống, có thể mang lại lợi ích cho tôm nuôi. Chúng có thể được sử dụng để phòng ngừa hoặc điều trị bệnh, cũng như cải thiện sự phát triển và sức khỏe của tôm. Probiotic được đặc trưng bởi cơ chế hoạt động đặc biệt: (1) Sản xuất enzyme trong ruột vật chủ, làm tăng khả năng tiêu hóa thức ăn và cải thiện sự phát triển của vật chủ; (2) sản xuất các hợp chất diệt khuẩn bên trong vật chủ; (3) kích thích hệ thống miễn dịch của vật chủ, khiến nó có khả năng chống lại mầm bệnh tốt hơn; (4) cạnh tranh với phần còn lại của vi khuẩn để giành nguồn tài nguyên, có thể làm giảm sự hiện diện của mầm bệnh; và (5) duy trì chất lượng nước; men vi sinh tiêu thụ các hợp chất nitơ, chẳng hạn như nitrit và amoniac, gây độc cho các loài nuôi. Ở tôm nuôi, liều lượng men vi sinh hòa tan trong nước phụ thuộc vào loài và điều kiện nuôi. Liều từ 103 đến 108 cfu/ mL là phổ biến nhất.
Công nghệ biofloc đang được phát triển ở châu Âu, nhưng việc sử dụng probiotic vẫn còn hạn chế. Một trong những nhược điểm chính là sự lựa chọn hạn chế các sảm phẩm probiotic và thức ăn được đưa ra thị trường châu Âu. Hơn nữa, việc nhập khẩu các sản phẩm này từ các khu vực khác trên thế giới như Mỹ hay Châu Á rất khó khăn do các quy định nghiêm ngặt từ Liên minh Châu Âu. Điều này đòi hỏi các thủ tục hành chính tốn kém, không mang lại lợi nhuận cho các công ty phân phối do khối lượng bán hàng nhỏ ở Liên minh Châu Âu.
Probiotic Ecobiol Plus® bao gồm vi khuẩn Bacillus amyloliquefaciens và được bán trên thị trường ở Liên minh Châu Âu để sử dụng cho gà và lợn. Những kinh nghiệm khác nhau cho thấy những tác động tích cực trong hệ thống tuần hoàn nước nuôi trồng thủy sản. Tuy nhiên, các điều kiện của hệ thống nuôi trồng thủy sản BFT rất khác nhau và Ecobiol Plus® chưa được thử nghiệm trong quá trình trưởng thành của hệ thống biofloc.
Mục tiêu của nghiên cứu này là nghiên cứu vai trò của vi khuẩn probiotic B. amyloliquefaciens trong quá trình trưởng thành của hệ thống biofloc và tác động đối với hệ thống biofloc (động lực chất lượng nước, sự phát triển trạng thái dinh dưỡng và tiến hóa hoạt động của vi sinh vật) và đối với tôm nuôi (các thông số tăng trưởng và hệ thống miễn dịch).
2. Vật liệu và phương pháp
2.1. Vị trí và hệ thống nuôi tôm
Thí nghiệm được phát triển tại cơ sở của Đại học Politècnica de València (Grau de Gandia, Tây Ban Nha), trong 169 ngày, từ ngày 11 tháng 5 đến ngày 16 tháng 10 năm 2016. Tôm thẻ chân trắng Postlarvae (PL) sạch bệnh có trọng lượng 0,07 ± 0,04 g được phân bố trong chín bể vuông chứa 2250 L nước và có diện tích bề mặt là 3,2 m2 cho mỗi bể. Mật độ tôm là 200 con/m2. Mỗi bể chứa đầy hỗn hợp nước biển và nước ngọt có độ mặn 22,5 g/L. Nước được khử trùng bằng 10 mg/L clo, sau đó được loại bỏ bằng cách thêm 1 mg/L axit ascorbic vào bể. Các bể được đặt trong nhà kính và được sục khí liên tục. Tôm được cho ăn bằng thức ăn công nghiệp 2 lần/ngày, 40% vào buổi sáng và 60% vào buổi chiều. Các thông số chất lượng nước sau đây đã được theo dõi: Độ mặn, nhiệt độ, pH, độ kiềm, oxy hòa tan, chất dinh dưỡng và tổng chất rắn lơ lửng (TSS).
Để duy trì chất lượng nước trong hệ thống biofloc nuôi tôm thẻ chân trắng, nghiên cứu đã thực hiện các biện pháp sau: Độ mặn được duy trì ở mức 22,5 g/L bằng cách bổ sung nước ngọt khi cần thiết. Nhiệt độ nước được kiểm soát bằng cách sử dụng các loại vải che nắng khác nhau. Ban đầu, mái nhà kính được phủ một tấm vải che nắng màu trắng để giảm nhiệt độ. Sau đó, tấm vải che nắng được thay thế bằng tấm vải che nắng đen để tăng nhiệt độ. Cuối cùng, tấm vải che nắng đen đã được dỡ bỏ do nhiệt độ môi trường thấp hơn vào cuối mùa hè và đầu mùa thu. Độ pH được duy trì trong khoảng từ 7 đến 9 (hơi kiềm) bằng cách bổ sung canxi hydroxit khi cần thiết. Độ kiềm được duy trì trên 50 mg CaCO3/L bằng cách bổ sung natri bicarbonate khi cần thiết.
Hệ thống bón phân ban đầu bằng sucrose (15 mg/L cacbon), để tạo điều kiện thuận lợi cho sự phát triển ban đầu của vi khuẩn dị dưỡng. Trong thí nghiệm, sucrose đã được thêm vào với tỷ lệ C:NTA là 15:1, khi amoniac do tôm và chất hữu cơ tạo ra đạt nồng độ lớn hơn 1 mg/L. Việc thay mới nước được thực hiện tối thiểu và chỉ khi mức nitrit đạt 15 mg/L, để tránh tác dụng độc hại của nitrit. Tổng lượng nước thay mới trong suốt quá trình thí nghiệm là 25% trong tất cả các bể. Lượng thức ăn được giảm 40% trong khoảng thời gian từ ngày 35 đến ngày 100 để giảm thiểu sự đóng góp của nitơ vào hệ thống.
2.2. Điều trị bằng probiotic
Trong quá trình thí nghiệm, chế phẩm sinh học Ecobiol Plus® đã được sử dụng với hàm lượng được nhà sản xuất chứng nhận là 1,3 × 1010 cfu/g bào tử sống sót của B. amyloliquefaciens ở dạng bột. Thí nghiệm được phát triển trong chín bể được phân bổ như sau: Ba bể đối chứng không có men vi sinh (điều trị đối chứng), 3 bể với liều men vi sinh là 103 cfu/mL (xử lý vi khuẩn thấp) và ba bể với liều 104 cfu/mL (xử lý vi khuẩn cao). Probiotic được bón trực tiếp vào nước hàng ngày.
2.3. Chlorophyll a và hoạt động của vi sinh vật
Để xác định diệp lục a (Chla), một lượng nước được lọc trên bộ lọc sợi thủy tinh (25 mm Ø) và siêu đông lạnh (−86 °C). Tiếp theo, các chất màu được chiết bằng phương pháp sắc ký lỏng hiệu năng cao axeton (HPLC) sau đó được đo bằng HPLC. Hoạt động của vi sinh vật được phân tích mỗi tuần một lần trong toàn bộ thí nghiệm. Phương pháp đóng chai tối màu và trong suốt của Strickland đã được sử dụng, bao gồm các bước sau: Đặt 6 chai 100 mL (3 chai tối và 3 chai trong suốt) được đặt trong mỗi bể cách mặt nước 5 cm, lắc thủ công sau mỗi 20 phút để giữ biofloc ở trạng thái lơ lửng, ủ các chai trong khoảng 8 giờ, đo oxy hòa tan vào lúc bắt đầu và kết thúc mỗi lần ủ. Hô hấp cột nước (WCR), năng suất sơ cấp ròng (NPP) và tổng năng suất sơ cấp (GPP) được tính toán bằng Công thức (1)–(3) theo Dodds và Cole.

2.4. Thông số tăng trưởng
Sinh trắc học ban đầu được thực hiện trên 100 PL với cân (Kern ABT 220-4M; ±0,0001). Sinh trắc học của 30 con tôm trong mỗi bể được thực hiện 2 tuần/ lần để theo dõi sự tăng trưởng và điều chỉnh liều lượng thức ăn cần thiết. Kết thúc thí nghiệm, đếm số lượng tôm và cân 50 con/bể. Tăng trọng, tăng cân hàng tuần, sinh khối cuối cùng, tăng sinh khối, tỷ lệ chuyển đổi thức ăn (FCR) và tỷ lệ sống được tính toán bằng các phương trình sau (Công thức (4)–(9)).

2.5. Thông số miễn dịch
Trạng thái hệ thống miễn dịch của tôm được xác định vào giữa thí nghiệm (ngày 86), khi hệ thống chưa trưởng thành và vào cuối thí nghiệm (ngày 169), khi hệ thống đã hoàn thành quá trình trưởng thành. Để phân tích hệ thống miễn dịch, bạch huyết được thu thập từ năm con tôm trong mỗi bể bằng ống tiêm vô trùng BD Plastipak® (3-8 con tôm trong mỗi bể). Mẫu được chia thành hai phần. Phần 20 μL đầu tiên được trộn với 80 μL dung dịch Alsever, để xác định tỷ lệ phần trăm tế bào máu dạng hạt (GH) và hyaline (HH) (có đường kính xấp xỉ 10–15 μm), sử dụng buồng Bürker và Leica DM kính hiển vi 2500. Phần thứ hai 500 μL được phép đông tụ trong 2 giờ ở 4°C. Sau đó, nó được ly tâm ở tốc độ 2000 × g để chiết xuất huyết thanh và đông lạnh. Sau đó, tổng nồng độ protein (TPC) được phân tích bằng phương pháp được mô tả bởi Lowry và cộng sự.
2.6. Phân tích thống kê
Kết quả của các thông số hệ thống miễn dịch được so sánh trong các giai đoạn trưởng thành khác nhau của hệ thống công nghệ Biofloc (BFT) (Bảng 3). Các kết quả được biểu thị bằng giá trị trung bình ± độ lệch chuẩn.
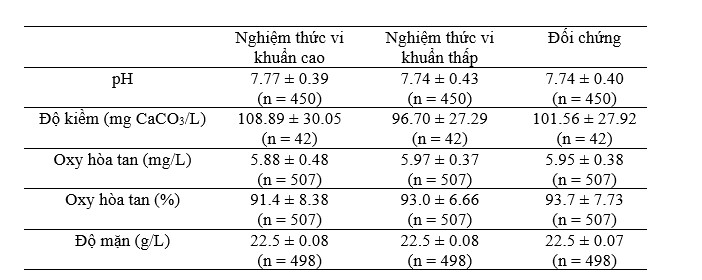
Bảng 1. Độ lệch trung bình và độ lệch chuẩn của pH, độ kiềm, độ mặn, nồng độ oxy hòa tan và phần trăm bão hòa oxy hòa tan đối với xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và nhóm đối chứng. Các giá trị n được chỉ định cho mỗi nghiệm thức.
Bảng 2. Độ lệch trung bình và độ lệch chuẩn của các thông số tăng trưởng đối với xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và nhóm đối chứng. Các giá trị n được chỉ định cho mỗi nghiệm thức.

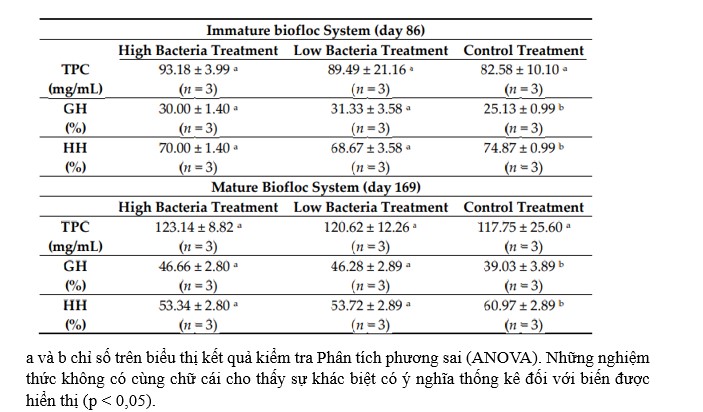
Bảng 3. Độ lệch trung bình và độ lệch chuẩn của các thông số hệ thống miễn dịch (nồng độ protein tổng số (TPC), tế bào máu hạt (GH) và tế bào máu hyaline (HH)) trong các giai đoạn tiến hóa khác nhau của công nghệ Biofloc (BFT) (BFT chưa trưởng thành và trưởng thành) đối với vi khuẩn cao xử lý (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng. Các giá trị n được chỉ định cho mỗi nghiệm thức.
3. Kết quả
3.1. Chất lượng nước
Nhiệt độ nước trong hệ thống biofloc nuôi tôm thẻ chân trắng dao động từ 22,5°C đến 31,0°C trong suốt thời gian nghiên cứu, do sự thay đổi nhiệt độ môi trường. Các tấm che bóng nhà kính được xử lý để tránh nhiệt độ quá cao. Bảng 1 cho thấy các giá trị trung bình của pH, độ kiềm, độ mặn và oxy hòa tan (nồng độ và phần trăm bão hòa) cũng như độ lệch chuẩn cho mỗi nghiệm thức. Độ pH và độ kiềm trung bình lần lượt là khoảng 7,75 và 102,38 mg CaCO3/L. Hàm lượng oxy hòa tan và độ mặn ổn định ở mức trung bình lần lượt là 5,93 mg/L và 22,5 g/L.
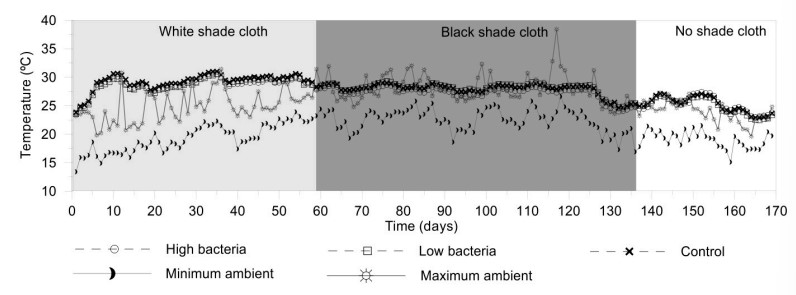
Hình 1. Sự biến đổi của nhiệt độ nước, giá trị nhiệt độ môi trường tối thiểu và tối đa được thể hiện trong suốt thời gian nghiên cứu. Mỗi dữ liệu đại diện cho mức trung bình của ba đơn vị thí nghiệm về xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng.
Trong nước, N-TA được tích lũy trong 45 ngày đầu tiên (Hình 2a), đạt giá trị tối đa là 1,44 mg/L ở nghiệm thức vi khuẩn thấp và 0,89 mg/L trong nghiệm thức vi khuẩn cao và đối chứng. N-NO2− duy trì ở giá trị rất thấp cho đến ngày thứ 35, khi nó bắt đầu tăng cho đến khi đạt tối đa 19,08 mg/L trong nghiệm thức vi khuẩn cao, 20,39 mg/L trong nghiệm thức vi khuẩn thấp và 21,10 mg/L trong nghiệm thức đối chứng. Nồng độ N-NO2– sau đó giảm dần, đạt mức rất thấp kể từ ngày thứ 118 (Hình 2b). N-NO3− được phát hiện lần đầu tiên vào ngày 90 và tăng dần để đạt giá trị tối đa vào cuối quá trình nuôi cấy (Hình 2c), khi nồng độ 65,18, 77,72 và 74,54 mg/L được đo ở vi khuẩn cao, vi khuẩn thấp và đối chứng. P-PO43− được tích lũy trong nước trong toàn bộ quá trình nuôi cấy (Hình 2d). Giá trị cao nhất được quan sát thấy vào cuối quá trình nuôi cấy, lần lượt là 17,91, 15,34 và 13,45 mg/L ở vi khuẩn cao, vi khuẩn thấp và nghiệm thức đối chứng. Nhìn chung, không có sự khác biệt đáng kể về mức độ dinh dưỡng giữa các nghiệm thức. Tuy nhiên, có xu hướng giá trị N-NO2− cao hơn trong nghiệm thức đối chứng.
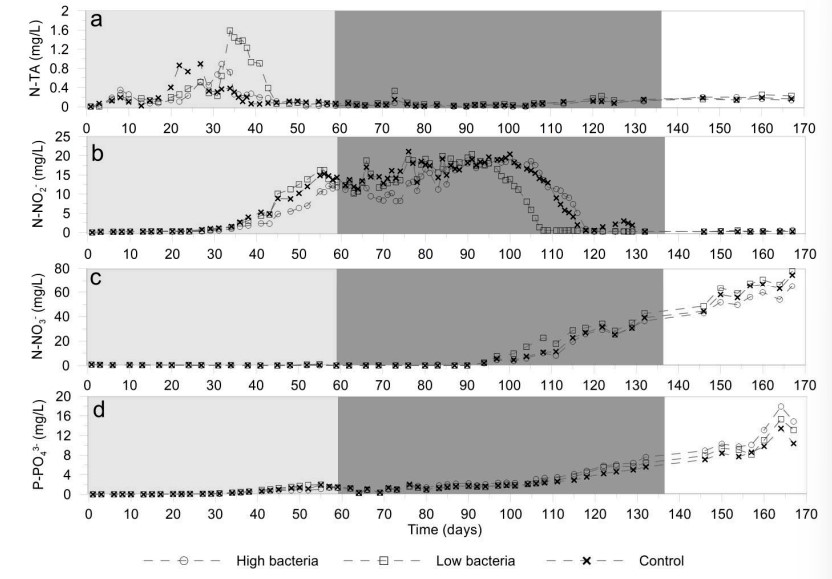
Hình 2. Sự phát triển của các chất dinh dưỡng, a) tổng lượng amoniac hòa tan, b) nitrit, c) nitrat và d) phốt phát. Mỗi dữ liệu đại diện cho mức trung bình của ba đơn vị thí nghiệm về xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng. Giữa ngày 56 và 80, khoảng 10 đến 15% lượng nước được thay mới để tránh nồng độ nitrit độc hại.
TSS được tích lũy trong hệ thống trong suốt thời gian nuôi (Hình 3). Giá trị trung bình tối đa thu được lần lượt là 1,19, 0,73 và 0,67 g/L ở nghiệm thức vi khuẩn cao, vi khuẩn thấp và nghiệm thức đối chứng. Giữa ngày 60 và ngày 130, nồng độ TSS giảm nhẹ, được tạo ra do thay nước, để kiểm soát nồng độ N-NO2− trong hệ thống.
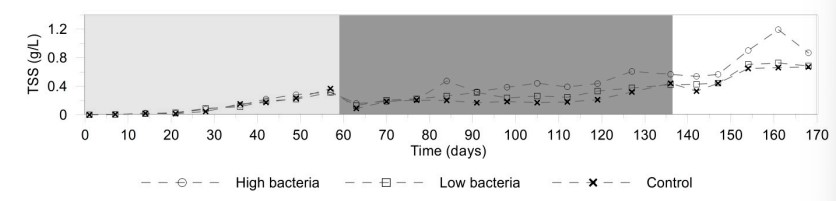
Hình 3. Sự phát triển của huyền phù rắn tổng số. Mỗi dữ liệu đại diện cho mức trung bình của ba đơn vị thí nghiệm về xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng.
3.2. Hoạt động của vi sinh vật
GPP đạt mức tối đa trong giai đoạn nuôi cấy đầu tiên, trong đó đạt được các giá trị lần lượt là 1,15, 0,93 và 0,74 mg O2/(L·h) ở vi khuẩn cao, vi khuẩn thấp và đối chứng; sau ngày thứ 58 nó vẫn ở mức dưới 0,5 mg O2/(L·h) trong tất cả các nghiệm thức (Hình 4a).
WCR tăng trong những tuần đầu tiên cho đến ngày thứ 35, sau đó duy trì ổn định trong suốt thí nghiệm, đạt mức tối đa vào ngày thứ 135 (Hình 4b). NPP dương tính trong những tuần đầu tiên, đạt mức tối đa vào ngày thứ 58, sau đó giảm dần cho đến khi kết thúc thử nghiệm. Tổng năng suất sơ cấp (GPP) tương đương với NPP. Chla (Hình 4d) ở dưới giới hạn phát hiện trong hai tuần đầu tiên, tăng dần sau đó để đạt tối đa vào giữa ngày 38 và 52. Khi nhà kính được che phủ bằng vải bóng râm màu đen, nồng độ Chla ổn định ở mức khoảng 150 μg/L. Khi tấm vải che màu đen được cởi bỏ, ngày thứ 136, người ta quan sát thấy Chla tăng lần thứ hai.
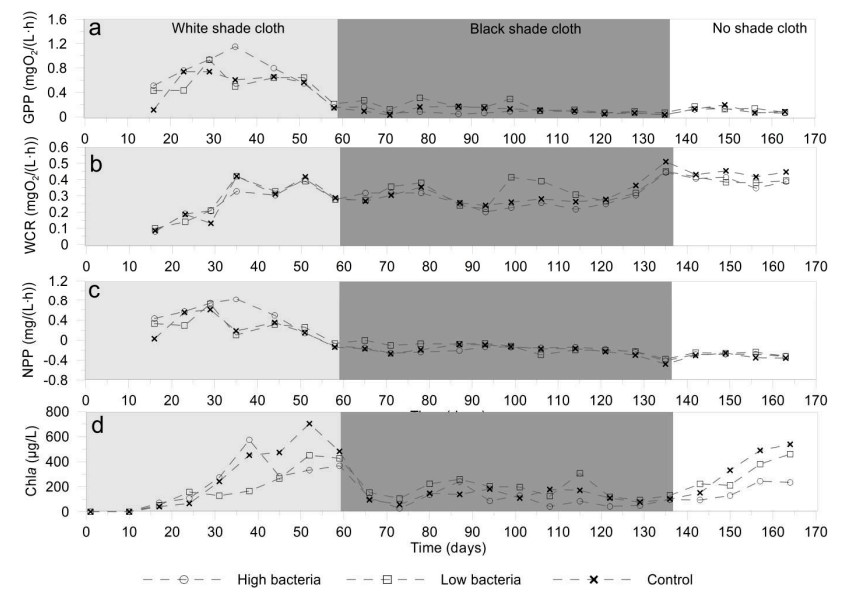
Hình 4. Sự phát triển của hoạt động vi sinh vật, a) tổng sản lượng sơ cấp, b) hô hấp cột nước, c) sản lượng sơ cấp ròng và d) chl a. Mỗi dữ liệu đại diện cho mức trung bình của ba đơn vị thí nghiệm về xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng.
3.3. Thông số tăng trưởng
Tăng trưởng của tôm ở tất cả các nghiệm thức đều như nhau (Hình 5). Khi bắt đầu thí nghiệm, tôm nặng 0,0675 ± 0,0433 g (sinh khối ban đầu 13,5074 g/m2). Chúng tăng lên lần lượt là 16,76 ± 0,15, 17,58 ± 1,41 và 17,94 ± 0,65 g ở nghiệm thức vi khuẩn cao, vi khuẩn thấp và đối chứng.
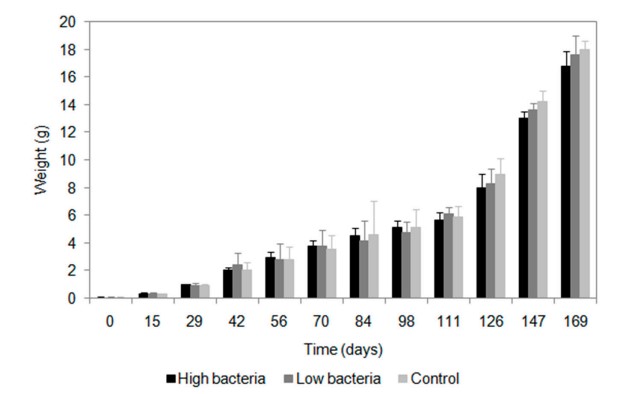
Hình 5. Tăng trọng của tôm. Mỗi thanh đại diện cho mức trung bình của ba đơn vị thí nghiệm về xử lý vi khuẩn cao (2,8 × 104 cfu/mL), xử lý vi khuẩn thấp (2,8 × 103 cfu/mL) và đối chứng.
Tăng trọng, tăng cân hàng tuần, tăng sinh khối, FCR và kết quả tỷ lệ sống được trình bày trong Bảng 2. Phân tích ANOVA cho thấy không có sự khác biệt có ý nghĩa thống kê giữa các nghiệm thức khác nhau về các thông số tăng trưởng này.
3.4. Thông số hệ thống miễn dịch
Vào ngày thứ 86, trong hệ thống tôm chưa trưởng thành, TPC của chúng tôi là khoảng 80-90 mg/mL trong hemolymp tôm. Phân tích thống kê cho thấy không có sự khác biệt đáng kể giữa các nghiệm thức (p = 0,65) (Bảng 3). Tỷ lệ GH là khoảng 30 và HH là khoảng 70% trong các nghiệm thức với B. amyloliquefaciens. Trong các giá trị nghiệm thức đối chứng lần lượt là gần 25 và 75% đối với GH và HH. Sự khác biệt (5%) giữa đối chứng và nghiệm thức bằng men vi sinh có ý nghĩa thống kê (p = 0,04).
Vào ngày thứ 169, trong hệ thống trưởng thành, TPC trong hemolymp là khoảng 120 mg/mL trong tất cả các nghiệm thức (p = 0,93). Tỷ lệ GH là khoảng 46 và HH là khoảng 54% trong các nghiệm thức với B. amyloliquefaciens. Trong nghiệm thức đối chứng, giá trị lần lượt là gần 39 và 61% đối với GH và HH. Sự khác biệt (7%) giữa đối chứng và nghiệm thức bằng men vi sinh có ý nghĩa thống kê (p = 0,04).
4. Thảo luận
4.1. Tác dụng lên hệ thống Biofloc
Thí nghiệm được thực hiện giữa mùa xuân và mùa thu ở vùng khí hậu Địa Trung Hải. Nhiệt độ nước được duy trì trong phạm vi thích hợp bằng cách sử dụng các loại vải che nắng khác nhau để kiểm soát nhiệt độ môi trường bên trong nhà kính.
Oxy hòa tan vẫn ở mức trên 5 mg/L và độ bão hòa 85% trong suốt thí nghiệm. Cả độ pH và độ kiềm đều giảm trong suốt thí nghiệm. nhưng không ảnh hưởng đến quá trình nitrat hóa. Việc bổ sung natri bicarbonate và canxi hydroxit đã giúp duy trì độ pH và độ kiềm tương ứng trong các giá trị tối ưu.
Trong hệ thống biofloc, các hợp chất nitơ (N-TA, N-NO2− và N-NO3−) tuân theo sự phát triển thông thường, với N-TA tích lũy trong giai đoạn BFT chưa trưởng thành, N-NO2− xuất hiện trong giai đoạn trưởng thành và N-NO3− được tích trong giai đoạn BFT trưởng thành. Trong thí nghiệm này, N-TA không vượt quá mức độ an toàn đối với việc nuôi tôm thẻ chân trắng L. vannamei, nhưng N-NO2− đã vượt quá giới hạn an toàn trong khoảng 30–40 ngày. B. amyloliquefaciens nảy mầm có thể loại bỏ N-NO2− trong phòng thí nghiệm, nhưng có tác dụng đáng kể trong hệ thống biofloc trưởng thành. P-PO43− và N-NO3− được tích lũy trong nước trong suốt quá trình nuôi cấy, đạt mức tương tự như mức quan sát được trong các thí nghiệm khác.
Sự phát triển của TSS tương tự như các thí nghiệm khác, nhưng cao hơn một chút so với mức tối ưu. Nồng độ oxy hòa tan không giảm xuống dưới 5 mg/L nên không cần thiết phải sử dụng bất kỳ kỹ thuật loại bỏ chất rắn nào. Kết quả thu được cho thấy, việc ứng dụng bào tử B. amyloliquefaciens không ảnh hưởng đến hoạt động của các hợp chất nitơ và TSS trong hệ thống biofloc.
Trong hệ thống biofloc, giá trị Chla trung bình là khoảng 150 μg/L, tương tự như các nghiên cứu khác. Nồng độ Chla tối đa (703,58 μg/L) cao hơn nồng độ được Gaona và cộng sự và Emerenciano và cộng sự (500 μg/L), mặc dù nó thấp hơn mức quan sát của Schrader và cộng sự. Nồng độ Chla trong BFT rất khác nhau và phụ thuộc vào nhiều yếu tố. Trong thí nghiệm này, hai đỉnh Chla được quan sát thấy ở đầu và cuối thí nghiệm. Đỉnh đầu tiên được quan sát thấy với tấm vải che nắng màu trắng và đỉnh thứ hai khi tấm vải che nắng được loại bỏ. Động lực của NPP, WCR và GPP tương tự như các nghiên cứu khác, trong đó WCR tăng và GPP giảm, chủ yếu trong hai tháng đầu nuôi cấy. Giá trị WCR trong nghiên cứu này khoảng 0,45 mg O2/(L·h) và thấp hơn so với các nghiên cứu chỉ thu được giá trị trên 1 mg O2/(L·h). Sự tiến hóa của NPP cho thấy ưu thế của các quá trình tự dưỡng trong BFT trong những tuần đầu nuôi, được đặc trưng bởi mức tiêu thụ oxy thấp hơn so với sản xuất. Kể từ ngày thứ 58, đã quan sát thấy sự thay đổi trạng thái dinh dưỡng sang ưu thế của các quá trình dị dưỡng. Sự gia tăng của Chla cho thấy ở cuối thí nghiệm không dẫn đến sự gia tăng GPP và NPP. Do đó, sự thay đổi trạng thái dinh dưỡng của BFT không phải do sự tiến hóa của Chla mà là do sự tiến hóa của quần thể vi khuẩn.
Quá trình nitrat hóa tạo ra một lượng vi khuẩn đáng kể, khiến quá trình dị dưỡng chiếm ưu thế trong hệ thống nuôi cấy. WCR tăng chậm qua các tuần, cùng lúc với TSS tăng, tiêu thụ lượng oxy hòa tan trong nước.
4.2. Tác dụng trên tôm
Tỷ lệ sống sót và tăng trưởng của tôm trong hệ thống biofloc tương tự như các nghiên cứu khác, với tỷ lệ sống sót trung bình là khoảng 60% và tốc độ tăng trưởng hàng tuần là khoảng 0,7 g/tuần. Sự gia tăng hàm lượng nitrit trong giai đoạn nuôi cấy quan trọng (từ ngày 70 và 110) đã dẫn đến tỷ lệ sống thấp hơn và giảm tốc độ tăng trưởng của tôm. Trong giai đoạn này, hàm lượng nitrit đã vượt quá mức an toàn (15mg/L), buộc các nhà nghiên cứu phải giảm lượng thức ăn cho tôm xuống 60%. Tuy nhiên, chúng tôi chưa quan sát thấy tác dụng này khi áp dụng chế phẩm sinh học này trong BFT. Có thể là do lượng protein hấp thụ từ việc tiêu thụ bioflocs mang lại nhiều lợi ích dinh dưỡng hơn so với việc B. amyloliquefaciens tạo ra các enzyme tiêu hóa trong đường tiêu hóa của tôm, không cho thấy bất kỳ sự khác biệt nào giữa các nghiệm thức.
Trong quá trình thí nghiệm, hệ thống miễn dịch được phân tích khi BFT ở hai trạng thái khác nhau, biofloc chưa trưởng thành (ngày 86) và biofloc trưởng thành (ngày 169). Tỷ lệ tế bào máu dạng hạt và hyaline trong hemolymp nằm trong phạm vi được quan sát bởi các tác giả khác nhau đối với L. vannamei. Trong lần lấy mẫu đầu tiên, quan sát thấy tỷ lệ GH cao hơn 5% ở cả hai nghiệm thức với B. amyloliquefaciens. Trong lần lấy mẫu thứ hai, sự khác biệt giữa nghiệm thức sử dụng men vi sinh và nghiệm thức đối chứng là 7%. Những kết quả này cho thấy việc áp dụng B. amyloliquefaciens làm tăng tỷ lệ GH so với HH. GH có các cơ chế hoạt động khác nhau chống lại mầm bệnh như thực bào, đóng gói, gây độc tế bào và lưu trữ và giải phóng prophenoloxidase vào hệ thống. HH chỉ chống lại mầm bệnh bằng thực bào, khiến chúng kém hiệu quả hơn trong việc chống lại mầm bệnh. Khi hệ thống biofloc chưa trưởng thành, hàm lượng nitrit cao hơn mức an toàn.
Việc áp dụng B. amyloliquefaciens làm tăng đáng kể tỷ lệ GH trong hemolymp. Hiệu ứng này rất đáng kể trong giai đoạn biofloc chưa trưởng thành và nồng độ nitrit cao và gây căng thẳng cho tôm.
Mức tăng GH 7% tương đương với mức tăng do các chế phẩm sinh học hoặc thành phần thực phẩm khác gây ra. B. amyloliquefaciens có tác dụng tốt hơn đối với hệ thống miễn dịch so với các chế phẩm sinh học khác và việc kết hợp B. amyloliquefaciens với các chủng vi sinh vật khác có thể mang lại lợi ích hơn so với tôm nuôi trong BFT. TPC của tôm trong các nghiệm thức khác nhau đáng kể. B. amyloliquefaciens có thể là một chất bổ sung tiềm năng cho các hệ thống biofloc để cải thiện sức khỏe của tôm và giảm nguy cơ mắc bệnh.
Trong hệ thống biofloc, tỷ lệ tế bào máu dạng hạt (GH) và tổng protein tan trong máu (TPC) của tôm thẻ chân trắng tăng lên đáng kể khi hệ thống trưởng thành. Ngoài ra, TPC tăng 34 mg/mL (p = 0,00) từ ngày 86 lên ngày 169. Mặc dù sự tăng trưởng của tôm có thể ảnh hưởng tích cực đến mức TPC, nhưng sự trưởng thành của BFT và việc loại bỏ nitrit do vi khuẩn BFT gây ra giúp cải thiện khả năng miễn dịch của tôm. Việc bổ sung chế phẩm sinh học B. amyloliquefaciens vào hệ thống biofloc có thể giúp tăng cường hệ thống miễn dịch của tôm, đặc biệt là trong giai đoạn trưởng thành của hệ thống. B. amyloliquefaciens có hiệu quả khi bón vào nước với liều ít nhất là 103 cfu/mL, liều lượng thấp hơn đáng kể so với liều lượng được sử dụng bởi các tác giả khác trong nuôi tôm.
5. Kết Luận
Việc bổ sung B. amyloliquefaciens vào hệ thống biofloc trưởng thành không có ảnh hưởng đáng kể đến chất lượng nước, động lực dinh dưỡng, trạng thái dinh dưỡng hoặc mức độ chl a. Tuy nhiên, B. amyloliquefaciens có thể giúp tăng cường hệ thống miễn dịch của tôm thẻ chân trắng, đặc biệt là trong giai đoạn biofloc chưa trưởng thành. B. amyloliquefaciens có hiệu quả ở liều 103 cfu/mL, liều lượng thấp hơn đáng kể so với liều lượng được sử dụng bởi các tác giả khác. Việc sử dụng B. amyloliquefaciens với liều lượng thấp hơn có thể giúp tiết kiệm chi phí và giảm tác động môi trường của nuôi trồng thủy sản.
Theo Ferran Llario, Silvia Falco, María-Teresa Sebastiá-Frasquet, Julia Escrivá, Miguel Rodilla, Luís Henrique Poersch
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Sản Xuất Tôm Thẻ Chân Trắng Ở Trung Quốc
- Xử Lý Nước Thải Trại Giống Tôm
- Shrimp III: Dịch bệnh và lợi nhuận

 English
English 中文 (中国)
中文 (中国)