Tóm tắt
Nghiên cứu này nhằm đánh giá và xác định việc sử dụng men vi sinh Lactobacillus pentosus BD6 qua đường miệng đến hiệu suất tăng trưởng, khả năng miễn dịch và khả năng kháng bệnh của tôm thẻ chân trắng Litopenaeus vannamei. Tôm được cho ăn khẩu phần ăn có chứa Lactobacillus pentosus BD6 ở mức 109-10 cfu/ kg cho thấy sự gia tăng đáng kể về hiệu suất tăng trưởng, hiệu quả sử dụng thức ăn, khả năng miễn dịch và khả năng kháng bệnh chống lại Vibrio alginolyticus. Tôm được cho ăn khẩu phần ăn có chứa men vi sinh Lactobacillus pentosus BD6 ở mức 1010 cfu/ kg cho thấy tỷ lệ chết thấp hơn đáng kể sau khi cảm nhiễm với Vibrio alginolyticus. Ngoài ra, tôm được cho ăn khẩu phần ăn có chứa men vi sinh Lactobacillus pentosus BD6 ở mức 1010 cfu/ kg cũng cho thấy tiềm năng chữa bệnh, giúp giảm tỷ lệ chết tích lũy của tôm bị nhiễm Vibrio parahaemolyticus. Phân tích hệ vi sinh vật vi khuẩn trong ruột tôm cho thấy việc sử dụng men vi sinh bằng đường miệng làm tăng sự phong phú tương đối của vi khuẩn có lợi và làm giảm sự phong phú của vi khuẩn gây bệnh có hại trong hệ thực vật đường ruột của tôm. Kết luận là Lactobacillus pentosus BD6 là một chế phẩm sinh học tiềm năng có thể được sử dụng để cải thiện hiệu suất tăng trưởng, khả năng miễn dịch và khả năng kháng bệnh của tôm thẻ chân trắng.
1. Giới thiệu
Nuôi trồng thủy sản đóng một vai trò quan trọng trong sản xuất thủy sản, nhưng đang phải đối mặt với nhiều thách thức, bao gồm bệnh tật. Các chế phẩm sinh học, bao gồm vi khuẩn axit lactic (LAB) là một phương pháp tiếp cận thân thiện với môi trường để ngăn ngừa bệnh tật trong nuôi trồng thủy sản. LAB có thể ức chế sự phát triển của vi khuẩn gây bệnh, chẳng hạn như Vibrio, và cải thiện sức khỏe của vật chủ, bao gồm cả động vật nuôi trồng thủy sản. Ngoài việc ức chế mầm bệnh, chế phẩm sinh học còn được biết là mang lại lợi ích sức khỏe cho vật chủ, bao gồm cả động vật nuôi trồng thủy sản. Vì lý do này, chế phẩm sinh học, bao gồm LAB đã được sử dụng rộng rãi trong nuôi trồng thủy sản để cải thiện tình trạng sức khỏe hoặc hiệu suất tăng trưởng của vật nuôi. Probiotic có khả năng tăng hoạt động của enzyme tiêu hóa và cải thiện quá trình tiêu hóa thông qua việc tăng quần thể vi sinh vật có lợi, ức chế mầm bệnh gây chết hoặc điều chỉnh phản ứng miễn dịch, từ đó cải thiện khả năng tiêu hóa và hấp thu thức ăn. LAB đã được sử dụng thành công trong nuôi trồng nhiều loài thủy sản khác nhau, bao gồm cá da trơn và tôm thẻ chân trắng. LAB là một công nghệ tiềm năng để cải thiện sức khỏe và hiệu suất của động vật nuôi trồng thủy sản.
Hiệu suất tăng trưởng và tình trạng sức khỏe của vật chủ tăng lên nhờ sử dụng men vi sinh là do vi khuẩn có lợi trong ruột, có khả năng sản xuất nhiều chất dinh dưỡng khác nhau cho vật chủ, ngăn ngừa nhiễm trùng do mầm bệnh đường ruột và điều chỉnh các phản ứng miễn dịch. Ngoài ra, sự gia tăng vi khuẩn axit lactic và giảm vi khuẩn giống Vibrio ở tôm đã được phát hiện bằng phương pháp thông thường, phương pháp thạch đếm đĩa. Tuy nhiên, việc đếm khuẩn lạc bằng phương pháp đếm đĩa có độ chính xác hạn chế và đánh giá thấp số lượng khuẩn lạc vi sinh vật trong mẫu. Gần đây, phân tích metagenomics và tin sinh học đã cho phép hiểu rõ hơn về các cộng đồng vi sinh vật phức tạp trong ruột động vật. Tuy nhiên, quần thể vi sinh vật khi áp dụng chế phẩm sinh học trên tôm thẻ chân trắng vẫn còn hạn chế. Do đó, cần nghiên cứu sâu hơn bằng các phương pháp tiên tiến, chẳng hạn như giải trình tự thông lượng cao, để đánh giá và xác định chính xác những thay đổi trong cộng đồng vi sinh vật trong ruột tôm sau khi cung cấp men vi sinh.
Trong nghiên cứu này, Lactobacillus pentosus BD6 lần đầu tiên được phân lập từ phân chim bồ câu (Columba livia) để xác định hoạt tính kháng khuẩn. Kết quả cho thấy hoạt tính đối kháng cao chống lại các mầm bệnh khác nhau, bao gồm cả mầm bệnh Vibrio ở tôm. Vì vậy, Lactobacillus pentosus BD6 được sử dụng dưới dạng probiotic đường miệng để cải thiện hiệu suất tăng trưởng và tình trạng sức khỏe của tôm thẻ chân trắng. Phân tích metagenomics cũng được sử dụng để xác định hệ vi sinh vật trong ruột tôm.
2. Vật liệu và phương pháp
2.1. Chế phẩm Probiotic và hoạt tính kháng khuẩn chống lại mầm bệnh thủy sản
Phòng thí nghiệm, Lactobacillus pentosus BD6, phân lập từ phân chim bồ câu (Columba livia) có khả năng kháng khuẩn rất tốt. Đầu tiên, vi khuẩn được nuôi cấy trong môi trường De Man, Rogosa và Sharpe (MRS) trong 24 giờ ở nhiệt độ 37℃. Sau đó, vi khuẩn được thu hoạch bằng cách ly tâm ở tốc độ 1520×g trong 10 phút ở nhiệt độ 4 ℃ và rửa sạch rồi hòa tan lại trong sữa gầy 10% rồi bảo quản ở nhiệt độ −80℃. Tiếp theo, mẫu đông lạnh được sấy khô trong máy sấy đông lạnh và đồng nhất thành bột mịn. Cuối cùng, bột được đựng trong thùng nhựa và bảo quản ở nhiệt độ −4℃ cho đến khi sử dụng. Trước khi việc chuẩn bị khẩu phần ăn được hoàn tất, tỷ lệ sống của Lactobacillus pentosus BD6 được tính toán bằng phương pháp đổ đĩa sử dụng thạch MRS.
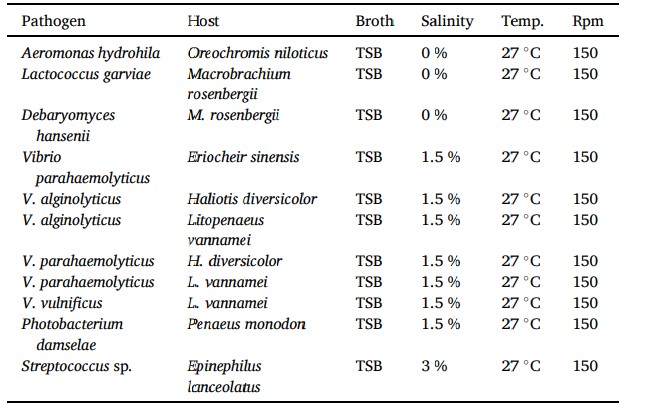
Để thử nghiệm hoạt tính kháng khuẩn của Lactobacillus pentosus BD6, một phương pháp khuếch tán giếng đã được sử dụng. Các điều kiện nuôi cấy mầm bệnh được trình bày trong Bảng 1. Tất cả các mầm bệnh được lơ lửng riêng lẻ trong nước muối thông thường vô trùng (0,85 % NaCl) và được điều chỉnh ở mức ~107 cfu/ ml. Một trăm huyền phù của từng mầm bệnh được trải trên môi trường dọc theo đĩa giấy trắng BBLTM (đường kính 6 mm, Becton, Dickinson và Company, Sparks, MD 21152 USA) có chứa phần nổi phía trên. Đĩa giấy trắng có/không có TSB vô trùng được sử dụng làm đối chứng. Tất cả các đĩa được ủ trong 24 giờ ở nhiệt độ 27℃. Hoạt tính kháng khuẩn được xác định bằng cách đánh giá đường kính vùng ức chế của vi khuẩn được thử nghiệm.
Bảng 1 Các mầm bệnh được sử dụng để thử nghiệm hoạt tính kháng khuẩn
2.2. Chuẩn bị khẩu phần ăn có chứa probiotic
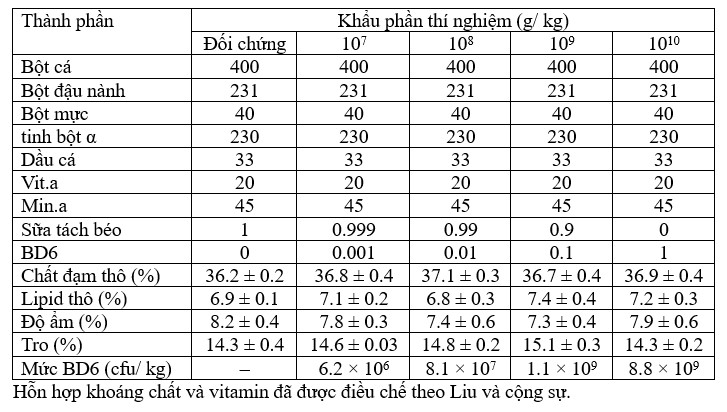
5 khẩu phần ăn thử nghiệm, bao gồm khẩu phần ăn đối chứng không bổ sung men vi sinh và bốn khẩu phần ăn thử nghiệm có chứa Lactobacillus pentosus BD6 ở các liều lần lượt là 107, 108, 109 và 1010 cfu/ kg. Công thức của khẩu phần thử nghiệm đã được chuẩn bị và các thành phần của khẩu phần thử nghiệm được liệt kê trong Bảng 2. Trước khi chuẩn bị khẩu phần, tất cả các thành phần đều được nghiền để đi qua sàng 60 lưới. Thức ăn được chuẩn bị dựa trên nhu cầu dinh dưỡng cho tôm thẻ chân trắng (37% protein và 7% lipid). Tất cả nguyên liệu được cho vào máy khuấy và thêm nước từ từ cho đến khi tạo thành khối bột cứng. Bột cứng thu được sau đó được đưa qua máy xay có khuôn để tạo thành các sợi giống như mì spaghetti và được cắt thành các viên có đường kính ~2 mm và chiều dài ~2 mm. Viên được sấy khô bằng điều hòa không khí ở nhiệt độ 20℃ khi độ ẩm thấp hơn 10 %. Các khẩu phần thí nghiệm được bảo quản riêng trong túi nhựa vô trùng trong suốt và giữ ở nhiệt độ 4℃ trước khi sử dụng. Khả năng tồn tại của probiotic trong khẩu phần thử nghiệm đã được đánh giá trước khi thử nghiệm và sau một tháng trong quá trình thử nghiệm, một đánh giá khác đã được thực hiện.
Bảng 2 Thành phần của khẩu phần thí nghiệm
2.3. Nuôi tôm
Tôm được cho ăn hàng ngày với khẩu phần đối chứng trong quá trình thích nghi, 3% thức ăn theo trọng lượng cơ thể và được nuôi 7 ngày trong bể xi măng (6 × 2 × 1 m) với 20% nước lợ. Sau khi thích nghi, 450 con tôm (trọng lượng ban đầu: 1,57 ± 0,05 g) được phân ngẫu nhiên vào các bể xi măng ba lớp (1,2 × 1,9 × 1,2 m) và mỗi bể chứa 30 con tôm. Các bể được trang bị bộ lọc nước liên tục, đá khí để sục khí và lò sưởi để kiểm soát nhiệt độ ở mức ~27 ℃. Tôm được cho ăn hai lần mỗi ngày trong 60 ngày với khẩu phần thử nghiệm chiếm 3% trọng lượng cơ thể. Trong thử nghiệm tăng trưởng, cân nặng được đo vào lúc bắt đầu thử nghiệm, lần lượt ở khoảng thời gian 15 ngày và 60 ngày. Theo đó, nồng độ amoniac-N và nitrit-N trong nước cũng được phân tích. Khi kết thúc thử nghiệm tăng trưởng, tôm được thu hoạch và cân riêng từng con. Các thông số về hiệu suất tăng trưởng được tính toán như sau:

2.4. Đánh giá tình trạng sức khỏe tôm
Khi kết thúc thử nghiệm tăng trưởng, tôm được lấy mẫu để đánh giá tình trạng sức khỏe, bao gồm thử nghiệm cảm nhiễm với mầm bệnh tiềm ẩn là Vibrio alginolyticus và phân tích thông số miễn dịch: tổng số lượng tế bào máu (THC), hoạt tính phenoloxidase (PO), superoxide effutase ( SOD), hoạt động bùng nổ hô hấp (RB), hoạt động lysozyme (LYS) và hoạt động thực bào (PA), đồng thời xác định các biểu hiện gen liên quan đến miễn dịch: prophenoloxidase I và II (proPOI và proPOII), lipopolysacarit và β-1,3-glucan -protein liên kết (LGBP) và penaeidin-4 (PEN4).
2.5. Thử nghiệm cảm nhiễm
V. alginolyticus và V. parahaemolytics phân lập từ tôm bị bệnh đã được sử dụng cho các thử nghiệm cảm nhiễm. Vi khuẩn được nuôi cấy trên tryptic soy broth (TSB) được bổ sung 1,5 % NaCl trong 24 giờ ở nhiệt độ 27 ℃, sau đó được thu hoạch bằng cách ly tâm trong 10 phút ở 2370×g và nhiệt độ 4 ℃. Viên này được rửa sạch và hòa tan lại trong nước muối thông thường vô trùng và điều chỉnh thành 107 cfu/ ml. Nồng độ huyền phù vi khuẩn được xác định bằng cách đo OD ở bước sóng 595 nm. OD = 1,0 tương đương với 109 cfu/ ml.
Đối với thử nghiệm cảm nhiễm đầu tiên, 30 con tôm ở giai đoạn lột xác từ mỗi nhóm thử nghiệm cho ăn đã được sử dụng. Mỗi nhóm được thực hiện ba lần và mỗi lần lặp lại bao gồm 10 con tôm. Tôm được tiêm 10 µl dung dịch V. alginolyticus, thu được 105 cfu /g tôm. Sau khi tiêm, tôm được tách thành 15 bể nuôi. Mỗi bể chứa 60 L nước lợ (20 ‰), được trang bị đá khí để sục khí. Tôm chết được ghi nhận hàng ngày.
Do Lactobacillus pentosus, BD6 có hoạt tính kháng khuẩn tuyệt vời chống lại mầm bệnh và tiềm năng chữa bệnh của Lactobacillus pentosus BD6 đã được xác định. Việc lây nhiễm thực nghiệm được thực hiện bằng cảm nhiễm bằng miệng. Huyền phù V. parahaemolytics được trộn với khẩu phần ăn để tạo ra mức 106 cfu/ g khẩu phần ăn. Tôm được cho ăn theo tỷ lệ bằng nhau giữa khẩu phần bổ sung men vi sinh (1010 cfu/ kg) và khẩu phần chứa mầm bệnh (kết quả là 105 cfu/g tôm) theo 3% tổng trọng lượng cơ thể của tôm. Sau khi cảm nhiễm mầm bệnh, tôm được cho ăn khẩu phần ăn có chứa men vi sinh ở mức 1010 cfu/ kg trong 1 tuần. Để kiểm soát cảm nhiễm, tôm được cho ăn bằng khẩu phần ăn có mầm bệnh và sau đó được cho ăn bằng khẩu phần ăn đối chứng. Sau đó, tôm được tách thành 6 bể nuôi. Mỗi bể chứa 60 L nước lợ (20 ‰), được trang bị đá khí để sục khí. Tỷ lệ chết tích lũy của tôm được ghi nhận hai lần mỗi ngày. Tôm được cho ăn bằng khẩu phần ăn có chứa men vi sinh mà không cần cảm nhiễm bằng miệng được coi là đối chứng.
2.6. Thông số miễn dịch
Để phân tích thông số miễn dịch, tôm ở giai đoạn giữa các lần lột xác được chọn để phân tích: sáu con từ mỗi nhóm để đo THC, PO, RB, SOD và LYS của chúng; 6 con tôm khác từ mỗi nhóm để đo PA.
Để chuẩn bị hemolymp, 100 μl hemolymp được rút ra bằng ống tiêm chứa 900 μl dung dịch chống đông máu (30 mM trisodium citrate, 0,34 M NaCl và 10 mM EDTA; pH 7,55; và độ thẩm thấu của dung dịch chống đông máu được điều chỉnh bằng glucose đến 780 mOsm/ kg). Sau đó, dịch hemolymp pha loãng được chuyển vào ống vô trùng và đặt trên đá.
Hỗn hợp chất chống đông máu-hemolymp được nhỏ giọt trên cả hai mặt của phiến đo huyết sắc tố để xác định THC bằng cách sử dụng kính hiển vi tương phản pha ngược (Leica DMIL, Leica Microsystems, Wetzlar, Đức). Mỗi mẫu được đo lặp lại.
Hoạt tính PO được đo dựa trên sự hình thành dopachrome được tạo ra bởi L-dihydroxyphenylalanine (L-DOPA) bằng cách sử dụng máy đo quang phổ. Chất chống đông máu-hemolymp (1 ml), được điều chế như mô tả ở trên, được ly tâm trong 10 phút ở 300×g và ở 4 ℃. Viên này được rửa và treo lại trong dung dịch đệm 200 μl cacodylate-citrate (natri cacodylate 0,01 M, natri clorua 0,45 M và trisodium citrate 0,1 M; pH 7,0) rồi ly tâm lại. Sau khi ly tâm, viên được treo lại trong dung dịch đệm cacodylat 200 μl (natri cacodylat 0,01 M, natri clorua 0,45 M, canxi clorua 0,01 M và magie clorua 0,26 M; pH 7,0). 100 µl huyền phù tế bào được ủ với 50 µl trypsin (1 mg/ ml) trong 10 phút ở nhiệt độ 25 ℃. Sau đó, 50 µl L-DOPA được thêm vào, cùng với việc bổ sung 800 µl đệm cacodylate 5 phút sau đó. OD được đo bằng máy quang phổ (Jasco V-630, Hachioji, Tokyo, Nhật Bản) ở bước sóng 490nm. Hoạt tính PO cơ bản được phân tích với huyền phù tế bào còn lại (100 μl) để ủ với 50 μl đệm cacodylate thay vì trypsin trước khi bổ sung 50 μl L-DOPA. Điều kiện phản ứng như mô tả ở trên.
Phân tích RB của tế bào máu dựa trên việc khử tetrazolium xanh nitro (NBT) thành formazan do anion superoxide (O2–) gây ra. Đĩa 96 giếng được phủ bằng dung dịch poly-lysine (0,2 %, 100 μl) trước khi lắng đọng dung dịch hemolymp pha loãng (100 μl). Các đĩa sau đó được ly tâm ở tốc độ 300 × g trong 15 phút và chất lỏng nổi trên bề mặt được loại bỏ. Sau đó, 100 μl zymogen được thêm vào và phản ứng trong 30 phút ở nhiệt độ phòng. Tế bào máu được rửa ba lần bằng 100 μl dung dịch Hank, sau đó phản ứng với 100 μl dung dịch NBT (0,3%) trong 30 phút ở nhiệt độ phòng. Sau phản ứng, loại bỏ dung dịch NBT, rửa ba lần bằng 100 µl metanol (70%) và để khô trong không khí. KOH (2 M, 120 μl) và DMSO (140 μl) được sử dụng để hòa tan formazan. Mỗi mẫu được thực hiện ba lần. OD ở bước sóng 630nm được đo bằng cách sử dụng máy quang phổ vi bản (Spectramax® 190, Sunnyvale, CA, USA).
Để phân tích các hoạt động SOD và LYZ, 100 μl hemolymp pha loãng được ly tâm trong 30 phút ở 300×g và 4 ℃; và sau đó viên được rửa hai lần bằng dung dịch muối đệm phốt phát (PBS, pH 7,5), đồng nhất trong PBS và ly tâm trong 30 phút ở 10.000×g ở 4 ℃. Chất nổi phía trên (HLS) được chuyển sang ống mới và đặt trên đá. Tổng hàm lượng protein trong HLS đã được phân tích bằng cách sử dụng thuốc thử xét nghiệm protein Bio-Rad (Phòng thí nghiệm Bio-Rad, Mississauga, ON, Canada) và albumin huyết thanh bò làm chất chuẩn.
Hoạt tính HLS SOD được phân tích dựa trên khả năng ức chế quá trình khử quang hóa của tetrazolium xanh nitro (NBT). Một 625 μl hỗn hợp phản ứng (dung dịch đệm 150 mM photphat (pH 7,8), 120 mM methionine, 7,5 μM riboflavin, 630 μM NBT và 1 mM EDTA) được trộn với HLS (125 μl) và PBS (250 μl). Phản ứng được thực hiện trong 10 phút ở nhiệt độ phòng. Đọc độ hấp thụ của hỗn hợp phản ứng ở bước sóng 560 nm. Một đơn vị hoạt độ SOD được định nghĩa là lượng enzyme cần thiết để tạo ra sự ức chế 50% tốc độ giảm NBT. Hoạt tính cụ thể được biểu thị bằng đơn vị (mg protein) −1.
Việc phân tích hoạt động LYZ của tế bào máu được thực hiện dựa trên phương pháp đo độ đục. 10 µL HLS được trộn với Micrococcus lysodeikticus 0,02% (Sigma, St. Louis, MO, USA) trong dung dịch đệm natri photphat (0,05 M, pH 6,2), sau đó ủ ở 25 ℃. OD ở bước sóng 530nm được phát hiện ở phút đầu tiên và phút thứ sáu bằng cách sử dụng máy quang phổ UV-Vis V-630 (Jasco). Đường cong chuẩn của LYZ từ lòng trắng trứng gà (L6876, Sigma) đã được sử dụng để tính toán hoạt động của LYZ trong HLS.
Phương pháp Bradford được áp dụng để phân tích nồng độ protein trong HLS bằng cách sử dụng thuốc thử xét nghiệm protein Bio-Rad (Phòng thí nghiệm Bio-Rad, Mississauga, ON, Canada). Albumin huyết thanh bò được coi là tiêu chuẩn để tính toán nồng độ protein trong HLS.
Hoạt động thực bào của tế bào máu cũng được xác định. Các hạt huỳnh quang (5 × 106 hạt huỳnh quang trong 1 ml PBS) được tiêm vào xoang bụng của tôm ở mức 105 hạt/ tôm. Sau đó, tôm được sử dụng ở đây được nuôi tạm thời trong bể chứa 40 L nước mặn (25‰) trong 2 giờ. Hemolymp của tôm được lấy ra như mô tả ở trên và trộn với dung dịch chống đông theo tỷ lệ 1:9. Sau đó, hemolymp đã pha loãng (100 μl) được trộn với 0,1 % paraformaldehyde (100 μl) ở 4℃. Sau khi cố định tế bào máu, 50 μl mẫu được nạp vào phiến kính bằng cách sử dụng máy ly tâm cytospin trong 3 phút ở tốc độ 113 × g. Khi phiến kính được làm khô trong không khí, nó được nhuộm bằng 0,1% propidium iodide trong 10 phút và sau đó được quan sát bằng kính hiển vi huỳnh quang (Leica DM2500, Leica Microsystems, Wetzlar, Đức). 200 tế bào máu được đếm ngẫu nhiên. Hoạt động thực bào (PA) được biểu thị như sau:
PA (%) = (Tế bào máu thực bào / Tổng số tế bào máu) × 100%
2.7. Biểu hiện gen liên quan đến miễn dịch
Việc chiết tách tổng số RNA của hemolymp bằng thuốc thử REzol™ C & T (AMRESCO, Solon, OH, USA). Sau khi tách toàn bộ RNA, quá trình tổng hợp DNA bổ sung chuỗi đầu tiên (cDNA) được tiến hành bằng cách sử dụng SuperScript™ II Reverse Transcriptase (Invitrogen) với mồi oligod (T)18. Các điều kiện phản ứng được tuân theo hướng dẫn của nhà sản xuất.
Các cặp mồi dùng để phân tích biểu hiện gen proPO I, proPO II, LGBP, PEN4 và β-actin lần lượt là POIF: 5′ – GCCTTGGCAACGCTTTCA-3′ và POIR: 5′ -CGCGCATCAGTTCAGTTTGT-3′, POIIF: 5′ – ACCACTGGCACTGGCACCTCGTCT-3′ và POIIR: 5′ -TCGCCAGTTCTCGAGCTTCTGCAC-3′, LGBPF: 5′ -CATGTCCAACTTCGCTTTCAGA-3′ và LGBPR: 5′ -ATCACCGCGTGGCATCTT-3′, PEN4F: 5′ -ATGCTACGGAATTCCCTCCT-3′ và PEN4R: 5′ -ATCCTTGCAACGCATAGACC-3′, và actinF: 5′ -GAGCAACACGGAGTTCGTTGT-3′ và actinR: 5′ -CATCACCAACTGGGACGACATGG-3′.
Quá trình khuếch đại được tiến hành trong một đĩa 96 giếng với thể tích phản ứng 20 μl chứa 10 μl 2 × SYBR Green Master Mix (Qiagen, Valencia, CA, USA), 0,8 μl mỗi mồi thuận và mồi ngược (10 mM), 2 μl cDNA (dưới dạng mẫu) và 6,4 μl nước DEPC. Cấu hình nhiệt cho PCR thời gian thực là 50 ℃ trong 2 phút và 95 ℃ trong 10 phút, sau đó là 40 chu kỳ 95 ℃ trong 15 giây và 60 ℃ trong 1 phút. Phản ứng trộn với nước cất thay vì mẫu được dùng làm đối chứng âm tính. Mỗi mẫu được phân tích lặp lại. Số lượng biểu hiện gen mục tiêu tương đối được tính toán bằng cách sử dụng phương pháp 2−ΔΔCt.
2.8. Phân tích hệ vi sinh vật đường ruột tôm
Khẩu phần ăn bổ sung men vi sinh Lactobacillus pentosus BD6 (1010 cfu/kg) đã làm tăng sự đa dạng của hệ vi sinh vật đường ruột ở tôm thẻ chân trắng. Tổng số DNA vi khuẩn trong ruột được chiết xuất bằng cách sử dụng Bộ Mini chiết xuất DNA bộ gen mô FavourPre TM (Favorgen Biotech, Pingtung, Đài Loan) theo hướng dẫn của nhà sản xuất. Việc trích xuất DNA của ruột tôm được thực hiện ba lần (mỗi lần sao chép từ ba con tôm được gộp lại với nhau). Sau khi xác định độ tinh khiết DNA bằng máy quang phổ NanoDrop, vùng V3–V4 của gen 16 S rRNA được khuếch đại bằng phương pháp PCR với các đoạn mồi đặc hiệu (mồi xuôi (S17): 5′ -TCGTCGGCAGCGTCAGATGTGTATAAGAGACGCCTACGGGNGGCWGCAG-3′ và mồi ngược (A21): 5′ – GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3′. Trình tự thông lượng cao cho bộ khuếch đại đủ điều kiện đã được thực hiện với trình sắp xếp NGS, nền tảng Illumina MiSeq® (Illumina) tại Welgene Biotech CO., Ltd. (Đài Bắc, Đài Loan). Đọc theo cặp (2 × 300-bp) được chỉ định cho các mẫu dựa trên một mã vạch duy nhất và bị cắt bớt bằng cách cắt bỏ mã vạch và trình tự mồi. Các lần đọc ở đầu cặp Illumina được căn chỉnh theo các chuỗi tham chiếu dài bằng Bowtie 2. Các chuỗi đã được lọc, các chuỗi có chất lượng kém hơn đã bị loại bỏ và các chuỗi mồi có gắn thẻ mã vạch đã bị cắt bỏ. Các thẻ thô sau đó được tạo ra bởi FLASH. Trình tự khảm tiềm năng được phân tích bằng cách sử dụng Mothur. Các thẻ hiệu quả được lọc và phân cụm thành các đơn vị phân loại vận hành (OTU) theo mức độ tương đồng nucleotide là 97%. Chú thích phân loại của OTU được thực hiện bằng cách sử dụng trình phân loại Dự án cơ sở dữ liệu Ribosomal (RDP). Các mức phân loại từ ngành đến chi đã được phân tích và kết quả phân cụm được hiển thị bằng cách quan sát sơ đồ phân tích thành phần chính (PCA). Nguyên tắc phân tích dữ liệu được sử dụng để xác định mức độ chồng chéo của quần thể vi sinh vật giữa các nhóm khẩu phần ăn. QIIME (http://qiime.org/scripts/alpha_diversity.html ) đã được áp dụng để tính toán chi, độ đồng đều của Pielou (J), chỉ số đa dạng Shannon và độ phong phú loài của Margalef (d). Các biểu đồ vectơ riêng PCA và biểu đồ ưu thế tích lũy (%) được phân tích bằng cách sử dụng Quy trình Plymouth trong Nghiên cứu sinh thái đa biến (PRIMER) Phiên bản 6.1.5.
3. Kết quả
3.1. Hoạt tính kháng khuẩn
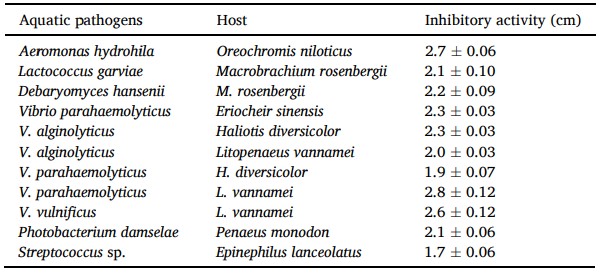
Đường kính vùng ức chế của Lactobacillus pentosus BD6 chống lại mầm bệnh được trình bày trong Bảng 3. Nhìn chung, Lactobacillus pentosus BD6 có nhiều hoạt tính kháng khuẩn chống lại tất cả các mầm bệnh được thử nghiệm. Sau 24 giờ ủ, vùng ức chế lớn nhất được ghi nhận ở V. vulnificus (2,8 ± 0,12 cm), và vùng hẹp nhất được tìm thấy ở Streptococcus sp. (1,7 ± 0,06 cm).
Bảng 3 Sự ức chế tăng trưởng của các mầm bệnh thủy sinh khác nhau nhờ chất nổi trên bề mặt của Lactobacillus pentosus BD6. Kết quả được trình bày dưới dạng đường kính vùng ức chế tính bằng cm. Đường kính đĩa là 6 mm.
3.2. Hiệu suất tăng trưởng
Hiệu suất tăng trưởng của tôm được cho ăn trong 60 ngày khẩu phần ăn thử nghiệm có chứa men vi sinh Lactobacillus pentosus BD6 khác nhau từ 107−10 cfu/ kg được thể hiện trong Bảng 4. Không có sự khác biệt đáng kể về tỷ lệ sống của tôm giữa các nghiệm thức được phát hiện trong thử nghiệm cho ăn 60 ngày. Lactobacillus pentosus BD6 đã đẩy nhanh tốc độ tăng trưởng của tôm. Tôm được nuôi bằng khẩu phần ăn có chứa men vi sinh ở mức 109-10 cfu/ kg trong 60 ngày có trọng lượng cuối cùng, SGR và PWG cao hơn đáng kể so với tôm được nuôi bằng khẩu phần ăn đối chứng và khẩu phần ăn có chứa men vi sinh ở mức 109-10 cfu/ kg lên tới 108 cfu/ kg. Tương tự, FE được cải thiện đáng kể ở nhóm được điều trị bằng 109−10 cfu/ kg men vi sinh khi so sánh với nhóm đối chứng và 107−8 cfu/ kg men vi sinh.
Bảng 4 Hiệu suất tăng trưởng của tôm thẻ chân trắng (trọng lượng ban đầu trung bình: 1,57 ± 0,05 g) sau khi được cho ăn các khẩu phần ăn thử nghiệm khác nhau trong 60 ngày. Giá trị có nghĩa là ±S.E. từ ba lần lặp lại của tôm (n = 3). Trong các hàng, các giá trị theo sau bởi các chữ cái khác nhau khác nhau đáng kể (p < 0,05, ANOVA một chiều, thử nghiệm đa phạm vi của Duncan).
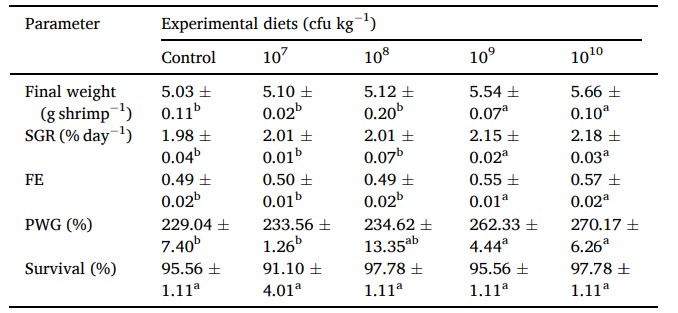
WG: tăng trọng; SGR: tốc độ tăng trưởng cụ thể; FE: hiệu quả sử dụng thức ăn; và PWG: phần trăm tăng trọng.
3.3. Thử nghiệm cảm nhiễm
Tỷ lệ chết tích lũy của tôm bị nhiễm V. alginolyticus được thể hiện trong Hình 1A. Tất cả tôm đối chứng đều sống. Ngược lại, tôm chết sau 12 giờ cảm nhiễm ngoại trừ tôm được cho ăn bằng khẩu phần ăn có chứa men vi sinh ở mức 1010 cfu /kg. Sau 24 giờ cảm nhiễm, cái chết xảy ra ở tất cả các nhóm cảm nhiễm. Khi kết thúc cảm nhiễm, tỷ lệ chết tích lũy của tôm được cho ăn khẩu phần ăn có chứa men vi sinh ở mức 1010 cfu /kg đã giảm đáng kể so với tôm ở nhóm đối chứng và các nhóm chế phẩm sinh học khác ngoại trừ tôm được cho ăn khẩu phần ăn có chứa men vi sinh ở mức 109 cfu /kg (Hình 1A). Tỷ lệ chết tích lũy của tôm khi được cảm nhiễm bằng miệng với V. parahaemolyticus và được cho ăn bằng khẩu phần ăn probiotic đồng thời được thể hiện trong Hình 1B. Không có tôm nào chết trong nhóm đối chứng không bị phản đối trong quá trình thử nghiệm. Tỷ lệ tôm chết trong nghiệm thức thấp hơn đáng kể so với tôm đối chứng (Hình 1 B).
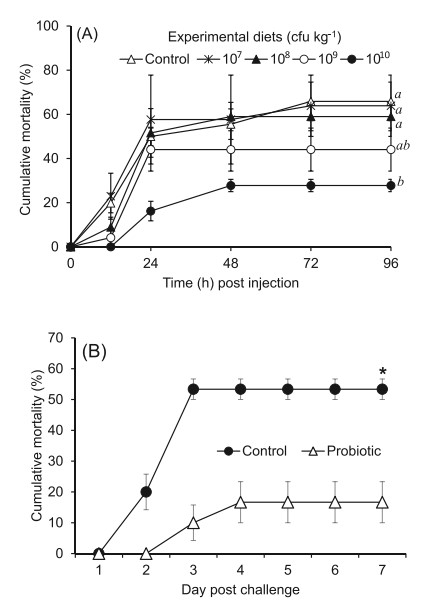
Hình 1. (A) Tỷ lệ chết tích lũy (%) của tôm được cho ăn các khẩu phần ăn thử nghiệm khác nhau trong 60 ngày và sau đó được tiêm mầm bệnh Vibrio alginolyticus trong 96 giờ. Dữ liệu (trung bình ± S.E.) từ các nhóm tôm (n = 30) vào cuối thí nghiệm với các chữ cái khác nhau có sự khác biệt đáng kể giữa hoặc giữa các nghiệm thức (p < 0,05). (B) Tỷ lệ chết tích lũy của tôm được cho ăn đồng thời men vi sinh và mầm bệnh V. parahemolyticus và sau đó được cho ăn khẩu phần ăn chứa men vi sinh (1010 cfu /kg) trong 7 ngày. Dữ liệu (trung bình ± S.E.) từ các nhóm tôm (n = 30) khi kết thúc thí nghiệm với ngôi sao khác biệt đáng kể so với nhóm đối chứng (p < 0,05).
3.4. Phản ứng miễn dịch
Phản ứng miễn dịch của tôm được nuôi bằng khẩu phần ăn thử nghiệm trong 60 ngày được thể hiện trong Bảng 5. Không tìm thấy sự khác biệt đáng kể nào về hoạt động THC, RB và SOD. Tôm được nuôi bằng chế phẩm sinh học với liều 109−10 cfu /kg có hoạt tính PO tăng đáng kể so với tôm được nuôi bằng khẩu phần ăn đối chứng, trong khi không có sự khác biệt đáng kể so với tôm được cho ăn khẩu phần ăn chứa men vi sinh khác (107−8 cfu/ kg). Tôm ăn Lactobacillus pentosus BD6 (108−10 cfu /kg) có thể tăng cường hoạt động LYS của chúng so với khẩu phần đối chứng và khẩu phần probiotic 107 cfu /kg. PA cũng được tìm thấy cao đáng kể ở tôm được nuôi bằng khẩu phần ăn có chứa men vi sinh ở mức 108-10 cfu/kg so với tôm được nuôi bằng khẩu phần ăn đối chứng. Tuy nhiên, không có sự khác biệt đáng kể về PA được tìm thấy ở tôm được điều trị bằng men vi sinh.
Bảng 5 Các thông số miễn dịch của tôm thẻ chân trắng sau khi được cho ăn với các khẩu phần ăn thử nghiệm khác nhau trong 60 ngày. Các kết quả đại diện cho giá trị trung bình (±S.E.) của 6 con tôm/nghiên cứu. Trong các hàng, các giá trị theo sau bởi các chữ cái khác nhau khác nhau đáng kể (p < 0,05, ANOVA một chiều, thử nghiệm đa phạm vi của Duncan).
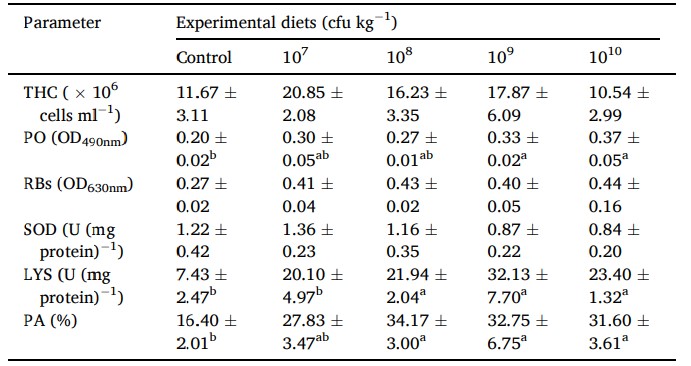
THC: tổng số lượng tế bào máu; PO: phenoloxydase; RB: các cơn hô hấp; SOD: superoxide oxydase; LYS: lysozyme; và PA: hoạt động thực bào.
3.5. Các gen liên quan đến miễn dịch
Sau khi ăn Lactobacillus pentosus BD6 được thu nhận, biểu hiện các gen liên quan đến miễn dịch ở tôm được thể hiện ở Bảng 6. ProPO I trong tế bào máu của tôm được nuôi bằng men vi sinh ở nồng độ 1010 cfu /kg tăng đáng kể so với tôm được cho ăn với thức ăn đối chứng và tôm được nuôi bằng khẩu phần ăn có chứa men vi sinh ở mức 107 cfu /kg. Tuy nhiên, biểu hiện proPO I ở tôm không khác biệt đáng kể giữa các nhóm sử dụng men vi sinh ở mức 108−10 cfu /kg. Không có sự khác biệt đáng kể được tìm thấy trong các biểu hiện của proPO II, LGBP và PEN4 ở tôm được nuôi bằng khẩu phần ăn thử nghiệm trong 60 ngày.
Bảng 6 Biểu hiện gen liên quan đến miễn dịch của tôm thẻ chân trắng sau khi được cho ăn các khẩu phần ăn thử nghiệm khác nhau trong 60 ngày. Các kết quả đại diện cho giá trị trung bình (±S.E.) của 6 con tôm/lần điều trị. Trong các hàng, các giá trị theo sau bởi các chữ cái khác nhau khác nhau đáng kể (p < 0,05, ANOVA một chiều, thử nghiệm đa phạm vi của Duncan).
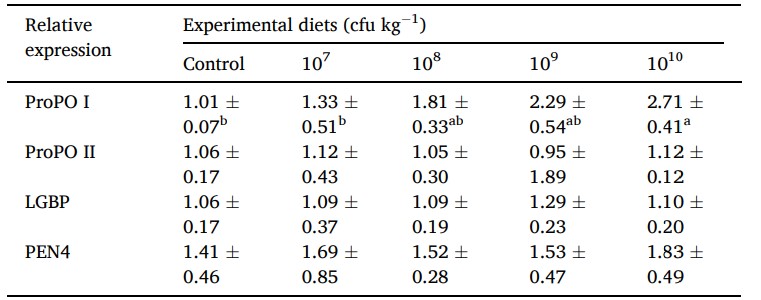
ProPO I: prophenoloxidase 1; ProPO II: prophenoloxidase 2; LGBP: lipopolysaccharide và protein gắn với β-1,3-glucan; và PEN4: penaeidin 4.
3.6. Phân tích hệ vi sinh vật đường ruột
Tổng trung bình tổng cộng lần lượt là 411.401 và 383.480 trình tự không dư thừa ở nhóm đối chứng và nhóm lợi khuẩn. Trình tự của các nhóm đối chứng và nhóm lợi khuẩn được nhóm lần lượt thành 1370 và 1406 OTU, với mức giới hạn nhận dạng là 97%. OTU được gán cho 14 ngành, 19 lớp, 39 bộ, 64 họ và 94 chi với tên phân loại (Hình 2). Biểu đồ Venn được sử dụng để xác định các chi cốt lõi và các chi khác nhau ở tôm được nuôi bằng các khẩu phần ăn khác nhau. Các chi cốt lõi trong số các bản sao đối chứng (Hình 3A) và các bản sao probiotic (Hình 3B) lần lượt là 63 và 74. Các mẫu ruột tôm từ cả nhóm đối chứng và nhóm probiotic đều có tổng cộng 58 chi. Trong số tất cả các mẫu ruột, 5 chi và 16 chi lần lượt là duy nhất thuộc nhóm đối chứng và nhóm lợi khuẩn (Hình 3C). Năm chi đại diện trong nhóm đối chứng là Halobacteriovorax, Neptumonas, Candidatus_Campbellbacteria, Fusibacter và Arcobacter, trong khi thuộc nhóm probiotic Coxiella, Halioglobus, Oceanirhabdus, Iamia, Nitrosomonas, Hahella, Hanstruepera, Halodesulfovibrio, Woeseia, Bauldia, Desulfobulbus, Maritalea, Arenibacter, và Vermiphilaceae được xác định.
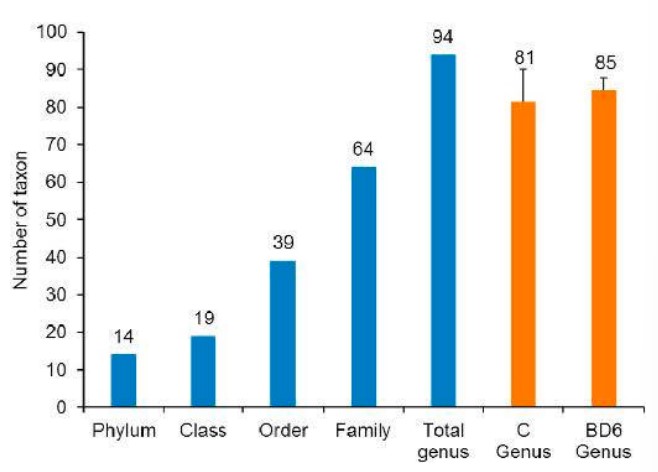
Hình 2. Xác định phân loại vi sinh vật trong ruột tôm được cho ăn khẩu phần có chứa probiotic Lactobacillus pentosus BD6 hoặc khẩu phần đối chứng.
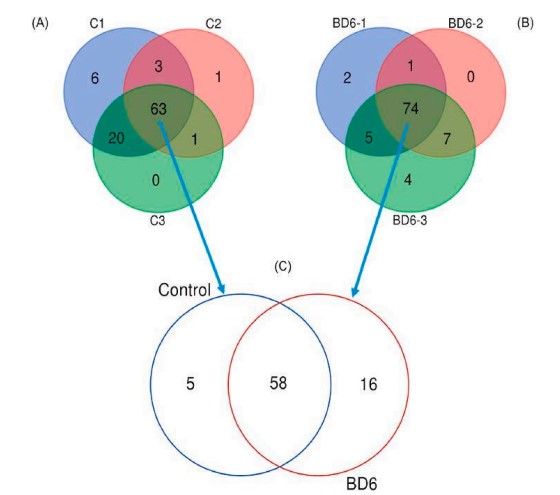
Hình 3. Phân tích sơ đồ Venn thể hiện số lượng hệ vi sinh vật chung và duy nhất giữa các lần lặp lại của mỗi nhóm (A và B) và giữa khẩu phần ăn probiotic (BD6) hoặc nhóm đối chứng (C).
Phân tích thành phần chính (PCA) cho thấy hệ vi sinh vật đường ruột của tôm được nuôi bằng khẩu phần ăn bổ sung men vi sinh có cấu trúc khác biệt đáng kể so với hệ vi sinh vật đường ruột của tôm được nuôi bằng khẩu phần ăn đối chứng. Ở cấp độ ngành, Proteobacteria vẫn là nhóm vi khuẩn chiếm ưu thế nhất trong cả hai nhóm, nhưng mức độ phong phú của Proteobacteria thấp hơn đáng kể ở nhóm được bổ sung men vi sinh. Tại cấp độ chi, sự phong phú tương đối của các chi vi khuẩn có lợi, chẳng hạn như Lactobacillus và Bacillus, tăng lên đáng kể ở nhóm được bổ sung men vi sinh, trong khi sự phong phú tương đối của các chi vi khuẩn gây bệnh, chẳng hạn như Vibrio và Photobacter, giảm xuống đáng kể.
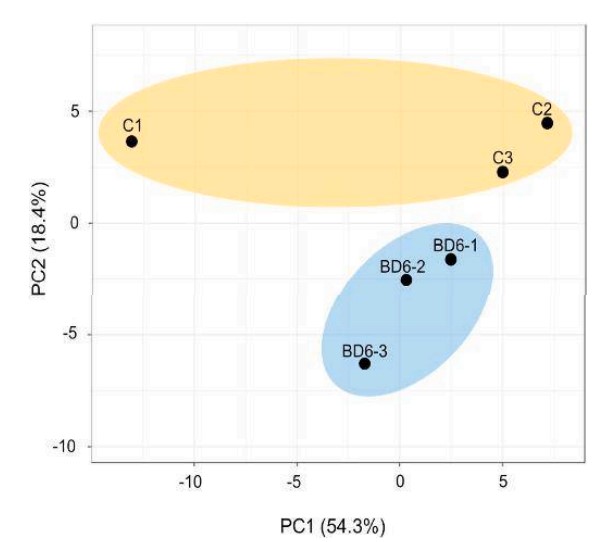
Hình 4. So sánh PCA ở mức độ chung giữa các vi khuẩn đường ruột của tôm được cho ăn khẩu phần ăn đối chứng (C) hoặc khẩu phần ăn probiotic (BD6).
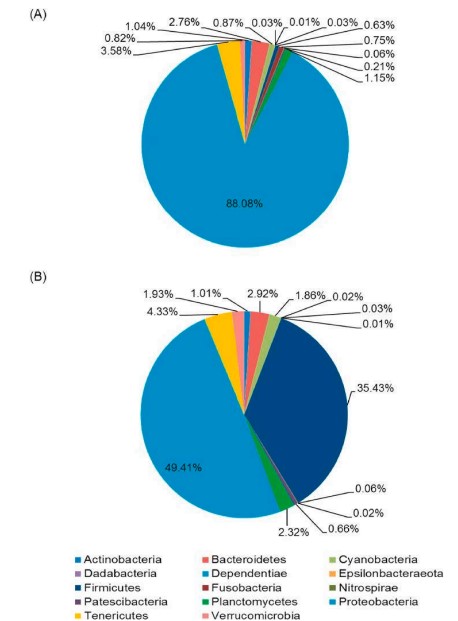
Hình 5. Sự phong phú về thành phần ở cấp độ ngành trong quần thể vi sinh vật đường ruột của tôm được cho ăn khẩu phần ăn đối chứng (A), hoặc khẩu phần ăn probiotic (BD6) (B).
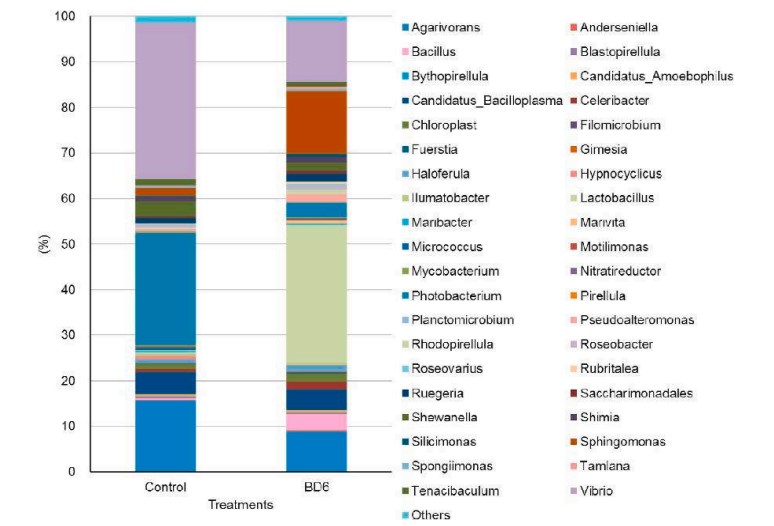
Hình 6. Sự phong phú của thành phần vi khuẩn ở mức độ chung trong ruột tôm được cho ăn khẩu phần ăn đối chứng, hoặc khẩu phần ăn probiotic (BD6). Các chi được biểu thị bằng các màu khác nhau được hiển thị ở phía bên phải của hình. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc có thể tham khảo phiên bản Web của bài viết này.)
Các sơ đồ vectơ riêng PCA chỉ ra rằng tôm ở nhóm đối chứng có sự tích lũy Vibrio và Photobacter trong đường ruột cao hơn so với tôm ở nhóm dùng men vi sinh. Ngoài ra, sự tích lũy Lactobacillus cao hơn trong đường ruột của tôm được cho ăn khẩu phần ăn probiotic so với tôm được cho ăn khẩu phần ăn đối chứng (Hình 7).
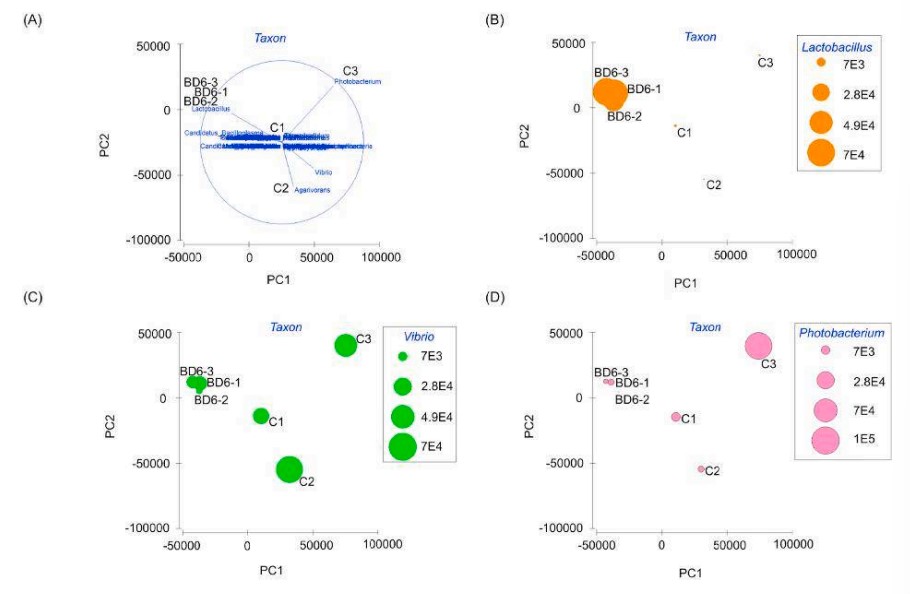
Hình 7. Sơ đồ vectơ riêng PCA của hệ vi sinh vật (A), Lactobacillus (B), và mầm bệnh tiềm ẩn, Vibrio (C) và Photobacter trong ruột tôm được cho ăn khẩu phần ăn đối chứng hoặc khẩu phần ăn probiotic (BD6)
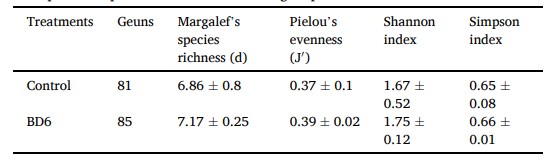
Chỉ số đa dạng alpha, bao gồm các giống quan sát được, độ đồng đều của Pielou (J), chỉ số đa dạng Shannon và độ phong phú loài của Margalef (d), được tính toán để đánh giá tính đa dạng và phong phú của hệ vi sinh vật trong ruột tôm giữa khẩu phần ăn đối chứng và khẩu phần ăn probiotic. Tôm được cho ăn khẩu phần ăn probiotic chứa 85 chi. Số lượng chi (81) thấp hơn một chút được phát hiện trong ruột của tôm đối chứng. Các chi được quan sát, độ đồng đều của Pielou (J), chỉ số đa dạng Shannon và độ phong phú loài của Margalef (d) trong nhóm chế phẩm sinh học cao hơn nhóm đối chứng nhưng không khác biệt đáng kể giữa nhóm đối chứng và nhóm chế phẩm sinh học (Bảng 7).
Bảng 7 α-Đa dạng của hệ vi sinh vật đường ruột của tôm. Các giá trị đại diện cho độ đa dạng trung bình của các lần lặp ba lần trong mỗi nhóm.
4. Thảo luận
Lactobacillus pentosus là một ứng cử viên tiềm năng cho nuôi trồng thủy sản, có khả năng ức chế sự phát triển của mầm bệnh, bao gồm cả Vibrio. Trong một nghiên cứu gần đây, Lactobacillus pentosus BD6 đã được chứng minh là có thể làm giảm nguy cơ mắc bệnh và tỷ lệ chết của tôm nhiễm V. parahaemolyticus. Nó có khả năng ức chế sự phát triển của mầm bệnh bằng cách tạo ra các chất ức chế khác nhau, chẳng hạn như bacteriocin, axit hữu cơ, hydro peroxide, diacetyl, carbon dioxide và peptide kháng khuẩn. Một nghiên cứu gần đây cho thấy Lactobacillus pentosus BD6 có thể ức chế hiệu quả nhiều loại mầm bệnh, bao gồm cả V. parahaemolyticus. Kết quả thử nghiệm cảm nhiễm cho thấy đây là chủng vi khuẩn Lactobacillus pentosus BD6 có thể làm giảm nguy cơ mắc bệnh cho động vật nuôi trồng thủy sản. Ngoài ra, tôm chết tích lũy đồng thời được cho ăn Lactobacillus pentosus BD6 và V. parahaemolyticus thấp hơn đáng kể so với tôm ở nhóm đối chứng. Điều này cho thấy rằng Lactobacillus pentosus BD6 có tiềm năng điều trị làm giảm tỷ lệ chết của tôm nhiễm V. parahaemolyticus. Vì vậy, cần nghiên cứu bổ sung để xác định tiềm năng điều trị của Lactobacillus pentosus BD6 trong tương lai.
Men vi sinh là một phương pháp tiếp cận thân thiện với môi trường, hiệu quả để cải thiện tăng trưởng, khả năng miễn dịch và khả năng kháng bệnh của tôm thẻ chân trắng. Cụ thể, men vi sinh có những tác dụng sau:
- Thúc đẩy tăng trưởng: Men vi sinh có thể cải thiện quá trình tiêu hóa, hấp thu và đồng hóa các chất dinh dưỡng, dẫn đến tăng trọng lượng, tốc độ tăng trưởng và hiệu quả sử dụng thức ăn của tôm.
- Cải thiện khả năng kháng bệnh: Men vi sinh có thể giúp tôm tăng cường khả năng miễn dịch, chống lại các tác nhân gây bệnh như Vibrio parahaemolyticus, V. alginolyticus, AHPND, …
- Cải thiện sức khỏe tổng thể: Men vi sinh có thể giúp tôm khỏe mạnh hơn, ít mắc bệnh hơn.
Các nghiên cứu đã chỉ ra rằng men vi sinh có thể được sử dụng hiệu quả trong nuôi trồng tôm thẻ chân trắng. Các phát hiện báo cáo rằng chế phẩm sinh học có thể góp phần cân bằng nội môi và ngăn chặn sự bùng phát của các loài gây bệnh cơ hội. Kết quả của nghiên cứu này cho thấy rằng dựa trên PO, LYS và PA, và biểu hiện gen của proPO, sức đề kháng tăng lên của tôm có thể liên quan đến sự điều hòa miễn dịch của men vi sinh Lactobacillus pentosus BD6.
Hệ thống miễn dịch bẩm sinh đóng một vai trò quan trọng trong việc bảo vệ tôm khỏi các tác nhân gây bệnh. Một số thông số, chẳng hạn như tổng số lượng tế bào máu, hoạt động PO, hoạt động LYS, hoạt động PA và biểu hiện gen proPO, có thể được sử dụng để đánh giá tình trạng sức khỏe của tôm. Trong nghiên cứu này, kết quả cho thấy tôm sau khi được bổ sung men vi sinh (1010 cfu /kg) trong 60 ngày đã tăng đáng kể hoạt động PO, hoạt động LYS và PA, cũng như các biểu hiện gen proPO I. Nhờ đó, tôm có khả năng kháng bệnh tốt hơn trước tình trạng nhiễm Vibrio. Hoạt động LYS và PA là hai yếu tố quan trọng giúp tôm chống lại các tác nhân gây bệnh. Men vi sinh có thể giúp tăng cường hoạt động LYS và PA của tôm. Do đó, tôm được nuôi bằng men vi sinh đã tăng PA do sự điều hòa tăng lên do hệ thống LYS hoặc proPO tăng lên.
Men vi sinh Lactobacillus pentosus BD6 có thể tăng cường hoạt động PO, hoạt động LYS và hoạt động PA của tế bào máu tôm, giúp tôm chống lại các tác nhân gây bệnh. Men vi sinh Lactobacillus pentosus BD6 có thể sản xuất các hợp chất kháng khuẩn, cạnh tranh các chất dinh dưỡng và vị trí gắn kết với vi khuẩn gây bệnh, từ đó ức chế sự phát triển của các vi khuẩn này. Men vi sinh Lactobacillus pentosus BD6 có thể làm tăng số lượng vi khuẩn có lợi, chẳng hạn như Lactobacillus và Bacillus, trong đường ruột của tôm. Đồng thời, nó có thể làm giảm số lượng vi khuẩn gây bệnh, chẳng hạn như Vibrio, Photobacter và Candidatus_Bacilloplasma.
Trong nghiên cứu này, Men vi sinh Lactobacillus pentosus BD6 là một giải pháp hiệu quả để cải thiện khả năng kháng bệnh của tôm thẻ chân trắng. Men vi sinh này có thể được sử dụng để giảm tỷ lệ chết của tôm nhiễm mầm bệnh Vibrio, tăng hiệu suất tăng trưởng và tăng cường khả năng miễn dịch của tôm. Dựa trên kết quả về hiệu suất tăng trưởng và tình trạng sức khỏe, 1010 cfu /kg được khuyến nghị mạnh mẽ trong khẩu phần ăn của tôm.
Theo Shieh-Tsung Chiu, Tah-Wei Chu, Tohap Simangunsong, Rolissa Ballantyne, Chiu-Shia Chiu, Chun-Hung Liu
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ảnh Hưởng Của Tăng Thân Nhiệt Đến Phản Ứng Miễn Dịch Của Tôm Thẻ Chân Trắng Bị Nhiễm IMNV
- Xử Lý Nước Thải Trại Giống Tôm
- Quan Hệ Đối Tác Nhằm Mục Đích Kiểm Tra Nhanh Bệnh Tôm

 English
English 中文 (中国)
中文 (中国)