Tóm tắt
Tôm thẻ chân trắng Litopenaeus vannamei được nuôi phổ biến. Gần đây, nông dân bắt đầu nuôi loài tôm này ở vùng nước lợ có độ mặn thấp (< 6 g/L). Việc thâm canh nuôi tôm thường dẫn đến nồng độ nitrit tăng cao trong mùa sinh trưởng. Nitrit gây độc cho tôm và có thể làm tôm chậm tăng trưởng và chết khi phơi nhiễm với nồng độ cao. Nghiên cứu này nhằm mục đích điều tra độc tính cấp tính và mãn tính của nitrit đối với L.vannamei được nuôi trong nước lợ có độ mặn thấp (2 g/L). Các nghiên cứu về giá trị EC50 và LC50 của nitrit trong 96 giờ đã được thực hiện để xác định độc tính cấp tính và một nghiên cứu về sự tăng trưởng của bể cá (2 ngày sau khi phơi nhiễm với nồng độ nitrit tăng cao) đã được thực hiện để đánh giá tác động mãn tính của nitrit đối với sản xuất tôm. Giá trị ECSO và LCSO của tôm thẻ chân trắng L vannamei trưởng thành trong nước có độ mặn 2 g/L là khoảng 9 mg/L NO2-N sau 96 giờ cho thấy nồng độ an toàn cho sản xuất tôm trong ao là dưới 0,45 mg/L NO2 -N. Tôm phơi nhiễm với nồng độ nitrit 4 mg/L trong 2 ngày cho thấy làm giảm tốc độ tăng trưởng nhưng không ảnh hưởng đến tỷ lệ sống.
Tôm thẻ chân trắng Litopenueus vannamei là loài tôm He được nuôi chủ yếu ở Tây bán cầu, chiếm 30% tổng sản lượng tôm He được nuôi trên toàn thế giới (Farfante và Kensley 1997). Loài tôm biển này phát triển tự nhiên ở độ mặn từ 1 đến 40 g/L (Menz và Blake 1980), bằng cách sử dụng các cơ chế điều hòa thẩm thấu khác nhau (Castille và Lawrence 1981). Hầu hết tôm thẻ chân trắng nuôi đều được nuôi trong nước có độ mặn cao hơn 15 g/L. Tuy nhiên, gần đây, việc nuôi tôm biển trong đất liền ở những khu vực nước có độ mặn thấp (2-6 g/L) rất được quan tâm, và thậm chí cả nuôi ở nước ngọt (Jory 1999). Nghề nuôi tôm thẻ chân trắng có độ mặn thấp đã được phát triển ở một số nước, trong đó có Mỹ, Thái Lan, Ecuador và Israel (Boyd 2001; Samocha và cộng sự, 2001).
Nuôi trồng thủy sản thâm canh dựa vào thức ăn có hàm lượng protein cao (Love 1989) giàu nitơ (5-6,5% N). Lượng thức ăn được sử dụng trong các hệ thống này thường đạt tới 60 g/ m3/ ngày (Creswell 1993). Điều này giải phóng một lượng lớn nitơ vào môi trường nuôi, gây ra những ảnh hưởng tiêu cực cho cả hệ thống nuôi và môi trường (Boyd và Tucker 1998). Hầu hết lượng nitơ được sử dụng (khoảng 70%) đi vào nước ao dưới dạng thức ăn thừa và chất thải bài tiết của cá (Boyd 1985; Gross và cộng sự, 2000). Vi khuẩn chuyển đổi thức ăn thừa thành amoniac và cá bài tiết amoniac qua mang. Amoniac gây độc cho cá ở mức độ thấp. Trong các ao nuôi cá tái chế thâm canh, amoniac bị oxy hóa bởi các bộ lọc sinh học thành nitrit, chất này cũng độc hại và thành nitrat không độc hại, trong một quá trình gọi là quá trình nitrat hóa (Losordo và Westers 1994).
Nitrit trong nước có thể xâm nhập vào máu của động vật thủy sinh. Sự hiện diện của nitrit trong máu (của cá) dẫn đến sự hình thành methemoglobin thay vì hemoglobin thông thường, là protein vận chuyển oxy trong máu (Boyd và Tucker 1998). Khi nồng độ methemoglobin trong máu tăng cao khiến cá bị ngạt thở và chết. Việc sử dụng ion clorua được biết là có tác dụng đối kháng độc tính nitrit ở cá, từ đó giảm thiểu vấn đề nuôi cấy ở những vùng nước có nồng độ clorua cao như nước biển (Wise và Tomasso 1989). Nitrite cũng độc đối với động vật giáp xác nhưng cơ chế này chưa được hiểu rõ. Hemocyanin, không phải hemoglobin, là protein vận chuyển oxy trong máu ở động vật giáp xác và phản ứng của nitrit với hemocyanin vẫn chưa được xác định. Mặc dù tác dụng đối kháng của clorua đối với độc tính nitrit ở động vật giáp xác đã được quan sát (Beitinger và Huey 1981; Gutzmer và Tomasso 1985), điều đáng ngạc nhiên là nitrite gây độc cho tôm trong môi trường biển (Boyd và Tucker 1998). Ví dụ, Chen và Lei (1990) ước tính rằng đối với tôm sú Penaeus monodon non, nồng độ an toàn trong nước có độ mặn 20 g/L sẽ là 3,8 mg/L NO2-N. Chen và Chen (1992) đã báo cáo rằng việc phơi nhiễm lâu dài tôm P. monodon với nồng độ 4 mg/L NO2-N hoặc cao hơn trong nước có độ mặn cao làm giảm đáng kể sự phát triển của tôm. Mặc dù tác động gây chết của nitrit đối với một số loài tôm thẻ chân trắng đã được nghiên cứu (Chen và cộng sự 1990a, 1990b; Chen và Lin 1991), nhưng thông tin về tác động của nó đối với tôm thẻ chân trắng L. vannamei vẫn còn thiếu (Chen và Lin 1991; Boyd và Tucker 1998) đặc biệt khi nuôi ở độ mặn thấp hơn 15 g/L.
Thử nghiệm độc tính dưới nước là các quy trình sử dụng phản ứng của sinh vật dưới nước để xác định hoặc đo lường tác động của một hoặc nhiều chất. Nồng độ gây chết 50 (LC50) và nồng độ hiệu quả 50 (EC50) là các xét nghiệm độc tính phổ biến, cung cấp nồng độ chất độc ước tính gây chết (LC) hoặc tác động (EC) ở 50% sinh vật (Clesceri và cộng sự, 1998). Phương pháp trong nuôi trồng thủy sản là duy trì nồng độ chất độc tiềm ẩn dưới nồng độ gây chết hoặc ảnh hưởng xấu đến sự tăng trưởng và sinh sản. Thông tin này thường được ước tính bằng thử nghiệm LC50 trong 96 giờ (Boyd và Tucker 1998).
Mục đích của nghiên cứu này là để xác định: 1) EC50 (nồng độ hiệu quả) và LC50 (nồng độ gây chết) của nitrit đối với tôm con L. vannamei trong nước có độ mặn thấp (2 g/L) trong 96 giờ; và 2) liệu việc phơi nhiễm ngẫu nhiên với nồng độ nitrit tăng cao trong 2 ngày có tác động tiêu cực đến năng suất của tôm hay không.
Nguyên liệu và phương pháp
LC50 và EC50
Vào ngày 16/1/2002, tôm thẻ chân trắng Litopertaeus vannamei có trọng lượng trung bình 0,20 ± 0,07 g được thu mua từ một trang trại nuôi tôm thương mại tại Kibbutz Mashabei Sade, Israel. 12 bể 7L đã được đổ đầy nước giếng địa nhiệt từ tầng ngậm nước Negev (giống như bể được sử dụng trong trang trại). Tổng chất rắn hòa tan (TDS) trong nước lên tới 1,95 g/L (EC 4 mS/cm) và độ pH là 8,3. Bể được sục khí trong 24 giờ, sau đó thả 10 con tôm vào mỗi bể. Khoảng 15 giờ sau khi thả giống, các nghiệm thức được phân ngẫu nhiên và nitrit được thêm cho bể lần lượt ở nồng độ 0, 10, 20 và 40 mg/L. Nghiệm thức được thực hiện trong ba lần. Mẫu nước được lấy hàng ngày để phân tích amoniac, nitrit và nitrat. Nhiệt độ nước được duy trì ở mức 25 ± 2℃ trong suốt thí nghiệm và mức oxy hòa tan (DO) ở trên 5 mg/L. Tôm không được cho ăn trong suốt thí nghiệm 96 giờ. Để tính nồng độ gây chết (LC50), tôm chết được đếm và loại bỏ sau mỗi 24 giờ. Các phân tích LC50 tuân theo quy trình chuẩn (Clesceri và cộng sự 1998).
Thí nghiệm thứ 2 sử dụng cách bố trí tương tự bắt đầu vào ngày 19 tháng 9 năm 2002. Mười con tôm có trọng lượng trung bình 0,08 ± 0,02 g được thả vào mỗi bể trong số 15 bể. Nitrit-nitơ được áp dụng cho bể ở nồng độ 0, 5, 10, 20 và 40 mg/L. Mẫu nước được thu thập hàng ngày để phân tích amoniac, nitrit và nitrat. Trong thí nghiệm này, tôm đang hấp hối (tức là nằm nghiêng và ít cử động) được đếm và tôm chết được đếm riêng và loại bỏ sau mỗi 24 giờ. Dữ liệu được sử dụng để tính toán giá trị nồng độ hiệu quả trung bình (EC50) và LC50 (Clesceri và cộng sự, 1998). Trong cả hai thử nghiệm, mô hình thống kê probit dựa trên quy trình bình phương trung bình đã được sử dụng để ước tính giá trị EC50 và LC50 (USEPA 1995).
Ảnh hưởng mãn tính của Nitrit đến năng suất tôm
Vào ngày 11/11/2002, 15 con tôm có trọng lượng trung bình 0,14 ± 0,02 g được thả vào mỗi bể trong số 15 bể. NO2-N được áp dụng cho bể ở nồng độ 0, 1, 2, 4 và 8 mg/L. Nghiệm thức đã được áp dụng trong ba lần. Trong quá trình phơi nhiễm với nitrit, tôm được cho ăn 2 lần/ngày bằng thức ăn cho tôm (Starter I, Rangen, USA) ở mức 1% trọng lượng cơ thể (40% protein). Sau 48 giờ phơi nhiễm với nồng độ nitrit cao, khoảng 30% nước từ mỗi bể cá được thay thế bằng nước giếng địa nhiệt có sục khí và mỗi bể được cung cấp một bộ lọc bể cá chứa đầy 130 mảnh vật liệu nhựa (Aridal, Cfar. Hasidim, Israel) được sử dụng trước trong bộ lọc sinh học hoạt động. Các quy trình này đã làm giảm nồng độ nitrit xuống nồng độ an toàn trong thời gian còn lại của thí nghiệm. Sau khi lắp đặt bộ lọc sinh học, lượng thức ăn được tăng dần lên 2 lần/ngày với tỷ lệ 8% trọng lượng cơ thể. Các mẫu nước được thu thập vào lúc 0, 2, 5 và 8 ngày sau khi áp dụng bộ lọc sinh học và cứ 6 ngày 1 lần trong hai tuần. Nước được phân tích amoniac bằng phương pháp natri salicylate (Krom 1980), nitrit bằng phương pháp diazotization (Clesceri và cộng sự, 1998) và nitrat bằng phương pháp salicylate (Yang và cộng sự 1998). Độ pH, nhiệt độ và DO của nước được theo dõi 2 lần/ tuần bằng máy đo Multi340i (WTW Đức). Bể được kiểm tra hàng ngày về tỷ lệ chết và động vật hôn mê. Chúng tôi xác định những con vật nằm nghiêng hoặc nằm ngửa là hôn mê. Các bể được hút 2 lần/ tuần để loại bỏ bùn (chủ yếu là phân và lột xác), và nước giếng có sục khí được thêm vào bể để bù đắp tổn thất do hút nước và bay hơi (thay nước khoảng 10%). Số lượng tôm sống sót trong mỗi bể được đếm cứ sau 7 ngày.
Tỷ lệ sống được so sánh bằng phân tích phương sai một chiều (ANOVA). Tốc độ tăng trưởng được so sánh bằng ANOVA, sau đó là phân tích đa so sánh (P <0,05). Nồng độ amoniac, nitrit và nitrat trong các nghiệm thức khác nhau, được đo từ ngày thứ 3 của thí nghiệm trở đi, được so sánh với các phân tích ANOVA lặp lại (P < 0,05). Phần mềm thống kê Sigmastat 2.03 (SPSS 1999) đã được sử dụng để phân tích thống kê.
Kết quả và thảo luận
LC50 và EC50
Những thay đổi về thành phần nitơ vô cơ (nitrit và amoniac) của nước được ghi lại hàng ngày vì chúng có thể ảnh hưởng đến kết quả của thử nghiệm LC50. Tại thời điểm 0, nồng độ nitrit thực tế trong bể nằm trong khoảng 5% nồng độ quy định được báo cáo trong cả hai nghiên cứu. Trung bình, tất cả các nghiệm thức đều cho thấy nồng độ nitrit tăng nhẹ theo thời gian, nhưng nó không vượt quá 15% nồng độ nitrit ban đầu sau 96 giờ trong cả hai thí nghiệm. Tổng lượng amoniac-nitơ (TAN) trong nước giếng nhỏ hơn 0,05 mg/L. Nồng độ TAN tăng theo thời gian nhưng vẫn ở mức dưới 0,8 mg/L trong tất cả các bể trong cả hai thí nghiệm. Những thay đổi về chất lượng nước chủ yếu là do chất thải của tôm.
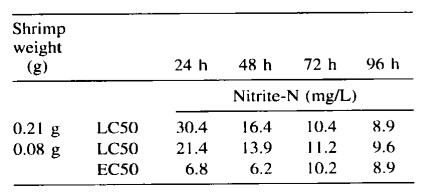
Trong hai thí nghiệm, nitrit-nitơ gây chết tôm ở nồng độ từ 10 mg/L trở lên (Hình 1). Các tác động tiêu cực đặc trưng bởi trạng thái tôm lờ đờ, xảy ra ngay cả ở nồng độ thấp hơn 5 mg/L (Hình 2). LC50 trong 96 giờ là 8,9 mg/L NO2-N đối với nghiên cứu được thực hiện vào tháng 1 năm 2002 và 9,6 mg/L NO2-N đối với nghiên cứu được thực hiện vào tháng 9 năm 2002 (Bảng 1). Việc giải thích dữ liệu về độc tính để sử dụng trong nuôi trồng thủy sản rất khó khăn (Boyd và Tucker 1998). Phân tích LC50 trong 96 giờ thường được thực hiện nhằm mục đích tìm ra nồng độ chất độc tối đa cho phép (MATC), xem xét độc tính cấp tính và mãn tính của chất độc. Để tìm MATC trực tiếp, cần phải tiến hành thử nghiệm vòng đời phức tạp. Tỷ lệ của MATC và LC50 trong 96 giờ được gọi là hệ số ứng dụng (AF), thường nằm trong khoảng từ 0,1 đến 0,01. Theo đó, khi không có thông tin nào khác ngoài LC50 trong 96 giờ, MATC có thể được ước tính bằng nhân AF với LC50 trong 96 giờ. AF bằng 0,05 được đề xuất sử dụng chung trong nuôi trồng thủy sản (Boyd và Tucker 1998). Dựa trên tính toán này, nồng độ an toàn của nitrit-nitrogen đối với tôm con L. vannamei nuôi trong nước mặn có độ mặn thấp (2 g/L) là 0,45 mg/L.
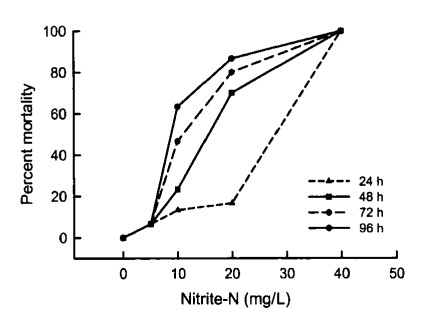
Hình 1. Ảnh hưởng của nồng độ nitrit đến tỷ lệ chết của L. vannamei ở các khoảng thời gian khác nhau. Tôm được nuôi trong nước có độ mặn thấp (2 g/L).
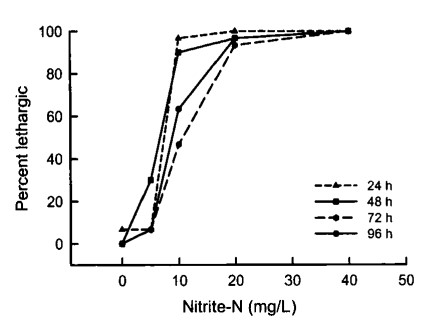
Hình 2. Ảnh hưởng của nitrit đến trạng thái lờ đờ của L. vannamei ở các khoảng thời gian khác nhau. Tôm được nuôi trong nước có độ mặn thấp (2g/L).
Giá trị EC50 trong 96 giờ không được sử dụng phổ biến trong nuôi trồng thủy sản. Tuy nhiên, thông tin bổ sung này có thể được thu thập trong các thử nghiệm LC50 trong 96 giờ, có thể giúp đánh giá nồng độ an toàn chính xác hơn. Điều thú vị là ở nồng độ 5 và 10 mg/L NO2-N, tôm bị ảnh hưởng nhiều hơn được quan sát thấy sau 24 và 48 giờ sau khi bắt đầu thí nghiệm so với 72 và 96 giờ. Trong các nghiệm thức đó, một số tôm dường như đã phục hồi sau áp lực ban đầu do nồng độ nitrit tăng cao. Các giá trị LC50 và EC50 từ 24 đến 72 giờ cũng được trình bày (Bảng l), mặc dù những giá trị này cũng không được sử dụng phổ biến trong nuôi trồng thủy sản.
Bảng 1. Giá trị LC50 và EC50 của nitrite-N (mg/L) sau thời gian phơi nhiễm khác nhau đối với tôm thẻ chân trắng L. vannamei.
Ảnh hưởng mãn tính của Nitrit đến năng suất tôm
2 ngày sau khi sử dụng bộ lọc, nồng độ nitrit-nitơ trong tất cả các nghiệm thức đều nhỏ hơn 0,2 mg/L, ngoại trừ trong các bể ban đầu chứa 8 mg/L NO2-N. Nồng độ trung bình trong các bể cá này là 0,7 mg/L, nhưng giảm xuống dưới 0,2 mg/L một ngày sau đó (Bảng 2). Trong suốt phần còn lại của thí nghiệm, tất cả các bể cá đều được xử lý như nhau và sự thay đổi về chất lượng nước không khác biệt đáng kể giữa các nghiệm thức (P < 0,05). Nồng độ nitơ vô cơ thấp và có thể chấp nhận được cho tôm phát triển bình thường.
Bảng 2. Nồng độ trung bình của tổng amoniac-nitơ (TAN), nitrit-N và nitrat-N trong các nghiệm thức khác nhau trước và sau khi sử dụng bộ lọc sinh học.
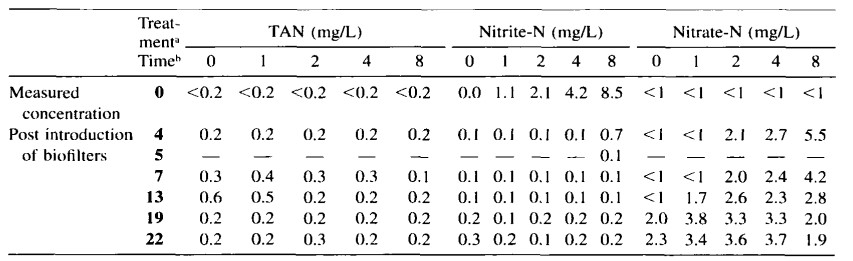
a Nghiệm thức là nồng độ NO2-N khác nhau trong bể.
b Ngày sau khi bắt đầu nghiên cứu.
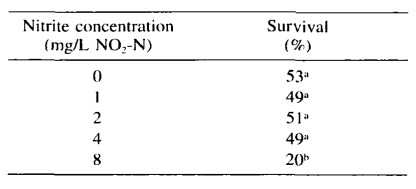
Tỷ lệ sống ở tất cả các nghiệm thức là tương tự nhau, khoảng 50% ngoại trừ tôm phơi nhiễm với 8 mg/L NO2-N trong đó khoảng 20% (Bảng 3). Tỷ lệ sống thấp trong nghiệm thức này là do phơi nhiễm với nồng độ nitrit cao và được dự đoán dựa trên các nghiên cứu LC50. Tỷ lệ chết tương đối cao (~50%) trong các nghiệm thức khác là do quan sát thấy việc ăn thịt đồng loại trong vài ngày đầu. Đến ngày thứ 8, số lượng tôm sống trong bể được đếm và khác với số lượng dự kiến dựa trên số lượng tôm chết. Do đó, chúng tôi báo cáo tỷ lệ sống, dựa trên số lượng hàng tuần (Bảng 3). Có thể mật độ nuôi tôm dày, cùng với chế độ ăn kiêng khi bắt đầu thí nghiệm, đã làm tăng khả năng ăn thịt đồng loại.
Bảng 3. Tỷ lệ sống ở L. vannamei 19 ngày sau khi phơi nhiễm với các nồng độ nitrit khác nhau. Các chữ cái chỉ số trên khác nhau thể hiện sự khác biệt đáng kể trong mỗi cột.
Sản lượng ròng được tính bằng tổng trọng lượng vào cuối nghiên cứu trừ đi trọng lượng ban đầu của tôm. Sản lượng ròng trung bình của tôm phơi nhiễm với 8 mg/L NO2-N là âm và thấp hơn đáng kể so với các nghiệm thức khác (Bảng 4). Tôm được phơi nhiễm với 4 mg/L NO2-N có tốc độ tăng trưởng chậm hơn so với tôm được nuôi trong môi trường 0, 1 và 2 mg/L NO2-N, nhưng tỷ lệ sống tương tự ở các nồng độ này (Bảng 3). Sản lượng ròng ở mức 4 mg/L NO2-N trung bình là 0,26 g trong khi ở các mức nitrit khác (0, 1, 2 mg/L NO2-N) là trên 1 g (Bảng 4). Không tìm thấy tác động tiêu cực nào ở tôm phơi nhiễm với 0, 1 hoặc 2 mg/L NO2-N trong 2 ngày.
Bảng 4. Các thông số tăng trưởng, được biểu thị bằng trọng lượng (g) của L. vannamei sau khi phơi nhiễm với các nồng độ nitrit khác nhau trong 2 ngày. Các giá trị trong ngoặc thể hiện sai số chuẩn. Các chữ cái chỉ số trên khác nhau thể hiện sự khác biệt đáng kể trong mỗi cột.
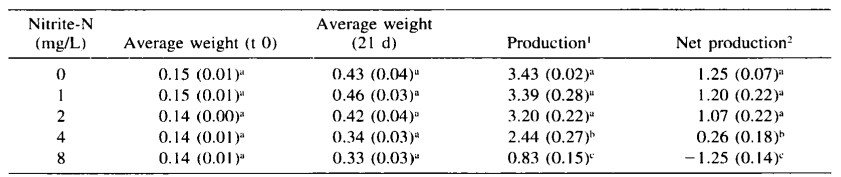
1 Sản lượng thể hiện tổng trọng lượng tôm trong bể khi kết thúc thí nghiệm.
2 Sản lượng ròng = sản lượng – tổng trọng lượng tôm tại thời điểm 0.
Nghiên cứu này cho thấy rằng việc phơi nhiễm lâu dài với nồng độ nitrit dưới 1 mg/L NO2-N có thể có tác động tiêu cực đến sự phát triển và tỷ lệ sống của L. vannamei khi được nuôi trong nước có độ mặn thấp. Hơn nữa, việc phơi nhiễm ngẫu nhiên với 4 mg/L NO2-N có thể có tác động tiêu cực đến sự tăng trưởng mà không có tác động rõ ràng đến tỷ lệ chết.
Nồng độ NO2-N trong các trang trại Negev ở Israel có thể vượt quá 0,5 mg/L. Đôi khi, nồng độ 8 mg/L và cao hơn đã được ghi nhận (Gross và cộng sự, 2003). Các báo cáo về tình trạng tôm chết và tăng trưởng chậm không rõ nguyên nhân ở các trang trại này có thể là do nồng độ nitrit tăng cao. Kết quả từ nghiên cứu này cho thấy nên duy trì nồng độ dưới 0,5 mg/L NO2-N ở các trang trại nuôi tôm sử dụng nước lợ có độ mặn thấp.
Theo AMIT GROS, SHAl ABUTBUL và DlNA ZILBERC
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Báo Cáo Mới Dự Đoán Tiêu Thụ Tôm Toàn Cầu Có Thể Tăng Nếu Ngành Đi Đúng Chiến Lược
- Bổ Sung Chiết Xuất Cỏ Gà Cynodon dactylon Để Chống Lại Virus Gây Hội Chứng Đốm Trắng (WSSV) Ở Tôm Sú Penaeus monodon
- Tổ chức Đối tác Nghề cá Bền vững mong muốn giảm thiểu tác động từ các trang trại nuôi tôm ở Ấn Độ

 English
English 中文 (中国)
中文 (中国)