Tóm tắt
Bệnh đốm trắng (WSD) đã được báo cáo là nguyên nhân gây chết nghiêm trọng ở tôm nuôi, đặc biệt là tôm sú ở nhiều quốc gia. WSSV là nguyên nhân gây thiệt hại kinh tế nặng nề cho ngành nuôi tôm trên toàn thế giới. Nghiên cứu này được thực hiện để kiểm tra hoạt tính kháng virus của chiết xuất cỏ gà Cynodon dactylon được sản xuất quy mô lớn để chống lại virus gây hội chứng đốm trắng (WSSV) ở tôm sú Penaeus monodon bằng thử nghiệm in vivo sau khi bổ sung qua đường miệng. Chiết xuất cỏ gà được phân lập từ C. dactylon kết hợp với thức ăn viên nhân tạo ở nồng độ 1% hoặc 2%. Thử nghiệm cảm nhiễm được thực hiện bằng cách cho tôm ăn thịt tôm nhiễm WSSV. Nhiễm WSSV được xác nhận bằng kỹ thuật PCR, xét nghiệm sinh học và phương pháp Western blot vào cuối thí nghiệm. Kết quả của nghiên cứu này cho thấy chiết xuất C. dactylon có hiệu quả cao trong việc ngăn ngừa nhiễm WSSV mà không gây chết, và không có dấu hiệu bệnh WSD ở mức 2%, đồng thời gây tỷ lệ chết 40% ở nồng độ 1% đối với tôm sú P. monodon.
1. Giới thiệu
Bệnh đốm trắng (WSD) đã được báo cáo là nguyên nhân gây chết nghiêm trọng ở tôm nuôi, đặc biệt là tôm sú ở nhiều quốc gia. Virus hội chứng đốm trắng (WSSV) là nguyên nhân gây thiệt hại kinh tế nặng nề cho ngành nuôi tôm trên toàn thế giới (Lightner, 1996). Kể từ khi được phát hiện ở Đông Á vào năm 1992, virus hội chứng đốm trắng đã lây lan nhanh chóng sang các vùng nuôi tôm ở Đông Nam Á, Trung Á và Mỹ Latinh, gây thiệt hại lớn về kinh tế cho nghề nuôi tôm. Tác động nghiêm trọng của WSSV trong ngành nuôi tôm trên toàn thế giới và phạm vi ký chủ rộng đòi hỏi phải có các chiến lược kiểm soát mới chống lại loại virus này. Các chiến lược trước đây thường được sử dụng để kiểm soát WSSV bao gồm kích thích miễn dịch, vô hiệu hóa, tiêm chủng, cách ly và quản lý môi trường (Xiang, 2001). Các thí nghiệm trung hòa bằng kháng huyết thanh chống lại VP28 tái tổ hợp đã chỉ ra rằng protein VP28 của WSSV có liên quan đến sự lây nhiễm của WSSV (Van Hulten và cộng sự, 2001; Syed Musthaq và cộng sự, 2006). Protein VP28 tái tổ hợp được sử dụng để đánh giá tiềm năng bảo vệ tôm chống lại WSSV. Kết quả cho thấy tỷ lệ chết tích lũy ở tôm được tiêm VP28 thấp hơn đáng kể so với các protein cấu trúc khác của WSSV hoặc tôm không được tiêm VP28 (Namikoshi và cộng sự, 2004; Witteveldt và cộng sự, 2004; Jha và cộng sự, 2006). Sarathi và cộng sự, (2008a, b) đã nỗ lực phát triển RNAi cho tôm chống lại WSSV bằng cách sản xuất dsRNA tương ứng với protein vỏ VP28 trong hệ thống biểu hiện ở sinh vật nhân sơ để kiểm soát nhiễm WSSV. Balasubramanian và cộng sự, (2006) đã báo cáo rằng natri hypochlorite và benzalkonium clorua có hiệu quả và có thể vô hiệu hóa WSSV ở nồng độ tương ứng là 200 và 100 ppm.
Nghiên cứu về thuốc kháng virus ở thực vật đã phát triển kể từ năm 1950. Nhiều loại thực vật đã được nghiên cứu về hoạt tính kháng virus. Hoạt tính kháng virus chỉ được phát hiện ở các bộ phận khác nhau như lá, vỏ, chồi, hoa, thân rễ và rễ của một số cây (Du và cộng sự, 2003; Premanathan và cộng sự, 1992). Nhiều loài thực vật trong số này có nguồn gốc trên cạn và đã được nghiên cứu để chống lại virus. Nhiều loại dược liệu đã được thử nghiệm và sử dụng với kết quả tốt trong việc kiểm soát bệnh do virus gây ra trên tôm (Balasubramanian và cộng sự, 2007; Direkbusarakom và cộng sự, 1998; Direkbusarakom và cộng sự, 1997). Cỏ Cynodon dactylon thuộc họ Poaceae, được người theo đạo Hindu coi là một loại thảo mộc linh thiêng và được sử dụng trong các nghi lễ tôn giáo. Loại cây này là một loại cỏ dại rất phổ biến trên khắp Ấn Độ cũng như ở các vùng nhiệt đới và ôn đới ấm áp quanh năm (Sivarajan và Balacharan, 1994). Balasubramanian và cộng sự, (2007) đã tiến hành sàng lọc nhiều loại thảo dược ở Ấn Độ để xác định hoạt tính kháng virus chống lại WSSV. Họ báo cáo rằng chiết xuất dạng nước của C. dactylon cho thấy hoạt tính kháng virus mạnh nhất trong việc chống lại WSSV. Dhar và cộng sự, (1968) cũng đã chứng minh hoạt tính kháng virus mạnh mẽ của chiết xuất C. dactylon trong dung môi cồn giúp chống lại virus Vaccinia. Bài viết này báo cáo việc chuẩn bị chiết xuất C. dactylon được sản xuất quy mô lớn. Đồng thời, hoạt tính kháng virus của chiết xuất C. dactylon trên quy mô lớn đối với virus gây hội chứng đốm trắng (WSSV) ở tôm sú Penaeus monodon bằng thử nghiệm in vivo sau khi bổ sung qua đường miệng cũng đã được nghiên cứu.
2. Vật liệu và phương pháp
2.1. Chuẩn bị cấy virus
Tôm sú P. monodon nhiễm WSSV, với những đốm trắng đặc trưng được thu thập từ các trang trại nuôi tôm gần Nellore, Ấn Độ. Máu được lấy trực tiếp từ tim tôm bị nhiễm bệnh bằng ống tiêm vô trùng. Sau đó, máu được tổng hợp và ly tâm ở tốc độ 3000 × g trong 20 phút ở 4°C. Chất lỏng nổi phía trên được ly tâm lại ở tốc độ 8000 × g trong 30 phút ở 4°C và chất lỏng cuối cùng nổi phía trên được lọc qua bộ lọc 0,4 μm. Dung dịch đã được lọc sau đó được bảo quản ở -20°C để nghiên cứu khả năng lây nhiễm. Tổng protein trong máu được xác định bằng phương pháp của Lowry và cộng sự, (1951). Sự hiện diện của WSSV trong máu đã được kiểm tra bằng PCR, sử dụng các đoạn mồi đã được công bố của Yoganandhan và cộng sự, (2003). Máu tôm không nhiễm WSSV với một nồng độ tương tự đã được chuẩn bị cho nhóm đối chứng âm, kết quả âm tính với WSSV được xét nghiệm bằng Nested PCR.
2.2. Chuẩn bị chiết xuất C. dactylon trên quy mô lớn
Cỏ C. dactylon (toàn bộ cây) được thu thập xung quanh Kamakkur, Tamil Nadu, Ấn Độ. Cỏ sau khi thu thập được phơi khô trong bóng râm và nghiền thành bột. Bước chuẩn bị được bắt đầu với việc ngâm 1 kg chiết xuất dạng bột của toàn bộ cây trong 10 lít nước và đun nóng ở nhiệt độ 60°C trong 20 phút. Dịch chiết thô dạng nước, màu vàng thu được bằng cách lọc cặn, và dung dịch lọc được pha loãng với 100% etanol theo tỷ lệ 1:4. Một lượng lớn kết tủa dạng gel được hình thành ngay sau khi thêm etanol. Phần nổi phía trên của chiết xuất chứa etanol được thu hồi bằng cách lọc và loại bỏ kết tủa. Dung dịch nổi phía trên được chưng cất ở 60°C để thu được chiết xuất cỏ trên quy mô lớn. Chiết xuất thu được được làm khô hoàn toàn trong không khí (Ngan và cộng sự, 1988). Những chất chiết xuất khô này được bảo quản trong tủ lạnh cho đến khi được sử dụng cho thử nghiệm sinh học.
2.3. Chuẩn bị khẩu phần thử nghiệm
Chiết xuất C. dactylon được kết hợp với thức ăn viên nhân tạo (thức ăn CP, Thái Lan) ở nồng độ 1% hoặc 2%. Nồng độ cần thiết của chiết xuất được hòa tan trong nước và phủ lên thức ăn viên. Để tạo được lớp phủ, dung dịch chiết xuất được trộn với viên thức ăn và ủ ở nhiệt độ phòng trong 15 phút để cho phép thức ăn hấp thụ chiết xuất, và sau đó phủ một lớp gel liên kết để ngăn sự phân tán của chiết xuất trong nước. Thức ăn sau đó được sấy khô và bảo quản ở nhiệt độ phòng cho đến khi cho tôm ăn.
2.4. Thu thập và bảo quản động vật thí nghiệm
Tôm sú P. monodon (trọng lượng cơ thể 8–10 g), được thu thập từ biển và được nuôi trong bể sợi thủy tinh dung tích 1000 L với bộ lọc sinh học Air-lift ở nhiệt độ phòng (27–30°C) với độ mặn từ 20 đến 25 ppt. Nước biển tự nhiên đã được sử dụng trong tất cả các thí nghiệm. Nước biển được lấy từ Vịnh Bengal, gần Chennai và được để lắng để loại bỏ cát và các hạt lơ lửng khác. Tôm được cho ăn thức ăn viên nhân tạo (thức ăn CP, Thái Lan). Nhiệt độ, pH, độ mặn và oxy hòa tan cũng được ghi lại. Từ những con tôm thí nghiệm, một phần nhỏ chân bơi được cắt ra và sử dụng để sàng lọc WSSV bằng phản ứng chuỗi polymerase (PCR) sử dụng mồi do Yoganandhan và cộng sự (2003) thiết kế. Chỉ những con tôm khỏe mạnh mới được sử dụng cho thử nghiệm.
2.5. Xác định hoạt tính kháng virus của chiết xuất thông qua đường miệng
Hoạt tính kháng virus của C. dactylon đã được thử nghiệm bằng cách cho tôm ăn chiết xuất kết hợp với thức ăn viên thương mại, tôm sú P. monodon được cảm nhiễm WSSV bằng cách sử dụng thịt tôm bị nhiễm bệnh. Sau khi thuần, tôm được chia thành bốn nhóm, mỗi nhóm 20 con và mỗi thử nghiệm được thực hiện ba lần. Ở nhóm I, tôm được cho ăn thức ăn viên bình thường trong suốt thời gian thử nghiệm và được xem như nhóm đối chứng âm. Ở nhóm II, tôm được cho ăn thức ăn viên bình thường trong 5 ngày đầu. Sau đó được cho ăn thịt tôm nhiễm WSSV hai lần vào ngày thứ sáu. Sau ngày thứ sáu, tôm được cho ăn thức ăn viên bình thường trong suốt thời gian thử nghiệm và nhóm này được xem là nhóm đối chứng dương. Ở nhóm III, tôm được cho ăn thức ăn kết hợp chiết xuất cỏ C. dactylon (1%) trong 5 ngày đầu. Sau đó được cho ăn thịt tôm nhiễm WSSV hai lần vào ngày thứ sáu. Sau ngày thứ sáu, tôm được cho ăn thức ăn kết hợp chiết xuất trong suốt thời gian thử nghiệm. Ở nhóm IV, tôm được cho ăn thức ăn kết hợp chiết xuất (2%) trong 5 ngày đầu. Sau đó được cho ăn thịt tôm nhiễm WSSV hai lần vào ngày thứ sáu. Sau ngày thứ sáu, tôm được cho ăn thức ăn kết hợp chiết xuất trong suốt thời gian thử nghiệm. Ở tất cả các nhóm, tôm được cho ăn hai lần mỗi ngày. Khẩu phần ban đầu là 5–7% trọng lượng cơ thể và sau đó được điều chỉnh tùy theo phản ứng ăn của tôm trong mỗi bể. Thức ăn thừa và chất thải được loại bỏ trước khi cho ăn. Tôm trong thử nghiệm được kiểm tra hai lần một ngày để tìm các dấu hiệu bệnh và tỷ lệ tôm chết được ghi lại.
2.6. Phát hiện WSSV bằng PCR
Nhiễm WSSV được xác nhận bằng kỹ thuật PCR sử dụng mồi của Yoganandhan và cộng sự, (2003), xét nghiệm sinh học, RT-PCR và phân tích Western blot (Sahul Hameed và cộng sự, 1998) vào cuối thí nghiệm. DNA mẫu cho xét nghiệm PCR được chuẩn bị từ tôm trong thử nghiệm bằng cách chiết xuất từ mang, theo phương pháp được mô tả bởi Lo và cộng sự, (1996). Các mô mang được cắt và đồng nhất. Mẫu mô mang đã đồng nhất được ly tâm ở tốc độ 3000 × g ở 4°C, sau đó, chất lỏng phía trên được đặt vào một ống ly tâm khác cùng với một lượng dung dịch tiêu hóa thích hợp (100 mM NaCl, 10 mM Tris HCl, 50 mM EDTA, 0,5% natri dodecyl sunfat, 0,1 mg/ml proteinase K, pH 8,0). Sau khi ủ ở 65°C trong 2 giờ, dung dịch tiêu hóa được khử protein bằng cách chiết liên tiếp bằng rượu phenol/chloroform/isoamyl, thu hồi bằng kết tủa etanol và sấy khô; viên DNA khô được hòa tan lại trong dung dịch đệm TE. Đối với PCR, các mồi được thiết kế bởi Yoganandhan và cộng sự, (2003) đã được sử dụng để khuếch đại đoạn WSSV-DNA 200 bp. Các sản phẩm PCR được phân tích bằng điện di trên gel agarose 1% được nhuộm bằng ethidium bromide và quan sát bằng phương pháp chiếu tia cực tím.
2.7. Phân tích PCR phiên mã ngược
Tổng RNA từ máu của tôm nhiễm WSSV được chiết xuất bằng thuốc thử Trizol (Gibco-BRL). Chuỗi cDNA đầu tiên được tổng hợp bằng cách sử dụng mồi phiên mã ngược (Promega) và oligo (dT) theo hướng dẫn của nhà sản xuất. Các sản phẩm phản ứng cDNA được xét nghiệm PCR với bộ mồi vp28-F và vp28-R (5′-CGCGGATCCGATGGATCTTTCTTTCACTCTTTC-3′/5′ CC GGAATTCTTACTCGGTCTCAGTGCCAG-3′) cho gen VP28. Phiên mã β-actin được khuếch đại bằng cách sử dụng bộ mồi Actin-F và Actin-R (5′-GAYGAYATGGAGAAGATCTGG-3′/5′CRGGGTACATGG TGGTRCC-3) đóng vai trò kiểm soát nội bộ về chất lượng RNA và hiệu quả khuếch đại. Sản phẩm PCR được phân tích bằng phương pháp điện di trên gel agarose 1%.
2.8. Phân tích Western blot
Phân tích Western blot được thực hiện để phát hiện biểu hiện của WSSV-VP28 ở các nhóm nghiệm thức khác nhau bằng phương pháp của Talbot và cộng sự, (1984). Sau khi tách trên SDS-PAGE, các mẫu được chuyển sang màng nitrocellulose (Macherey–Nagel, Dueren, Đức) ở 300 mA trong 2 giờ ở 4°C. Sau khi chuyển, màng được chặn trong 1 giờ bằng 3% sữa tách béo trong dung dịch PBS. NCP được ủ trong kháng huyết thanh chống lại protein VP28 của WSSV (Yoga-nandhan và cộng sự, 2004) ở nồng độ pha loãng 1/10.000 trong PBS chứa 0,2% BSA trong 3 giờ. Sau đó, màng này được ủ trong kháng thể IgG (Sigma) thỏ kết hợp với ALP trong 1 giờ, và VP28 được phát hiện với dung dịch gồm 4-nitroblue tetrazolium clorua (NBT) và 5-bromo-4-chloro-3- indolyl phosphate (BCIP) (Sigma) trong dung dịch đệm.
3. Kết quả
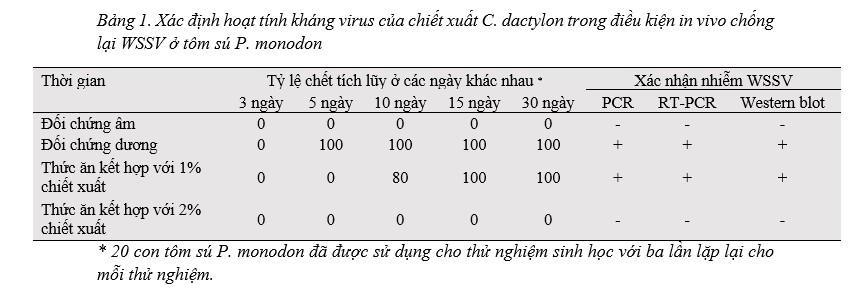
Đối với các thử nghiệm in vivo, tôm được cho ăn bằng thức ăn viên nhân tạo phủ chiết xuất cỏ C. dactylon và được cảm nhiễm WSSV thông qua đường miệng. Trong thí nghiệm này, bốn nhóm tôm được cho ăn các loại thức ăn khác nhau như đã đề cập ở Phần 2.5, và mối quan hệ giữa thời gian và tỷ lệ tôm chết trong thử nghiệm này được trình bày trong Bảng 1. Ở nhóm I, tôm được cho ăn bằng thức ăn viên bình thường, không có tỷ lệ tôm chết cho đến khi kết thúc thử nghiệm. Ở nhóm II, tôm được cho ăn bằng thức ăn bình thường và cảm nhiễm với WSSV thông qua đường miệng, được xem là nhóm đối chứng dương và cho thấy tỷ lệ chết 100% vào ngày thứ 4 sau khi nhiễm bệnh. Ở nhóm III, tôm được cho ăn thức ăn kết hợp với 1% chiết xuất cỏ C. dactylon và được cảm nhiễm WSSV thông qua đường miệng, cho thấy tỷ lệ chết 100% vào ngày thứ 9 sau khi nhiễm bệnh, chậm hơn 5 ngày so với nhóm II. Ở Nhóm IV, tôm được cho ăn thức ăn kết hợp với 2% chiết xuất và được cảm nhiễm WSSV thông qua đường miệng đã sống sót mà không có bất kỳ tỷ lệ chết và dấu hiệu lâm sàng nào của WSSV cho đến khi kết thúc thời gian thử nghiệm 30 ngày.
Các mẫu mô được chuẩn bị từ tất cả các nhóm được sàng lọc bằng PCR để xác nhận nhiễm WSSV (Bảng 1; Hình 1). Trong các thử nghiệm in vivo, tôm sống sót ở nhóm đối chứng dương và đối chứng âm cho kết quả âm tính với WSSV thông qua xét nghiệm PCR, và những con tôm trong trạng thái “hấp hối” từ nhóm đối chứng dương và Nhóm III được cho ăn thức ăn viên phủ 1% chiết xuất cho kết quả dương tính với WSSV thông qua xét nghiệm PCR.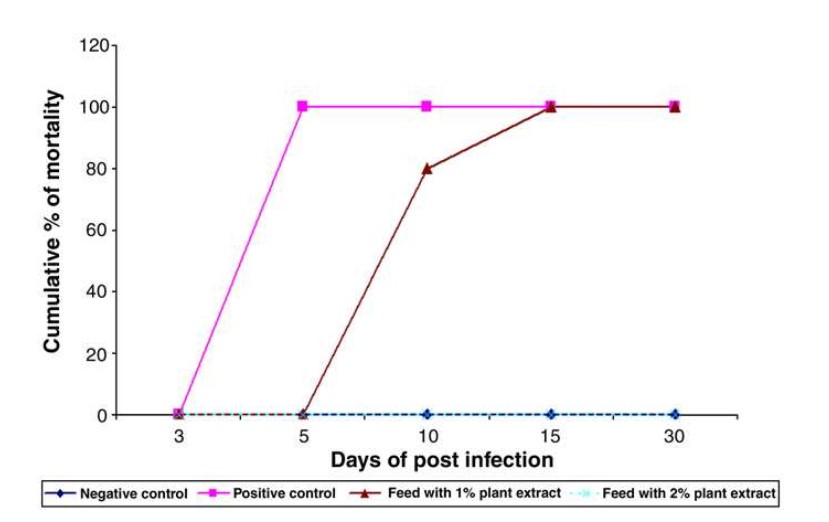
Hình 1. Tỷ lệ chết tích lũy của tôm từ các nhóm thử nghiệm được cho ăn thức ăn viên thông thường và thức ăn viên được bọc chiết xuất C. dactylon (1% hoặc 2%). Tỷ lệ chết tích lũy và giá trị P được xác định vào ngày thứ 30 sau cảm nhiễm WSSV.
Phương pháp RT-PCR và phân tích Western blot được thực hiện trên tôm có trạng thái bình thường, tôm trong nhóm đối chứng dương và tôm được cho ăn thức ăn viên kết hợp với 1% hoặc 2% chiết xuất, được cảm nhiễm với WSSV vào cuối thí nghiệm để phát hiện phiên mã đặc hiệu WSSV VP28. Nghiên cứu này cũng tập trung vào việc tìm hiểu khả năng nhân lên của WSSV trên tôm sau khi xử lý bằng chiết xuất C. dactylon. Kết quả chỉ ra rằng phiên mã đặc hiệu VP28 không được phát hiện trong máu của tôm bị bệnh được cho ăn thức ăn viên có chứa 2% chiết xuất thực vật như ở nhóm đối chứng âm. Phiên mã VP28 được quan sát thấy trong tất cả các cơ quan của tôm trong nhóm III được cho ăn thức ăn viên có chứa 1% chiết xuất như ở nhóm đối chứng dương.
4. Thảo luận
Động vật giáp xác chỉ có phản ứng miễn dịch bẩm sinh không đặc hiệu và không có trí nhớ miễn dịch, dẫn đến hệ thống miễn dịch của tôm không có khả năng tự bảo vệ cơ thể chúng khỏi nhiễm WSSV (Sarathi và cộng sự, 2007). Việc phát triển chiết xuất thực vật kháng virus WSSV thông qua đường miệng là một giải pháp khả thi để kiểm soát sự lây lan nhanh chóng của dịch bệnh nguy hiểm này. Trước đây, Balasubramanian và cộng sự, (2007) đã chỉ ra rằng việc tiêm chiết xuất thô dạng nước của C. dactylon sẽ bảo vệ tôm chống lại WSSV một cách hiệu quả. Nghiên cứu hiện tại được thực hiện để điều tra xem liệu việc sử dụng chiết xuất C. dactylon được sản xuất quy mô lớn để bổ sung qua đường miệng có khả năng bảo vệ tôm sú P. monodon chống lại WSSV hay không. Do đó, việc sản xuất chiết xuất C. dactylon trên quy mô lớn đã được thực hiện, chiết xuất này được bổ sung kết hợp với thức ăn viên thương mại cho tôm bị nhiễm WSSV bằng cách sử dụng thịt tôm bị nhiễm bệnh.
Các loại thảo dược đang ngày càng được dự đoán là nguồn thay thế thích hợp cho các chất chống virus. Chiết xuất của năm loại thảo dược khác nhau C. dactylon, Aegle marmelos, Tinospora cordifolia, Picrorhiza kurooa và Eclipta alba trong dung môi metanol đã cho thấy tỷ lệ sống là 74% ở liều 800 mg/kg đối với tôm sú P. monodon nhiễm WSSV (Citarasu và cộng sự, 2006). Tỷ lệ sống của tôm sú P. monodon nhiễm WSSV được cho ăn thức ăn tôm có chiết xuất lá cây Pongamia pinnata trong dung môi etanolic được nhận thấy là 40% ở mức 200 mg/g trọng lượng cơ thể tôm mỗi ngày, và 80% ở mức 300 mg/g trọng lượng cơ thể tôm mỗi ngày (Rameshthangam và Ramasamy, 2007). Direkbusarakom và cộng sự, (1998) đã chiết xuất các chất chống virus từ lá của Clina-canthus nutans (cây thuốc cổ truyền của Thái Lan) trong dung môi ethanol và báo cáo rằng hiệu quả của hỗn hợp chiết xuất và thức ăn viên ở mức 1 g/kg thức ăn là nồng độ tốt nhất để bảo vệ tôm sú P. monodon khỏi bệnh đầu vàng. Direkbusarakom và cộng sự, (1997) đã chứng minh hoạt tính kháng virus của chiết xuất guva (Psidium guvajava) trong dung môi etanolic chống lại mầm bệnh IHNV, OMV và YHV trên cá và tôm. Balasubramanian và cộng sự, (2007) đã báo cáo hoạt động kháng virus trong điều kiện in vitro của 5 cây thuốc ở Ấn Độ có tác dụng chống lại WSSV trong số 21 cây được thử nghiệm. Trong số 5 loại cây được thử nghiệm, chiết xuất dạng nước của C. dactylon cho thấy hoạt tính kháng virus mạnh nhất, giúp chống lại WSSV mà không gây chết và không có dấu hiệu của bệnh WSD ở mức 100 mg/kg trọng lượng cơ thể tôm. Chiết xuất của Momordica charantia trong dung môi metanol cho thấy hoạt động kháng virus đáng kể mà không gây chết và không có dấu hiệu bệnh WSD ở liều 150 mg/kg trọng lượng cơ thể. Chiết xuất dạng nước của Lantana camara, Phyllanthus amarus và chiết xuất của A. marmelos trong dung môi metanol cho thấy hoạt tính kháng virus chống lại WSSV ở một mức độ nhất định.
Việc tiêm chiết xuất thực vật vào tôm trong hệ thống nuôi thực tế là không khả thi. Trong nghiên cứu này, một nỗ lực đã được thực hiện để khám phá khả năng sử dụng chiết xuất thực vật được sản xuất trên quy mô lớn thông qua đường miệng để bảo vệ tôm chống lại WSSV. Các kết quả được nhận thấy là khả quan khi tôm bị nhiễm WSSV được nuôi bằng thức ăn phủ chiết xuất C. dactylon được sản xuất quy mô lớn. Chiết xuất C. dactylon cho thấy hoạt tính kháng virus mạnh nhất, chống lại WSSV mà không gây chết và không có dấu hiệu của bệnh WSD ở mức 2%, và tỷ lệ chết 40% ở mức 1% đối với tôm sú P. monodon. Người ta thường tin rằng việc sử dụng chiết xuất thực vật thông qua đường miệng sẽ bảo vệ tôm chống lại WSSV, như báo cáo của Witteveldt và cộng sự, (2004) sử dụng vi khuẩn tạo ra protein VP28 tái tổ hợp và phủ lên thức ăn sẽ mang lại tỷ lệ sống là 64%. Điều tương tự cũng được báo cáo bởi Sarathi và cộng sự, (2008b) sử dụng vi khuẩn tạo ra VP28dsRNA và phủ lên thức ăn viên sẽ mang lại tỷ lệ sống là 67%. Trong nghiên cứu này, chiết xuất C. dactylon được phát hiện là có hiệu quả cao trong việc ngăn ngừa nhiễm WSSV ở tôm sú. Điều này có thể là do phương pháp quản lý được sử dụng. Ở người, chiết xuất được bôi trực tiếp lên vết thương bị nhiễm trùng, trong khi đối với tôm, chiết xuất được bổ sung bằng cách trộn với thức ăn viên và cho tôm ăn. Vì tôm là loài động vật ăn chậm và có ruột ngắn nên khả năng hấp thu ở tôm chắc chắn thấp hơn ở người. Theo đó, chỉ một lượng nhỏ chiết xuất sẽ được tôm hấp thụ. Thức ăn viên phủ chiết xuất C. dactylon được bao bọc gel liên kết giúp ngăn ngừa sự thất thoát chiết xuất trong quá trình cho ăn.
Trong số các protein virus WSSV, VP28 được phát hiện là protein chiếm ưu thế và đóng vai trò quan trọng trong quá trình lây nhiễm (Nadala và cộng sự, 1997; Sahul Hameed và cộng sự, 1998; Sarathi và cộng sự, 2008a, b; Van Hulten và cộng sự, 2001). Vì VP28 là protein chiếm ưu thế nên kháng huyết thanh được tạo ra để chống lại protein này đã được sử dụng để phát hiện WSSV ở tôm thông qua kỹ thuật Western blot trong nghiên cứu hiện tại. Đoạn mồi được thiết kế dựa trên trình tự gen VP28 được sử dụng để nghiên cứu sự nhân lên của WSSV trên tôm được xử lý bằng chiết xuất thực vật thông qua kỹ thuật RT-PCR. Kết quả cho thấy gen VP28 không được biểu hiện, như đã được xác nhận bởi kỹ thuật RT-PCR và sau đó là phân tích tịnh tiến bằng kháng huyết thanh của protein VP28. Điều này cho thấy WSSV không nhân lên trong tôm được xử lý bằng chiết xuất thực vật. Những kết quả này cho thấy rằng sự bất hoạt của virus có thể xảy ra do phản ứng giữa dịch chiết và vỏ của virus, dẫn đến sự ức chế quá trình phiên mã và dịch mã của gen VP28 như được nhận thấy trong nghiên cứu này, và đây có thể là lý do phát triển tính kháng ở tôm được xử lý bằng chiết xuất thực vật chống lại WSSV. Tuy nhiên, cần có những nghiên cứu sâu hơn để đánh giá việc bổ sung chiết xuất thông qua đường miệng trong các hệ thống thực tế.
Theo G. Balasubramanian, M. Sarathi, C. Venkatesan, John Thomas, A.S. Sahul Hameed
Nguồn: https://www.sciencedirect.com/science/article/abs/pii/S0044848608002445?via%3Dihub
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Shrimp II: Thức Ăn Và Quản Lý
- Shrimp III: Dịch Bệnh Và Lợi Nhuận
- Tổ chức Đối tác Nghề cá Bền vững mong muốn giảm thiểu tác động từ các trang trại nuôi tôm ở Ấn Độ

 English
English