Tóm tắt
Enterocytozoon hepatopenaei (EHP) là một loại ký sinh trùng nội bào bắt buộc, gây nhiễm trùng gan tụy (HPM) trên tôm nuôi ở các nước châu Á. Chiến lược để kiểm soát EHP là xác định và loại bỏ những nơi có chứa nguồn bệnh trong ao nuôi tôm. Một số sinh vật sống ở biển và nước lợ, bao gồm cả vẹm (Mytilopsis) đã được báo cáo là cho kết quả dương tính với EHP thông qua xét nghiệm PCR. Vì vậy, chúng tôi đã thử nghiệm vẹm (Mytilopsis leucophaeata) thu thập từ 6 ao nuôi tôm nhiễm EHP ở Thái Lan để tìm sự hiện diện của EHP bằng phương pháp SWP-PCR. Kết quả cho thấy vẹm được lấy mẫu từ cả 6 ao đều dương tính với EHP thông qua PCR. Các xét nghiệm sinh học tiếp theo được thực hiện để nghiên cứu sự truyền nhiễm EHP giữa vẹm và tôm. Đầu tiên, những con vẹm không nhiễm bệnh được cho sống chung với tôm nhiễm EHP và tất cả vẹm đều dương tính với EHP ở ngày thứ 20 sau khi chung sống, đã được kiểm tra bằng phương pháp SWP-PCR. Lô vẹm dương tính với EHP này được chuyển sang sống chung với tôm không nhiễm bệnh và kết quả quan sát thấy có 37,5% tôm dương tính với EHP trong vòng 10 ngày. Phân tích mô của vẹm dương tính với EHP bằng kính hiển vi ánh sáng, kỹ thuật lai tại chỗ và kính hiển vi điện tử cho thấy không nhiễm EHP. Tóm lại, không có bằng chứng nào chứng minh rằng bản thân Mytilopsis leucophaeata đã bị nhiễm EHP. Tuy nhiên, những con vẹm rõ ràng có khả năng mang các bào tử nhiễm bệnh sau một thời gian tiếp xúc và hoạt động như một cá thể mang mầm bệnh nhưng không có triệu chứng. Kết quả này hỗ trợ các báo cáo trước đây cảnh báo về nguy cơ khi cho tôm bố mẹ trong trại giống hoặc tôm trong ao nuôi ăn động vật hai mảnh vỏ tươi sống mà không được xử lý bằng cách nấu hoặc đông lạnh trước đó.
1/ Giới thiệu
Enterocytozoon hepatopenaei (EHP) là một ký sinh trùng nội bào bắt buộc, hiện đang đe dọa ngành nuôi tôm ở một số nước châu Á (Ha và cộng sự, 2010; Tangprasittipap và cộng sự, 2013; Rajendran và cộng sự, 2016, Shen và cộng sự, 2019). EHP lần đầu tiên được phát hiện ở Thái Lan vào năm 2004, trên tôm sú Penaeus monodon (Chayaburakul và cộng sự, 2004) và sau đó được mô tả chi tiết và được đặt tên vào năm 2005 và 2009 (Tourtip, 2005; Tourtip và cộng sự, 2009). Các trường hợp nhiễm có biểu hiện tương tự đã được báo cáo trước đây đối với tôm sú P. monodon từ Malaysia (Anderson và cộng sự, 1989) và tôm P. japonicus ở Úc (Hudson và cộng sự, 2001). Có lẽ việc nuôi tôm thẻ chân trắng rộng rãi như một loài nuôi chính ở châu Á vào khoảng năm 2004 và việc mở rộng sản xuất nhanh chóng sau đó, cùng với sự thiếu chú ý đến EHP đã khiến ngành nuôi tôm dễ bị tác động hơn bởi mầm bệnh này. Một đánh giá gần đây (Chaijarasphong và cộng sự, 2020) đã tóm tắt hiện trạng nghiên cứu về EHP.
May mắn thay, đàn tôm giống P. vannamei sạch bệnh (SPF) đã được phát triển trước khi EHP xâm nhập vào châu Á, và có thể EHP không xuất hiện tự nhiên trong môi trường bản địa của P. vannamei ở Tây Thái Bình Dương. Do đó, những con tôm giống này đã không mang mầm bệnh và hiện nay tất cả những người nuôi tôm “cẩn thận” có thể tránh thả tôm giống (PL) nhiễm EHP. Tuy nhiên, có bằng chứng cho thấy sự lây nhiễm trên diện rộng có thể xảy ra do ô nhiễm nguồn tôm bố mẹ SPF trong trại sản xuất giống hoặc con của chúng khi thả trong ao nuôi tôm. Trong những trường hợp này, nhiễm khuẩn bắt nguồn từ những con mang EHP tự nhiên. Vẫn còn rất ít thông tin về những cá thể có thể mang mầm bệnh, mặc dù một số động vật biển được sử dụng làm thức ăn cho tôm bố mẹ đã có kết quả xét nghiệm dương tính với EHP (Chaijar- asphong và cộng sự, 2020). Nếu không có phân tích mô và xét nghiệm sinh học chi tiết, không thể phân biệt cá thể mang mầm bệnh nhưng không có triệu chứng và cá thể mang mầm bệnh, trong đó, cá thể mang mầm bệnh có khả năng tạo thành ổ bệnh.
Có nhiều báo cáo về EHP trong các mô khác nhau ở nhuyễn thể, như trong mô liên kết của tuyến tiêu hóa ở sò Aequipecten opercularis (Lohrmann và cộng sự, 2000), trong mô liên kết bao quanh biểu mô ruột của hàu Ostrea lutaria (Jones, 1981) và trong biểu mô dạ dày của nghêu Ruditapes decussatus, Venerupis pullastra và V. rhomboides (Villalba và cộng sự, 1993a, b). Vẹm Mytilopsis leucophaeata, màu đen thường sống bám trong các ao nuôi tôm và có thể tập hợp với số lượng rất lớn trong giai đoạn trước khi thu hoạch. Thử nghiệm sơ bộ của chúng tôi cho thấy vẹm dương tính với EHP thông qua xét nghiệm PCR. Do đó, nếu vẹm là vật chủ thay thế theo chu kỳ của EHP, nó có thể là nguyên nhân chính làm tăng số lượng bào tử bị nhiễm khuẩn được sinh ra bởi chính tôm bị nhiễm bệnh.
Vì những lý do này, chúng tôi tập trung vào việc kiểm tra vẹm M. leucophaeata (Hình 1) có thể là “ổ chứa” EHP. Cuộc điều tra sơ bộ đã được thực hiện đối với những ao nuôi thương phẩm có tôm dương tính với EHP nghiêm trọng (bằng phân tích PCR). M. leucophaeata cho thấy dương tính với EHP (bằng cách kiểm tra PCR) được tìm thấy trong tất cả các ao này. Các xét nghiệm sau đó trong phòng thí nghiệm được thực hiện bằng cách sử dụng M. leucophaeata âm tính cho sống chung với tôm nhiễm EHP để kiểm tra sự lây truyền EHP từ tôm sang vẹm. Những con vẹm bị nhiễm bệnh được chia thành 2 nhóm. Một nhóm được sử dụng trực tiếp, bằng cách cho những con vẹm nhiễm bệnh sống chung với tôm chưa nhiễm bệnh để xác định khả năng lây truyền EHP của vẹm sang tôm. Một nhóm khác được sử dụng để thực hiện phân tích mô bằng mô học, phân tích lai tại chỗ và kính hiển vi điện tử truyền qua (TEM) để xác định xem vẹm dương tính với EHP có thực sự bị nhiễm EHP hay không.

Hình 1. Ảnh chụp loài vẹm Mytilopsis leucophaeata bám trên trụ cầu trong ao nuôi tôm.
2/ Vật liệu và phương pháp
2.1 Lựa chọn các ao lấy mẫu
Có tổng 21 ao nuôi tôm ở 3 huyện (Na Yai Arm, Tha Mai và Laem Singh) thuộc tỉnh Chantaburi, Thái Lan bị nhiễm EHP và chậm lớn đã được kiểm tra để tìm nguyên nhân. Có 6 ao nuôi tôm bị nhiễm EHP nghiêm trọng và những ao này cũng chứa những con vẹm đã được lựa chọn để nghiên cứu thêm. Từ mỗi ao, các mẫu tôm (P. vannamei) và vẹm (M. leucophaeata) được thu thập. Việc xử lý tôm và vẹm được sử dụng trong nghiên cứu này tuân theo luật của Thái Lan về chăm sóc động vật có đạo đức theo luật Động vật vì Mục đích Khoa học, B.E. 2558 (A.D. 2015) và theo phê duyệt dự án số BT- Animal 12/2563.
Bảng 1: Các mồi PCR được sử dụng trong nghiên cứu và kích thước amplicon dự kiến của chúng.
![]()
2.2 Chuẩn bị mẫu mô tôm và vẹm để phân tích PCR
Gan tụy (HP) của 10 con tôm từ mỗi ao được mổ và đồng nhất riêng lẻ trong 1 ml dung dịch đệm phân giải DNA (đệm (50 mM Tris pH 9, 0,1 M EDTA pH 8, 50 mM NaCl, 2% SDS) chứa 100 μg/ml proteinase K để chuẩn bị tách chiết DNA. 10 con vẹm được làm sạch bên ngoài bằng nước máy 3 lần trước khi mổ để lấy mô bên trong, được đồng nhất trong cùng dung dịch đệm cho tôm.
2.3 Phương pháp tách chiết DNA và PCR
Các mẫu trong bộ đệm phân giải DNA được tách chiết DNA bằng QIAamp® DNA Mini Kits (Qiagen). Dịch chiết DNA được định lượng bằng máy quang phổ (Nano drop 200c, Thermo Scientific) trước khi xét nghiệm PCR.
Để phát hiện EHP, chiết xuất DNA được sử dụng làm khuôn mẫu cho phương pháp SWP- PCR (Jaorenlak và cộng sự, 2016). Các mồi được thể hiện trong Bảng 1. Sử dụng PCR và nested PCR (12,5 μl) chứa 1X OneTaq Hot Start Master Mix (NEB) và 0,2 μM mỗi mồi. Mẫu xét nghiệm PCR chứa 100 ng mẫu DNA, trong khi mẫu xét nghiệm nested PCR chứa 1 μl dung dịch phản ứng cuối cùng từ bước PCR đầu. Sau đó, các amplicon được phân tích bằng cách điện di trên gel agarose 1,5% với nhuộm ethidium bromide và sử dụng chất DNA ladder (DNA ladder 2 log, 100 bp, hoặc 1 kb từ New England Biolabs, Hoa Kỳ). Kích thước sản phẩm dự kiến thông qua PCR và nested PCR lần lượt là 514 và 148 bp.
2.4 Tôm chưa nhiễm EHP và tôm nhiễm EHP
Tôm P. vannamei chưa nhiễm bệnh (kích cỡ 2–3 g trọng lượng tươi, n = 40) được vận chuyển từ một trang trại nuôi tôm ở tỉnh Chacheongsao, Thái Lan và 10 con tôm đã được kiểm tra riêng lẻ để không nhiễm EHP bằng phương pháp SWP-PCR.
Tôm P. vannamei bị nhiễm EHP nghiêm trọng được lấy từ một trang trại nuôi tôm thương phẩm (kích cỡ 8–10 g trọng lượng tươi, n = 50) ở tỉnh Chantaburi, Thái Lan. Tôm đã được xác nhận là nhiễm EHP bằng PCR (n = 10) trước khi thuần 5 ngày trong bể nhựa 500 L chứa 350 L nước biển nhân tạo, độ mặn 20 ppt, oxy hòa tan 5 ppm, pH 7,8, độ kiềm 130–150 mg/l và cho ăn hàng ngày ở mức 3% trọng lượng cơ thể.
2.5 Thu thập, sàng lọc và xác định Mytilopsis sp.
300 con vẹm (M. leucophaeata) được tách khỏi trụ cầu trong các ao tôm âm tính với EHP (tỉnh Chantaburi, Thái Lan). Chúng được rửa kỹ 3 lần bằng nước máy sạch để loại bỏ hết các sinh vật bám trên vỏ. Những con vẹm không có mầm bệnh được thuần 3 ngày trong nước biển nhân tạo sạch, thay nước 100% hàng ngày. 5 con vẹm được lấy mẫu bằng cách bảo quản toàn bộ cơ thể của chúng trong dung dịch đệm phân giải để tách chiết DNA và xác định loài bằng PCR sử dụng cặp mồi gen 18S rRNA của sinh vật nhân chuẩn; UnivF-15 (5’-CTGCCAGTAGTCATATGC-3’) và UnivR-1765 (5’-ACCTTGTTACGACTTTAC-3’) (Frischer và cộng sự, 2000). Các đoạn mồi PCR được phân tích trình tự (Macrogen, Hàn Quốc). Kích thước mồi dự kiến là 1.769 bp. Bên cạnh đó, 10 con vẹm đã được kiểm tra PCR để đảm bảo rằng chúng không bị nhiễm EHP trước khi sử dụng cho thí nghiệm. Số còn lại được làm sạch và được giữ trong bể để duy trì (bể 100 L, ở 28°C) có chứa nước biển nhân tạo với độ mặn 20 ppt, được cho ăn trong 7 ngày trước khi tiến hành thử nghiệm sống chung với tôm nhiễm EHP.
2.6 Thử nghiệm sinh học “sống chung” giữa tôm nhiễm EHP và vẹm không nhiễm EHP
Thử nghiệm này (thử nghiệm sống chung đầu tiên) được thiết kế để xác định liệu tôm dương tính với EHP có thể truyền EHP cho vẹm M. leucophaeata chưa từng nhiễm bệnh hay không. 10 con tôm bị nhiễm EHP và 150 con vẹm không nhiễm EHP được cho sống chung trong 20 ngày trong bể nhựa 100 L có chứa nước biển nhân tạo độ mặn 20 ppt ở 28°C và đủ sục khí (oxy hòa tan> 4 ppm). Không có tuần hoàn nước hoặc thay nước ngoại trừ việc bổ sung nước biển sạch để thay thế lượng nước bị mất do bốc hơi. Tôm được cho ăn thức ăn viên công nghiệp 2 lần/ngày với 3% trọng lượng cơ thể. Vào ngày thứ 7 và ngày thứ 20 sau khi sống chung, 30 con vẹm được lấy ra để xét nghiệm sự hiện diện của EHP; 10 con vẹm được kiểm tra bằng phương pháp SWP-PCR, 5 con vẹm được kiểm tra bằng kỹ thuật soi tươi, 10 con vẹm được kiểm tra bằng mô học nhuộm H&E và lai tại chỗ (ISH), và 5 con vẹm được kiểm tra bằng kính hiển vi điện tử truyền qua. Những con vẹm này được làm sạch bề mặt 3 lần bằng cách sử dụng nước máy để khử nhiễm bên ngoài. Sau đó, chúng được loại bỏ vỏ và rửa sạch bằng nước khử trùng trước khi thử nghiệm. Số vẹm còn lại được sử dụng cho thí nghiệm sống chung thứ hai, trong đó những con vẹm này đóng vai trò là nguồn lây nhiễm EHP.
2.7 Thử nghiệm sống chung giữa vẹm nhiễm EHP và tôm không nhiễm EHP
Thử nghiệm này (thử nghiệm sống chung thứ hai) được thiết kế để xác định liệu vẹm M. leucophaeata dương tính với EHP có thể truyền EHP cho tôm chưa mang mầm bệnh hay không. Vẹm nhiễm EHP từ thử nghiệm sống chung thứ nhất đã được làm sạch bên ngoài trước khi sử dụng trong thử nghiệm này. 60 con vẹm nhiễm EHP được cho sống chung với 10 con tôm không nhiễm EHP trong bể 100 L trong 10 ngày. Thử nghiệm này bắt đầu 2 ngày sau khi kết thúc thử nghiệm sống chung trước đó (tức là sau khi có kết quả xét nghiệm PCR dương tính với EHP). Tôm được cho ăn theo cách tương tự như trong thử nghiệm sinh học sống chung thứ nhất. Vào ngày thứ 10 sau khi sống chung, các cá thể tôm (n = 8) được mổ dọc để chia gan tụy thành 2 phần. Một nửa được sử dụng để tách chiết DNA, sau đó là kiểm tra nested SWP-PCR nhau để phát hiện EHP. Nửa còn lại được điều tra bằng nghiên cứu mô học và ISH.
2.8 Kiểm tra mô học
10 con vẹm và gan tụy của 10 con tôm được cố định riêng lẻ trong dung dịch Davidson (Bell và Lightner, 1988) từ 18–24 giờ và được xử lý để phân tích mô học như mô tả trước đây (Bell và Lightner, 1988). Tóm lại, dung dịch cố định được thay thế bằng 70% etanol, để qua đêm trước khi xử lý, nhúng, cắt (dày 4 µm) và nhuộm bằng hematoxylin và eosin (H&E).
Đối với phân tích soi tươi, các tuyến tiêu hóa của vẹm (n = 5) được mổ và khử nhiễm bên ngoài bằng cách sử dụng nước cất khử trùng trước khi chúng được cắt thành từng miếng mỏng. Sau đó, các mảnh mô được đặt trên lam kính và nghiền nhẹ trước khi nhuộm với 2% phloxine B để quan sát khả năng xâm nhập của EHP thông qua vòi phân cực (Aldama-Cano và cộng sự 2018).
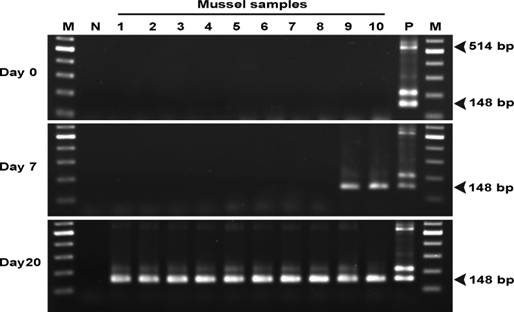
Hình 2. Điện di trên gel agarose sử dụng SWP-PCR của các mẫu được thu thập ở ngày 0, 7 và 20 sau khi sống chung trong thí nghiệm đầu giữa tôm nhiễm EHP và vẹm không nhiễm EHP (M. leucophaeata). Cột M: điểm đánh dấu 2 log, Cột N: đối chứng âm tính sử dụng nước vô trùng làm tiêu bản; Cột 1–10: Mỗi ngày thu 10 con vẹm; Cột P: đối chứng dương tính bằng cách sử dụng DNA chiết xuất từ tôm nhiễm EHP làm tiêu bản. Kích thước amplicon dự kiến cho PCR và SWP-PCR lần lượt là 514 và 148 bp. Lưu ý rằng trong các mẫu có số lượng bản sao mục tiêu cao, một dải bổ sung ở khoảng 180 bp cũng được phát hiện do tương tác giữa các đoạn mồi còn lại trong DNA mẫu từ PCR với các đoạn trong nested PCR (Jaroenlak và cộng sự, 2016)
Bảng 2: Mô tả bệnh, ngày lấy mẫu sau thời gian sống chung để phát hiện EHP bằng PCR và kết quả phát hiện của hai xét nghiệm chung sống.
|
Thử nghiệm sống chung |
Mẫu thử nghiệm | Ngày lấy mẫu | Số mẫu nhiễm EHP / Tổng số mẫu nhiễm được phát hiện |
% nhiễm EHP |
|
1. Vẹm không nhiễm EHP sống chung với tôm nhiễm EHP |
Vẹm
M. leucophaeata |
Ngày 0 | 0/10 | 0% |
| Ngày 7 | 2/10 |
20% |
||
|
Ngày 20 |
10/10 |
100% |
||
|
2. Tôm không nhiễm EHP sống chung với vẹm nhiễm EHP |
Tôm thẻ
P. vannamei |
Ngày 0 | 0/5 | 0% |
| Ngày 10 | 3/8 |
37,5% |
2.9 Phân tích lai tại chỗ
Đối với lai tại chỗ (ISH), một đoạn gen RNA ribosome nhỏ của EHP (SSU rRNA) đã được sử dụng để tạo ra mẫu dò EHP với bộ ghi nhãn PCR-DIG (Roche, Đức) ENF779 và ENR779 (Tangprasittipap và cộng sự, 2013). Đầu dò cụ thể cho gen virus hội chứng đốm trắng (WSSV) được chuẩn bị để phục vụ như một mẫu dò DNA đối chứng âm bằng cách sử dụng cùng một bộ ghi nhãn DIG với cặp mồi 447F và 447R (Srisala và cộng sự, 2008). Lý do sử dụng đầu dò DNA không đặc hiệu cho EHP thay vì không dùng đầu dò làm đối chứng âm là để loại trừ khả năng thu được các phản ứng ISH sai có thể phát sinh từ liên kết không đặc hiệu của DNA đôi khi xảy ra, như với chitin trong mẫu tôm. Kích thước của amplicon cho các đầu dò SSU và WSSV lần lượt là 779 bp và 447 bp. Các sản phẩm PCR thu được đã được tinh sạch bằng cách sử dụng Gel / PCR Gene pHlowTM (Geneaid). Các phần parafin liền kề được chuẩn bị để nhuộm H&E và cho các xét nghiệm ISH đối chứng dương tính và âm tính như đã mô tả trước đây (Tangprasittipap và cộng sự, 2013).
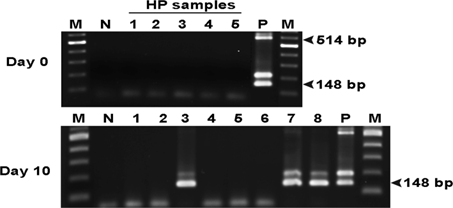
Hình 3. Điện di trên gel agarose bằng cách sử dụng SWP-PCR phát hiện các mẫu được thu thập ở ngày 0 và 10 sau thời gian sống chung trong thí nghiệm thứ hai giữa tôm không nhiễm EHP và M. leucophaeata nhiễm EHP. Vào ngày 0 sau khi chung sống, 5 con tôm được kiểm tra (Cột 1–5) và vào ngày 10 sau khi chung sống, 10 con tôm được kiểm tra (Cột 1–10). Cột M: điểm đánh dấu 2 log, Cột N: đối chứng âm tính sử dụng nước vô trùng làm tiêu bản; Cột P: đối chứng dương tính bằng cách sử dụng DNA chiết xuất từ tôm nhiễm EHP làm tiêu bản. Kích thước amplicon dự kiến cho bước đầu tiên và SWP-PCR bước 2 lần lượt là 514 và 148 bp.
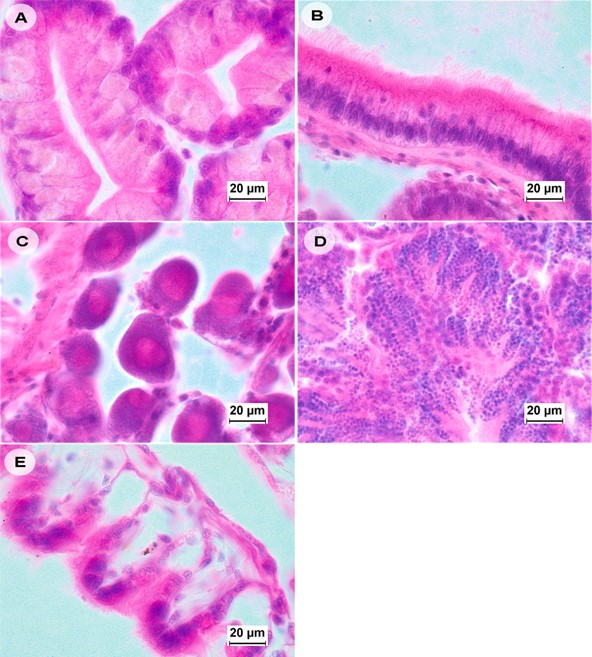
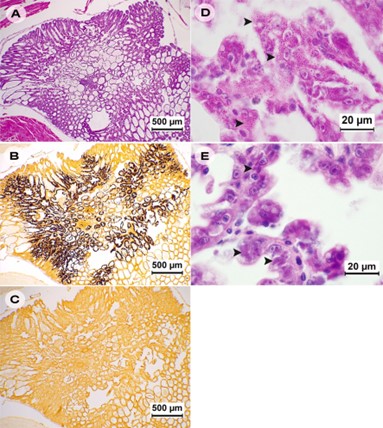
Hình 4. Ảnh kiểm tra mô học của vẹm M. leucophaeata dương tính với EHP bằng PCR cho thấy EHP không hiện diện trong các mô của vẹm bao gồm (A): tuyến tiêu hóa, (B): ruột, (C và D): cơ quan sinh sản của con cái và con đực, lần lượt và (E): mang (nhuộm H&E, độ phóng đại 100x).
2.10 Kính hiển vi điện tử truyền qua (TEM)
Đối với phân tích TEM (n = 5), các mảnh nhỏ (2 mm3) của tuyến tiêu hóa từ vẹm Mytilopsis sp được đồng nuôi 20 ngày, được cố định trong 4% glutaraldehyde trong dung dịch đệm 0,1 M PB và được tiến hành theo quy trình của Tourtip và cộng sự (2009). Các phần mẫu nhuộm uranyl axetat và chì xitrat trên lưới đồng được kiểm tra bằng kính hiển vi điện tử truyền qua H-800 của Hitachi.
3/ Kết quả
3.1 Xác định vẹm trong ao có tôm nhiễm EHP
Trong số 21 ao được khảo sát, 6 ao có biểu hiện tôm bị nhiễm EHP nặng và có cả vẹm. Sử dụng đoạn mồi gen 18S rRNA của sinh vật nhân chuẩn với 6 mẫu vẹm được thu thập ngẫu nhiên từ các trang trại này đã thu được amplicon gồm 1.741 nucleotide, kết quả giải trình tự cho thấy 99,94% danh tính đối với bản ghi cơ sở dữ liệu GenBank KX713323.1 đối với Mytilopsis leucophaeata.
3.2 Vẹm không nhiễm bệnh sống chung với tôm nhiễm EHP trở nên dương tính với EHP thông qua PCR
10 con vẹm trong 300 con không nhiễm bệnh được chọn ngẫu nhiên để kiểm tra không có EHP trước khi được sử dụng cho thử nghiệm sống chung. 10 con vẹm này lựa chọn ngẫu nhiên để nuôi chung với 10 con tôm bị nhiễm EHP nặng trong 7 ngày. Kết quả cho thấy 2/10 con vẹm (20%) lấy mẫu ở ngày thứ 7 sau sống chung cho kết quả dương tính với EHP thông qua PCR, nhưng sau 20 ngày sống chung, 10/10 trai lấy mẫu (100%) dương tính (Hình 2 và Bảng 2).
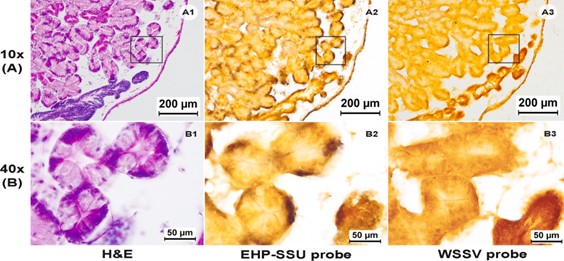
Hình 5. Ảnh chụp vi thể nhuộm H&E và ISH của tuyến tiêu hóa của M. leucophaeata dương tính với EHP-PCR ở độ phóng đại 10x (A) và 40x (B). Vùng hộp trong (A) được phóng đại trong (B). 1–3: tuyến tiêu hóa bị nhiễm EHP được nhuộm bằng đầu dò H&E, EHP-SSU và đầu dò WSSV, lần lượt. A1 và B1 cho thấy tuyến tiêu hóa nhuộm H&E mà không có bất kỳ giai đoạn EHP nào bên trong tế bào, A2 và B2 cho thấy các tín hiệu dương tính lan tỏa của đầu dò EHP-SSU trong tế bào chất của tế bào biểu mô của tuyến tiêu hóa, còn A3 và B3 cho thấy không có phản ứng WSSV với tuyến tiêu hóa.
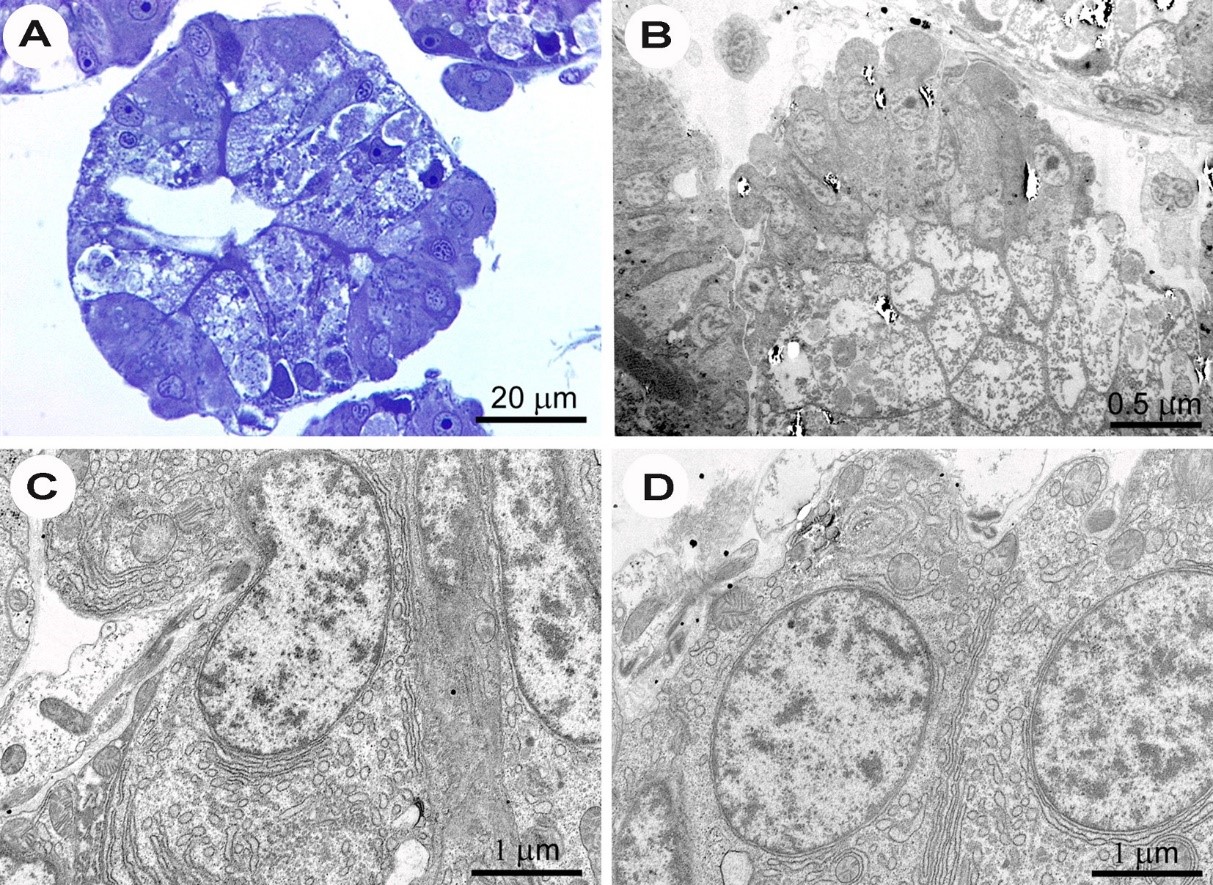
Hình 6. Hình ảnh chụp vi mô của semithin (dày 1 µm; A) để kiểm tra bằng kính hiển vi ánh sáng và các phần mỏng (dày ~ 70 nm; B-D) để kiểm tra bằng kính hiển vi điện tử truyền qua các tuyến tiêu hóa của vẹm. A và B: Tế bào biểu mô của các tuyến tiêu hóa được phân tích ISH dương tính với EHP bằng cách sử dụng đầu dò EHP-SSU cho thấy không có giai đoạn sống nội bào của EHP. C và D: Hình ảnh hiển vi điện tử truyền qua của tế bào biểu mô cho thấy nhân và tế bào chất có chứa nhiều lưới nội chất thô ráp và một vài ti thể không có EHP.
3.3 Kiểm tra EHP truyền từ vẹm dương tính sang tôm âm tính sau khi sống chung thông qua SWP-PCR
Đối với lần thử nghiệm sống chung thứ hai, vẹm M. leucophaeata từ lần thử nghiệm sống chung thứ nhất đã được rửa sạch trước khi chung sống với tôm âm tính với EHP (không có kết quả dương tính đối với 5 con tôm được lấy mẫu trước bằng SWP-PCR). Vào ngày thứ 10 sau khi sống chung, 3/8 (37,5%) tôm dương tính với EHP thông qua SWP-PCR (Hình 3 và Bảng 2). Kết quả này tương tự như những kết quả trong các thử nghiệm sống chung lây truyền từ tôm sang tôm, cho thấy khả năng lây truyền tương đối thấp sau 7 sống chung, nhưng lây truyền 100% sau 14 ngày (Salachan và cộng sự, 2017).
3.4 Kiểm tra Vẹm M. Leucophaeata dương tính với EHP nhưng không có dấu hiệu nhiễm EHP bằng PCR-SWP
Khi kết thúc thử nghiệm sống chung ban đầu (20 ngày) với tôm nhiễm EHP, các mẫu vẹm (n = 10) được kiểm tra bằng phân tích mô học bình thường (phiến kính nhuộm H&E) (Hình 4) không có dấu hiệu nhiễm EHP. Cả bào tử hay bất kỳ giai đoạn phát triển nào của EHP đều không được hiển thị trong tế bào của tất cả các mô được kiểm tra, bao gồm mang, tuyến sinh dục, tinh hoàn, cơ quan tiêu hóa, ruột và dạ dày của vẹm bị ảnh hưởng bởi EHP. Tuy nhiên, các phần mô lân cận được phân tích ISH bằng cách sử dụng đầu dò gen SSU rRNA để kiểm tra EHP đã cho thấy các dấu hiệu về sự hiện diện của EHP-DNA trong tế bào chất ở các tế bào biểu mô của tuyến tiêu hóa (Hình 5). Phân tích ISH cho thấy 4/10 mẫu nhiễm EHP nặng trong tế bào chất gần nhất với tuyến tiêu hóa của tế bào. Mặc dù sử dụng ISH, việc kiểm tra cả phiến kính nhuộm H&E và các phiến kính của các phần liền kề được nhuộm bằng ISH không cho thấy dấu hiệu nào về các giai đoạn phát triển của vi bào tử trùng, như plasmodia hoặc bào tử. Cũng không có bất kỳ cấu trúc nào giống như vi bào tử trùng hoặc phản ứng dương tính nào được quan sát thấy ở các mô khác bằng ISH (tức là mang, tuyến sinh dục, ruột và dạ dày). Vì chúng tôi đã sử dụng một đầu dò DNA không đặc hiệu (WSSV) thay vì không dùng một đầu dò làm đối chứng âm tính, nên có rất ít khả năng tín hiệu ISH phát sinh từ liên kết DNA không đặc hiệu như đôi khi có thể được nhìn thấy với chitin ở tôm.
Để kiểm tra thêm vẹm M. leucophaeata từ thử nghiệm sống chung này, các mô tuyến tiêu hóa đã được nghiên cứu, vì một số mẫu đã cho kết quả ISH dương tính với EHP. Cũng giống như phân tích mô học bằng kính hiển vi ánh sáng, không có tế bào biểu mô nào của tuyến tiêu hóa cho thấy sự hiện diện của EHP (ví dụ, tế bào bào tử, bạch cầu hoặc bào tử) bằng TEM (Hình 6). Mặt khác, phân tích soi tươi của tuyến tiêu hóa với phương pháp nhuộm phloxine-B cho thấy sự hiện diện của các bào tử giống như EHP, một số trong số đó có các vòi phân cực (Hình 7). Các vòi phân cực khi nhuộm phloxine-B được sử dụng như một dấu hiệu về khả năng tồn tại của EHP (Aldama-Cano và cộng sự 2018).
Đối với thử nghiệm sống chung thứ hai sử dụng vẹm dương tính với EHP với tôm âm tính, việc kiểm tra tôm ở ngày 10 sau khi sống chung bằng kính hiển vi ánh sáng với các lam kính nhuộm H&E cho thấy rõ ràng EHP trong biểu mô ống gan tụy (Hình 8, D và E). Các phần liền kề được nhuộm để phân tích ISH cho tín hiệu dương tính đối với EHP trong tế bào chất của biểu mô gan tụy có chứa các giai đoạn phát triển tế bào vi mô (Hình 8, B). Các kết quả này không chỉ xác nhận sự hiện diện của EHP, mà còn được sử dụng như một đối chứng dương đối với EHP ISH-probe, tính đặc hiệu của nó được xác nhận khi không có bất kỳ tín hiệu ISH nào trong phần mô đối chứng âm tính liền kề được thăm dò bằng WSSV-DNA thăm dò (tức là các tín hiệu ISH dương tính trong các mô của tôm và vẹm không thể phát sinh từ liên kết không đặc hiệu của DNA).
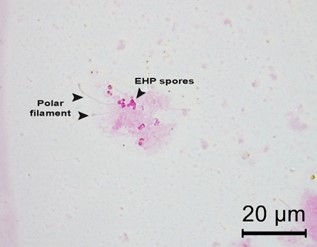
Hình 7. Hình ảnh chụp ảnh phân tích soi tươi của tuyến tiêu hóa cho thấy sự hiện diện của các bào tử EHP hình bầu dục và các vòi phân cực của chúng bằng cách nhuộm phloxine B (độ phóng đại 100x).
Hình 8. Ảnh chụp gan tụy của tôm P. vannamei bị nhiễm EHP được nhuộm H&E và ISH. Các phần lân cận của mô tôm được nhuộm bằng H&E (A), với đầu dò EHP-SSU và đầu dò WSSV (B và C). Sự lây nhiễm trên diện rộng được phát hiện bằng ISH (nhuộm màu nâu sẫm đến đen, B). Độ phóng đại cao hơn (100X) của tế bào gan tụy của tôm nhiễm EHP rõ ràng cho thấy cấu trúc của bào tử EHP (mũi tên, D) và plasmodium (mũi tên, E).
4/ Thảo luận
Vẹm Mytilopsis leucophaeata, là loài ăn lọc huyền phù trong lớp nhuyễn thể. Mặc dù chưa có báo cáo xác nhận nào về việc EHP ký sinh trên vẹm, nhưng đã có báo cáo về một số mẫu dương tính với EHP bằng cách kiểm tra PCR. Hai thử nghiệm sống chung được tiến hành để nghiên cứu xem M. leucophaeata có thể hoạt động như một cá thể mang EHP trong ao nuôi tôm hay không, và nếu có, EHP có thể nhân lên trong vật chủ đó hay không. Kết quả chỉ ra rằng M. leucophaeata có thể mang bào tử truyền nhiễm EHP sau khi được nuôi chung với tôm nhiễm EHP trong 7 ngày và những bào tử mà chúng mang theo này có thể lây nhiễm cho tôm. Điều này đã được xác nhận bằng cách quan sát các bào tử EHP hoạt động trong tuyến tiêu hóa của vẹm và không bị loại trừ thông qua phân. Do đó, chúng có thể là một phần của khẩu phần ăn của vẹm và có thể khiến vẹm bị nhiễm EHP nếu chúng dễ bị nhiễm bệnh. Thật vậy, nhiễm vi bào tử trùng đã được mô tả trong các cơ quan tiêu hóa của các loài hai mảnh vỏ khác như sò (Aequipecten opercularis) (Lohrmann và cộng sự 2000). Tuy nhiên, chúng tôi không tìm thấy bất kỳ dấu hiệu nào của sự nhiễm vi bào tử trùng trong tuyến tiêu hóa của vẹm dương tính với EHP bằng kính hiển vi điện tử hoặc ánh sáng. Sự hiện diện của các bào tử này có thể cho kết quả dương tính với EHP qua SWP-PCR mà chúng tôi thu được từ mô vẹm. Đồng thời, giả sử rằng các bào tử EHP được chọn làm một phần trong chế độ ăn của vẹm, có thể các phản ứng ISH dương tính mà chúng ta thấy trong các tế bào biểu mô tuyến tiêu hóa phát sinh từ DNA bị phân hủy không hoàn toàn của các bào tử EHP ăn vào.
Tuyến tiêu hoá của cá hai mảnh vỏ chứa 2 loại tế bào là tế bào ưa bazơ và tế bào tiêu hoá. Các tế bào ưa bazơ chủ yếu có chức năng sản xuất và tiết ra các enzym (Dimitriadis và cộng sự, 2004) có thể bao gồm chitinase vì chúng đã được báo cáo từ loài vẹm thuộc chi Dreissena, một chi Mytilopsis trong họ Dreissenidae (McCartney và cộng sự, 2019 bản in trước). Các tế bào tiêu hóa được biết là đóng một vai trò quan trọng trong việc hấp thụ các chất dinh dưỡng đã tiêu hóa hoặc tiêu hóa một phần, trong quá trình tiêu hóa nội bào và chống oxy hóa (Faggio và cộng sự, 2016). Do đó, có thể các tín hiệu ISH khuếch tán mà chúng ta thấy trong tuyến tiêu hóa phát sinh từ EHP-DNA đã được tiêu hóa một phần bởi các tế bào tiêu hóa hấp thụ nhưng vẫn còn đủ nguyên vẹn để lai với đầu dò gen SSU rRNA.
Những cá thể được dự đoán có thể mang EHP đã cho kết quả dương tính với EHP bằng PCR bao gồm polychaetes. Thitamadee và cộng sự (2016) đã báo cáo polychaetes sống thu được từ các nguồn địa phương và nhập khẩu từ Thái Lan cho kết quả dương tính với EHP thông qua PCR. Kết quả tương tự được báo cáo bởi Desrina và cộng sự (2020) về tỷ lệ lưu hành thấp của EHP được tìm thấy trong polychaetes bằng PCR thu thập từ các ao nuôi tôm ở Bờ biển phía Bắc của Đảo Java, Indonesia. Tình trạng mang mầm bệnh của polychaetes cần được nghiên cứu giống như nghiên cứu ở vẹm M. leucophaeata.
Kết Luận
Kết quả trong nghiên cứu này cho thấy M. leucophaeata có thể “tích lũy” các bào tử EHP được thải ra từ tôm nhiễm EHP nhưng chúng không bị nhiễm và do đó không thể gia tăng EHP. Trong trường hợp đó, vẹm có thể là cá thể mang EHP nhưng không có triệu chứng và có thể truyền EHP cho tôm trong ao. Các nhà nghiên cứu khuyến cáo nên loại bỏ hoặc triệt tiêu vẹm sống một cách cẩn thận trong quá trình cải tạo ao trước khi thả giống, đặc biệt là sau vụ nuôi trước có tôm bị nhiễm EHP. Sự lây truyền từ vẹm trong ao tôm nhiễm EHP sang ao tôm chưa nhiễm EHP, trong đó, vẹm có thể đóng vai trò là cá thể mang mầm bệnh nhưng không có triệu chứng, truyền bào tử nhiễm bệnh sang những con tôm chưa nhiễm bệnh. Tương tự, vẹm sẽ trở thành nguồn thức ăn sống đầy rủi ro cho tôm bố mẹ không có EHP trong trại sản xuất tôm giống nếu không được khử trùng, đông lạnh hoặc tiệt trùng như khuyến cáo trước đây. Mặt khác, vì vẹm “ăn phải” các bào tử EHP (tiêu thụ như thức ăn), nên việc kiểm tra tính hữu dụng của chúng trong việc loại bỏ bào tử EHP khỏi nước bị ô nhiễm là rất cần thiết. Nếu có hiệu quả, vẹm có thể đóng vai trò là bộ lọc sinh học tích cực để loại bỏ bào tử EHP. Vẹm âm tính với EHP cũng có thể đóng vai trò như những vật chủ an toàn khi có sự hiện diện của bào tử EHP trong nước ao hoặc các hồ chứa nước cấp.
Theo Natthinee Munkongwongsiri, Orawan Thepmanee, Kanokwan Lertsiri, Rapeepun Vanichviriyakit, Ornchuma Itsathitphaisarn, Kallaya Sritunyalucksana
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
Từ khóa: Enterocytozoon hepatopenaei (EHP), Penaeus vannamei, Mytilopsis leucophaeata, Vẹm, Nguồn bệnh, Ao nuôi tôm
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Các Nhà Nghiên Cứu Đã Thiết Kế Một Máy Sục Khí Trong Ao Nuôi Tôm Chạy Bằng Năng Lượng Mặt Trời
- Axit linolenic cải thiện năng suất tăng trưởng và tình trạng miễn dịch của tôm thẻ Penaeus vannamei bị nhiễm Enterocytozoon hepatopenaei (EHP)
- Hệ Thống Cho Ăn Bằng Âm Thanh Giúp Cải Thiện Năng Suất Ở Các Trang Trại Nuôi Tôm

 English
English 中文 (中国)
中文 (中国)