Tóm tắt
Nghiên cứu thành phần vi mô của biofloc trong hệ thống nuôi tôm giống khép kín được thực hiện nhằm xác định sự tương tác giữa các khối kết tụ trong quá trình xử lý sinh học đối với quá trình phân hủy và phân hủy chất hữu cơ nạp vào bể nuôi tôm. Nghiên cứu được thực hiện trong hệ thống khép kín không thay nước trong 105 ngày để xác định thành phần vi sinh vật trong biofloc bằng kính hiển vi Advanced Nikon 80i và phân tích nguồn gốc chất hữu cơ nạp vào bể nuôi. Từ nghiên cứu này đã xác định được nhiều loài thực vật phù du, động vật phù du, động vật nguyên sinh, tuyến trùng và tảo trong biofloc. Các sinh vật này cộng sinh với nhau, cung cấp thức ăn, hỗ trợ tiêu thụ tảo, ổn định nước và phân hủy chất hữu cơ. Vi khuẩn dị dưỡng được xác định từ họ Pseudomonas và Aeromonas phân hủy chất hữu cơ thành thức ăn protein cho tôm. Nhìn chung, Biofloc đóng vai trò là tác nhân xử lý sinh học tự nhiên trong hệ thống nuôi không thay nước, đảm bảo chất lượng nước tối ưu cho tôm trong suốt thời gian nuôi.
Giới thiệu
Xử lý sinh học là phương pháp sử dụng vi sinh vật để phân hủy các chất ô nhiễm thành các chất ít độc hại hoặc không độc hại. Vi sinh vật được kích thích bằng chất dinh dưỡng và hóa chất để tăng cường khả năng phân hủy của chúng. Ưu điểm của xử lý sinh học là vi sinh vật có thể phân hủy các chất độc hại thành các chất an toàn hơn. Vi sinh vật có thể phân hủy nhiều loại chất ô nhiễm, cả tự nhiên và tổng hợp. Vi sinh vật có thể tích lũy các hợp chất độc hại, giúp loại bỏ chúng khỏi môi trường. Theo Das và cộng sự. (2006), vi sinh vật giúp điều hòa các chu trình sinh địa hóa trong môi trường. Vi sinh vật góp phần kiểm soát lượng khí thải nhà kính và các chất ô nhiễm khác. Bất kỳ vi sinh vật nào được sử dụng làm phương pháp xử lý sinh học đều phải có kiểu gen kháng chất gây ô nhiễm cụ thể và do đó, vi sinh vật có những đặc tính độc đáo nhất định khiến chúng phù hợp với các quá trình xử lý sinh học (Stelting và cộng sự, 2010).
Công nghệ biofloc (BFT) là một phương pháp nuôi trồng thủy sản tiên tiến sử dụng các vi sinh vật để chuyển đổi chất thải thành thức ăn tự nhiên cho tôm. Hệ thống Biofloc bao gồm các vi sinh vật như vi khuẩn dị dưỡng, tảo (tảo hai roi và tảo cát), nấm, động vật nguyên sinh, luân trùng, tuyến trùng, động vật đa bào và các mảnh vụn kết tụ lại với nhau. Cộng sinh giữa các vi sinh vật này giúp duy trì chất lượng nước, đảm bảo an ninh sinh học, hỗ trợ nuôi tôm mật độ cao và giảm nhu cầu thay nước trong hệ thống nuôi trồng thủy sản. Vi khuẩn dị dưỡng trong Biofloc chuyển đổi chất thải nitơ từ thức ăn thừa thành protein, cung cấp nguồn thức ăn tự nhiên cho tôm. Cộng đồng vi khuẩn dị dưỡng dày đặc thay thế tảo, giúp xử lý sinh học tại chỗ, loại bỏ chất thải trong hệ thống nuôi. Bổ sung nguồn carbohydrate giá rẻ như mật đường hoặc bột sắn (C:N 12–15:1) giúp Biofloc chuyển hóa chất dinh dưỡng độc hại thành thức ăn cho tôm. Việc xác định thành phần biofloc ở cấp độ vi mô có thể giúp hiểu rõ hơn về ứng dụng của biofloc. Nghiên cứu về biofloc xác định thành phần vi sinh vật trong Biofloc giúp hiểu rõ hơn về hoạt động và ứng dụng của nó. Nghiên cứu hiệu quả của Biofloc trong việc xử lý sinh học, loại bỏ chất hữu cơ trong hệ thống nuôi không thay nước.
Chuẩn bị nghiên cứu
Thiết kế thử nghiệm
Bể tròn 8 tấn (cao = 1,2 m, đường kính = 3,3 m) được thả tôm thẻ chân trắng Penaeus vannamei giai đoạn PL10 với mật độ 100 PL/m3. 6 bể được sử dụng trong thí nghiệm để xử lý (T1, T2 và T3 và các bể đối chứng C1, C2 và C3). Mật đường là nguồn carbohydrate hoặc carbon theo tỷ lệ C:N 10:1 được chuyển sang bể nuôi xử lý sau khi được lên men trong 24 giờ để thúc đẩy quá trình phân hủy của vi khuẩn hoặc vi sinh vật trong công thức biofloc. Tôm được nuôi trong 105 ngày cho đến khi đạt cỡ thu hoạch ở PL115. Trong thời gian nuôi, vi sinh vật trong bể nuôi được lấy mẫu hàng tuần để xác định thành phần vi sinh vật trong quá trình kết tụ biofloc trong hệ thống khép kín và không thay nước. Tất cả các thông số nước được kiểm tra hàng tuần về độ pH, độ mặn, DO, TDS và nhiệt độ bằng cách sử dụng đầu dò đa năng YSI YSI 556 và các chất dinh dưỡng (amoniac, nitrit, nitrat) được phân tích bằng máy quang phổ bằng phương pháp amoniac-salicylate (Phương pháp tiêu chuẩn 8155), diazot hóa nitrit (Phương pháp tiêu chuẩn 8507) và phương pháp khử nitrat-cadmium (Phương pháp tiêu chuẩn 8192) của (Sổ tay quy trình DR/2400 2002).
Bộ sưu tập mẫu
3 L mẫu nước từ bể xử lý được lọc bằng lưới sinh vật phù du 20 lm để xác định vi sinh vật phù du. Để xác định vi khuẩn, nước mẫu được hút ra bằng micropipette và pha loãng liên tục cho đến 10-5 để phân tích vi khuẩn. Mẫu phân tích sinh vật phù du được để 24 giờ cho cơ chất lắng xuống đáy và cô đặc thành 10 ml mẫu nước và sau đó được bảo quản bằng formalin 10%. Tất cả các mẫu nước được đưa về phòng thí nghiệm để phân tích thêm.
Xác định vi sinh vật
Phân lập vi khuẩn bằng cách sử dụng thạch TSA và TCBS để phân lập Vibrio sp., sau đó pha loãng mẫu đến 10–5 và đếm số khuẩn lạc (CFU). Nhuộm gram cũng được thực hiện để xác định vi khuẩn gram dương và âm tính. Bộ API (Biomerieux) API20E và API 20NE được sử dụng để xác định vi khuẩn gram âm. Hộp ủ, khay và nắp đã được chuẩn bị sẵn sàng cho việc chuẩn bị phết. Pha loãng vi khuẩn trong dung dịch NaCl 0,85% đến độ đục 0,5 McFarland. Đối với quá trình cấy dải API 20NE, quá trình khử nitrat thử nghiệm (NO3) và quá trình thủy phân p-nitrophenyl-b-D-galactopyranoside (PNPG) được cấy bằng cách phân phối huyền phù nước muối vào các ống bằng pipet Pasteur. Môi trường API Aux đã được thêm vào khoảng 200 ll huyền phù còn lại trong ống và được đồng nhất hóa tốt. Các ống và cốc thử nghiệm lên men glucose (GLU) và thử nghiệm đồng hóa Phenyl-axetat (PAC) được đổ huyền phù. Dầu khoáng được thêm vào các cốc của 3 thử nghiệm (GLU), thủy phân arginine (ADH) và thủy phân urê (URE) cho đến khi hình thành sụn lồi. Hộp ủ được đóng kín và ủ ở 29 ± 2℃ trong 24 giờ. Sau thời gian ủ, các dải được đọc bằng cách tham khảo bảng đọc. Các phản ứng đối với (GLU, ADH, URE, thử nghiệm thủy phân aesculin (ESC)), thủy phân gelatine (GEL) và (PNPG) đã được ghi lại trên phiếu kết quả. Đối với thử nghiệm NO3, 1 giọt thuốc thử NIT 1 và 1 giọt thuốc thử NIT 2 được thêm vào cốc NO3. Đối với thử nghiệm tryptophan deaminase (TRP), 1 giọt thuốc thử JAMES được thêm vào và phản ứng ngay lập tức diễn ra. Thuốc thử NIT 1, NIT 2 và JAMES được loại bỏ bằng pipet và mẫu NO3 và TRP được phủ bằng dầu khoáng. Kit được ủ lại ở 29 ± 2℃ trong 24 giờ và tất cả các xét nghiệm được đọc lại ngoại trừ NO3, TRP và GLU được gạch chân, chỉ được đọc một lần sau 24 giờ. Nhận dạng có được với hồ sơ số. Cơ sở dữ liệu (V6.0) trong chỉ mục web API đã được sử dụng bằng cách nhập hồ sơ số gồm bảy chữ số vào phần mềm nhận dạng để nhận dạng loài.
Đối với quá trình cấy dải API20E, huyền phù vi khuẩn được phân phối vào các ống hút để thử nghiệm đồng hóa citrate (CIT), thử nghiệm Voges–Proskauer (VP) để phát hiện acetyl methyl carbinol, thử nghiệm thủy phân gelatine (GEL) bằng cách đổ đầy vào cả ống và cốc nhỏ để thử nghiệm ADH, thử nghiệm lysine decarboxylase (LDC), thử nghiệm Ornithine decarboxylase (ODC) và sản xuất thử nghiệm hydro sulfua (H2S) và thủy phân urê (URE) chứa đầy dầu khoáng trong các hạt nhỏ. Hộp ủ được đóng kín và ủ ở 36 ± 2℃ trong 18–24 giờ. Dải được đọc bằng cách tham khảo bảng đọc sau thời gian ủ bệnh. Đối với thử nghiệm Tryptophan deaminase (TDA), 1 giọt thuốc thử TDA đã được thêm vào, đối với thử nghiệm sản xuất Indole (IND), 1 giọt thuốc thử JAMES đã được thêm vào và đối với thử nghiệm VP, thuốc thử VP 1 và VP 2 đã được thêm vào. Nhận dạng được lấy bằng hồ sơ số chín chữ số bằng cách sử dụng cơ sở dữ liệu (v4.1) trong chỉ mục web API để nhận dạng loài.
Xác định sinh vật phù du bằng kính hiển vi
Kính hiển vi tiên tiến Nikon 80i được sử dụng để nhận dạng vi sinh vật biofloc và đo chiều dài và kích thước sinh vật phù du. Các phân tích định tính và định lượng thực vật phù du và động vật phù du được thực hiện bằng phương pháp Lackey. Kính hiển vi phức hợp được sử dụng để đếm thực vật phù du. Phiến phủ được đặt trên một giọt nước trong phiến kính và toàn bộ phiến kính được kiểm tra bằng các dải chồng lên nhau song song để đếm tất cả các sinh vật trong giọt nước. Mỗi giọt được kiểm tra khoảng 22 dải. Số lượng mẫu phụ được lấy phụ thuộc vào việc kiểm tra 2–3 mẫu phụ liên tiếp mà không bổ sung loài bắt gặp khi so sánh với các mẫu phụ được kiểm tra trong cùng một mẫu (Hiệp hội Y tế Công cộng Hoa Kỳ APHA 1989).
Công thức tính toán:
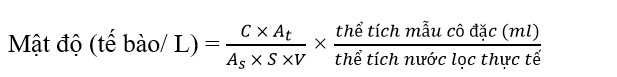
trong đó C: Số lượng vi sinh vật đếm được, At: Diện tích của tấm đậy (22 mm922 mm), S: Số lượng dải được đếm, As: Diện tích của dải (22 mm x 91 mm), V: Thể tích mẫu dưới tấm che.
Kết quả
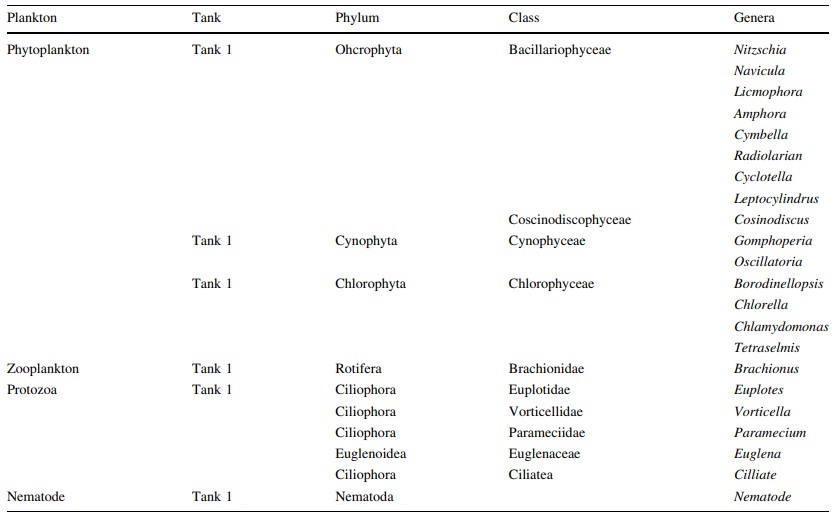
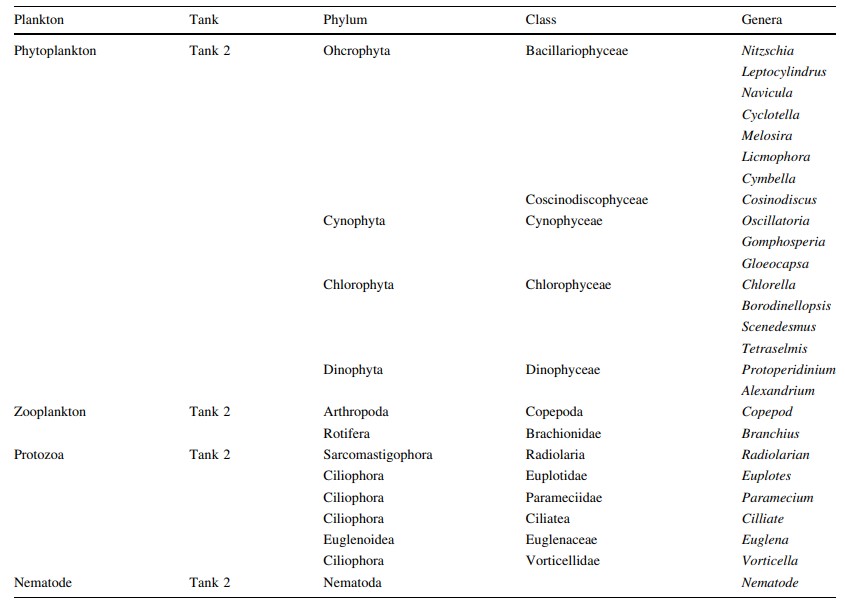
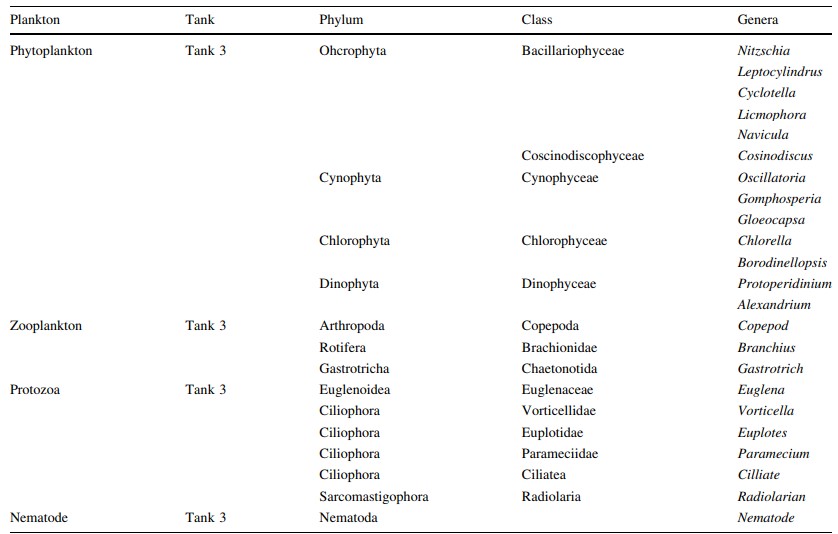
Có nhiều loại vi sinh vật được xác định từ quá trình kết tụ sinh học, bao gồm: các loại tảo thực vật phù du, tảo ăn cỏ (luân trùng, tuyến trùng) cũng như động vật nguyên sinh (Vorticella sp.) (Hình 1), vi khuẩn Gram dương hình que (Bacillus sp.), vi khuẩn dị dưỡng (Aeromonas hydrophila, Pseudomonas aeruginosa) và cả vi khuẩn kỵ khí (Vibrio sp., ví dụ V. fluvialis). Đối với các kết quả thông số nước, lượng oxy hòa tan trung bình, DO, là 6,67 ± 0,97 mg/l (5,9–9,53 mg/l; n = 12), nhiệt độ trung bình 28 ± 0,30℃ (26–28℃; n = 12), pH trung bình 7,36 ± 0,49 (6,1–8,2; n = 12), độ mặn trung bình 33,66 ± 1,45 ppt (31–36 ppt; n = 12) và tổng chất rắn hòa tan trung bình, TDS 33,52 ± 1,33 (31,5–35,5 mg/l; n = 12). Quá trình xử lý sinh học hiệu quả khi NH3 giảm từ 8,0 xuống 0,3 mg/l, nitrit giảm từ 0,8 xuống 0,5 và nitrat giảm từ 15,3 xuống 5,7 mg/L trong suốt quá trình xử lý (Hình 2). Loài Pseudomonas sp. và Aeromonas sp. được xác định là chiếm ưu thế khi đếm đơn vị hình thành khuẩn lạc (CFU). Vibrio sp. cũng được xác định là tập hợp trong quá trình kết tụ sinh học (Bảng 1). Tỷ lệ vi khuẩn được xác định chủ yếu đến từ các loài vi khuẩn dị dưỡng (ví dụ Aeromonas hydrophyila) và cả Vibrio spp. (V. alginolyticus và V. fluvialis) (Hình 3). Có rất nhiều loại thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học ở bể xử lý 1 (Bảng 2), bể xử lý 2 (Bảng 3) và bể xử lý 3 (Bảng 4). Mật độ vi sinh vật còn được xác định dựa vào Ngày nuôi (DOC) của tôm, mật độ vi sinh vật ở tôm DOC11 (Hình 4), DOC17 (Hình 5), DOC30 (Hình 6), DOC58 (Hình 7), DOC65 (Hình 8), DOC76 (Hình 9) và đối với DOC93 (Hình 10).

Hình 1 Các vi sinh vật cực nhỏ được xác định trong khối: a rotifer; b euplotes, động vật nguyên sinh có lông; c Alexandrium sp. của dinoflagellate; d tảo cát chaetoceros; e vorticella động vật nguyên sinh và tuyến trùng. Tất cả được quan sát dưới độ phóng đại x400
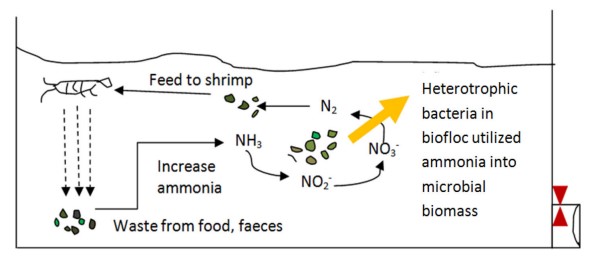
Hình 2 Quá trình xử lý sinh học được thực hiện thành công nhờ các vi sinh vật trong biofloc (vi khuẩn, tảo, sinh vật phù du) để phân hủy các chất dinh dưỡng độc hại trong bể nuôi xử lý thành các chất không độc hại và có thể được tiêu thụ trở lại làm thức ăn bổ sung protein cho tôm tự tiêu thụ
Bảng 1 Các loài vi khuẩn gram âm được xác định bằng bộ API 20E và 20NE bioerieux
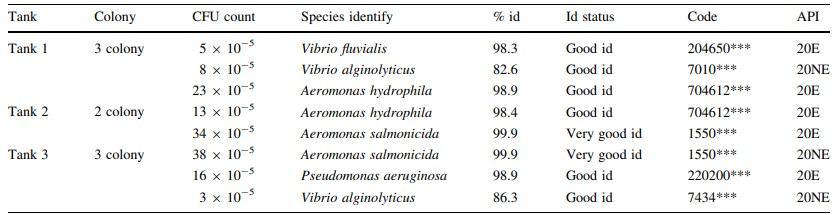
*** Mã hóa hồ sơ của chỉ số hồ sơ phân tích
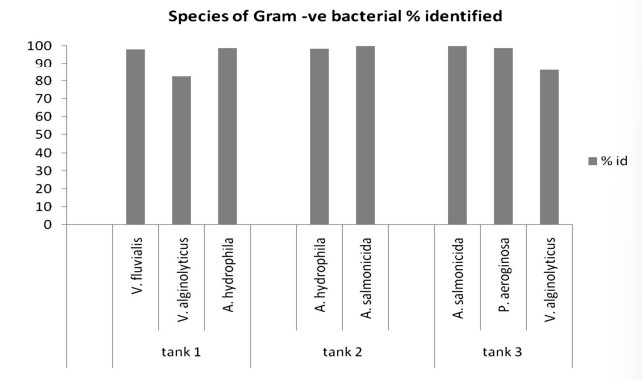
Hình 3 Tỷ lệ các loài vi khuẩn được xác định tích lũy cùng nhau trong biofloc ở bể 1 (T1), bể 2 (T2) và bể 3 (T3)
Bảng 2 Loại vi sinh vật được xác định là tập hợp trong biofloc ở Bể 1
Bảng 3 Loại vi sinh vật được xác định là tập hợp trong biofloc ở Bể 2
Bảng 4 Loại vi sinh vật được xác định là tập hợp trong biofloc ở Bể 3
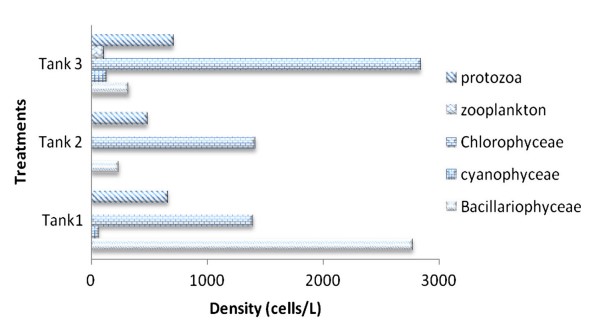
Hình 4 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi xử lý cho Ngày nuôi cấy, DOC11
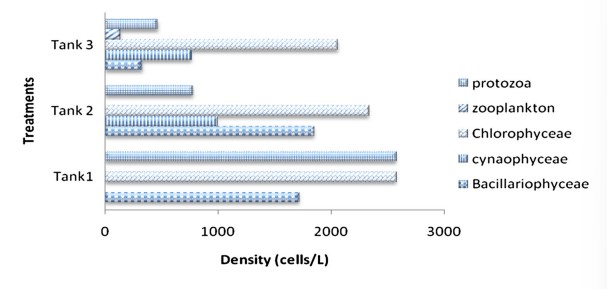
Hình 5 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi xử lý cho Ngày nuôi cấy, DOC17
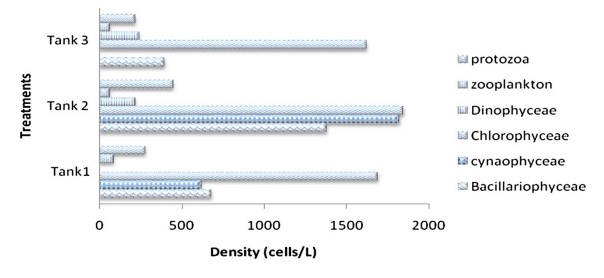
Hình 6 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi cấy xử lý cho Ngày nuôi cấy, DOC30
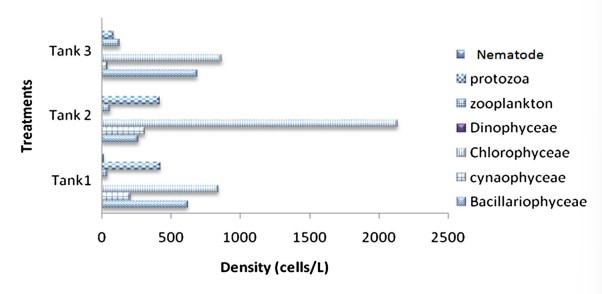
Hình 7 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi cấy xử lý cho Ngày nuôi cấy, DOC58
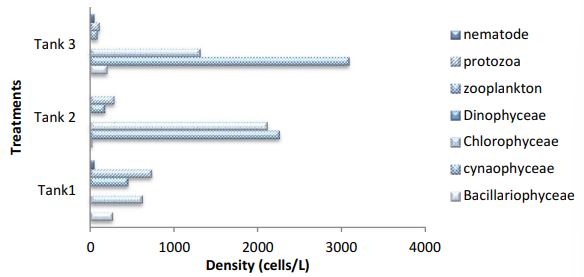
Hình 8 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi cấy xử lý cho Ngày nuôi cấy, DOC65
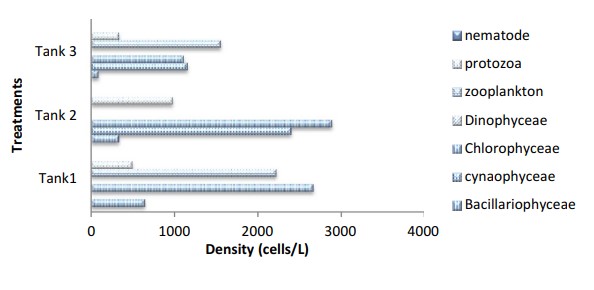
Hình 9 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi cấy xử lý cho Ngày nuôi cấy, DOC76
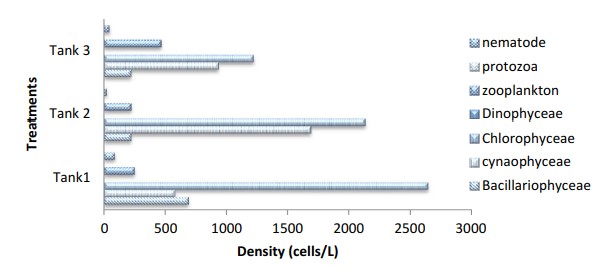
Hình 10 Mật độ thành phần vi sinh vật được xác định từ quá trình keo tụ sinh học trong cột nước của bể nuôi cấy xử lý cho Ngày nuôi cấy, DOC93
Thảo luận
Từ việc nhận dạng được thực hiện trên các tập hợp biofloc, các vi sinh vật có thể được chia thành năm nhóm chồng chéo nhau đó là: sinh vật hình thành floc, sinh vật hoại sinh (sinh vật lấy chất dinh dưỡng từ chất hữu cơ chết), vi khuẩn nitrat hóa, sinh vật ăn tảo và vi khuẩn gây bệnh (Vibrio spp). Các sinh vật hình thành floc gồm một số sinh khối tảo và vi khuẩn tiết ra EPS dính giúp tạo cấu trúc, diện tích bề mặt, keo tụ, lắng đọng và hấp thụ cho biofloc và có khả năng kết dính các mảnh vụn từ chất thải, hấp thụ amoniac và chuyển đổi thành protein vi sinh vật. Sinh vật hoại sinh (vi khuẩn dị dưỡng) sử dụng hợp chất hữu cơ từ chất hữu cơ còn sót lại trong bể làm nguồn năng lượng và thức ăn, bao gồm Aeromonas spp và Pseudomonas spp. tham gia vào quá trình xử lý sinh học, trung hòa các chất dinh dưỡng (amoniac, nitrit và nitrat) từ chất thải. Vi khuẩn khử nitrat (Pseudomonas sp) chuyển đổi nitrat NO3– thành nitơ khí N2; làm cho môi trường nước ít độc hại hơn và chuyển đổi nitrat trong nước thành protein có lợi cho tôm. Sinh vật ăn tảo bao gồm động vật phù du, động vật nguyên sinh và ký sinh trùng động vật nguyên sinh. Ví dụ: tuyến trùng, gastrotrich, euplotes động vật nguyên sinh, động vật nguyên sinh vorticella, ciliate, luân trùng và giáp xác chân chèo. Các sinh vật được xếp vào nhóm gây bệnh được xác định là động vật nguyên sinh gây hại cho tôm và vi khuẩn gây bệnh Vibrio sp. chẳng hạn như Vibrio alginolyticus bị kiểm soát bởi chính biofloc thông qua sự đa dạng cao hơn của thực vật phù du và tảo, cũng như sự cạnh tranh từ các vi khuẩn khác. Việc cạnh tranh với các vi khuẩn dị dưỡng và vi khuẩn nitrat hóa chiếm ưu thế về các chất dinh dưỡng thiết yếu như nitơ cũng sẽ hạn chế Vibrio sp. nhóm khỏi sự tăng trưởng không kiểm soát được (Emerenciano và cộng sự, 2013).
Kết luận
Công nghệ keo tụ sinh học là công nghệ đầy triển vọng hướng tới môi trường nuôi trồng thủy sản thân thiện. Trên thực tế, nó có thể cung cấp thêm khẩu phần ăn cho tôm từ chất kết tụ sinh học của nhiều loại vi sinh vật được xác định trong khối; biofloc cũng được công nhận là có hiệu quả và thành công như một tác nhân xử lý sinh học và phân hủy sinh học để duy trì chất lượng nước trong hệ thống nuôi trồng thủy sản khép kín mà không cần thay nước.
Theo Hidayah Manan, Julia Hwei Zhong Moh, Nor Azman Kasan, Suhaimi Suratman, Mhd Ikhwanuddin
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Nuôi Ghép Tôm Biển Và Tôm Càng Xanh Ở Tỉnh Chachoengsao
- Mối Tương Quan Giữa Các Đặc Tính Khoáng Chất Chính Trong Môi Trường Ao Nước Lợ Và Tôm Thẻ Chân Trắng Litopenaues vannamei: Tỷ Lệ Sống, Tăng Trưởng Và Sản Xuất
- Công Nghệ Mới Biofloc Và Bệnh Tôm Trong Nuôi Trồng Thủy Sản Siêu Thâm Canh

 English
English