Tóm tắt
Phương pháp nuôi tôm sú truyền thống là một phương pháp phổ biến ở Sundarbans Ấn Độ và được thực hiện mà không có sự hỗ trợ khoa học thích hợp, quản lý chất lượng nước và thức ăn thích hợp. Người nuôi tôm sử dụng thức ăn truyền thống có nguồn gốc động vật thường gây ô nhiễm chất lượng nước và bùng phát dịch bệnh ở các loài nuôi. Bài báo này nhấn mạnh tác động của việc thay thế toàn bộ các thành phần động vật trong thức ăn tôm bằng các thành phần có nguồn gốc thực vật đối với chất lượng nước và sức khỏe tôm. Tăng trọng, chỉ số thể trạng, hệ số chuyển đổi thức ăn (FCR), tỷ lệ sống, sắc tố cơ thể (mức astaxanthin) được phân tích ở tôm cùng với chất lượng nước ao. Các giá trị về chỉ số tình trạng (CI), tỷ lệ sống và tăng trọng tôm cao hơn được quan sát thấy ở ao thí nghiệm (E) so với ao đối chứng (C). Giá trị FCR thấp được quan sát thấy ở ao thí nghiệm so với ao đối chứng. Giá trị Astaxanthin trong tôm ở ao thí nghiệm cũng cao hơn ao đối chứng, điều này cho thấy Catenella repens là nguồn cung cấp carotenoid trong mô tôm. Phân tích chi phí-lợi nhuận cũng chứng minh năng suất và lợi nhuận tốt hơn trong trường hợp ao nuôi thử nghiệm, cho thấy tính bền vững của hoạt động kinh doanh hiện tại.
Giới thiệu
Ấn Độ có đường bờ biển dài 8085 km và hoạt động chính là nuôi trồng thủy sản. Tôm sú Penaeus monodon được nuôi ở các hệ thống nước lợ của nước này, chủ yếu nhằm tăng sản lượng cá phục vụ nhu cầu tiêu dùng của con người. Các lợi ích khác của nó bao gồm tạo việc làm, an ninh lương thực và cải thiện sinh kế chung của người dân ở các hòn đảo xa xôi và khu phức hợp đồng bằng như Sundarbans của Ấn Độ (nằm ở đỉnh Vịnh Bengal). Để tận dụng tiềm năng tối đa trong việc góp phần phát triển con người và trao quyền cho xã hội, nuôi Penaeus monodon đòi hỏi những cách tiếp cận mới mang tính thực tế và có thể đạt được trong bối cảnh hoàn cảnh môi trường hiện tại (Tacon và De Silva, 1997). Trong thập kỷ qua, nghề nuôi tôm P. monodon ở Sundarbans Ấn Độ đã có sự tăng trưởng vượt bậc khi phương pháp nuôi tôm bán thâm canh đạt đến đỉnh cao. Tuy nhiên, hình thức nuôi này dẫn đến suy giảm chất lượng nước và tạo ra tác động tiêu cực đến sức khỏe của người dân ven biển cũng như hệ sinh thái rừng ngập mặn (Mitra và Bhattacharya, 2003). Do đó, Tòa án Tối cao Ấn Độ đã cấm phương pháp nuôi tôm bán thâm canh vào tháng 12 năm 1996 (Sen, 1998). Ở Sundarbans của Ấn Độ, phương pháp nuôi tôm truyền thống đã được sửa đổi hiện nay để nuôi các loài nuôi bằng thức ăn truyền thống.
Thức ăn cho tôm là yếu tố quan trọng làm tăng năng suất và lợi nhuận của ngành nuôi trồng thủy sản (Jamu và Ayinla, 2003). Từ góc độ kinh tế, chi phí thức ăn và quản lý thức ăn chiếm ít nhất 60% chi phí sản xuất và dường như là một trong những hạn chế chính cản trở việc mở rộng nuôi trồng thủy sản (Kaushik, 1990). Thức ăn cho cá là nguồn cung cấp chất dinh dưỡng lớn nhất trong sản xuất nuôi trồng thủy sản, đòi hỏi sự hiểu biết rõ ràng về tác động đối với môi trường xung quanh để nuôi trồng thủy sản bền vững. Điều này sẽ giúp giảm tác động tiêu cực và cải thiện khả năng dự đoán các tác động môi trường. Kiến thức và hiểu biết hiện tại về tác động môi trường của thức ăn nuôi tôm của các nhà nuôi trồng thủy sản và các nhà dinh dưỡng còn rất thấp và cần được sàng lọc thêm. Hiện nay, chú trọng vào việc xây dựng công thức thức ăn cho tôm có độ ngon miệng tốt sẽ thúc đẩy tăng trưởng nhanh trong một khoảng thời gian giới hạn mà không xem xét đến các tác động đối với môi trường. Thức ăn chứa thành phần động vật tạo ra chất thải có tính chất phức tạp trong hệ thống nuôi. Các chất gây ô nhiễm phổ biến ở các trang trại nuôi tôm là các chất phốt pho và nitơ, cũng như các chất hữu cơ được thải ra môi trường xung quanh thông qua phân và thức ăn dư thừa (Mitra và Choudhury, 1995). Vi tảo và tảo lớn đã được sử dụng trong nhiều năm trong thức ăn chăn nuôi trên cạn để thay thế các nguyên liệu động vật (Hansen và cộng sự, 2003; Leupp và cộng sự, 2005) như một nguồn sắc tố (Strand và cộng sự, 1998) để tăng khả năng kháng bệnh (Turner và cộng sự, 2002), để tăng sản lượng trứng (Bratova và Ganovski, 1982) v.v. Ở động vật thủy sinh, rong biển đã được sử dụng làm chất bổ sung vào khẩu phần ăn cho cá vược (Valente và cộng sự, 2006), cá lóc (Hashim và Mat- Saat, 1992) và tôm (Moss, 1994; Penaflorida và Golez, 1996; Cruz-Suarez và cộng sự, 2000). Trong một số trường hợp, việc đưa tảo vào công thức thức ăn đã giúp cải thiện hiệu suất, bao gồm cải thiện hiệu quả sử dụng thức ăn, chất lượng viên và chất lượng sản phẩm động vật. Hầu hết các nghiên cứu dinh dưỡng với rong biển đã điều tra tỷ lệ đưa vào khẩu phần ăn thấp (dưới 80 g/kg) để xác định tính hữu ích như là chất bổ sung chức năng (tác dụng kết dính), dinh dưỡng và nutraceutic (tác dụng bảo vệ sức khỏe) (Cruz-Suarez và cộng sự, 2009). Mức độ lưu trữ tối ưu khác nhau tùy thuộc vào loại tảo hoặc loài tiêu dùng (Penaflorida và Golez, 1996; Cruz-Suarez và cộng sự, 2000; Suarez-Garcia, 2006). Rất nhiều nghiên cứu đã chứng minh đặc tính chống oxy hóa của carotenoid ở tảo và vai trò của chúng trong việc ngăn ngừa nhiều bệnh lý liên quan đến stress oxy hóa (Okuzami và cộng sự, 1993; Yan và cộng sự, 1999). Các carotenoid chính trong rong biển đỏ là β-carotene và α-carotene và các dẫn xuất dihydroxyl hóa của chúng như zeaxanthin và lutein.
Bài viết này là nỗ lực nghiên cứu ảnh hưởng của thức ăn công thức dựa trên rong biển đến chất lượng nước, sản lượng tôm, tỷ lệ sống và FCR trong một đơn vị nuôi tôm ở Sundarbans miền trung Ấn Độ. Khu phức hợp đồng bằng ngập mặn chiếm ưu thế này nằm ở đỉnh Vịnh Bengal và đã được UNESCO công nhận là Di sản Thế giới (1987) do tính đa dạng phân loại phong phú. Khu phức hợp đồng bằng là nơi sinh sống của 14 loài rong biển (Mukhopadhyay và Pal, 2002) nhưng cho đến nay chúng vẫn chưa được khai thác ứng dụng thương mại (Mitra và Banerjee, 2005). Đây là nỗ lực đầu tiên trong việc sử dụng Catenella repens làm nguyên liệu trong thức ăn cho tôm. Mục tiêu chính của nghiên cứu này là chứng minh hiệu quả của thức ăn thu được bằng cách đưa rong biển vào thức ăn công thức đối với hiệu suất tăng trưởng và sắc tố cơ thể.
Vật liệu & Phương pháp
Thiết kế và bố trí thí nghiệm
Khu vực nghiên cứu (Hình 7.3.1) nuôi tôm (Penaeus monodon) được chọn ở khu vực trung tâm của Sundarbans Ấn Độ tại khối Canning nằm ở quận Nam 24 Parganas của bang Tây Bengal (22o16′40,6″ vĩ độ Bắc và 88o38 ′18,4” kinh độ Đông). Khu nuôi nằm bên bờ sông Matla, nơi có độ mặn trung bình 8,5 psu. Hai ao đã được chọn tại địa điểm nghiên cứu, trong đó một ao được chọn làm đối chứng (C) và ao còn lại được coi là thử nghiệm (E). Tôm nuôi (Penaeus monodon) trong ao thí nghiệm được cung cấp thức ăn công thức có nguồn gốc từ rong biển và ao đối chứng được cung cấp thức ăn truyền thống. Tôm giống chất lượng tốt thu được từ một trang trại nuôi tôm địa phương đã được thả sau khi thích nghi với điều kiện môi trường xung quanh. Mật độ thả giống là 5 PL20/m2 ở cả ao đối chứng và ao thí nghiệm. Tôm được cho ăn ban đầu ở mức 15% sinh khối trong mỗi ao và khẩu phần sau đó được điều chỉnh theo mức tiêu thụ thực tế hàng ngày, do đó giảm lượng thức ăn thừa xuống mức tối thiểu.
Hình 7.3.1: Bản đồ vị trí ao nuôi tại Canning, Sundarbans Ấn Độ
Các thông số chất lượng nước được phân tích 2 tuần/lần trong thời gian nuôi 90 ngày (15 tháng 4 đến 15 tháng 7 năm 2019). Các thông số vẫn nằm trong mức tối ưu trong suốt quá trình thử nghiệm. Độ mặn của nước mặt được ghi lại tại chỗ bằng khúc xạ kế quang học (Atago, Nhật Bản) và kiểm tra chéo trong phòng thí nghiệm bằng phương pháp Mohr-Knudsen (Strickland và Parsons, 1968). Hệ số hiệu chỉnh được tìm ra bằng cách chuẩn độ dung dịch bạc nitrat bằng nước biển tiêu chuẩn (Dịch vụ nước biển tiêu chuẩn IAPO Charlottenlund, Slot Đan Mạch, độ clo 19,376 psu). Phương pháp của chúng tôi đã được áp dụng để ước tính độ mặn của nước biển tiêu chuẩn được mua từ NIO và thu được độ lệch chuẩn là 0,02% cho độ mặn. Độ chính xác trung bình đối với độ mặn (liên quan đến 3 lần lấy mẫu) là ±0,28 psu và đối với nhiệt độ là ±0,035°C. Các chai thủy tinh 125ml được đổ đầy các mẫu nước đã thu thập và chuẩn độ Winkler được thực hiện để xác định lượng oxy hòa tan. Độ pH được đo bằng máy đo pH cầm tay (Hanna, Hoa Kỳ), có độ chính xác ± 0,1. Đĩa Secchi được sử dụng để đo độ trong suốt của cột nước và dữ liệu được sử dụng để tính toán độ sâu euphotric (lớp mặt nước có đầy đủ ánh sáng để cây sinh trưởng). Nước bề mặt được phân tích về nồng độ chất dinh dưỡng (nitrat, phốt phát và silicat) theo phương pháp đo quang phổ tiêu chuẩn (Strickland và Parsons, 1972). Nồng độ sắc tố thực vật (Chl a) được phân tích theo phương pháp này (Jeffrey và Humphrey, 1975). Hàm lượng cacbon hữu cơ trong đất đáy ao được ước tính bằng phương pháp chuẩn độ tiêu chuẩn (Walkey và Black, 1934).
Công thức thức ăn tôm và phân tích thành phần sinh hóa
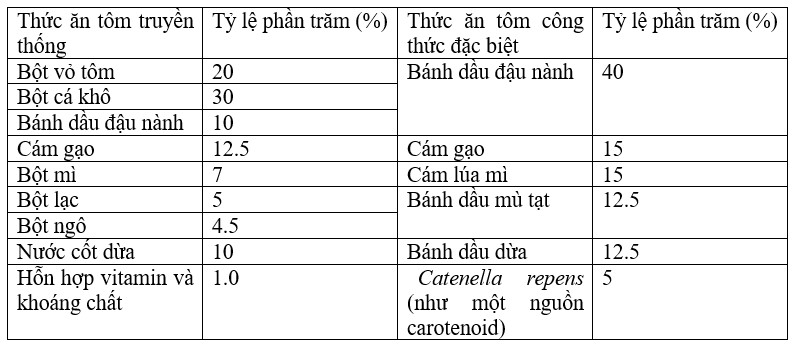
Thức ăn được coi là đầu vào quan trọng nhất để tăng sản lượng cá. Tôm tiêu thụ nhiều loại phụ phẩm nông nghiệp ở dạng thức ăn viên hoặc bột. Một số nghiên cứu đã được thực hiện để phát triển thức ăn công thức cho các loài trong hệ thống nuôi có kiểm soát (Mohanty và cộng sự, 1995; Mukhopadhyay và Ray, 1999, 2001; Khan và cộng sự, 2004; Biswas và cộng sự, 2006). Rong biển đỏ Catenella repens được chọn là loài ứng cử viên (nguồn astaxanthin) để chế biến thức ăn công thức cho tôm. Bảng so sánh giữa thức ăn truyền thống (thường được sử dụng ở khu vực nghiên cứu) và thức ăn công thức dựa trên rong biển được đưa ra (Bảng 7.3.1). Thành phần gần đúng của bột rong biển được xác định bằng phương pháp Lowry cho protein (Lowry và cộng sự, 1951), Soxhlet cho lipid (Tecator, 1983) và phương pháp Anthrone cho carbohydrate (Trevelyan và Harrison, 1952). Astaxanthin được ước tính theo phương pháp đo quang phổ tiêu chuẩn (Schuep và Schierle, 1995).
BẢNG 7.3.1: Phân tích so sánh các thành phần thức ăn cho tôm
Các thông số kỹ thuật trong chăn nuôi và phân tích thống kê
Trọng lượng và chiều dài từng con tôm được đo 2 tuần/ lần trong thời gian nuôi 90 ngày và các biến phản ứng có liên quan được xác định cho từng ao đối chứng và ao thí nghiệm. Chỉ số tình trạng được phân tích 2 tuần/ lần trong thời gian nuôi cấy theo biểu thức; C.I. = W/L3 x 100, trong đó W = trọng lượng của loài nuôi (tính bằng gm) và L = chiều dài của loài nuôi (cm). Phần trăm tăng trọng được tính bằng chênh lệch trọng lượng giữa trọng lượng trung bình cuối cùng so với trọng lượng ban đầu; tăng trọng = [(trọng lượng trung bình cuối cùng của cá thể – trọng lượng ban đầu trung bình của cá thể)/trọng lượng ban đầu trung bình của cá thể] x 100. Mức tiêu thụ thức ăn được báo cáo là tổng mức tiêu thụ ước tính trong khoảng thời gian 90 ngày. Tỷ lệ sống được đo bằng phần trăm chênh lệch giữa số lượng thả giống và khối lượng sản xuất (No.) vào cuối giai đoạn nuôi. Tỷ lệ chuyển đổi thức ăn (FCR) là trọng lượng thức ăn tiêu thụ trên một đơn vị tăng trọng và được phân tích sau khi thu hoạch tôm theo biểu thức: FCR = ∆f/∆b, trong đó, ∆f = Thay đổi sinh khối thức ăn và ∆b = Sự thay đổi sinh khối cơ thể của loài nuôi.
Sắc tố cơ thể được đánh giá cho mỗi nghiệm thức tôm được nấu trong nước sôi trong 5 phút và so sánh màu đỏ cam với điểm màu Roche SalmoFanTM. Phân tích phương sai (ANOVA) được tính toán giữa tất cả các thông số đã chọn (các chỉ số trong thí nghiệm của chúng tôi) xem xét cả ao đối chứng và ao thử nghiệm để đánh giá sự khác biệt do đưa rong biển vào thức ăn gây ra.
Kết quả
Thành phần sinh hóa của rong biển và thức ăn có công thức đặc biệt
Thành phần sinh hóa của Catenella repens cho thấy hàm lượng protein nằm trong khoảng từ 4,01 ± 1,28% đến 15,97 ± 1,17%; lipid dao động trong khoảng 0,17 ± 0,02% đến 0,24 ± 0,01%; giá trị carbohydrate trong khoảng từ 21,52 ± 1,87% đến 35,74 ± 1,55% và giá trị astaxanthin trong khoảng từ 87,91 ± 2,67 ppm đến 188,34 ± 2,89 ppm (Banerjee và cộng sự, 2009). Rong biển được sử dụng làm thành phần (5%) của thức ăn có công thức đặc biệt. Thành phần tương tự của thức ăn công thức truyền thống và thức ăn công thức dựa trên rong biển được trình bày trong Bảng 7.3.2. Thức ăn truyền thống cho thấy giá trị protein, lipid và carbohydrate cao hơn thức ăn làm từ rong biển. Tuy nhiên, hàm lượng astaxanthin gần như bằng không trong thức ăn truyền thống.
BẢNG 7.3.2: Thành phần gần đúng của thức ăn truyền thống và thức ăn công thức

Sự tăng trưởng và sắc tố của tôm
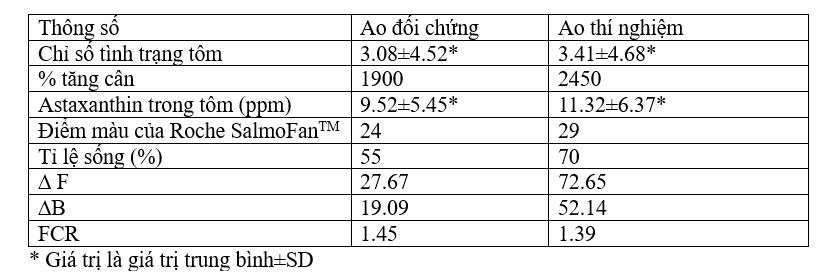
Tôm được nuôi bằng khẩu phần ăn Catenella có trọng lượng cuối cùng cao hơn và tăng trọng tốt hơn (Bảng 7.3.2) vào cuối thí nghiệm (trọng lượng cuối cùng 25,5 gm và tăng trọng 2450 %) so với ao đối chứng (trọng lượng cuối cùng 20 gm). và tăng cân 1900%). Giá trị Chỉ số trạng thái của tôm ở ao thí nghiệm cũng cao hơn (3,41±4,68) so với ao đối chứng (3,08±4,52) (Bảng 7.3.3 và Hình 7.3.2). Giá trị FCR ở ao đối chứng là 1,45 và ao thí nghiệm là 1,39. Tỷ lệ sống ở ao đối chứng là 55% và ao thí nghiệm là 70%. Sản lượng cũng đạt tối đa ở ao thí nghiệm (69,97 kg) so với ao đối chứng (20,10 kg) như đã trình bày trong Bảng 7.3.4. Nghiên cứu quy mô thí điểm hiện nay hỗ trợ môi trường ao nuôi khỏe mạnh, tăng trưởng tốt hơn, tỷ lệ sống cao hơn và giá trị FCR thấp thông qua việc sử dụng thức ăn làm từ rong biển.
BẢNG 7.3.3: Các thông số kỹ thuật vườn thú ghi nhận trong ao nuôi
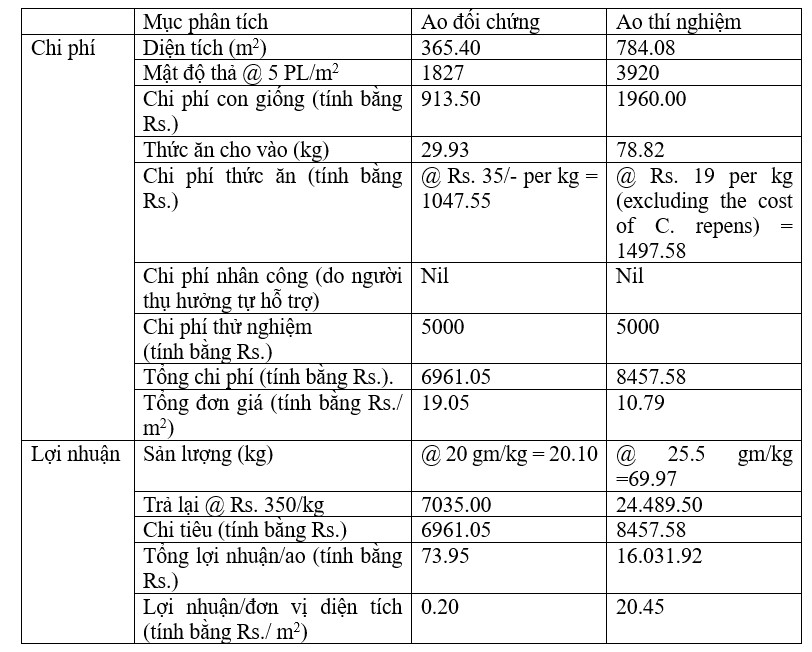
BẢNG 7.3.4: Phân tích chi phí-lợi ích của ao nuôi
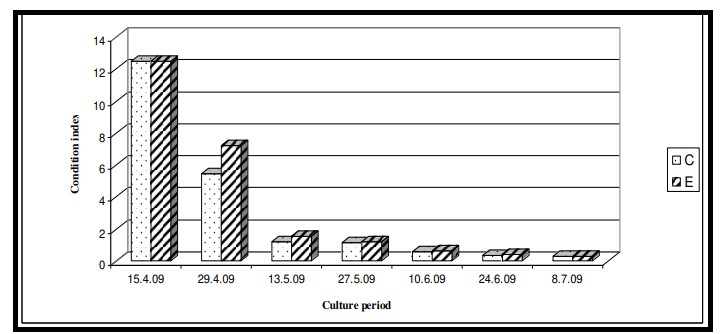
Hình 7.3.2: Sự thay đổi tình trạng Chỉ số tôm nuôi 2 tuần/ lần từ ao đối chứng (C) và ao thí nghiệm (E)
Một yếu tố quan trọng quyết định sự chấp nhận của người tiêu dùng và giá trị thị trường của nhiều loài cá và tôm nuôi là màu hồng hoặc đỏ của thịt hoặc vỏ ngoài khi nấu chín (Brun và Vidal, 2006). Trong tự nhiên, màu sắc này đạt được thông qua việc ăn vào các sắc tố carotenoid, đặc biệt là astaxanthin có trong các sinh vật không xương sống (Johnson và cộng sự, 1977; Ibrahim và cộng sự, 1984). Thức ăn dựa trên Catenella trong nghiên cứu này đã mang lại giá trị astaxanthin cao hơn ở tôm ở ao thí nghiệm (11,32±6,37 ppm) được phản ánh qua màu sắc đỏ cam đậm hơn của vỏ ngoài của tôm so với ao đối chứng (9,52±5,45 ppm). Điểm màu Roche SalmoFanTM cho thấy giá trị 24 ở ao đối chứng, thấp hơn nhiều so với ao thí nghiệm có điểm màu là 29 (Bảng 7.3.3 và Hình 7.3.3).
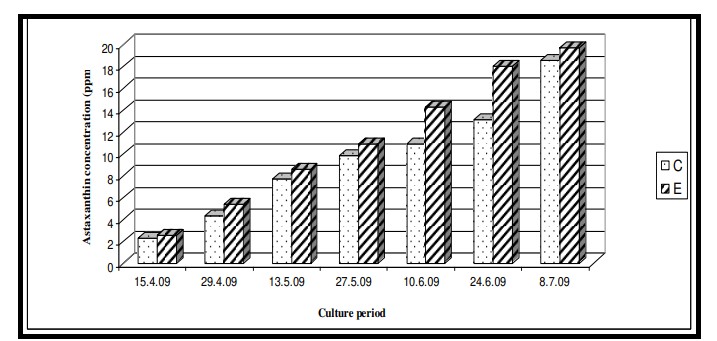
Hình 7.3.3: Sự thay đổi nồng độ 2 tuần/lần trong tôm từ ao đối chứng (C) và ao thí nghiệm (E)
Sự thay đổi các thông số môi trường
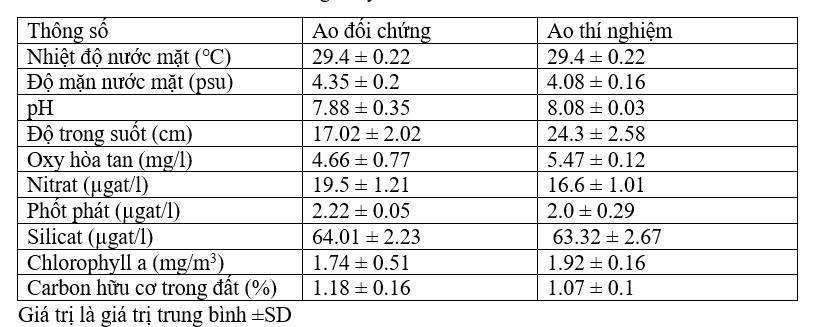
Nhiệt độ nước bề mặt trong thời gian nghiên cứu dao động từ 29,0℃ đến 29,6℃ với giá trị trung bình là 29,4 ± 0,22℃ ở cả hai ao nuôi (Bảng 7.3.5 và Hình 7.3.4). Độ mặn nước mặt dao động từ 3,72 psu đến 4,45 psu với giá trị trung bình là 4,35 ± 0,2 psu ở ao đối chứng và 4,08 ± 0,16 psu ở ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.5). Độ pH mặt nước dao động từ 7,10 đến 8,12 với giá trị trung bình là 7,88 ± 0,35 ở ao đối chứng và 8,08 ± 0,03 ở ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.6). Giá trị DO dao động từ 3,08 mg/l đến 5,58 mg/l với giá trị trung bình là 4,66 ± 0,77 mg/l trong ao đối chứng và 5,47 ± 0,12 mg/l trong ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.7). Độ trong của nước trong thời gian nghiên cứu dao động từ 14,35 cm đến 27,5 cm với giá trị trung bình là 17,02 ± 2,02 cm ở ao đối chứng và 24,3 ± 2,58 cm ở ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.12). Giá trị dinh dưỡng (nitrat, photphat và silicat) dao động từ 15,12 µgat/l đến 21,33 µgat/l với giá trị trung bình là 19,5 ± 1,21 µgat/l trong ao đối chứng và 16,6 ± 1,01 µgat/l trong ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.8) đối với nitrat, từ 1,53 µgat/l đến 2,28 µgat/l với giá trị trung bình là 2,22±0,05 µgat/l trong ao đối chứng và 2,0 ± 0,29 µgat/l trong ao ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.9) đối với photphat và từ 59,63 µgat/l đến 66,2 µgat/l với giá trị trung bình là 64,01 ± 2,23 µgat/l ở ao đối chứng và 63,32 ± 2,67 µgat/l ở ao ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.10) đối với silicat. Nồng độ Chl a trong thời gian nghiên cứu dao động từ 0,97 mg/ m3 đến 2,66 mg/ m3 với giá trị trung bình là 1,74 ± 0,51 mg/ m3 trong ao đối chứng và 1,92 ± 0,16 mg/ m3 trong ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.11). Carbon hữu cơ của đất đáy ao trong thời gian nghiên cứu dao động từ 0,97 % đến 1,35 % với giá trị trung bình là 1,18 ± 0,16 % ở ao đối chứng và 1,07 ± 0,10 % ở ao thí nghiệm (Bảng 7.3.5 và Hình 7.3.13).
BẢNG 7.3.5: Sự biến đổi các thông số lý hóa của ao nuôi
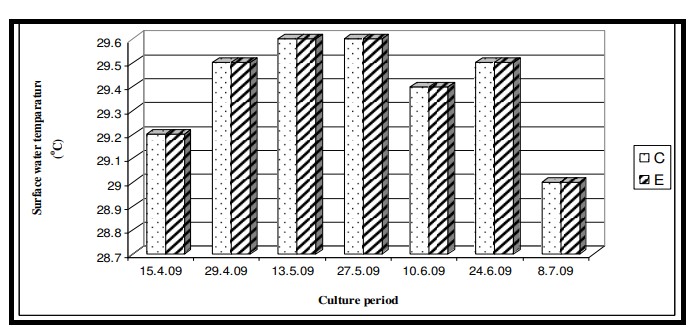
Hình 7.3.4: Sự biến đổi nhiệt độ nước mặt 2 tuần/ lần ở ao đối chứng (C) và ao thí nghiệm (E)
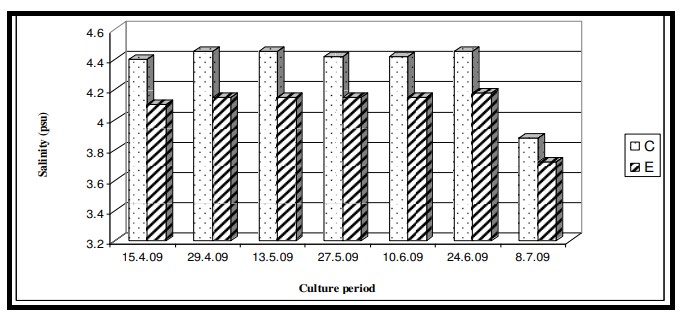
Hình 7.3.5: Sự biến đổi độ mặn nước mặt 2 tuần/ lần ở ao đối chứng (C) và ao thí nghiệm (E)
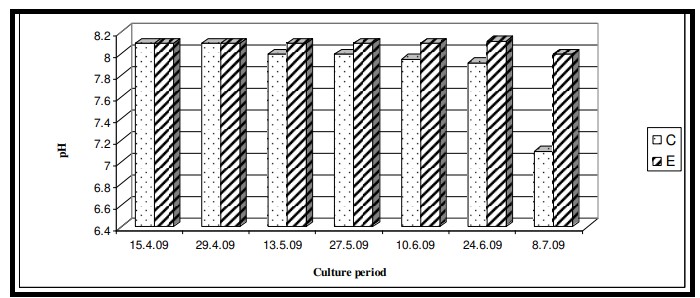
Hình 7.3.6: Sự biến đổi pH nước mặt 2 tuần/ lần ở ao đối chứng (C) và ao thí nghiệm (E)
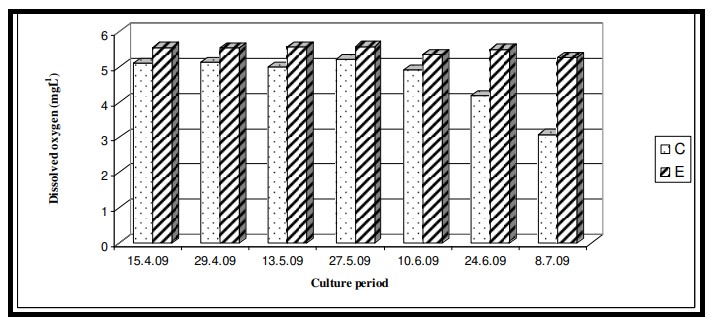
Hình 7.3.7: Sự biến đổi oxy hòa tan 2 tuần/ lần trong ao đối chứng (C) và ao thí nghiệm (E)
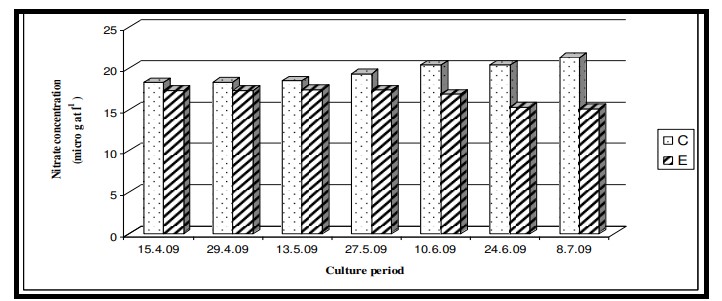
Hình 7.3.8: Sự biến đổi nồng độ nitrat 2 tuần/ lần trong ao đối chứng (C) và ao thí nghiệm (E)
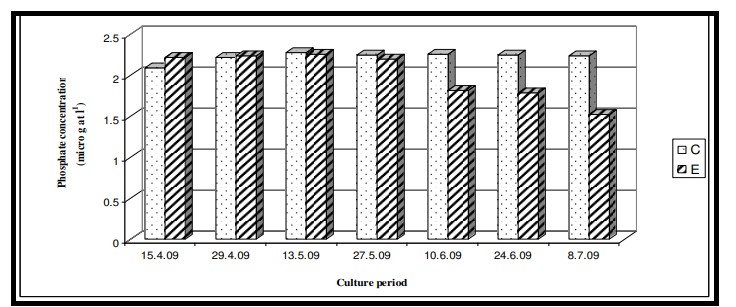
Hình 7.3.9: Sự thay đổi nồng độ phốt phát 2 tuần/ lần trong ao đối chứng (C) và ao thí nghiệm (E)
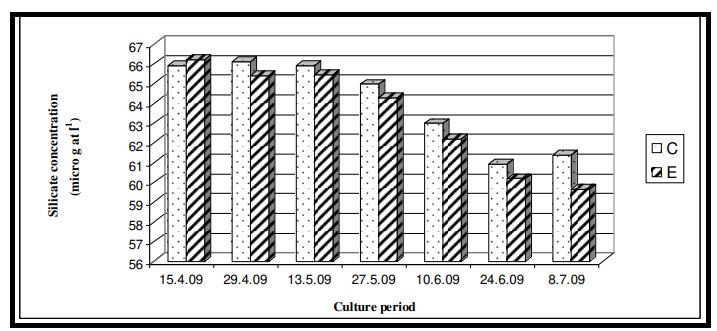
Hình 7.3.10: Sự thay đổi nồng độ silicat 2 tuần/ lần trong ao đối chứng (C) và ao thí nghiệm (E)
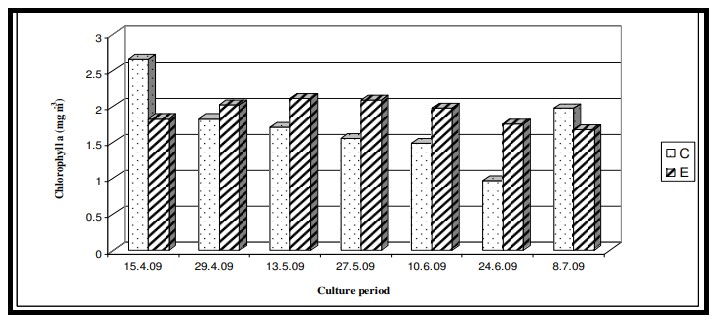
Hình 7.3.11: Sự biến đổi nồng độ chất diệp lục 2 tuần/ lần trong ao đối chứng (C) và ao thí nghiệm (E)
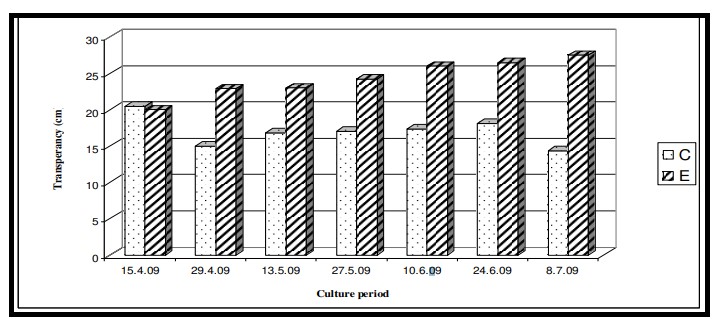
Hình 7.3.12: Sự thay đổi độ trong của nước 2 tuần/ lần ở ao đối chứng (C) và ao thí nghiệm (E)
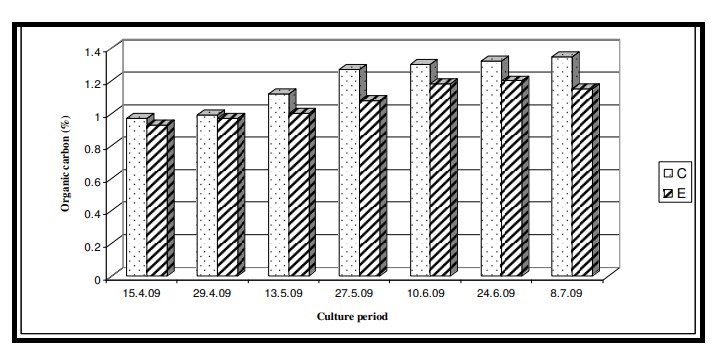
Hình 7.3.13: Sự biến đổi hàm lượng cacbon hữu cơ trong đất 2 tuần/ lần ở ao đối chứng (C) và ao thí nghiệm (E)
Thảo luận
Chất lượng thức ăn
Sự tăng trưởng, sức khỏe và sinh sản của cá và các động vật thủy sinh khác phụ thuộc vào việc cung cấp đủ chất dinh dưỡng thông qua thức ăn cả về chất lượng và số lượng, bất kể hệ thống nuôi (Kader và cộng sự, 2005). Do đó, việc cung cấp đầu vào (thức ăn, phân bón, v.v.) phải được đảm bảo để đáp ứng nhu cầu về chất dinh dưỡng và năng lượng của các loài nuôi và đạt được mục tiêu sản xuất của hệ thống (Hasan, 2001). Sự cân bằng dinh dưỡng của thức ăn ảnh hưởng đến việc sử dụng thức ăn và tăng trưởng của cá. Điều rất cần thiết là phải biết các yêu cầu dinh dưỡng đặc biệt về protein, lipid và năng lượng để các loài cá tăng trưởng tối ưu cũng như xây dựng khẩu phần ăn cân bằng. Mức protein và năng lượng trong khẩu phần ăn được biết là có ảnh hưởng đến sự tăng trưởng và thành phần cơ thể của cá (Lovell, 1989). Mức protein và năng lượng không phù hợp trong thức ăn làm tăng chi phí sản xuất cá và làm suy giảm chất lượng nước. Năng lượng không đủ trong khẩu phần ăn gây lãng phí protein do tỷ lệ protein được sử dụng làm năng lượng trong khẩu phần ăn tăng lên và amoniac được tạo ra có thể làm giảm chất lượng nước (Phillips, 1972; Prather và Lovell, 1973; Shyong và cộng sự, 1998). Ngược lại, năng lượng dư thừa trong khẩu phần ăn có thể dẫn đến tăng tích tụ lipid trong cơ thể và giảm tăng trưởng do thiếu chất dinh dưỡng cần thiết cho tăng trưởng (Daniels và Robinson, 1986; Van der Meer và cộng sự, 1997). Điều này thường xảy ra với thức ăn truyền thống và dẫn đến sự suy giảm các thông số chất lượng nước trong ao đối chứng (Bảng 7.3.3). Trong nghiên cứu này, thức ăn có công thức đặc biệt được chế biến từ Catenella repens có hàm lượng protein, lipid, carbohydrate và astaxanthin tối ưu và các giá trị này cũng nằm trong mức dinh dưỡng được khuyến nghị cho cá (Hội đồng Nghiên cứu Quốc gia, 1983).
Protein là yếu tố thúc đẩy tăng trưởng chính trong thức ăn. Nhu cầu protein của cá bị ảnh hưởng bởi nhiều yếu tố khác nhau như kích cỡ cá, nhiệt độ nước, tốc độ cho ăn, khả năng sử dụng và chất lượng của thức ăn tự nhiên cũng như hàm lượng năng lượng tiêu hóa tổng thể trong khẩu phần ăn (Satoh, 2000; Wilson, 2000). Trong nghiên cứu này, mức protein trong thức ăn công thức được tìm thấy là 28,29 ± 0,58% so với 32 ± 2,65% trong thức ăn truyền thống. Lipid chủ yếu được đưa vào khẩu phần ăn theo công thức để tối đa hóa tác dụng tiết kiệm protein (Hasan, 2001) bằng cách trở thành nguồn năng lượng. Hàm lượng lipid thấp trong thức ăn có công thức đặc biệt mang lại hiệu quả liên kết cao hơn và độ ổn định trong nước viên cao hơn. Giá trị lipid được nhận thấy là thấp hơn trong thức ăn có công thức đặc biệt cho thấy hiệu quả của thức ăn hiện tại trong việc duy trì sự ổn định của nước. Hàm lượng carbohydrate trong thức ăn là nguồn năng lượng thích hợp nhất cho tôm. Nguồn carbohydrate tốt nhất trong thức ăn cho tôm là những nguồn có nguồn gốc từ các nguyên liệu thực tế có chi phí thấp (ví dụ: bột mì, cám gạo, v.v.). Thức ăn công thức trong nghiên cứu này cũng ủng hộ quan điểm trên (Bảng 7.3.1 và 7.3.3). Việc sử dụng Catenella repens làm chất bổ sung astaxanthin (nguồn carotenoid) đã làm tăng đặc tính chống oxy hóa của thức ăn và dẫn đến nồng độ sắc tố cao hơn ở các loài tôm trong ao thí nghiệm (Bảng 7.3.3 và 7.3.4).
Hiệu suất tăng trưởng của tôm
Kết quả của việc đưa tảo lớn vào thức ăn cho tôm có thể khác nhau tùy theo loài tiêu dùng, loại tảo và mức độ đưa vào được thử nghiệm (Cruz-Suarez và cộng sự, 2009). Penaflorida và Golez (1996) quan sát thấy tôm Penaeus monodon (200 mg) tăng trọng tốt hơn trong khẩu phần bao gồm 50 g/kg bột Kappaphycus alvarezii. Cruz-Suarez và cộng sự (2000) đã tìm thấy sự gia tăng đáng kể về tốc độ tăng trưởng (530-680 g/kg) ở tôm con Litopenaeus vannamei (450 mg) cho ăn khẩu phần ăn có chứa 20 hoặc 40 g/kg bột tảo bẹ Mexico (Macrocystis pyrifera). Nghiên cứu điển hình này cho thấy sự tăng trọng đáng kể trong ao thí nghiệm so với ao đối chứng (Fobs = 1.759 < Fcrit = 5,987) nhưng quan sát thấy sự thay đổi đáng kể ở mức 5% giữa các giai đoạn nuôi. Sự thay đổi đáng kể của C.I. theo thời gian là do sự tăng trưởng sinh khối theo thời gian. Cho tôm ăn (Penaeus monodon) bổ sung bột Catenella giúp tôm tăng trưởng và tỷ lệ sống tốt hơn trong nghiên cứu này. Tỷ lệ tăng sinh khối ở ao thí nghiệm cũng cao hơn ao đối chứng (Bảng 7.3.3). Điều này cũng được thể hiện qua giá trị FCR ở ao thí nghiệm thấp hơn so với ao đối chứng, cho thấy các loài tôm chấp nhận thức ăn có công thức đặc biệt. Phân tích chi phí-lợi nhuận (CBA) cũng xác nhận tỷ lệ lợi nhuận cao hơn (Bảng 7.3.4).
Sắc tố
Sự phát triển màu sắc phụ thuộc vào hàm lượng carotenoid trong thức ăn (Moretti và cộng sự, 2006) mặc dù đã có báo cáo rằng carotenoid trong khẩu phần ăn chiếm ít hơn 20% sắc tố thịt ở sinh vật thủy sinh (Torrisen và cộng sự, 1989; Storebakken và Không, 1992). Sắc tố carotenoid bị ảnh hưởng bởi nguồn sắc tố trong khẩu phần ăn, mức liều lượng, thời gian cho ăn, thành phần khẩu phần, mức độ este hóa carotenoid, v.v. (Meyers và Latscha, 1997; Bjerkeng, 2000; Buttle và cộng sự, 2001; Gomes và cộng sự, 2002; White và cộng sự, 2002). Động vật bao gồm cá và tôm không thể tổng hợp carotenoid nhưng một số loài nuôi trồng thủy sản nhất định (như động vật giáp xác, cá ăn tạp/ăn cỏ) có khả năng chuyển hóa carotenoid khi ăn vào như ∞-carotene và tích tụ các sản phẩm cuối cùng, thường là astaxanthin trong mô của chúng (Simpson và Chichester, 1981; NRC, 1983). Kết quả ANOVA cho thấy sự khác biệt đáng kể của astaxanthin giữa các ao (p<0,05) cũng như giữa các giai đoạn nuôi (p <0,05) do sự khác biệt về mức độ astaxanthin trong các loại thức ăn. Thức ăn làm từ rong biển có astaxanthin là 62,33 ± 2,78 ppm, trong khi mức astaxanthin trong thức ăn truyền thống là BDL. Rong biển đỏ Catenella repens là nguồn giàu carotenoid (Chakraborty và Santra, 2008; Banerjee và cộng sự, 2009) và do đó có thể là nguyên nhân gây ra hàm lượng astaxanthin cao trong các loài ao thí nghiệm. Sắc tố của cơ là đặc điểm chính của tôm (Brun và Vidal, 2006; Darachai và cộng sự, 1998). Màu sắc của cơ tôm sử dụng rong biển như Catenella repens làm nguồn sắc tố tự nhiên có thể nâng cao tiềm năng đưa rong biển vào thức ăn cho tôm và có thể thay thế hoặc giảm bớt chất tạo màu nhân tạo hiện đang được ngành công nghiệp sử dụng (Banerjee, 2009; Nickell và Bromage, 1998).
Chất lượng nước ao nuôi
Các thông số thủy sinh của ao nuôi tôm phản ánh chất lượng thức ăn cung cấp cho loài nuôi và các giá trị chỉ số điều kiện thể hiện cho sự phù hợp của môi trường đối với loài (Maceina và Murphy, 1998). Nhiệt độ nước bề mặt ở cả hai ao nuôi cho thấy xu hướng biến đổi ít nhiều song song trong suốt thời gian nghiên cứu. Điều này được phản ánh trong kết quả ANOVA cho thấy không có sự khác biệt đáng kể về thông số giữa ao đối chứng và ao thí nghiệm cũng như giữa các giai đoạn nuôi. Sự đồng nhất về nhiệt độ là do vị trí của cả hai ao trong cùng một địa điểm có thời tiết và khí hậu tương tự nhau. Nhiệt độ nước đóng vai trò quan trọng trong hoạt tính enzyme của tôm và có thể có ảnh hưởng điều tiết đến sự phát triển của chúng (Mitra và cộng sự, 2006). Nó cũng ảnh hưởng đến quá trình lột xác trong giai đoạn hậu ấu trùng của tôm (WWF-Ấn Độ, 2006). Trong nghiên cứu này, không có mối quan hệ đáng kể nào được quan sát giữa chỉ số thể trạng của tôm và nhiệt độ nước bề mặt.
Độ mặn của khu phức hợp cửa sông Hugli-Matla được biết là có sự biến đổi mạnh mẽ (Saha và cộng sự, 1975). Trạm được chọn Canning nằm ở đoạn cửa sông Matla, nơi được biết đến với điều kiện thủy triều biến thay đổi. Kết quả ANOVA cho thấy sự khác biệt đáng kể về độ mặn giữa các ao (p<0,05) cũng như giữa các giai đoạn nuôi (p < 0,05). Sự khác biệt về độ mặn giữa các ao có thể là do độ mặn của đất khác nhau (như chất nền của ao) khiến muối hòa tan vào nước ao. Sự khác biệt về độ mặn giữa các thời kỳ có đặc điểm của vùng Sundarbans Ấn Độ, nơi giá trị độ mặn tùy theo mùa. Nhìn chung, độ mặn cao được ghi nhận trong thời kỳ tiền gió mùa và giá trị giảm mạnh trong thời kỳ gió mùa (Mitra và cộng sự, 1992, Mitra, 1993, Mitra và Choudhury, 1993, Mitra và cộng sự, 1994, 1999; Mitra, 2000). Trong nghiên cứu này, thời gian nuôi là từ ngày 15 tháng 4 đến ngày 15 tháng 7 năm 2009, bao gồm cả mùa tiền gió mùa (tháng 4 đến giữa tháng 6) và mùa gió mùa (giữa tháng 6 đến tháng 7). Giá trị C.I. tương đối cao hơn các giá trị trong ao thí nghiệm có độ mặn ít hơn (4,08 ± 0,16 psu) chứng tỏ hiệu quả của thức ăn công thức trong việc chống lại căng thẳng do độ mặn gây ra, từ đó làm tăng mức độ astaxanthin trong các loài nuôi (Kobayashi và cộng sự, 1992; Tjahjono và cộng sự, 1994; Harker và cộng sự, 1996; Boussiba, 2000; Sarada và cộng sự, 2002). Nuôi tôm ảnh hưởng trực tiếp đến độ pH của đáy ao thông qua việc tích tụ thức ăn thừa, phân tôm, tôm chết, v.v. Những điều này làm chuyển độ pH quá mức trong nước và đất sang trạng thái axit. Trong nghiên cứu này, tình trạng này không được quan sát thấy ở khu vực nuôi trồng do tập quán bón vôi truyền thống định kỳ ở vùng hạ lưu sông Hằng. Kết quả ANOVA cũng xác nhận quan điểm trên khi không quan sát thấy sự thay đổi đáng kể về độ pH giữa các ao cũng như giữa các giai đoạn nuôi. Tải lượng carbon hữu cơ cao được quan sát thấy trong ao đối chứng do sử dụng thức ăn truyền thống dẫn đến độ pH thấp. Kết quả ANOVA cho thấy sự khác biệt đáng kể về hàm lượng carbon hữu cơ giữa các ao (p < 0,05) cũng như giữa các giai đoạn nuôi (p < 0,05). Chất bài tiết và dư lượng thức ăn từ động vật là những tác nhân chính tạo ra tải lượng hữu cơ trong ao nuôi tôm đã gây ra sự thay đổi này.
Oxy hòa tan (DO) là một thông số quan trọng quyết định đời sống thủy sinh. Sức khỏe của tôm bị ảnh hưởng trực tiếp bởi lượng oxy hòa tan và những biến động trong ngày của nó. Tải lượng chất hữu cơ quá mức trong hệ thống dẫn đến giảm giá trị D.O. sẽ đe dọa đến tỷ lệ sống của đời sống thủy sinh. Trong nghiên cứu này, giá trị D.O. trong ao đối chứng có giá trị thấp hơn do sự tích tụ cacbon hữu cơ ở đáy ao. Kết quả ANOVA đã xác nhận sự thay đổi đáng kể của D.O. giữa các ao nuôi (p < 0,05) và sự khác biệt không đáng kể giữa các giai đoạn nuôi. Giá trị D.O. biến động giữa các ao có thể là do tốc độ tăng trưởng khác nhau của các loài nuôi và việc sử dụng các loại thức ăn khác nhau. Thức ăn truyền thống chứa bột cá khô và bột tôm tạp làm giảm lượng D.O. do việc sử dụng nó để oxy hóa các chất còn sót lại. Mặt khác, thức ăn có nguồn gốc từ thực vật tạo ra rất ít dư lượng do đó giá trị D.O. hầu như vẫn không thay đổi. Sự đồng nhất trong D.O. theo thời gian được cho là do các đặc điểm khí tượng thủy văn tương tự của khu vực chung.
Độ trong suốt kiểm soát số lượng thực vật phù du tồn tại trong ao nuôi tôm do chúng phụ thuộc vào bức xạ mặt trời để quang hợp. Do đó, thông số này có vai trò quan trọng trong việc điều chỉnh mức độ sắc tố thực vật và màu sắc của nước ao nuôi tôm. Thức ăn công thức được cung cấp trong ao thí nghiệm cho thấy độ trong của nước tăng lên do đặc tính liên kết độc đáo của nó. Điều này đã nâng cao chất lượng nước được phản ánh qua các giá trị chỉ số thể trạng cao của tôm trong ao thí nghiệm. Tuyên bố trên được xác nhận bằng kết quả ANOVA cho thấy sự thay đổi đáng kể về độ trong suốt giữa các ao (p < 0,05) nhưng không có sự khác biệt đáng kể giữa các giai đoạn nuôi. Việc các loài nuôi trong ao thí nghiệm chấp nhận thức ăn làm từ rong biển có thể là cơ sở để giảm các hạt lơ lửng trong pha thủy sinh gây ra sự thay đổi độ trong của nước.
Các chất dinh dưỡng như nitrat, phốt phát và silicat trong giai đoạn thủy sinh của ao nuôi được tạo ra thông qua các sản phẩm bài tiết của loài nuôi, thức ăn thừa và sự xáo trộn của đáy ao (do dòng chảy từ các vùng đất lân cận). Kết quả ANOVA cho thấy sự thay đổi đáng kể của nitrat giữa các ao (p < 0,05) có thể là do sự rửa trôi của các thành phần thức ăn (đặc biệt là từ thành phần động vật trong thức ăn truyền thống) trong nước ao và cả chất phân tạo ra amoniac (Mitra và Choudhury, 1995). Tuy nhiên, không quan sát thấy có sự khác biệt đáng kể giữa các giai đoạn nuôi cấy. Kết quả ANOVA về nồng độ phốt phát trong thời gian nghiên cứu cho thấy không có sự khác biệt đáng kể giữa các ao cũng như giữa các giai đoạn nuôi do việc chấm dứt hoàn toàn việc sử dụng nước ao nuôi để tắm rửa và sinh hoạt hàng ngày. Kết quả ANOVA về nồng độ silicat cho thấy sự thay đổi đáng kể của silicat giữa các ao (p < 0,05) cũng như giữa các giai đoạn nuôi (p < 0,05). Sự khác biệt đáng kể của silicat giữa các ao có thể là do thành phần nền hoặc đáy khác nhau. Giữa các giai đoạn nuôi trồng, sự khác biệt là do sự biến động theo mùa như thường thấy ở vùng Sundarbans ở Ấn Độ. Dòng chảy gió mùa từ các vùng đất lân cận làm xáo trộn vật liệu đáy ao và làm thay đổi mức độ silicat của pha thủy sinh.
Sắc tố thực vật (Chl a) là các chỉ số đánh giá năng suất thủy sản và trữ lượng thực vật phù du hiện có. Mặc dù nồng độ sắc tố thực vật cao hơn biểu thị hiện tượng phú dưỡng của nước, nhưng sự hiện diện của chúng ở mức tối ưu sẽ thuận lợi cho sự phát triển của tôm vì thực vật phù du tạo thành khẩu phần ăn tự nhiên của tôm. Trong nghiên cứu này, nồng độ Chl a tối ưu và giá trị dinh dưỡng thấp hơn trong ao thí nghiệm chứng tỏ thực vật phù du thủy sinh sử dụng hiệu quả các chất dinh dưỡng. Kết quả ANOVA cho thấy không có sự thay đổi đáng kể của Chl a giữa các ao cũng như giữa các giai đoạn nuôi, cho thấy sự phát triển lành mạnh của các loài nuôi.
Kết luận
Nuôi trồng thủy sản đã trở thành một ngành công nghiệp hành dầu trong thiên niên kỷ hiện nay, bao gồm nuôi trồng hải sản với tôm, mực nang, mực, tôm hùm và các món ngon khác thực sự được “nuôi” trong các bể thủy sinh trong điều kiện được kiểm soát khoa học (Rajkhowa, 2005). Để cải thiện chất lượng sản phẩm thủy sản, việc sử dụng thức ăn giàu dinh dưỡng tiếp tục được chấp nhận rộng rãi trong ngành nuôi trồng thủy sản. Việc sử dụng thức ăn chất lượng giúp giảm đáng kể tổng chi phí biến đổi của hoạt động thông qua năng suất vật nuôi được cải thiện, tỷ lệ chuyển đổi thức ăn (FCR) tốt hơn và chất lượng nước được cải thiện do giảm lượng chất dinh dưỡng và chất rắn (tức là phân và thức ăn thừa) trong nước thải. Thức ăn công thức dựa trên Catenella repens cho thấy hiệu suất tăng trưởng tốt hơn của các loài nuôi xét về giá trị chỉ số điều kiện và tỷ lệ sống. Sắc tố cơ thể được cải thiện ở các loài nuôi trong ao thí nghiệm và cho thấy hàm lượng astaxanthin cao hơn đáng kể so với ao đối chứng. Phân tích Chi phí-Lợi nhuận (CBA) phản ánh khả năng sinh lời cao khi sử dụng thức ăn làm từ thực vật thay vì thức ăn truyền thống. Vẫn cần một loạt thử nghiệm để có thời gian kiểm tra kết quả và giúp chương trình trở nên bền vững đối với cư dân đảo nghèo ở vùng hạ lưu đồng bằng sông Hằng.
Theo Prosenjit Pramanick, Sufia Zaman, Pavel Biswas và Abhijit Mitra
Nguồn: https://www.academia.edu/45654419/Shrimp_feed_from_red_seaweed
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phần 1: Sử Dụng Chất Nền Nhân Tạo Trong Nuôi Tôm Litopenaeus vannamei (Hệ Thống Biofloc) Ở Các Mật Độ Thả Khác Nhau: Ảnh Hưởng Đến Hoạt Động Của Vi Sinh Vật, Chất Lượng Nước Và Năng Suất
- Phần 2: Sử Dụng Chất Nền Nhân Tạo Trong Nuôi Tôm Litopenaeus vannamei (Hệ Thống Biofloc) Ở Các Mật Độ Thả Khác Nhau: Ảnh Hưởng Đến Hoạt Động Của Vi Sinh Vật, Chất Lượng Nước Và Năng Suất
- Phương Án Đưa Ra Các Giải Pháp Quản Lý Nước Thải Trong Nuôi Tôm Dựa Vào Thiên Nhiên

 English
English