Thảo luận
Bệnh nhiễm vi bào tử trùng do EHP gây ra là một bệnh chính phải đối mặt trong việc nuôi tôm thẻ chân trắng trên toàn cầu. Do đó, nghiên cứu sâu rộng đã được thực hiện về mức độ phổ biến của nó, (Tourtip và cộng sự, 2009; Ha và cộng sự, 2010; Flegel, 2012; Tangprasittipap và cộng sự, 2013; Liu và cộng sự, 2015; Tang và cộng sự, 2015; Rajendran và cộng sự, 2016; Biju và cộng sự, 2016; Giridharan và Uma, 2017), khả năng gây bệnh (Tourtip và cộng sự, 2009) và các biện pháp phòng ngừa (Chaijarasphong và cộng sự, 2020). Tuy nhiên, thông tin về phản ứng miễn dịch của vật chủ đối với sự lây nhiễm EHP còn rất hạn chế (Santhoshkumar và cộng sự, 2016; Pan và cộng sự, 2018). EHP chủ yếu lây nhiễm chính vào gan tụy, tuyến tiêu hóa, dẫn đến suy giảm khả năng hấp thu dinh dưỡng dẫn đến chậm phát triển nghiêm trọng hoặc tăng trưởng còi cọc và khả năng miễn dịch kém (Anderson và cộng sự, 1989; Chayaburakul và cộng sự, 2004; Tourtip và cộng sự, 2009; Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2016).
Một nghiên cứu về khả năng gây bệnh của EHP và phản ứng của vật chủ trên tôm dựa trên thực nghiệm, cho ăn gan tụy bị nhiễm EHP đã cho kết quả dương tính yếu ở 2 ngày sau cảm nhiễm (dpc) và kết quả dương tính mạnh ở 4 và 7 dpc theo kết quả PCR (Tangpra-sittipap và cộng sự, 2013). Điều này tương tự với các quan sát được thực hiện trong nghiên cứu hiện tại, trong đó tôm bị nhiễm bệnh trong các nhóm HPI và SPI được phát hiện có PCR lồng dương tính với EHP ở 24 hpi và PCR 01 bước dương tính ở 72 hpi.
Trong một nghiên cứu khác, nó đã được chứng minh rằng việc cho ăn với mô bị nhiễm EHP cho kết quả EHP-PCR dương tính sau 5 ngày sau khi nhiễm bệnh (dpi) (Santhoshkumar và cộng sự, 2016). Sự khác biệt về thời gian trong việc phát hiện nhiễm EHP có thể là do nồng độ của EHP hiện diện trong các mô bị nhiễm và các phương pháp được sử dụng để gây nhiễm. Việc chung sống của tôm thẻ chân trắng khỏe mạnh với tôm nhiễm EHP đã làm cho tôm thí nghiệm dương tính với EHP sau 7 ngày (Salachan và cộng sự, 2017). Mặc dù phương pháp sống chung là một phương pháp không gây chết và an toàn để kích thích sự lây nhiễm EHP, nhưng nó có thể không phải là một phương pháp hiệu quả để nghiên cứu phản ứng miễn dịch của vật chủ vì nồng độ EHP mà tôm tiếp xúc có thể không được đánh giá chính xác (Mai và cộng sự, 2020). Hơn nữa, cho ăn mô nhiễm EHP cũng có một hạn chế là không thể bảo quản các mô bị nhiễm ở nhiệt độ thấp vì mô HP đông lạnh không tạo ra nhiễm EHP ở động vật khỏe mạnh (Mai và cộng sự,2020), Trong khi đó, việc tiêm vào xoang có thể được sử dụng như một phương pháp đề cử để cảm nhiễm tôm với nồng độ EHP đã biết nhằm đánh giá các phản ứng miễn dịch của vật chủ, vì nó tạo điều kiện cho việc lây nhiễm với một lượng EHP đã biết (Mun-kongwongsiri và cộng sự, 2021; Sathish Kumar và cộng sự, 2022).
Trong nghiên cứu này, lần đầu tiên sự lây nhiễm EHP của Tôm thẻ chân trắng bằng thực nghiệm đã được chứng minh bằng cách tiêm các bào tử EHP qua xoang ở đầu ngực của Tôm thẻ chân trắng. Gopel và Wirkner (2020) đã chứng minh rằng hệ thống haemolymph rỗng có liên quan đến sự tuần hoàn của haemolymph ở Tôm thẻ chân trắng. Do đó, bằng cách tiêm qua xoang, các bào tử EHP được đưa trực tiếp vào hệ thống ống dẫn, có thể sẽ chảy cùng với hệ thống mạch huyết tương và đi đến tuyến ruột giữa, nơi chúng có khả năng tạo ra sự lây nhiễm khi đến gan tụy.
Hệ thống miễn dịch bẩm sinh của tôm bao gồm các phản ứng miễn dịch tế bào và dịch thể, hoạt động phối hợp để bảo vệ chống lại các bệnh nhiễm trùng do vi sinh vật gây ra (Iwanaga và Bok, 2005; Kurata và cộng sự, 2006). Các phản ứng của tế bào liên quan đến một số chức năng miễn dịch như quá trình thực bào (phagocytosis) và chết tế bào theo chương trình (apoptosis) thông qua các tế bào miễn dịch như tế bào hồng cầu, hệ thống prophenoloxidase, hệ thống chất chống oxy hóa như gốc tự do ROS, superoxide dismutase (SOD), Catalase, v.v., (Wang và cộng sự, 2014). Trong khi đó, các phản ứng dịch thể liên quan đến một số enzyme hoặc yếu tố không đặc hiệu như lysozyme, lectin, v.v., loại bỏ mầm bệnh bằng cách giết trực tiếp hoặc bằng cách ức chế sự phát triển và lây lan của chúng (Marques và Barracco, 2000; Tassanakajon và cộng sự, 2013). Bước đầu tiên, hệ thống miễn dịch bẩm sinh của tôm xác định các tác nhân gây bệnh thông qua các thụ thể nhận dạng mẫu (PRR) để kích hoạt một loạt các con đường tín hiệu miễn dịch hạ lưu làm trung gian cho việc kích hoạt các phản ứng miễn dịch tế bào và dịch thể (Li và cộng sự, 2019). Các thụ thể gần giống như Toll (TLR) là một họ PRR cổ tiến hóa có ở các loài động vật từ Lớp sứa có gai đến động vật có vú, có thể phát hiện tất cả các loại mầm bệnh (Janeway và Medzhitov, 2000; Robalino và cộng sự, 2004). Xác nhận điều này, trong nghiên cứu của chúng tôi, chúng tôi đã tìm thấy sự điều chỉnh ban đầu trong sự biểu hiện của gen Toll trong các nhóm bị nhiễm thực nghiệm ở 6 hpi, sau đó là sự gia tăng rõ rệt ở 24 hpi và biểu hiện cao nhất ở 72 hpi. Đồng thời, có một sự thay đổi rõ rệt trong các phản ứng tế bào. Nồng độ THC trong các nhóm bị nhiễm thực nghiệm giảm đáng kể (p <0,05) từ 6 hpi. Ngược lại, hoạt động của propennoloxidase tăng đáng kể (p <0,05) từ 6 hpi khi so sánh với các nhóm đối chứng. Kết quả tương tự về sự điều hòa biểu hiện gen Toll đã được quan sát ở 24 hpi ở P. monodon cảm nhiễm với Vibrio harveyi và WSSV (Dechamma và cộng sự, 2015; Arts và cộng sự, 2007) và ở 5 hpi ở Fenneropenaeus chinensis được cảm nhiễm với Vibrio anguillarium với biểu hiện tối đa ở 23 hpi (Yang và cộng sự, 2008).
Quan sát nghiên cứu của chúng tôi cho thấy rằng biểu hiện gen Toll tăng lên để phản ứng với nhiễm trùng EHP có thể đã kích hoạt các con đường dòng chảy xuống làm trung gian cho các phản ứng tế bào như THC và proPO. Sự biểu hiện của các gen liên quan đến con đường tín hiệu Toll của hệ thống miễn dịch bẩm sinh được tìm thấy được điều chỉnh ở tằm để phản ứng với nhiễm N. bombycis (microsporidian) (Ma và cộng sự, 2013).
Tế bào máu là loại tế bào miễn dịch quan trọng nhất ở tôm và các loài giáp xác khác (Vazquez và cộng sự, 2009). Chúng đóng một vai trò quan trọng trong phản ứng miễn dịch bẩm sinh như melanin hoá, thực bào, đông máu, hình thành nốt sần, giao tiếp tế bào với tế bào, sản xuất thể bao của các peptide kháng khuẩn (AMPs), v.v., để chống lại các mầm bệnh xâm nhập (Tassanakajon và cộng sự, 2013; Soderhall, 2016). Trong nghiên cứu của chúng tôi, THC giảm đáng kể ở tôm thẻ chân trắng sau khi nhiễm EHP. Sự giảm THC đáng kể (p <0,05) được quan sát thấy ở 6 hpi đến 72 hpi khi tôm bị nhiễm bệnh nặng (PCR 01 bước dương tính với EHP). Sự giảm THC này có thể là do sự di chuyển của các tế bào hồng cầu đến vị trí nhiễm EHP để thực bào hoặc để chữa lành vết thương được tạo ra do sự đẩy ra của các ống phân cực gần các tế bào biểu mô của gan tụy (Sahul Hameed, 1989). Sự giảm nồng độ THC đã được quan sát thấy ở tôm khi thử nghiệm thực nghiệm với các mầm bệnh chính trên tôm như Vibrio harveyi (Bhoopathy và cộng sự, 2021; Huang và cộng sự, 2013), WSSV (van de Braak và cộng sự, 2002)
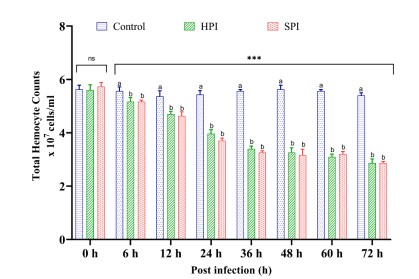
ProPO là con đường phản ứng miễn dịch chính ở động vật giáp xác vì nó có liên quan đến một loạt các chức năng miễn dịch như thực bào, sản xuất và bao bọc melanin (Ji và cộng sự, 2009). Sự gia tăng đáng kể (p <0,05) trong hoạt động proPO của tôm cảm nhiễm EHP (nhóm SPI và HPI) được quan sát từ 6 đến 60 hpi, cao hơn khoảng 42% so với nhóm đối chứng không bị nhiễm với mức giảm mạnh ở 72 hpi. ProPO có thể được kích hoạt thông qua một số yếu tố như protein liên kết β-1,3 glucan, lipopolysaccharides (LPS) và peptidoglycan của các dị vật, được tạo điều kiện bởi chuỗi phản ứng qua trung gian serine protease trong cơ thể tôm (Ji và cộng sự, 2009).
Một yếu tố khác kích hoạt proPO là enzyme kích hoạt proPO (PPAE). Một khi mầm bệnh xâm nhập vào vật chủ, PPAE này sẽ kích hoạt hệ thống propennoloxidase, chuyển đổi propennoloxidase thành phenoloxidase hoạt động, gây melanin hoá ở tôm (Johansson và Soderhall, 1996). Kết quả nghiên cứu của chúng tôi phù hợp với một nghiên cứu trước đây, trong đó các phản ứng protein và chuyển hóa ở tôm thẻ chân trắng bị nhiễm EHP tiết lộ rằng có một sự điều chỉnh đáng kể của nhiều loại protein liên quan đến khả năng miễn dịch của vật chủ bao gồm cả β-1,3 protein liên kết glucan, enzyme kích hoạt propnoloxidase (PPAE) và chất ức chế serine protease (Ning và cộng sự, 2019). Các protein liên kết β-1,3 glucan cũng được tìm thấy ở tằm để phản ứng với nhiễm trùng Nosema bombycis (microsporidian) vào thời điểm ban đầu (Yue và cộng sự, 2015).
Trong nghiên cứu của chúng tôi, sự lây nhiễm thực nghiệm với proPO kích hoạt EHP ở Tôm thẻ chân trắng có thể là sự tương tác giữa các thành phần miễn dịch của vật chủ như thụ thể Toll và protein liên kết β-1,3 glucan hoặc bất kỳ protein liên quan nào khác từ thành bào tử của EHP, tiếp tục kích hoạt PPAE hoặc hệ thống phân tầng qua trung gian serine protease dẫn đến tăng mức proPO để chống lại EHP xâm nhập. Mặc dù có sự gia tăng hoạt động của proPO trong thời gian đầu lên đến 60 hpi, nhưng mức độ nhiễm EHP vẫn không giảm, hơn nữa mức proPO cũng giảm xuống ở mức 72 hpi khi tôm cảm nhiễm bắt đầu dương tính với EHP. Kết quả tương tự cũng được quan sát thấy ở tằm trong quá trình nhiễm Nosema bombycis (microsporidian), nơi có sự gia tăng mức proPO lên đến 60 hpi và giảm dần sau 60 hpi có thể do sự ức chế một phần của quá trình melanin hoá haemolymph do tác hại của bào tử xâm nhập (Ma và cộng sự, 2013). Các chất ức chế serine protease như serpins được tiết ra bởi vi bào tử trùng (N. bombycis) có khả năng tham gia vào việc làm giảm hoạt động của serine protease ở tằm, do đó ức chế hệ thống thác qua trung gian serine protease (Ma và cộng sự, 2013). Điều này đã được khẳng định thêm (Ning và cộng sự, 2019) khi tôm nhiễm EHP, cho thấy sự điều chỉnh các chất ức chế serine protease lên gần 8,4 lần so với tôm khỏe mạnh.
Các lysozymes là enzym miễn dịch chính khu trú trong lysosome (Misra và cộng sự, 2004) có trong tế bào hồng cầu và được giải phóng vào huyết tương khi tế bào hồng cầu phân hủy trong quá trình đáp ứng miễn dịch (Ratcliffe và cộng sự, 1985). Sau khi được giải phóng vào huyết tương, lysozyme và các enzym phân giải protein khác sẽ được giải phóng để chống lại các mầm bệnh ngoại lai (Nicholson, 2003). Trong nghiên cứu này, việc nhiễm EHP trong thực nghiệm đã làm giảm đáng kể (p<0,05) hoạt động của lysozyme từ 24 hpi khi tôm dương tính yếu với EHP (PCR lồng). Khi lysozyme hoạt động từ bên trong tế bào hồng cầu, trong nghiên cứu này, cả mức THC và LYS đều giảm đáng kể (p <0,05) ở tôm bị nhiễm EHP so với tôm đối chứng không bị nhiễm. Rõ ràng là các tế bào huyết cầu đã được di chuyển đến các vị trí bị nhiễm bệnh để chữa lành vết thương mô do nhiễm trùng nhưng có thể không thực bào được EHP. Trong trường hợp không có hiện tượng thực bào hoặc phân hủy tế bào hồng cầu, các lysozyme có thể không được giải phóng để chống lại EHP xâm nhập và cho phép chúng gây ra nhiễm trùng gia tăng. Việc không có lysozyme đã dẫn đến giảm số lượng bạch cầu và làm tăng số lượng vi khuẩn ở tôm khi cảm nhiễm với Vibrio sp. (Kaizu và cộng sự, 2011). Đây có thể là lý do làm giảm hoạt động của THC và lysozyme ở các nhóm bị nhiễm EHP. Tuy nhiên, các lysozyme không bị vô hiệu hóa hoàn toàn và có thể được biểu hiện khi kích hoạt thành công quá trình thực bào. Các protein lysozyme được tìm thấy đã được điều chỉnh ở tôm nhiễm EHP trong các ao nuôi (Ning và cộng sự, 2019), cho thấy rằng lysozyme có thể được kích hoạt trong những thời điểm muộn hơn khi quá trình lây nhiễm xảy ra. Cơ chế chính xác của EHP trong việc khắc phục lysozyme của tôm vẫn chưa được biết nhưng nhiều lysozyme được cho là có hoạt tính chitinase để phân hủy chitin (thành phần chính của thành bào tử) và tầm quan trọng của chúng trong việc kiểm soát EHP phải được nghiên cứu sâu trong các nghiên cứu trong tương lai.
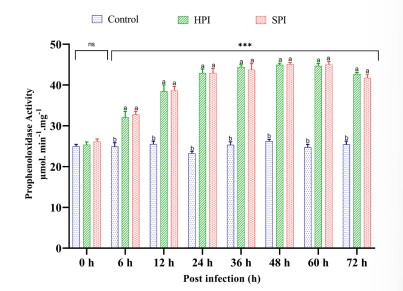
EHP là một ký sinh trùng nội bào bắt buộc thiếu cơ chế sản xuất ATP của riêng nó để đáp ứng đầy đủ nhu cầu năng lượng của nó và vì vậy chúng hoàn toàn phụ thuộc vào vật chủ về nhu cầu năng lượng và dinh dưỡng bắt đầu từ giai đoạn đầu của quá trình nhiễm trùng (Yang và cộng sự, 2021). Khi một sinh vật bị căng thẳng về vật lý, hóa học hoặc sinh học sẽ bị thiếu oxy đột ngột dẫn đến các con đường trao đổi chất bất thường dẫn đến hình thành quá nhiều oxy đơn (O2–) và các gốc tự do (Rabek và Rånby, 1978) được gọi là các loại oxy phản ứng (ROS) được tạo ra bởi trọng lực bùng nổ hô hấp (RBA). Các gốc tự do như anion superoxide (O2-), hydrogen peroxide (H2O2), oxy đơn và gốc hydroxyl (OH–) có tính diệt vi sinh cao và được biết đến là thành phần quan trọng nhất của phản ứng miễn dịch ở động vật giáp xác (Mu˜ noz và cộng sự, 2000). Những ROS này không chỉ độc đối với mầm bệnh xâm nhập mà còn thể hiện tác dụng gây độc tế bào đối với tế bào vật chủ (Forman và Torres, 2001). O2– có thể được SOD chuyển hóa thành H2O2, chất này có thể tiếp tục được chuyển hóa thành H2O bởi catalase, do đó ngăn cản quá trình tổng hợp gốc hydroxyl và góp phần tránh các tác động có hại của ROS (Fridovich, 1998). Trong nghiên cứu này, RBA tăng đáng kể (p <0,05) từ 6 hpi, đạt mức tối đa ở 24 hpi ở nhóm bị nhiễm EHP và mức độ giảm đáng kể (p <0,05) sau 24 hpi so với nhóm đối chứng không bị nhiễm. Những kết quả này cho thấy rằng trong thời gian đầu nhiễm bệnh, EHP đã gây ra stress oxy hóa ở tôm do chúng hấp thụ năng lượng và chất dinh dưỡng từ vật chủ để phát triển. Nhiễm trùng Nosema ceranae ở ong mật làm tăng căng thẳng oxy hóa trong ruột giữa (Aufauvre và cộng sự, 2014; Kurze và cộng sự, 2016). Điều này cho thấy rằng microsporidian có thể thay đổi các quá trình trong vật chủ liên quan đến chuyển hóa năng lượng và phản ứng miễn dịch.
SOD và Catalase được tìm thấy đã bị thay đổi trong quá trình nhiễm EHP để vượt qua stress oxy hóa do nhiễm trùng. Mức SOD tăng lên đáng kể (p <0,05) song song với RBA bắt đầu từ 6 hpi, đạt giá trị đỉnh ở 24 hpi và giảm sau 24 hpi ở nhóm bị nhiễm so với nhóm chứng không bị nhiễm. Ngược lại, mức catalase trong haemolymph được giảm xuống một cách có ý nghĩa (p <0,05) đều đặn từ 6 hpi xuống 72 hpi. Những kết quả này cho thấy rằng sự gia tăng hoạt động SOD và giảm RBA sau 24 hpi có thể là do sự gia tăng mức độ anion superoxide và các gốc tự do khác trong quá trình oxy hóa. Những kết quả này được hỗ trợ bởi những phát hiện trước đây khi hoạt động SOD giảm ở P. monodon bị nhiễm WSSV so với ở những động vật đối chứng không bị nhiễm (Lin, 1998; Chang và cộng sự, 2003). Các gốc O2– và OH– làm bất hoạt SOD dẫn đến làm mất hoạt tính của enzym (Escobar và cộng sự, 1996). Nghiên cứu này cũng ghi nhận mức độ catalase thấp hơn trong haemolymph. Có vẻ như hoạt động gia tăng của SOD có thể được sản xuất quá mức các hợp chất hydrogen peroxide từ ROS có thể tự trở thành chất độc đối với tế bào chủ và catalase có trong bạch huyết có thể được sử dụng để chuyển hóa H2O2 dư thừa này thành H2O. Một nghiên cứu của Mohankumar và Ramasamy. (2006) đã chứng minh rằng sự lây nhiễm WSSV trong thực nghiệm đã làm giảm hoạt động của SOD và Catalase để phản ứng với stress oxy hóa do mầm bệnh gây ra ở Fenneropenaeus sp. Nghiên cứu hiện tại đã xác nhận sự xuất hiện của một cơ chế tương tự ở Tôm thẻ chân trắng bị nhiễm EHP. Các chất chống oxy hóa có thể đóng một vai trò trong việc bảo vệ các tế bào vật chủ khỏi stress oxy hóa do EHP gây ra, đây có thể là lý do làm giảm tỷ lệ chết ở tôm bị nhiễm EHP khiến chúng đói dinh dưỡng và năng lượng khi bị ký sinh trùng xâm nhập dẫn đến khả năng miễn dịch kém và chậm phát triển như một hiệu quả lâm sàng chính. Hiểu biết về khả năng miễn dịch của vật chủ ở Tôm thẻ chân trắng trong quá trình nhiễm EHP thử nghiệm sẽ rất hữu ích để phát triển các biện pháp dự phòng miễn dịch nhằm giảm tác động tiêu cực do EHP gây ra trên vật chủ. Có một số báo cáo về việc sử dụng các chất kích thích miễn dịch ở tôm để tạo ra các chỉ số miễn dịch không đặc hiệu như THC, PPO, SOD, RBA, hoạt động của Lysozyme như một phương tiện bảo vệ chống lại nhiễm trùng (Apines-amar và Amar, 2015).
Nghiên cứu hiện tại làm sáng tỏ các phản ứng miễn dịch đầu tiên xảy ra trên Tôm thẻ chân trắng trong quá trình nhiễm EHP. Kết quả cho thấy nhiễm EHP dẫn đến tăng stress oxy hóa (RBA) bắt đầu từ 6 hpi được chống lại bởi SOD và CAT bắt đầu từ 6 giờ và 24 giờ tương ứng để bảo vệ tế bào chủ khỏi bị tổn thương do oxy hóa như vậy. Biểu hiện gen Toll được kích hoạt như một phản ứng sớm khi EHP tương tác với vật chủ và kích hoạt hệ thống prophenoloxidase và các tế bào hồng cầu di chuyển đến vị trí nhiễm trùng để chống lại EHP xâm nhập từ 6 hpi. Mặc dù các phản ứng thích hợp đã được kích hoạt, nhưng có vẻ như chúng không đủ hiệu quả để loại bỏ EHP.
Mặt khác, các lysozyme hoạt động từ bên trong tế bào hồng cầu dường như đã bị vô hiệu hóa bởi EHP hoặc thậm chí có thể không được giải phóng khỏi các tế bào máu do các tế bào hồng cầu không thể tự phân hủy hoặc không có khả năng thực bào ký sinh giữa các tế bào khi mức độ giảm từ 24 hpi. Mặc dù thực tế là có nhiều chiến lược được vật chủ sử dụng để chống lại bất kỳ sự lây nhiễm nào, nhưng các vi mạch có thể xâm nhập vào các tế bào biểu mô của vật chủ, vì quá trình tăng sinh của chúng liên quan đến việc hình thành các giai đoạn trước có màng bao bọc (Troemel và cộng sự, 2008). Việc nhiễm EHP trong thực nghiệm đã gây ra nhiễm trùng nặng cho tôm vì chúng được phát hiện ở bước đầu tiên PCR dương tính với EHP ở 72 hpi. Điều này có thể là do các microsporidians có khả năng sử dụng nhiều loại protein được tiết ra và bề mặt để tương tác với các tế bào chủ và thao túng chúng (Cuomo và cộng sự, 2012).
Bảng 3 Thử nghiệm ảnh hưởng giữa các đối tượng và so sánh nhiều đối tượng cho các thông số miễn dịch được phân tích trong nghiên cứu này.
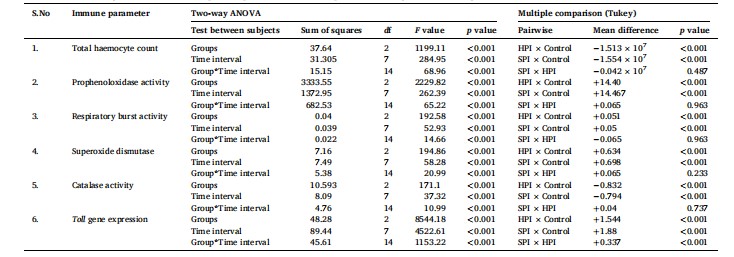
Hình 2. Tổng số lượng hồng cầu ở Tôm thẻ chân trắng sau khi thực nghiệm nhiễm EHP.
Biểu đồ thanh đứng thể hiện giá trị trung bình ± SD của ba lần lặp lại trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC khác nhau đáng kể giữa các nhóm (SPI, HPI và Controls) tại các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p <0,05). ns không thể hiện sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể.
Hình 3. Hoạt động của prophenoloxidase ở Tôm thẻ chân trắng sau khi thực nghiệm nhiễm EHP.
Biểu đồ thanh dọc thể hiện giá trị trung bình ± SD của ba bể đại diện trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC thực sự khác nhau giữa các nhóm (SPI, HPI và Controls) tại các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p <0,05). ns không có sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể được đánh giá chính xác
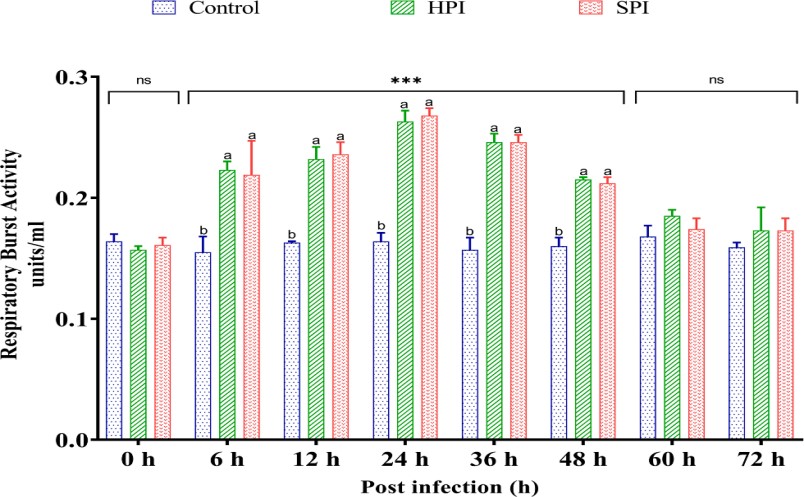
Hình 4. Hoạt động bùng phát hô hấp ở Tôm thẻ chân trắng sau khi thực nghiệm nhiễm EHP.
Biểu đồ thanh dọc thể hiện giá trị trung bình ± SD của ba bể đại diện trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC thực sự khác nhau giữa các nhóm (SPI, HPI và nhóm đối chứng) tại các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p <0,05). ns không có sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể.
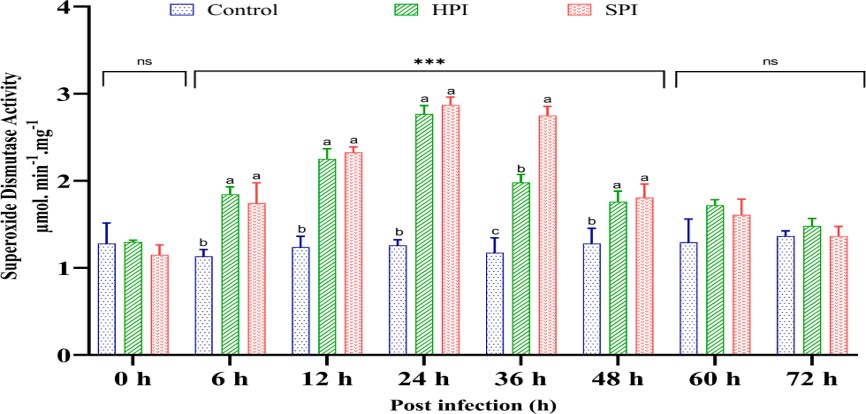
Hình 5. Hoạt động của Superoxide dismutase ở Tôm thẻ chân trắng sau khi thực nghiệm với EHP.
Biểu đồ thanh đứng thể hiện giá trị trung bình ± SD của ba bể lặp lại trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC khác nhau đáng kể giữa các nhóm (SPI, HPI và các đối chứng) ở các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p < 0,05). ns không có sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể.
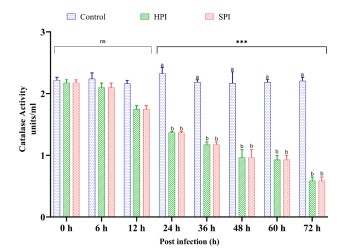
Hình 6. Hoạt động của catalase ở Tôm thẻ chân trắng sau khi thực nghiệm nhiễm EHP.
Biểu đồ thanh đứng thể hiện giá trị trung bình ± SD của ba bể lặp lại trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC khác nhau đáng kể giữa các nhóm (SPI, HPI và các đối chứng) ở các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p <0,05). ns không thể hiện sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể.
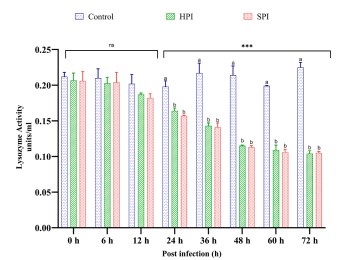
Hình 7. Hoạt động của Lysozyme ở Tôm thẻ chân trắng sau khi thực nghiệm nhiễm EHP.
Biểu đồ thanh đứng thể hiện giá trị trung bình ± SD của ba bể lặp lại trên mỗi bể (n = 3). Dấu hoa thị (***) cho biết sự hiện diện của THC khác nhau đáng kể giữa các nhóm (SPI, HPI và các đối chứng) ở các khoảng thời gian khác nhau được xác định bằng phân tích tác động chính đơn giản (p <0,05). ns không thể hiện sự khác biệt đáng kể giữa các nhóm. Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể (p <0,05) giữa các nhóm tại một khoảng thời gian cụ thể.
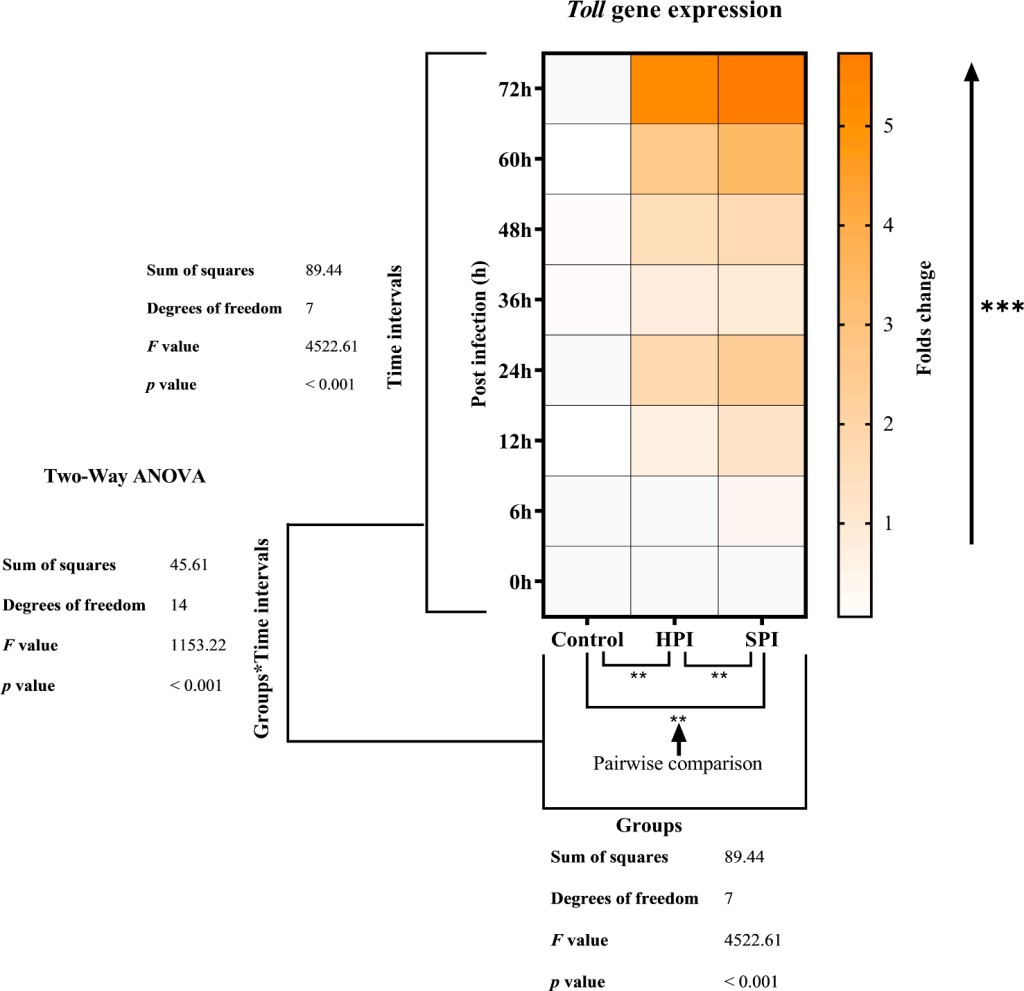
Hình 8: Biểu hiện của các gen Toll của tôm thẻ chân trắng sau khi cho nhiễm EHP. Bảng đồ nhiệt cho thấy biển hiện của các gen Toll về mặt thay đổi nếp fold (Cuối cùng – ban đầu/ban đầu). Sự khác biệt của 2 ảnh hưởng chính (Nhóm và Khoảng thời gian) và tương tác (Nhóm * Khoảng thời gian) đã được ANOVA phân tích hai chiều. Các ảnh hưởng chính đơn giản (***) chỉ ra sự hiện diện của các quy định khác nhau đáng kể (p <0,05) của các gen Toll giữa mỗi nhóm tại các khoảng thời gian khác nhau. Các phép so sánh nhiều lần của Tukey cho thấy sự khác biệt từng cặp giữa mỗi nhóm trong các khoảng thời gian ở mức ý nghĩa 0,05 (**). Các bảng chữ cái khác nhau (a, b, c) trên các thanh cho thấy sự khác biệt đáng kể giữa các nhóm tại một khoảng thời gian cụ thể (p<0,05).
4/ Kết luận
Đây là nghiên cứu tài liệu đầu tiên cung cấp thông tin cơ bản về các phản ứng miễn dịch ở Tôm thẻ chân trắng trong quá trình nhiễm EHP thực nghiệm. Những kết quả này có thể giúp phát triển các biện pháp dự phòng miễn dịch để tạo ra khả năng miễn dịch bẩm sinh hoặc không đặc hiệu để chống lại sự lây nhiễm EHP ở Tôm thẻ chân trắng.
Nhóm tác giả: Palaniappan Subasha, Arumugam Uma a, b, *, Baboonsundaram Ahilana
Biên dịch: Minh Nhựt – Tôm giống gia hoá Bình Minh.
Từ khóa: EHP, Microsporidians, phản ứng miễn dịch ở tôm, Enterocytozoon hepatopenaei, bệnh tôm
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Phần 1-Các Phản Ứng Sớm Của Tôm Thẻ Chân Trắng Trong Thực Nghiệm Cho Nhiễm Vi Bào Tử Trùng Enterocytozoon Hepatopenaei (EHP) Bằng Đường Tiêm Và Đường Uống
- Thức ăn thay thế Artemia được ra mắt ở Ấn Độ
- Phụ Phẩm Tái Chế Từ Thức Ăn Chăn Nuôi Có Tiềm Năng Dinh Dưỡng Trong Nuôi Trồng Thủy Sản

 English
English