TÓM TẮT
Bệnh vi bào tử trùng gây ra bởi Enterocytozoon hepatopenaei (EHP) gây ra thiệt hại nghiêm trọng trong nuôi tôm thẻ chân trắng. Các phản ứng ban đầu ở Tôm thẻ chân trắng bị nhiễm EHP bằng thực nghiệm đã được đánh giá trong nghiên cứu này bằng cách cho ăn mô gan tụy bị nhiễm bệnh và bằng cách tiêm các bào tử EHP tinh sạch (~1 × 105 bào tử / tôm). Các phản ứng miễn dịch đối với nhiễm EHP được đánh giá trên haemolymph bằng cách phân tích tổng tế bào máu (THC), hoạt động của superoxide dismutase (SOD), hoạt động propnoloxidase (proPO), hoạt động bùng nổ hô hấp (RBA), hoạt động catalase (CAT), hoạt động lysozyme (LYS) và biểu hiện gen Toll trong gan tụy ở 0, 6, 12, 24, 36, 48, 60 và 72 giờ sau khi nhiễm bệnh (hpi). Thực nghiệm nhiễm EHP dẫn đến giảm đáng kể (p <0,05) các thông số miễn dịch như THC, CAT và LYS lần lượt ở 6, 24 và 24 hpi trong khi mức độ SOD, proPO tăng đáng kể (p <0,05). và RBA ở 6 hpi. Sự biểu hiện của gen Toll được điều chỉnh đáng kể (p <0,05) sau thực nghiệm nhiễm EHP từ 6 hpi. Những phát hiện về phản ứng miễn dịch này ở Tôm thẻ chân trắng trong quá trình nhiễm EHP sẽ hỗ trợ việc phát triển các biện pháp quản lý phù hợp để giảm tác động tiêu cực của EHP trong nuôi Tôm thẻ chân trắng. Đây là báo cáo đầu tiên về các phản ứng sớm ở Tôm thẻ chân trắng khi nhiễm EHP.
1/ Giới thiệu
Tôm thẻ chân trắng là loài giáp xác được nuôi rộng rãi nhất, đóng góp khoảng 50,3% tổng sản lượng giáp xác (9,862 tấn) và 6% tổng sản lượng nuôi trồng thủy sản thế giới (82,095 tấn). Sự thâm canh hóa trong nuôi tôm thẻ chân trắng để đáp ứng với nhu cầu ngày càng tăng về tôm đã dẫn đến một số bệnh do các mầm bệnh đa dạng như virus, vi khuẩn, nấm và ký sinh trùng gây ra. Chúng tác động tiêu cực đến việc nuôi và sản xuất tôm thẻ chân trắng ở Mỹ, Trung Quốc, Ấn Độ và nhiều nước châu Á (Subasinghe, 2017).
Enterocytozoon hepatopenaei (EHP) là một loại vi bào tử trùng gây ra bệnh trên gan tụy ở Tôm thẻ chân trắng, dẫn đến chậm phát triển và giảm sản lượng nghiêm trọng trong nuôi trồng (Tourtip và cộng sự, 2009; Ha và cộng sự, 2010; Flegel, 2012; Tangprasittipap và cộng sự, 2013; Liu và cộng sự, 2015; Tang và cộng sự, 2016; Rajendran và cộng sự, 2016; Gir-idharan và Uma, 2017). EHP được biết là lây nhiễm vào gan tụy của tôm, nơi đóng vai trò là tuyến tiêu hóa chính (ruột giữa) tiết ra các enzym tiêu hóa, hấp thụ các sản phẩm đã tiêu hóa và duy trì trữ lượng khoáng chất (Díaz và cộng sự, 2010). Do đó, nhiễm EHP ảnh hưởng đến các chức năng tiêu hóa và hấp thu, dẫn đến tăng trưởng kém và suy giảm khả năng miễn dịch (Otta và cộng sự, 2016). Tuy nhiên, dữ liệu về phản ứng miễn dịch đối với nhiễm EHP ở Tôm thẻ chân trắng còn hạn chế.
Cơ chế bảo vệ không đặc hiệu hoặc do bẩm sinh đóng vai trò chính trong việc bảo vệ tôm chống lại sự lây nhiễm bao gồm, tổng tế bào máu (THC), hoạt động của men propnoloxidase (proPO), hoạt động hô hấp (RBA), hoạt động superoxide dismutase (SOD), catalase, thực bào, kết dính, melanin hóa, hình thành nốt sần, peptide kháng khuẩn, glutathione, hoạt động của lysozyme, v.v., (Johansson và Soder- hall, 1989; Warner, 1994; Fridovich, 1998; Broderick và cộng sự, 2009; Coate năm 2021). Tất cả các thông số miễn dịch không đặc hiệu này dựa vào các mẫu phân tử liên quan đến mầm bệnh (PAMP) được phát hiện bởi PRR (Cơ quan nhận biết mẫu) của tôm. Các thụ thể Toll được công nhận là PRR chính, đóng một vai trò thiết yếu trong việc nhận biết hệ vi sinh và tạo ra các phản ứng miễn dịch không đặc hiệu trong quá trình bảo vệ vật chủ (Akira và cộng sự, 2001; Beutler, 2004; Uma và cộng sự, 2012; Dechamma và cộng sự, 2015). Ở tôm, gen thụ thể Toll được xác định có vai trò trong việc kích hoạt khả năng miễn dịch bẩm sinh chống lại phân tử ngoại lai (Yang và cộng sự, 2008).
Vai trò của gen Toll ở tôm đã được nghiên cứu rộng rãi về các bệnh quan trọng như virus gây hội chứng đốm trắng (WSSV) (Deepika và cộng sự, 2014), Vibrio harveyi (Dechamma và cộng sự, 2015), Bệnh hoại tử gan tụy cấp tính (AHPND) (Boonchuen và cộng sự, 2021) và ngay cả ở virus gây ánh kim hồng cầu (SHIV) mới xuất hiện (Liu và cộng sự, 2021). Tuy nhiên, sự biểu hiện của các gen Toll trong quá trình nhiễm EHP ở tôm vẫn chưa được báo cáo cho đến nay.
Thí nghiệm về sự lây nhiễm ở tôm thẻ chân trắng khỏe mạnh với EHP đã được chứng minh bằng nhiều nghiên cứu khác nhau, như cho tôm khỏe mạnh sống chung với tôm bị nhiễm EHP (Tang và cộng sự, 2016); cho tôm khỏe ăn gan tụy nhiễm EHP (Santhoshkumar và cộng sự, 2016); ngâm Post khỏe mạnh trong mô động vật bị nhiễm EHP đồng nhất (Karthikeyan và Sud- hakaran, 2019); tiêm trực tiếp mô nhiễm EHP đồng nhất vào HP và tiêm ngược qua lỗ hậu môn của tôm (Mai và cộng sự, 2020); cho ăn với dây phân bị nhiễm EHP (Aranguren Caro và cộng sự, 2021); cho ăn với giun nhiều tơ bị nhiễm EHP (Krishnan và cộng sự, 2021) và cho ăn các bào tử EHP đã tinh sạch (Munkongwongsiri và cộng sự, 2021). Các phản ứng của Tôm thẻ chân trắng trong quá trình thử nghiệm với EHP đã được ghi nhận dựa trên những thay đổi sinh hóa như AST, ALT và hoạt động của AP (Santhoshkumar và cộng sự, 2016) và sự biểu hiện của các gen miễn dịch khác nhau như proph-enoloxidase, superoxide dismutase và các gen crushtin ở Tôm thẻ chân trắng nhiễm EHP (Karthikeyan và Sudhakaran, 2019). Do có rất ít thông tin về các phản ứng của vật chủ đối với nhiễm EHP nên trong nghiên cứu này, vật chủ phản ứng miễn dịch ở Tôm thẻ chân trắng trong quá trình nhiễm EHP thực nghiệm được nghiên cứu dựa trên các xét nghiệm miễn dịch học và biểu hiện gen Toll.
2/ Vật liệu và phương pháp
2.1 Các mẫu tôm thẻ chân trắng
Tôm thẻ chân trắng (9 ± 1 g) với các dấu hiệu lâm sàng nhiễm EHP, chậm phát triển, thay đổi kích thước, phân trắng và vỏ lỏng lẻo được thu thập từ một trang trại nuôi tôm ở quận Tiruvallur (13◦21′ 36,0′ ′N, 80◦17′ 06.0′ ′E), Tamil Nadu, Nam Ấn Độ và được vận chuyển trực tiếp đến phòng thí nghiệm trong túi nhựa có sục khí. Tôm thẻ chân trắng khỏe mạnh (10 ± 1 g) cũng được thu thập từ một trang trại nuôi tôm ở quận Tiruvallur, Nam Ấn Độ (13◦ ′ 19,2′ ′N, 80◦13′ 51,6′ ′E) và vận chuyển đến phòng thí nghiệm để thử nghiệm nghiên cứu. Khi đến phòng thí nghiệm, tôm được gây mê bằng cách ngâm trong nước đá, các mô đích được mổ vô trùng để sàng lọc EHP và các bệnh khác được liệt kê của OIE trên tôm (Bảng 1) (OIE, 2016). Gan tụy của tôm nhiễm EHP được thu thập và xử lý để phân lập bào tử EHP sử dụng cho quá trình thử nghiệm lây nhiễm.
2.1 Chiết xuất axit nucleic
Các mô đích được đồng nhất riêng lẻ trong đệm NTE (0,02 M EDTA, 0,2 M NaCl, và, 0,02 M Tris – HCl, pH 7,4) và huyền phù đồng nhất mô 10% được tạo trong ống ly tâm 1,5 mL. Sau đó, huyền phù được ly tâm ở 3000 g trong 15 phút ở 4◦C và phần nổi phía trên được thu thập trong một ống riêng biệt. Phần nổi phía trên sau đó được trộn với một thể tích đệm phân hủy bằng nhau (100 mM NaCl, 50 mM EDTA, pH 8,0, 10 mM Tris – HCl, pH 8,0, 5% natri dodecyl sulphat và 0,1 mg mL 1 proteinase K) và ủ ở 65◦C trong 2 giờ. Các mô phân hủy sau đó được khử protein bằng cách chiết liên tiếp với rượu phenol / chloroform / isoamyl và DNA được thu hồi bằng kết tủa ethanol, làm khô, lơ lửng trong nước không có nuclease và được sử dụng làm mẫu cho xét nghiệm PCR. Độ tinh khiết (A 260/280 ~ 1,8) và số lượng (10 ng) của DNA được xác định bằng cách sử dụng Nanodrop Onec (Thermo Fisher).
Tổng số RNA được chiết xuất bằng cách sử dụng một bộ công cụ thương mại (NucleoSpin RNA Postus, Takara Bio Inc.) để sàng lọc các virus RNA được liệt kê trong OIE và cho nghiên cứu biểu hiện gen Toll. Mô gan tụy của tôm đối chứng khỏe mạnh và bị nhiễm EHP được thu thập ở 0, 6,12, 24, 36, 48, 60 và 72 hpi được sử dụng để tách chiết RNA. Định lượng RNA được thực hiện bằng cách sử dụng Nanodrop Onec(Thermo Fisher Scientific, USA). Khoảng 2 µg RNA tổng số từ các mẫu được phiên mã riêng biệt bằng cách sử dụng Bộ tổng hợp cDNA Revert Aid First Strand (Thermo Fisher Scientific, Hoa Kỳ).
2.3 Tinh sạch bào tử EHP từ mô gan tụy
Việc tinh lọc và cô đặc bào tử microsporidian từ gan tụy của tôm nhiễm EHP được thực hiện bằng phương pháp ly tâm gradient mật độ theo quy trình được mô tả bởi Aldama-Cano và cộng sự, (2018), lơ lửng trong dung dịch đệm muối photphat (137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 1,8 mM KH 2PO4, pH 7,4) và được bảo quản ở nhiệt độ phòng như giống gốc ban đầu. Nồng độ của bào tử được xác định bằng máy đo huyết cầu và được điều chỉnh để thành chất gốc ~ 1 × 108 bào tử/ml. Khả năng tồn tại của bào tử tinh sạch được xác định bằng thử nghiệm đùn ống phân cực (Aldama-Cano và cộng sự, 2018), Một cách ngắn gọn, 2 µ L huyền phù bào tử được ủ với 10 µL dung dịch Phloxine B 2% (w / v) và 10 µ L natri cacboxymetyl xenluloza (0,1% w / v trong nước cất vô trùng) trên lam kính hiển vi trong 10 phút ở nhiệt độ phòng (250C). Các bào tử được quan sát dưới kính hiển vi ánh sáng (Olympus) trong ba lần lặp lại để đếm các bào tử đùn ra. Trung bình “đùn” ống phân cực (%) được tính bằng cách đếm số lượng bào tử đùn ra trong tổng số 100 bào tử. Các lô bào tử có > 70% số bào tử còn sống (trước khi sử dụng để gây nhiễm thực nghiệm) được chọn cho nghiên cứu.
2.4 PCR lồng để khuếch đại EHP
PCR của EHP được thực hiện theo quy trình của Jaroenlak và cộng sự (2016). Bước đầu tiên khuếch đại PCR được thực hiện bằng cách sử dụng mồi SWP_1F và SWP_1R với biến tính ban đầu ở 95◦C trong 5 phút, sau đó là 30 chu kỳ biến tính ở 95◦C trong 30 s, ủ ở 58◦C trong 30s, kéo dài ở 68◦C trong 45 s và độ giãn cuối cùng ở 68◦C trong 5 phút. PCR lồng nhau được thực hiện với các sản phẩm PCR bước đầu tiên (1 μL) sử dụng mồi SWP_2F và SWP_2R với biến tính ban đầu ở 95◦C trong 5 phút sau đó là 20 chu kỳ biến tính ở 95◦C trong 30 s, ủ ở 64◦C trong 30 s và kéo dài ở 68◦C trong 20s và kéo dài cuối cùng ở 68◦C trong 5 phút. Các sản phẩm khuếch đại PCR được phân giải bằng điện di trên gel agarose trong gel agarose 1,5%. Khoảng 10 μL sản phẩm PCR khuếch đại được nạp trong gel agarose 1,5% cùng với chất đánh dấu trọng lượng phân tử 100 bp (New England Biolabs, Hoa Kỳ). Các sản phẩm được điện di ở 120 V trong 30 phút trong thiết bị điện di gel (BioRad, Hoa Kỳ), được xem và ghi lại trong hệ thống tài liệu gel UV (BioRad, Hoa Kỳ) cho các dải PCR khuếch đại ở 514 bp (bước đầu) và 148 bp (bước lồng)
Bảng 1 Các mô mục tiêu được chọn để sàng lọc bệnh được liệt kê theo OIE trong các mẫu tôm thu thập.
| STT | Bệnh | Mục đích | Kết quả PCR |
| 1 | Enterocytozoon hepatopenaei (EHP) | Gan tụy | Dương tính |
| 2
|
Bệnh hoại tử gan tụy cấp tính (AHPND) | Các mô liên quan đến gan tụy và ruột | Âm tính
|
| 3 | Virus đầu vàng (YHV) | Cơ quan bạch huyết, ruột | Âm tính |
| 4 | Virus hoại tử cơ tạo máu và cơ quan biểu mô (IHHNV) | Mang | Âm tính
|
| 5 | virus gây hoại tử cơ (IMNV) | Cơ | Âm tính |
| 6 | Nhiễm vi khuẩn gan tụy hoại tử (NHP) | Gan tụy | Âm tính |
| 7 | virus hội chứng Taura (TSV) | Cơ, mang, cơ quan bạch huyết | Âm tính |
| 8 | Hội chứng đốm trắng (WSSV) | Mang, Pereopods | Âm tính |
2.5 Nghiên cứu thử nghiệm nhiễm trùng
Tôm thẻ chân trắng khỏe mạnh đã được duy trì và thuần hóa trong hai tuần tại các cơ sở phòng thí nghiệm nhà nước về sức khỏe động vật thủy sản của Tamil Nadu Tiến sĩ J. Jayalalithaa Đại học Thủy sản với sục khí và cho ăn thích hợp (thức ăn CP).
Ba nhóm, cụ thể là HPI (nuôi bằng mô gan tụy nhiễm EHP), SPI (tiêm bào tử EHP tinh khiết), đối chứng (tôm đối chứng được nuôi bằng mô gan tụy không bị nhiễm / tiêm PBS) gồm 40 con, mỗi con được duy trì trong hồ nhựa (45- L) với 3 lần lặp. Khi bắt đầu thử nghiệm, đối với nhóm HPI cho ăn bằng miệng, mỗi con tôm được cho ăn mô gan tụy bị nhiễm EHP (~ 1 × 105 bào tử / g) với tỷ lệ 10% trọng lượng cơ thể tươi. Đối với thử nghiệm nhiễm trùng bằng cách tiêm trong nhóm SPI, mỗi con tôm được tiêm 1 µ L huyền phù bào tử EHP (~ 1 × 105 bào tử) pha loãng trong PBS (50 µ L) trực tiếp vào xoang bụng bằng cách sử dụng 1 mL ống tiêm (kim loại 25 viên). Nhóm đối chứng được tiêm một lượng PBS bằng nhau (50 µ L) hoặc cho ăn gan tụy chưa nhiễm bệnh (1 g / con). Tôm trong tất cả các nhóm được duy trì và cho ăn bằng thức ăn công nghiệp (thức ăn CP). Khoảng năm con tôm được chọn ngẫu nhiên từ tất cả ba đại diện của HPI, SPI và nhóm Đối chứng để thu thập mẫu haemolymph và gan tụy ở 0, 6, 12, 24, 36, 48, 60 và 72 hpi để phân tích miễn dịch các thông số và tỷ lệ nhiễm EHP.
Haemolymph được thu thập từ xoang của phần đầu ngực bằng cách sử dụng một ống tiêm 2 mL với một kim cỡ 26 có chứa 100 µ L dung dịch chống đông máu (100 mM glucose, 30 mM trinatri citrat, 26 mM axit xitric, 510 mM NaCl và 10 mM EDTA.Na 2: pH = 7,3) (Vargas- Albores và cộng sự, 1993). Gan tụy được mổ vô trùng từ tất cả các nhóm và cố định trong etanol 90% cho PCR và ở Trizol (Invi- trogen, Hoa Kỳ) để đánh giá biểu hiện gen Toll.
2.6 Đáp ứng miễn dịch ở Tôm thẻ chân trắng bị nhiễm EHP trong thực nghiệm
2.6.1 Tổng tế bào máu (THC)
Mẫu haemolymph (100 μL) được lấy trong ống ly tâm siêu nhỏ, được cố định với một thể tích tương đương của chất cố định haemolymph (10% formalin trong 0,45 M NaCl) và để yên trong 10 phút. Khoảng 20 μL huyền phù bạch cầu cố định được chuyển sang một ống ly tâm siêu nhỏ mới có chứa cùng một thể tích dung dịch Rose Bengal (1,2% Rose Bengal trong 50% ethanol) để nhuộm hồng cầu và ủ ở nhiệt độ môi trường trong 20 phút. Tổng số hồng cầu được đếm trong 5/25 ô vuông trên một buồng đếm tế bào Neubauer cải tiến (Thể tích ô vuông = 0,2× 0,2 × 0,1 mm3) trong ba lần (Ananda Raja và cộng sự, 2012).
2.6.2 Hoạt tính của prophenoloxidase (proPO)
Hoạt tính của proPO được đo bằng quang phổ (trong ba lần) bằng cách ghi lại sự hình thành dopachrome từ L-dihydrox- yphenylalanine (L-DOPA) (Gollas-Galv´ an và cộng sự, 1999). Hỗn dịch tế bào (100 μL) được ủ trước với 50 μL laminarin (1 mg /ml trong đệm cacodylate) hoặc chỉ với đệm cacodylate trong trường hợp đối chứng, trong 1 giờ ở 20◦C trước khi thêm 50 μL L -DOPA (3 mg / mL trong đệm cacodylate). Sau khi ủ, 800 μL đệm cacodylate được thêm vào và phản ứng được phép tiến hành trong 10 phút ở 20◦C, tiếp theo là đo độ hấp thụ ở bước sóng 490 nm trong đầu đọc ELISA (BioTek, Hoa Kỳ)
2.6.3 Hoạt tính bùng nổ hô hấp (RBA)
Hoạt tính bùng nổ hô hấp được đánh giá theo phương pháp của Anderson và Siwiki (1995). Khoảng 100 μL mẫu haemolymph được ủ với một thể tích tương đương của dung dịch NBT 0,2% trong 30 phút ở nhiệt độ phòng. Khoảng 50 μL huyền phù NBT haemolymph được thêm vào với N, N-dimethyl formamide (DMF) (1 mL) và được ly tâm (Eppendorf 5810R) ở 5.000 vòng / phút trong 5 phút. Phần nổi phía trên được đánh giá riêng biệt và độ hấp thụ được đo ở bước sóng 540 nm,
2.6.4 Hoạt tính của Superoxide dismutase (SOD)
Để đánh giá hoạt tính của SOD (Campa-C´ ordova và cộng sự, 2002), khoảng 40 μL mẫu haemolymph được pha loãng với 10 thể tích nước muối đệm phosphat (PBS) và ly tâm (Eppendorf 5810R) ở 6000 g, 4◦C trong 7 phút. Phần nổi phía trên sau đó được làm nóng ở 65◦C trong 5 phút trong nồi cách thủy để thu được dịch chiết thô SOD. Khoảng 150 μL dịch chiết thô SOD được thêm vào với 50 μL thuốc thử Nitro blue tetrazolium (NBT) và ủ trong 2 phút. Mật độ quang học được đo ở bước sóng 630 nm bằng đầu đọc ELISA (BioTek, Hoa Kỳ).
2.6.5 Hoạt tính của catalase
Để đánh giá hoạt tính của catalase (Takahara và cộng sự, 1960), khoảng 2,5 mL dung dịch đệm phosphat và 0,5 μL haemolymph đã được trộn và phản ứng enzyme được bắt đầu bằng cách thêm 1,0 mL dung dịch hydrogen peroxide. Những thay đổi về độ hấp thụ được theo dõi ở bước sóng 240 nm cứ sau 30 s đến 3 phút để đánh giá hoạt tính của enzym.
2.6.6 Hoạt tính của Lysozyme
Hoạt tính của Lysozyme được phân tích theo phương pháp được mô tả bởi Ellis (1990). Khoảng 100 μL haemolymph được bổ sung cho Micrococcus lysodeikticus (Sigma) lơ lửng (0,15 mg / mL) trong dung dịch đệm natri phosphat 0,02 M ở nhiệt độ phòng. Độ hấp thụ của mẫu được đo trong khoảng từ 0,5 đến 4,5 phút bằng máy đo quang phổ (590 nm). Một đơn vị hoạt độ lysozyme được tính bằng lượng haemolymph làm giảm độ hấp thụ 0,001 phút-1.
2.6.7 Phiên mã ngược định lượng-PCR (qRT-PCR)
Biểu hiện gen Toll được đánh giá theo các đoạn mồi và hướng dẫn của Dechamma và cộng sự (2015) (Bảng 2). QRT-PCR được hình thành trong thiết bị PCR thời gian thực cảm ứng Bio-Rad CFX96 (Bio-Rad, Hoa Kỳ) với tổng thể tích phản ứng là 15 µ L chứa 8 µ L hỗn hợp tổng thể xanh SYBR (TB Green TM premix EX Taq TM ll) (Takara, Nhật Bản), 2,5 µ L mồi thuận, 2,5 µ L mồi ngược, 2 µ L enzyme Taq và 1 µ L mẫu cDNA (6 µ g / µ L). Khuếch đại PCR được thực hiện với biến tính ban đầu ở 95◦C trong 3 phút; tiếp theo là 40 chu kỳ điều chỉnh ở 95◦C trong 30 s; ủ ở 60◦C trong 20 s; kéo dài ở 72◦C trong 30 s tiếp theo là kéo dài cuối cùng ở 72◦C trong 4 phút. Phương pháp so sánh 2-ΔΔCT(Livak và Schmittgen, 2001) được thực hiện để phân tích mức độ biểu hiện của gen Toll.
2.7 Phân tích thống kê
Tất cả dữ liệu trong nghiên cứu này được phân tích bằng IBM SPSS 26 (SPSS Inc.). Dữ liệu (N = 27) được kiểm tra tính chuẩn bằng phép thử Shapiro-Wilk và được coi là có phân phối chuẩn khi p> 0,05. Thống kê mô tả (Giá trị trung bình và độ lệch chuẩn) đã được tính toán cho tất cả các tham số. Ảnh hưởng của hai yếu tố (Các biến độc lập) cụ thể là nhóm (HPI, SPI và Controls), khoảng thời gian (0, 6, 12, 24, 36, 48, 60 và 72 hpi) và tương tác (nhóm × khoảng thời gian) trên biến phụ thuộc (Các thông số miễn dịch) được xác định bằng ANOVA hai chiều. Phân tích hiệu ứng trung bình đơn giản được thực hiện để phát hiện sự hiện diện của sự khác biệt có ý nghĩa giữa các nhóm trong các khoảng thời gian khác nhau (p <0,05). Kiểm định Tukey cho nhiều phép so sánh với mức ý nghĩa p <0,05 được sử dụng để so sánh sự khác biệt giữa ba nhóm thử nghiệm (HPI × Đối chứng, SPI× Đối chứng và SPI × HPI) so với biến phụ thuộc (thông số miễn dịch).
Bảng 2 Các đoạn mồi được sử dụng để phát hiện biểu hiện gen Toll.
| Toll mồi gen | Trình tự (5 ′ đến 3 ′) | (Tham chiếu) |
| Chuyển tiếp
Ngược |
AGTCCCAAGCGGTGATGTG
AGGGAGTCCAAGTGCCATTCT |
Dechamma và cộng sự. (2015) |
3/ Kết quả
3.1 Thực nghiệm lây nhiễm
Những con tôm bị nhiễm EHP thử nghiệm bằng cách cho ăn bằng cả đường uống (HPI) và tiêm vào xoang bụng các bào tử EHP tinh khiết (SPI) được phát hiện là dương tính yếu (PCR lồng dương tính) với EHP ở 24 hpi. Những con tôm được quan sát là bị nhiễm nặng ở 72 hpi vì chúng được PCR ở bước đầu tiên dương tính với EHP. Cả hai nhóm HPI và SPI đều có tỷ lệ nhiễm tương tự nhau (100%) vì tất cả các mẫu tôm (5/5) đều được xét nghiệm dương tính với EHP bằng PCR (Hình 1).
3.2 Các xét nghiệm miễn dịch học
3.2.1 Tổng số lượng bạch cầu
Giá trị THC trong các nhóm SPI và HPI bị nhiễm- rõ ràng là (p <0,05) giảm so với các nhóm đối chứng từ 6 đến 72 hpi khi được xác định bởi ANOVA hai chiều (các nhóm * khoảng thời gian – F (12,48) = 68,96, P <0,001), phân tích các tác động chính đơn giản (p <0,05) và kiểm định Tukey để so sánh trung bình (p <0,05) (Bảng 3). Giảm tối đa 47% THC ở 72 hpi với EHP trong các nhóm bị nhiễm. Không có thay đổi đáng kể nào về THC được quan sát thấy ở tôm đối chứng (Hình 2).
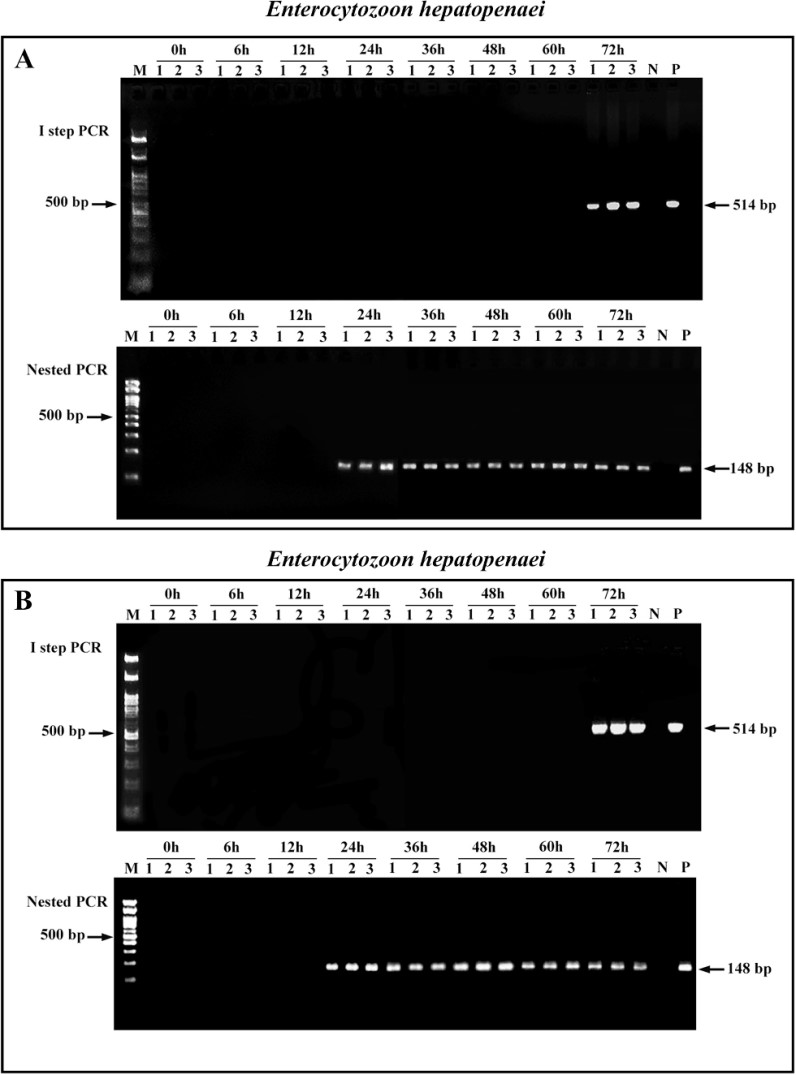
Hình 1. Điện di Gel Agarose các sản phẩm PCR của tôm nhiễm EHP.
A.Các sản phẩm khuếch đại PCR thu được từ PCR 01 bước (gel trên) và PCR lồng (gel dưới) của nhóm SPI tại mỗi thời điểm cho thấy sự khuếch đại có thể phát hiện được của các sản phẩm PCR lồng ở 24 hpi và sản phẩm PCR 01 bước ở 72 hpi.
B.Sản phẩm khuếch đại PCR thu được từ PCR 01 bước (gel trên) và PCR lồng (gel dưới) của nhóm HPI tại mỗi thời điểm cho thấy khả năng khuếch đại có thể phát hiện được của sản phẩm PCR lồng ở 24 hpi và sản phẩm PCR 1 bước ở 72 hpi. [Làn đường: M- DNA Marker (100 bp); 0 h đến 72 h- Sản phẩm khuếch đại PCR tại mỗi thời điểm trong đó 1,2,3 là bản sao của chúng; N- đối chứng âm; P- đối chứng dương].
3.2.2 Hoạt tính của prophenoloxidase
Kết quả của ANOVA hai chiều (các nhóm * khoảng thời gian – F (14,48) = 65,22, P <0,001), phân tích các tác động chính đơn giản (p <0,05) và kiểm định Tukey (p <0,05) cho thấy sự hiện diện của hoạt tính proPO có ý nghĩa thống kê khi nhiễm EHP ở cả nhóm SPI và HPI ở các khoảng thời gian khác nhau khi so sánh với nhóm đối chứng (Bảng 3). Hoạt tính proPO ở tôm bị nhiễm EHP ở cả hai nhóm HPI và SPI cao hơn có ý nghĩa (p <0,05) khi so sánh với nhóm đối chứng từ 6 đến 72 hpi với giá trị đỉnh ở 48 hpi. Hoạt tính proPO giảm nhẹ được quan sát thấy ở các nhóm bị nhiễm ở 72 hpi. Tuy nhiên, không có thay đổi về mức proPO được quan sát thấy ở tôm đối chứng không bị nhiễm EHP trong quá trình thử nghiệm (Hình 3).
3.2.3 Hoạt động bùng nổ hô hấp
RBA cao hơn đáng kể (p <0,05) ở nhóm bị nhiễm EHP so với nhóm đối chứng khỏe mạnh từ 6 đến 48 hpi như được xác định bằng phân tích ảnh hưởng chính đơn giản. Giá trị được quan sát thấy tăng đáng kể (p <0,05) lên đến 24 hpi và giảm sau đó. Tuy nhiên, không có sự khác biệt đáng kể nào về RBA được quan sát thấy giữa nhóm bị nhiễm và nhóm chứng sau 48 hpi (Hình 4). Kết quả được xác nhận thống kê bởi ANOVA hai chiều (nhóm * khoảng thời gian – F (14,48) = 14,611, P <0,001) và kiểm định Tukey (p <0,05) (Bảng 3).
3.2.4 Hoạt tính Superoxide dismutase (SOD)
Hoạt động SOD ở cả hai nhóm HPI và SPI cao hơn đáng kể (p <0,05) từ 6 đến 48 hpi với hoạt động cao nhất ở 24 hpi khi so sánh với nhóm chứng. Tuy nhiên, mức độ giảm sau 48 hpi. Không có thay đổi đáng kể nào trong hoạt động SOD được quan sát thấy trong các nhóm đối chứng. Kết quả của hoạt động SOD được trình bày trong Hình 5. Kết quả của ANOVA hai chiều (nhóm * khoảng thời gian – F (14,48) = 20,99, P <0,001), phân tích tác động chính gần như (p <0,05) và kiểm định Tukey để so sánh nhiều mức trung bình đối với hoạt động SOD được cung cấp trong Bảng 3.
3.2.5 Hoạt tính của catalase
Tương tác giữa tác động của các nhóm và khoảng thời gian lên hoạt tính của catalase là khác nhau có ý nghĩa (các nhóm * khoảng thời gian – F (14,48) = 10,9, p <0,001) được xác định bởi ANOVA hai chiều. Phân tích tác động chính đơn giản cho thấy hoạt động CAT giảm đáng kể (p <0,05) trong nhóm HPI và SPI so với nhóm chứng từ 24 đến 72 hpi với giá trị thấp nhất quan sát được là 72 hpi. Kiểm định Tukey cho thấy sự khác biệt đáng kể về hoạt động CAT giữa các nhóm (Hình 6 và Bảng 3).
3.2.6 Hoạt tính của Lysozyme
Tôm nhiễm EHP ở cả SPI và HPI cho thấy hoạt động LYS giảm đáng kể (p <0,05) sau 24 hpi với giá trị giảm tối đa (50%) ở 72 hpi so với nhóm đối chứng không bị nhiễm như được xác định bởi ANOVA hai chiều (nhóm * khoảng thời gian – F (14,48) = 23,51, p <0,001), phân tích tác động chính đơn giản (p <0,05) và các so sánh của Tukey giữa SPI, HPI và đối chứng (Hình 7 và Bảng 3). Không có sự thay đổi đáng kể nào về giá trị LYS được quan sát thấy trong các nhóm đối chứng.
3.2.7 Biểu hiện gen Toll
Sự biểu hiện của gen Toll được quan sát thấy được điều chỉnh trong gan tụy trong quá trình nhiễm EHP. Sự tăng cường đáng kể (p <0,05) của gen Toll được quan sát thấy từ 12 hpi ở tôm trong các nhóm bị nhiễm, HPI (0,7 lần) và SPI (1,2 lần). Sự gia tăng rõ rệt trong biểu hiện gen Toll của HPI (1,8 lần) và SPI (2,3 lần) được quan sát ở 24 hpi, tiếp theo là biểu hiện đỉnh ở HPI (5,25 lần) và SPI (5,73 lần) ở 72 hpi. Không có thay đổi đáng kể nào được quan sát thấy ở mức độ biểu hiện của gen Toll ở nhóm đối chứng ở 0, 6, 12, 24, 36, 48, 60 và 72hpi (Hình 8). Kết quả của ANOVA hai chiều (khoảng thời gian nhóm * – F (14,48) = 1153,2, p <0,001), phân tích tác dụng chính đơn giản (p <0,05) và so sánh nhiều lần theo cặp của Tukey trong Bảng 3.
Nhóm tác giả: Palaniappan Subasha, Arumugam Uma a, b, *, Baboonsundaram Ahilana
Biên dịch: Minh Nhựt – Tôm giống gia hoá Bình Minh.
Từ khóa: EHP, Microsporidians, phản ứng miễn dịch ở tôm, Enterocytozoon hepatopenaei, bệnh tôm
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Phần 2 – Các Phản Ứng Sớm Của Tôm Thẻ Chân Trắng Trong Thực Nghiệm Cho Nhiễm Vi Bào Tử Trùng Enterocytozoon Hepatopenaei (EHP) Bằng Đường Tiêm Và Đường Uống
- Phần 1 – BỆNH DO VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) GÂY RA TRÊN TÔM: Sinh thái, Bệnh học, Chẩn đoán và Kiểm soát
- Cơ Quan Quản Lý Ở Châu Âu Xem Xét Lại Độ An Toàn Của Ethoxyquin

 English
English