3. Kết quả
3.1. Lắp ráp và chú thích trình tự bộ gen
Kích thước bộ gen của L. vannamei được đo là 2,45 Gb bằng phương pháp tế bào học dòng chảy (Hình bổ sung 1), tương tự như kích thước được ước tính bằng phân tích k-mer (2,60 Gb, Hình bổ sung 2). Việc giải trình tự và lắp ráp bộ gen của L. vannamei là một thách thức do có rất nhiều SSR theo đề xuất của phân tích khảo sát bộ gen. Do đó, chúng tôi đã áp dụng nhiều công nghệ giải trình tự khác nhau, tạo ra các trình tự sạch 828 Gb của Illumina (338×), 133 Gb của PacBio lần đọc dài (54×) và 34.266 trình tự kết thúc BAC (0,46×) (Bảng bổ trợ 1-3). Chúng tôi cũng đã tiến hành nhiều phương pháp thông thường để lắp ráp bộ gen, mang lại kết quả không đạt yêu cầu (Bảng bổ trợ 4). Cuối cùng, chúng tôi đã phát triển phương pháp WTDBG, sử dụng phương pháp đồ thị Bruijn mờ, để có được sự lắp ráp tốt nhất với tính liên tục và độ chính xác cao nhất cho bộ gen, chứa 1,66 Gb trong 4683 khung, với N50 contig là 57,65 Kb và khung N50 là 605,56 Kb (Bảng 1). Tổ hợp này tương đương hoặc tốt hơn so với các loài giáp xác khác, bao gồm cả bộ gen được công bố gần đây của tôm càng cẩm thạch (khung N50 là 39,40 Kb) (Bảng bổ trợ 5).
Bảng 1. Tóm tắt bộ gen của L. vannamei
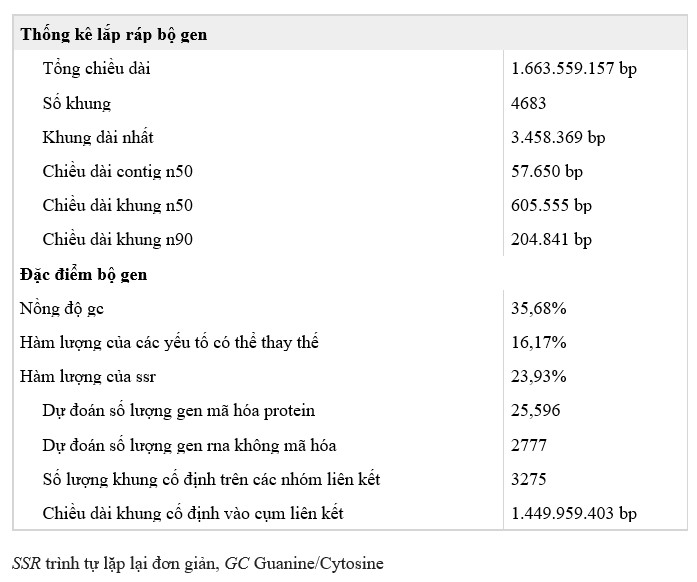
Việc lắp ráp cho thấy tính toàn vẹn và chất lượng cao. Hơn 93% số lần đọc Illumina có thể được ánh xạ tới bộ gen (Bảng bổ trợ 6). Bộ gen bao phủ > 94% số unigene được lắp ráp từ dữ liệu RNA-Seq và 94,76% gen của sinh vật nhân thực lõi được bảo tồn (Bảng bổ trợ 7 và 8). Độ chính xác của quá trình lắp ráp được chứng minh thêm bằng 14 bản sao BAC được giải trình tự, được bao phủ hoàn toàn bởi các khung tương ứng với độ tổng hợp cao (Hình bổ sung 3 và 4). Để lắp ráp các trình tự cấp độ nhiễm sắc thể, một bản đồ liên kết mật độ cao đã được sử dụng để cố định các khung. Tổng cộng có 3.275 khung được cố định vào 44 giả nhiễm sắc thể, chiếm 87,34% tổng số bộ gen (Hình 1a, Bảng bổ trợ 9).
Hình 1. Đặc điểm bộ gen của tôm thẻ chân trắng L. vannamei. a Biểu diễn sơ đồ các đặc điểm bộ gen của L. vannamei. Đường 1 (từ vòng ngoài): 44 nhóm liên kết (LG) của bộ gen tôm. Đoạn 2: Khung được cố định vào từng cụm liên kết. Đường 3: Các gen mã hóa protein có trong khung. Màu đỏ đại diện cho các gen trên chuỗi thuận và màu xanh lá cây cho các gen trên chuỗi ngược. Đường 4: Phân phối mật độ gen với các cửa sổ trượt 1 Mb. Mật độ cao hơn được thể hiện bằng màu đỏ đậm hơn. Đường 5: Phân phối hàm lượng GC trong bộ gen. Đường 6: Phân phối mật độ SNP với các sliding windows 5 Mb. Mật độ cao hơn được hiển thị bằng màu xanh đậm hơn. Đường 7: Sự phân bố của 6 họ gen được mở rộng đáng kể trong bộ gen, đó là opsin (O), protein giống peritrophin (P), chitinase (H), protein biểu bì vôi hóa (A), crucyanin (C) và giống JHE cacboxylesteraza 1 (J). Đường 8: Phân phối SSR trong bộ gen. Mật độ SSR cao hơn được hiển thị với màu sâu hơn. Đường 9: Phân phối miRNA trong bộ gen. Các cụm miRNA đồng phiên mã ở các vị trí liền kề được hiển thị theo kiểu xếp chồng lên nhau. Đường 10: Trình bày sơ đồ về các mối quan hệ giữa các nhiễm sắc thể chính trong bộ gen của tôm. b Hàm lượng SSR giữa các bộ gen động vật khác nhau. c Phân bố các loại SSR khác nhau trong bộ gen của L. vannamei. d Lai huỳnh quang tại chỗ (FISH) của (AACCT)n loại SSR với nhân (i) và nhiễm sắc thể (ii) của tôm thẻ chân trắng L. vannamei. Đa hình đơn nucleotide SNP, lặp lại trình tự đơn SSR
Phân tích k-mer chỉ ra rằng các trình tự lặp lại chiếm ~78% bộ gen (Hình bổ sung 2), nhiều hơn so với trình tự được xác định trong tập hợp cuối cùng (49,38%) (Bảng bổ trợ 10), chỉ ra rằng một số trình tự lặp lại là vẫn còn thiếu từ hội đồng. Bộ gen chứa tỷ lệ SSR cao nhất (23,93%) trong số tất cả các bộ gen của động vật được giải trình tự (Hình 1b, Bảng bổ sung 11). Chiều dài trung bình của SSR là 72,21 bp, dài hơn gấp đôi so với chiều dài ở các loài động vật chân đốt khác (20,11−31,91 bp). Mật độ SSR (3315,23/Mb, một SSR trên 301 bp) trong bộ gen của L. vannamei, theo như chúng tôi biết, cũng là cao nhất trong số các bộ gen được báo cáo khác, ngoại trừ Pediculus humanus (4508,69/Mb) (Hình 1b). Dinucleotide lặp lại là loại SSR chiếm ưu thế, với (AT)n, (AC)n và (AG)n chiếm 81,40% tổng số SSR (Hình 1c, Hình bổ sung 5). Hầu hết các SSR nằm ở các vùng liên gen (24,63%) và các đoạn intron của các gen mã hóa protein (22,07%), và số lượng ít hơn nhiều được tìm thấy ở các exon (1,41%). (AACCT)n, một thành phần telomere được xác định bằng huỳnh quang trong lai tạo tại chỗ (Hình 1c), dài hơn nhiều SSR khác, với SSR dài nhất (13.769 bp), thuộc loại này (Hình bổ sung 6). Hơn nữa, độ dài của (AACCT)n nằm trong các intron dài hơn so với các intron được tìm thấy ở các vùng gen khác (Hình bổ sung 7).
Các phần tử có thể thay thế (TE) chiếm 16,17% bộ gen của L. vannamei, với các phần tử chuyển vị DNA (9,33%) và các phần tử xen kẽ dài (LINE, 2,82%) bao gồm hai lớp chính. En-Spm (6,39%) được phát hiện là TE có nhiều nhất, với mức độ phong phú của nó cao hơn rõ rệt so với D. pulex (0,05%), P. virginalis (0,01%) và P. hawaiensis (0,25%) (Bảng bổ sung 12). Hầu hết các TE ở L. vannamei cho thấy sự khác biệt cao hơn (tỷ lệ thay thế 19−33%) so với các loài giáp xác khác (Hình bổ sung 8). Tuy nhiên, các LINE ở tôm thẻ chân trắng L. vannamei, đặc biệt là RTE-BovB và Penelope, cho thấy độ phân kỳ thấp (Hình bổ sung 8).
Tổng cộng, 25.596 mô hình gen mã hóa protein đã được chú thích ở tôm thẻ chân trắng L. vannamei. So với D. pulex và P. hawaiensis, L. vannamei có kích thước exon trung bình dài hơn (259 bp) và nhiều exon hơn trên mỗi gen (5,94) (Hình bổ sung 9, Bảng bổ trợ 13). Chúng tôi cũng chú thích các RNA nhỏ không mã hóa, bao gồm 1.458 tRNA, 464 rRNA, 296 RNA nhân nhỏ (snRNA), 255 RNA nhân nhỏ (snoRNA), 90 ribozyme và 214 microRNA (miRNA) (Bảng bổ trợ 14).
3.2. Tiến hóa bộ gen
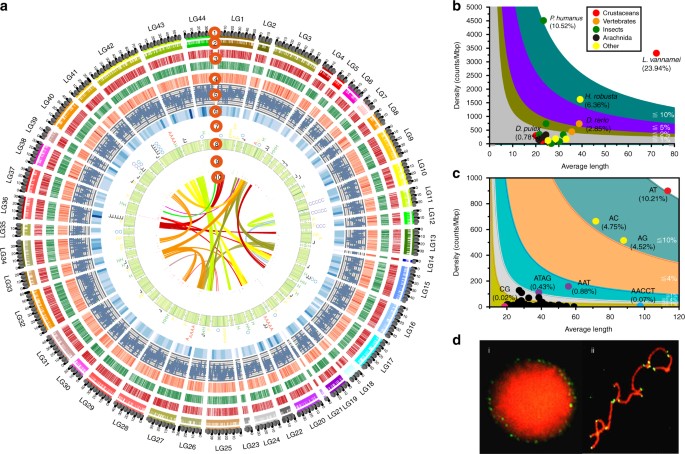
Phân tích phát sinh loài chỉ ra rằng động vật giáp xác và 6 lớp tạo thành một nhóm Pancrustacea đơn ngành, với nhóm thứ hai được lồng trong nhóm trước, làm cho Crustacea trở thành cận ngành (Hình 2a). Là thành viên của Malacostraca, L. vannamei (Decapoda) và P. hawaiensis (Amphipoda) phân kỳ vào khoảng 240 MYA (triệu năm trước), tức là vào đầu Đại Trung sinh. Sự khác biệt này xảy ra sau đợt tuyệt chủng hàng loạt kỷ Permi-Trias, khi khoảng 96% các loài sinh vật biển bị tuyệt chủng, kéo theo sự bức xạ của nhiều dạng sống mới. Khoảng thời gian phân kỳ này cũng phù hợp với sự phát xạ của các loài decapod giống như tôm vào đầu giữa kì Trias. Chúng tôi đã tìm thấy ba đặc điểm bộ gen nổi bật từ L. vannamei có thể là cơ sở cho sự tiến hóa nhanh chóng của tôm He, cụ thể là SSR phong phú, tỷ lệ gen đặc hiệu của đơn vị phân loại cao và sự sao chép gen song song trên diện rộng.

Hình 2. Phân tích bộ gen so sánh của L. vannamei và các loài động vật chân đốt khác. a vị trí phát sinh loài của L. vannamei trong cây phát sinh loài chân đốt. Các số trên các nhánh biểu thị số lượng gen tăng (+) hoặc mất (-). Thời gian phân kỳ ước tính được hiển thị bên dưới cây phát sinh gen. Tín dụng hình ảnh: Gewin V, Martin Cooper, Bernard Dupont, Carlo Brena, Gilles San Martin, David Ludwig, S. Rae. b So sánh các tiết mục gen của mười bộ gen động vật chân đốt. “1:1” biểu thị các gen sao chép đơn lẻ, “X:X” biểu thị các gen chỉnh hình hiện diện trong nhiều bản sao ở tất cả mười loài, trong đó X có nghĩa là một hoặc nhiều chỉnh hình trên mỗi loài, “chắp vá” biểu thị sự tồn tại của các chỉnh hình khác được trình bày trong ít nhất một bộ gen. c Phân tích thành phần chính (PCA) về việc sử dụng codon tương đối của các gen đặc hiệu
Do các phẩm chất chức năng và đột biến đặc biệt của chúng, SSR đóng vai trò chính trong việc tạo ra biến thể di truyền làm cơ sở cho quá trình tiến hóa thích nghi. Bên cạnh L. vannamei, hai loài tôm He, Penaeus monodon và Marsupenaeus japonicus, cũng có tỷ lệ SSR cao (~10%) trong bộ gen, có thể theo dõi thông qua giải trình tự bộ gen có độ che phủ thấp. Tuy nhiên, bộ gen của tôm càng cẩm thạch P. virginalis và amphipod P. hawaiensis chỉ chứa 0,99 và 1,27% SSR (Bảng bổ sung 12). Do đó, sự mở rộng của SSR có thể bắt nguồn từ tổ tiên chung của tôm He. SSR đóng vai trò quan trọng trong việc điều chỉnh tính dẻo của bộ gen (bao gồm tái tổ hợp và sao chép DNA) và biểu hiện gen. SSR ở tôm thẻ chân trắng L. vannamei được phân bố rộng rãi giữa các intron (22,07%) trong 16.741 gen (65,47%), biểu hiện của chúng có thể được điều chỉnh bởi tính đa hình của SSR. SSR cũng có thể góp phần tái tổ hợp DNA với TE, vì hầu hết TE và trình tự ngược hoặc xuôi của chúng đều chứa SSR (Hình bổ sung 10), chiếm hơn 90% cho ERV1, Charlie, Sola, MuDR và En-Spm. Do đó, sự mở rộng đáng kể của SSR có thể cung cấp một cấu trúc di truyền độc đáo cho quá trình tiến hóa thích nghi của tôm.
So với các loài giáp xác khác, bộ gen của L. vannamei có 762 họ gen mở rộng và 16.291 gen đặc trưng cho loài (>57% tổng số gen, Hình 2b), bao gồm các gen liên quan đến phức hợp myosin, liên kết chitin, quá trình trao đổi chất và truyền tín hiệu (Dữ liệu bổ sung 1-2, Bảng bổ sung 15-16, Hình bổ sung 11). Các gen đặc hiệu có thể góp phần vào sự thích nghi đặc trưng của thế hệ. Tổng cộng có 3.369 gen đặc hiệu được xác định trong bộ gen tôm thẻ chân trắng L. vannamei. Chúng hiển thị số lượng exon thấp hơn (4,47 exon/gen), nhưng chiều dài exon lớn hơn (292 bp/gen) trái ngược với chiều dài trung bình của tất cả các gen (5,94 exon và 260 bp mỗi gen). Chúng thể hiện các ký tự cấu trúc gen đặc biệt và các kiểu biểu hiện thời gian/không gian đặc biệt, cho thấy nguồn gốc độc lập của chúng (Hình 2c, Hình bổ sung 12 và 13). Khi tìm kiếm các unigene phiên mã của các loài decapods khác, các gen đặc hiệu được phát hiện có trong các loài tôm He khác, chẳng hạn như Fenneropenaeus chinensis (83,07%) và P. monodon (64,59%), nhưng hiếm khi xuất hiện trong các loài decapods khác, ví dụ như Exopalamon carincauda (1,95%), Eriocheir sinensis (1,09%) và Neocaridina denticulata (3,82%), cho thấy rằng những gen đặc hiệu này đặc trưng cho thế hệ và có thể góp phần vào sự thích nghi đặc trưng của tôm He.
Sao chép song song gen là một trong những đặc điểm hấp dẫn nhất của bộ gen L. vannamei. Tổng cộng có 4.662 gen được xác định là sao chép song song (Hình bổ sung 14) và những bản sao này có điểm tương đồng trình tự cao (nhận dạng> 98%), cho thấy các bản sao gần đây. Hơn nữa, những gen này chủ yếu bao gồm opsin, crucyanin, chitinase, protein biểu bì, myosin, actin và protein sốc nhiệt, có thể quan trọng đối với quá trình tiến hóa thích nghi của tôm.
3.3. Hệ thống thị giác để sinh vật đáy thích nghi
L. vannamei có một cặp cuống mắt to với bề mặt thị giác hình trứng tạo thành từ một số lượng lớn các thấu kính ommatidial (Hình 3a). Mỗi mắt kép bao gồm khoảng 55.000–80.000 ommatidia, sánh ngang với những mắt sắc bén nhất ở động vật chân đốt. L. vannamei trưởng thành và con non là sinh vật đáy ở vùng nước nông và đục đến độ sâu 50 m, nơi không có ánh sáng có bước sóng <500 nm xuyên qua. Do đó, L. vannamei được cho là đã phát triển các tế bào cảm quang có khả năng bắt giữ các photon phổ biến nhất trong môi trường này. Lần đầu tiên giải trình tự bộ gen của tôm thẻ chân trắng L. vannamei cho phép suy ra sự tiến hóa ở cấp độ bộ gen trong con mắt tinh vi này. Chúng tôi đã xác định được 42 gen opsin, là những yếu tố cảm nhận ánh sáng chính chịu trách nhiệm truyền tín hiệu hình ảnh (Hình 3b). Tất cả các opsin này thuộc loại thị giác liên quan đến cảm giác màu sắc. Theo hiểu biết của chúng tôi, L. vannamei có nhiều gen opsin thị giác nhất trong số các loài động vật, bao gồm cả những sinh vật thường được coi là có thị giác xuất sắc như tôm bọ ngựa (6–33 opsin) và chuồn chuồn (20 opsin). 42 visual-opsins có thể được chia thành ba phân họ, 33 phân họ loại bước sóng dài (LW), bảy phân họ loại bước sóng trung bình (MW) và hai phân họ loại bước sóng ngắn (SW) (Hình 3c). Thật thú vị, hầu hết các gen của phân họ LW thuộc về hai cụm trong bộ gen (Hình 3c), cho thấy sự mở rộng lớn thông qua sao chép song song.
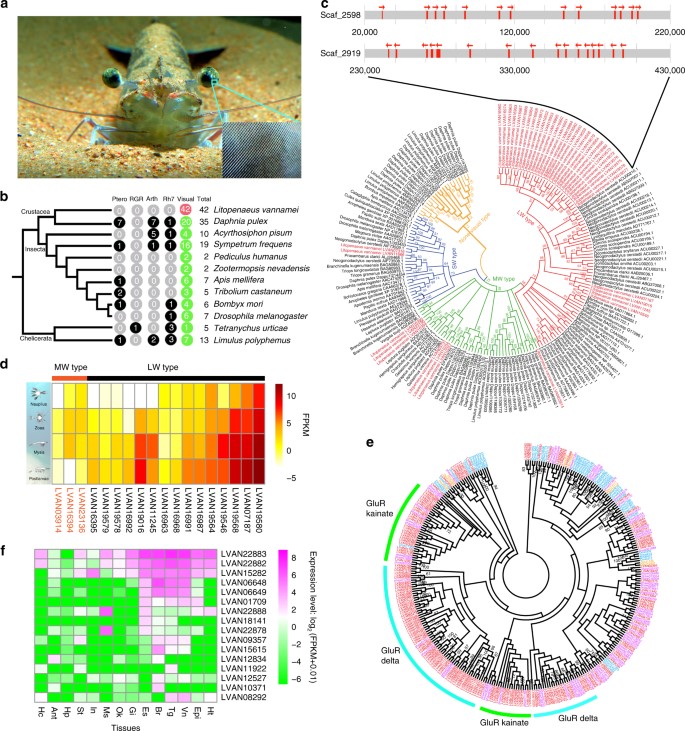
Hình 3. Họ gen opsin và iGluR trong bộ gen của tôm. a Hình ảnh mắt L. vannamei và ommatidia. b Các gen opsin của L. vannamei so với các gen trong bộ gen của các loài động vật chân đốt khác nhau. Số lượng gen opsin loại trực quan và không trực quan, bao gồm pteropsin (Ptero), giống RGR (RGR), arthropsin (Arth), giống Rh7 (Rh7) đã được xác định bằng cách sử dụng căn chỉnh trình tự với các tìm kiếm opsin và miền GPCR đã biết (Hình bổ sung 18 ). c Cây phát sinh họ gen opsin ở động vật chân đốt. 6 nhánh opsin trong bộ gen của L. vannamei đã được quan sát (màu đỏ). Các gen trong nhánh lớn nhất là các opsin được mở rộng cụ thể ở bộ gen tôm thẻ chân trắng L. vannamei, chúng cũng được nhân đôi song song. Mũi tên chỉ định hướng phiên mã. d Biểu hiện gen opsin (FPKM>1) trong các giai đoạn ấu trùng khác nhau của L. vannamei. e Sự mở rộng của gen thụ thể ionotropic glutamate (iGluR) ở L. vannamei . f Biểu hiện gen iGluR trong các mô khác nhau: tế bào máu (Hc), tuyến râu (Ant), gan tụy (Hp), dạ dày (St), ruột (In), cơ (Ms), cơ quan bạch huyết (Ok), mang (Gi) , cuống mắt (Es), não (Br), hạch ngực (Tg), hạch bụng (Vn), ngoại bì (Epi), tim (Ht). Thụ thể kết hợp protein GPCR G
Sự mở rộng của LW opsin nhạy cảm với ánh sáng ở bước sóng 560 nm tạo điều kiện cho tôm ăn trong môi trường sinh vật đáy với ánh sáng chủ yếu là vàng và đỏ (bước sóng dài). Sự mở rộng gen opsin cũng được quan sát thấy trong bộ gen của bọ chét nước D. pulex (36 opsin), nhưng sự mở rộng này chỉ giới hạn ở phân họ MW, nhạy cảm với ánh sáng ở bước sóng ~ 530 nm liên quan đến môi trường sống của sinh vật phù du (Hình bổ sung 15). Xem xét sự thay đổi từ môi trường sinh vật phù du sang sinh vật đáy trong vòng đời của tôm, chúng tôi đã phân tích sự biểu hiện của gen opsin ở các giai đoạn ấu trùng khác nhau của L. vannamei. Điều thú vị là, các gen opsin loại LW cho thấy mức độ biểu hiện cao hơn đáng kể ở tôm post sống đáy, trong khi các gen opsin MW biểu hiện cao hơn ở ấu trùng sinh vật phù du (Hình 3). Những dữ liệu này cung cấp hỗ trợ mạnh mẽ cho mối tương quan của sự biểu hiện khác biệt giữa các loại gen opsin thị giác với môi trường sống của sinh vật phù du và sinh vật đáy, cho thấy rằng L. vannamei có một hệ thống thị giác hiệu quả cao thích nghi với quá trình chuyển đổi môi trường sống.
3.4. Dẫn truyền tín hiệu thần kinh và vận động
Trong hệ thống thần kinh trung ương của decapods, các sợi thần kinh khổng lồ bắt nguồn từ não và kết thúc tại hạch đuôi chịu trách nhiệm cho các phản ứng trốn thoát nhanh chóng. Các sợi thần kinh này của tôm He có tốc độ dẫn truyền ~200 ms, thường được coi là tốc độ dẫn truyền nhanh nhất ở động vật, so với chỉ 20 ms ở mực ống, loài có hệ thần kinh lớn nhất trong số các động vật không xương sống. Trong bộ gen của L. vannamei, các loại gen để nhận biết tín hiệu và phát triển thần kinh được làm phong phú đáng kể (Dữ liệu bổ sung 1, Bảng bổ trợ 16). Sự mở rộng rõ rệt đã được tìm thấy trong một số họ gen, bao gồm các thụ thể kết hợp với protein 457 G (GPCR), 53 kênh tiềm năng thụ thể tạm thời, 21 innexin và 47 protocadherin (Bảng bổ sung 17), được coi là các gen liên quan đến phát triển thần kinh cốt lõi xuyên song phương. Sự dẫn truyền thần kinh nhanh chóng ở tôm dựa trên vỏ myelin nặng nề, nhưng chất nền myelin, cholesterol, không thể được tổng hợp ở hầu hết các động vật không xương sống. Crustacyanin, các gen thuộc họ apolipoprotein vận chuyển cholesterol, được mở rộng đáng kể và nhân đôi song song ở bộ gen tôm thẻ chân trắng L. vannamei và hầu hết chúng được thể hiện cao trong hệ thống thần kinh và tiêu hóa (Dữ liệu bổ sung 3).
Không giống như động vật có xương sống và hầu hết các động vật nguyên sinh sử dụng acetylcholine làm chất dẫn truyền thần kinh, động vật chân đốt sử dụng glutamate ở điểm nối thần kinh cơ. Tổng cộng có 169 gen thụ thể glutamate ionotropic (iGluRs) và 148 gen thụ thể glycine (GlyRs) có trong bộ gen của L. vannamei (Hình 3e, Hình bổ sung 16, Bảng bổ trợ 18). iGluRs tham gia vào quá trình dẫn truyền thần kinh kích thích, có thể diễn ra nhanh chóng và kéo dài trong một thời gian dài. Chúng cũng đóng một vai trò trong việc điều chỉnh quá trình myelin hóa. GlyRs có thể kích hoạt độ dẫn Cl− trong tế bào thần kinh. Hơn nữa, các gen iGluRs và GlyRs chủ yếu được biểu hiện trong hệ thống thần kinh cũng như trong cơ bắp (Hình 3f , Hình bổ sung 17). Ngoài ra, một số họ gen liên quan đến sự co cơ, chẳng hạn như actin và myosin, cũng được mở rộng đáng kể trong bộ gen của L. vannamei (Bảng bổ sung 16). Những tính năng này có thể giúp tôm thực hiện nhanh chóng quá trình truyền tín hiệu thần kinh, tăng cường khả năng phản ứng và tăng cường khả năng vận động của tôm, bao gồm cả các phản ứng trốn thoát để thích nghi với cuộc sống bơi ở đáy trong vùng nước biển nông.
3.5. Đường dẫn tín hiệu ecdysone tăng cường
Lột xác là một quá trình sinh lý cơ bản của động vật giáp xác (Hình 4a), qua đó chúng thực hiện quá trình biến thái, sinh trưởng và phát triển. Một đường truyền tín hiệu ecdysone, dưới sự điều chỉnh của hoóc-môn, kiểm soát từng bước trong quá trình lột xác (Hình 4b). Cả sự tăng ban đầu và giảm phối hợp nồng độ ecdysone trong tuần hoàn đều cần thiết cho quá trình lột xác thành công. Ở L. vannamei, chức năng tức thời của ecdysone trong việc thúc đẩy quá trình lột xác được khuếch đại bởi các gen xuôi dòng được mở rộng trong đường dẫn tín hiệu ecdysone. Sau khi đi vào nhân, ecdysone kích hoạt quá trình phiên mã liên tiếp của các gen phản ứng ecdysone ở giai đoạn đầu (Hình 4b). Gen phản ứng ecdysone chính, Broad-Complex (Br-C), đã được mở rộng rõ rệt trong bộ gen (Hình 4c) và được biểu hiện cao ở giai đoạn tiền lột xác sớm (D1) và sau thay lông (P1) (Hình 4d), phù hợp với chức năng của chúng trong việc điều chỉnh biểu hiện của các tác nhân hạ lưu, chẳng hạn như chitinase và protein biểu bì. Protein biểu bì, protein liên kết chitin (CBP) và protein biểu bì liên quan đến canxi hóa (CaCP) là các protein cấu trúc chính để xây dựng lớp biểu bì, giúp bảo vệ tôm khỏi vi khuẩn, nấm, vi rút và các tổn thương cơ học. Tuy nhiên, để cho phép tăng trưởng về kích thước cơ thể, lớp biểu bì bị thoái hóa trước khi phân hủy bởi chitinase. Các gen mã hóa CBP, CaCP và chitinase được mở rộng đáng kể ở bộ gen tôm thẻ chân trắng L. vannamei (Hình 4c, Bảng bổ sung 19). Những gen này chủ yếu được biểu hiện ở lớp biểu bì và ma trận peritrophic ở ruột (Hình bổ sung 19). Các protein cấu trúc được biểu hiện phối hợp trong quá trình lột xác, bắt đầu bằng sự phân hủy ban đầu bởi chitinase, và sau đó là sự tổng hợp của lớp biểu bì mới với biểu hiện cao của protein biểu bì loại Rebers và Riddiford 2 (R&R2) và các gen CBPs từ giai đoạn tiền lột xác sớm (D2) đến lột xác muộn (D4). Sau quá trình tạo phôi (P1–P2), các protein biểu bì loại CaCP và R&R1 được tạo ra để làm cứng lớp biểu bì (Hình 4d, Hình bổ sung 19). Các gen mở rộng mã hóa Br-C và các protein biểu bì trong bộ gen có thể tăng cường hoạt động của ecdysone, một khi nồng độ của nó đạt đến một ngưỡng nhất định. Chức năng ecdysone nâng cao có thể là cơ chế chính để đảm bảo hành vi lột xác thường xuyên của tôm.
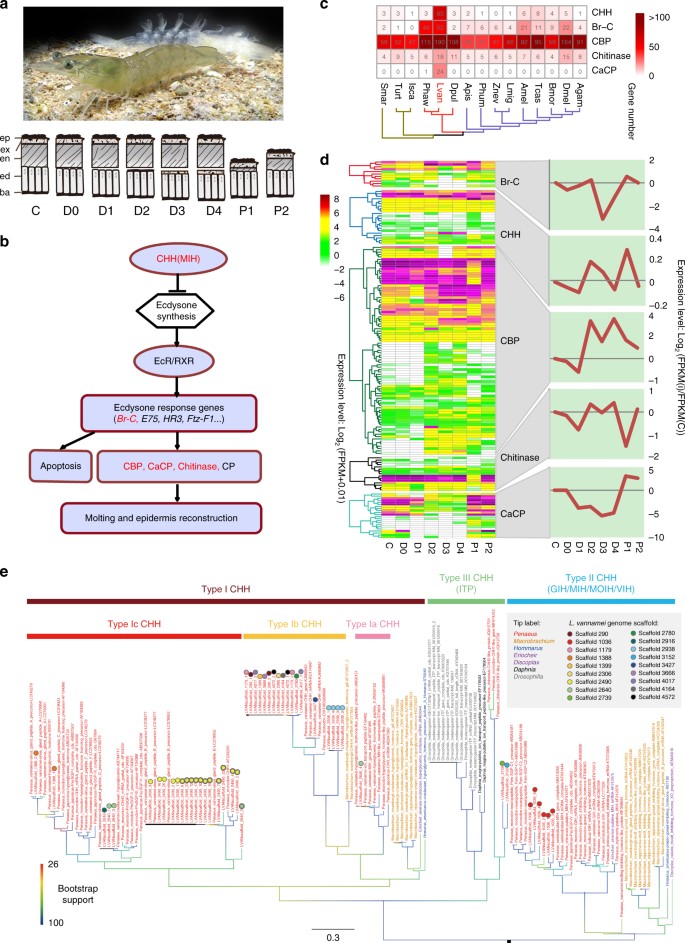
Hình 4. Các họ gen chính liên quan đến đường truyền tín hiệu ecdysone trong bộ gen của L. vannamei. a Hình ảnh của tôm và vỏ ngoài của nó. Sơ đồ bên dưới hình ảnh cho thấy những thay đổi của lớp biểu bì (ep: biểu bì, ví dụ: exocuticle, en: endocuticle, ed: biểu bì, ba: màng đáy) trong chu kỳ lột xác. Chu kỳ lột xác có thể được chia thành tám giai đoạn: Giai đoạn giữa lột xác (C), giai đoạn Tiền lột xác (D0–D4) và giai đoạn Sau lột xác (P1–P2). b Đường dẫn tín hiệu ecdysone của tôm. Các họ gen mở rộng được tô màu đỏ. c Mô hình phân bố của các họ gen mở rộng trong con đường truyền tín hiệu ecdysone của tôm và so sánh với các loài động vật chân đốt khác. d Các kiểu biểu hiện của các gen họ gen mở rộng ở các giai đoạn lột xác khác nhau của tôm thẻ chân trắng L. vannamei. Xu hướng biểu hiện tổng thể trong các giai đoạn lột xác khác nhau được thể hiện ở bên phải. e Phân tích phát sinh loài của họ CHH dựa trên trình tự CDS chứa miền CHH đầy đủ, được tái tạo bằng IQ-tree 1.6.2 theo mô hình TVMe + I + G4 với phương pháp bootstrap cực nhanh. Các trình tự từ bộ gen của L. vannamei được chú thích bằng các vòng tròn có nhiều màu sắc khác nhau để biểu thị nguồn gốc tương ứng của chúng. Trình tự GenBank của họ CHH từ chi Penaeus sl, Macrobrachium, Homarus, cũng như từ loài Eriocheir sinensis, Discoplax celeste, Daphnia magna và Drosophila melanogaster đã được đưa vào phân tích này. Các trình tự này được chú thích trong cây phát sinh loài như sau: tên loài/mô tả gen/số gia nhập. Chúng được phân loại thành các phân họ CHH loại I, II và III, trong đó CHH loại III bao gồm các peptide vận chuyển ion (ITP). Hormone tăng đường huyết CHH của loài giáp xác
Ở L. vannamei, sự mở rộng đáng chú ý của họ hormone tăng đường huyết (CHH) của loài giáp xác làm cơ sở cho việc kiểm soát chức năng ecdysone tăng cường (Hình 4c). Quá trình tổng hợp ecdysone trong cơ quan Y của giáp xác chủ yếu chịu sự kiểm soát tiêu cực của hormone ức chế lột xác (MIH), một trong những peptide loại II thuộc họ CHH. Chúng tôi đã xác định được bảy gen MIH được nhân đôi song song (Hình 4e) với độ tương tự trình tự cao (Hình bổ sung 20). Điều này có thể tạo điều kiện cho sự cùng tồn tại và chức năng của các gen này trong quá trình lột xác. Bảng phiên mã MIH chủ yếu nằm ở dây thần kinh mắt và dây thần kinh bụng (Dữ liệu bổ sung 4) và biểu hiện của chúng thấp ở giai đoạn tiền lột xác muộn và cao từ giai đoạn sau lột xác đến giai đoạn tiền lột xác sớm (Dữ liệu bổ sung 4), đảo ngược chính xác của cấp độ ecdysone hemolymp. Bên cạnh đó, các peptide loại I thuộc họ CHH cũng được biết là có tác dụng ngăn chặn quá trình tạo dị vật trong cơ quan Y, mặc dù ở liều cao hơn MIH. Trong bộ gen của L. vannamei, chúng tôi đã xác định được ba nhánh chính của peptit CHH loại I: (1) nhánh Ia CHH, chứa các peptit được biểu hiện nhiều hơn trong ruột, hạch ngực và cơ quan bạch huyết so với ở cuống mắt và các mô khác (Dữ liệu bổ sung 4), và có thể hoạt động trong quá trình điều hòa ion/thẩm thấu và hấp thu nước nhưng thiếu chức năng tăng đường huyết, (2) nhánh loại Ib, được biểu hiện nhiều ở cuống mắt cũng như hạch não và hạch ngực, và ít được nghiên cứu kỹ hơn nhưng cũng được cho là giả định một chức năng ion/điều hòa thẩm thấu, và (3) nhánh Ic loại, đặc trưng cho tôm He và chứa các peptit liên quan đến quá trình điều hòa quá trình lột xác, sinh sản, năng lượng và chuyển hóa ion (Hình 4e). Đáng chú ý, chúng tôi đã phát hiện ra sự mở rộng nổi bật hơn nhiều ở loại Ic CHH so với các gen CHH loại I khác trong bộ gen (Hình 4e, Dữ liệu bổ sung 5). Các gen CHH loại Ic cho thấy các kiểu biểu hiện tương tự như các gen MIH ở các mô và giai đoạn lột xác khác nhau, trong khi loại I CHH khác thì không (Hình 4d, Dữ liệu bổ sung 4). Hầu hết các gen CHH loại Ic được đặt song song trong khung 2490 (Hình 4e) và chia sẻ độ tương tự trình tự cao (Hình bổ sung 21). Các kiểu tổ chức và biểu hiện gen tương tự giữa các gen Ic CHH và gen MIH cho thấy rằng chúng có thể đóng vai trò tương tự trong quá trình lột xác. Hơn nữa, MIH và CHH cũng làm tăng nồng độ nội bào của nucleotide vòng (cAMP hoặc cGMP) và Ca2+ trong cơ quan Y, điều này tiếp tục ức chế quá trình tạo ecdysteroid bằng cách kích hoạt giai đoạn “kích hoạt” của quy định MIH. Các gen liên quan đến giai đoạn “kích hoạt” của quy định MIH, bao gồm protein kinase phụ thuộc cAMP, phosphodiesterase 1, calmodulin và Ca2+ /các gen kinase protein phụ thuộc calmodulin, đều được chọn lọc tích cực (Hình bổ sung 22 , Dữ liệu bổ sung 6). Sự mở rộng và sao chép song song của các gen thuộc họ CHH, và sự lựa chọn tích cực của các gen giai đoạn “kích hoạt” MIH có thể tăng cường khả năng kiểm soát tiêu cực của quá trình tổng hợp ecdysone. Nói chung, con đường tín hiệu ecdysone tăng cường này, được tạo ra bởi sự mở rộng gen, sao chép song song và chọn lọc tích cực, với sự khuếch đại chức năng ecdysone và kiểm soát tiêu cực đối với quá trình hình thành ecdysteroid, nhằm đảm bảo quá trình lột xác thường xuyên và chính xác ở tôm.
3.6. Các gen chính làm trung gian cho các yếu tố môi trường trong quy định lột xác
Quá trình lột xác bị ảnh hưởng bởi nhiều yếu tố môi trường, chẳng hạn như dinh dưỡng và thời gian chiếu sáng. Các gen MIH của tôm thẻ chân trắng L. vannamei thường chứa các yếu tố điều hòa sterol (SRE), tức là các vị trí gắn protein gắn SRE (SREBP), trong trình tự điều hòa (Hình bổ sung 23). Hơn nữa, tất cả các bản sao được phát hiện của MIH và SREBP đều có các kiểu biểu hiện tương tự nhau, với mức độ biểu hiện cao trong mắt ở giai đoạn giữa lột xác và mức thấp ở giai đoạn tiền lột xác muộn (Hình 5a). SREBP là chất điều chỉnh chính quá trình chuyển hóa cholesterol và chức năng của nó bị ức chế bởi hàm lượng cholesterol cao trong tế bào. Ecdysone được sinh tổng hợp với cholesterol làm cơ chất, và cholesterol không thể được tổng hợp in vivo trong động vật giáp xác. Mức ecdysone thể hiện xu hướng tương tự với mức cholesterol in vivo trong quá trình lột xác và cả hai đều thể hiện xu hướng ngược lại với các kiểu biểu hiện của MIH và SREBP. Những quan sát này cho thấy rằng mức cholesterol cao có thể thúc đẩy quá trình lột xác thông qua SREBP, điều này có thể điều chỉnh tích cực biểu hiện MIH, do đó ngăn chặn quá trình tổng hợp và lột xác ecdysone. Giả thuyết này được hỗ trợ bằng cách giảm (~ 95%) biểu hiện của tất cả các gen MIH được phát hiện sau khi vô hiệu hóa SREBP trong mắt (Hình 5b, Hình bổ sung 24). Tiêm cholesterol vào tôm có chức năng ức chế tương tự đối với biểu hiện MIH, làm giảm mức biểu hiện MIH >90% (Hình 5b). Sự ức chế này có thể được thực hiện thông qua việc ức chế chuyển vị hạt nhân của SREBP. Vô hiệu hóa MIH (Hình bổ sung 24) tăng tốc đáng kể quá trình lột xác của tôm, khiến chúng phát triển đến giai đoạn tiền lột xác muộn (D3, Hình 5c, i). Tuy nhiên, hầu hết tôm đối chứng ở giai đoạn giữa lột xác tiến triển thành giai đoạn lột xác sớm (D1) trong cùng khoảng thời gian (Hình 5c, ii). Ngược lại, tiêm Lipitor, một chất làm giảm lipid, dường như làm chậm quá trình lột xác ở giai đoạn D3 (Hình 5c, iii), khi tôm đối chứng tiến tới giai đoạn sau lột xác (Hình 5c, iv). Những dữ liệu này chỉ ra rằng vô hiệu hóa SREBP và mức cholesterol cao có chức năng tương tự như vô hiệu hóa MIH, hỗ trợ cho giả thuyết rằng SREBP làm trung gian cho quá trình phát sinh dị vật do MIH điều chỉnh.

Hình 5. Quy định tổng hợp ecdysone qua trung gian MIH ở tôm. a Các dạng biểu hiện của SREBP và MIH trong cuống mắt tôm ở các giai đoạn lột xác khác nhau. b Các cấu hình biểu hiện của MIH trong mắt với các nghiệm thức khác nhau. Việc tiêm DSEGFP và PBS đóng vai trò kiểm soát. c Sự thay đổi kiểu hình của lớp biểu bì vỏ tôm sau khi xử lý. Tôm ở giai đoạn giữa lột xác được xử lý bằng RNAi: (i) 2 ngày sau khi tiêm DSMIH; (ii) 2 ngày sau khi tiêm DSEGFP. Tôm giai đoạn tiền lột xác sớm được xử lý Lipitor; (iii) 2 ngày sau khi tiêm Lipitor; (iv) 2 ngày sau khi tiêm PBS. Mũi tên màu vàng chỉ khoảng cách giữa lớp biểu bì cũ và mới ở các giai đoạn lột xác khác nhau. Thanh = 50 m. d Ảnh hưởng của việc vô hiệu hóa opsin đối với tốc độ lột xác tích lũy, với việc tiêm DSEGFP đóng vai trò kiểm soát. Mũi tên màu xanh lá cây cho thấy thời điểm điều trị dẫn đến tỷ lệ xuất huyết tích lũy thấp hơn đáng kể so với nhóm đối chứng. e Sơ đồ quy định SREBP và opsin trong quá trình tổng hợp ecdysone qua trung gian MIH. Protein liên kết SREBP SRE
Quang kỳ có ảnh hưởng rõ rệt đến quá trình lột xác của giáp xác. Do chức năng chính của opsin trong quá trình truyền tải thị giác, chúng tôi suy đoán rằng opsin có thể là chất trung gian chính giữa quang kỳ và lột xác. Điều này được hỗ trợ bởi mức độ điều hòa của các gen MIH sau khi làm im lặng một số gen LW opsin (Hình 5b, Hình bổ sung 25), cho thấy vai trò ức chế của opsin trong biểu hiện MIH. Ngoài ra, sau 10 ngày vô hiệu hóa opsin, tôm có tốc độ lột xác thấp hơn so với đối chứng (Hình 5d).
Tóm lại, chúng tôi suy luận rằng việc cung cấp cholesterol và photoperiod điều chỉnh quá trình lột xác thông qua SREBP và opsin (Hình 5e). Trong mô hình này, mức cholesterol thấp tương ứng với biểu hiện SREBP và MIH tăng lên sau khi lột xác. Sự hấp thu cholesterol dẫn đến vô hiệu hóa SREBP và do đó làm giảm biểu hiện MIH ở giai đoạn tiền lột xác sớm. Đồng thời, ecdysone cũng tăng lên để bắt đầu các đường truyền tín hiệu xuôi dòng. Mô hình cũng đề xuất chức năng của opsin trong việc làm trung gian ảnh hưởng của quang kỳ thông qua điều chỉnh quá trình lột xác do MIH điều chỉnh.
3.7. Bảo vệ miễn dịch trong quá trình lột xác
Lớp biểu bì mới hình thành của tôm sau lột xác còn mỏng, chưa cứng nên dễ bị nhiễm mầm bệnh. Chúng tôi dự đoán rằng tôm có thể có khả năng bảo vệ miễn dịch tăng cường trong quá trình phân hủy. Động vật giáp xác chủ yếu dựa vào hệ thống miễn dịch bẩm sinh của chúng, bao gồm miễn dịch dịch thể và miễn dịch tế bào, để chống lại mầm bệnh. Chúng tôi đã tìm thấy 111 gen liên quan đến miễn dịch với các kiểu biểu hiện khác nhau ở các giai đoạn lột xác khác nhau. Các gen này được nhóm thành sáu nhóm theo chức năng của chúng, bao gồm 15 peptide kháng khuẩn (AMP), 59 thụ thể nhận dạng mẫu (PRR), sáu gen liên quan đến hệ thống phenoloxidase, 14 gen liên quan đến quá trình tự hủy và 17 gen liên quan đến cân bằng nội môi (Dữ liệu bổ sung 7).
Crustins đã đóng góp cho 13 trong số 15 AMP được thể hiện khác nhau (Dữ liệu bổ sung 7). Hầu hết trong số chúng cho thấy mức độ biểu hiện thấp nhất trong giai đoạn tiền lột xác muộn và mức độ biểu hiện tăng lên ngay sau khi lột xác (Hình bổ sung 26A). Lớp vỏ được phân bố chủ yếu ở lớp biểu bì, dạ dày, mang và tế bào máu (Hình bổ sung 26B). Trong số 59 PRR được xác định, 53 là lectin, PRR quan trọng liên quan đến khả năng miễn dịch bẩm sinh của động vật giáp xác 45 (Dữ liệu bổ sung 7). Một số gen lectin được biểu hiện cao ở giai đoạn P1 (Hình bổ sung 26C), chủ yếu được phát hiện ở lớp biểu bì, dạ dày và mang (Hình bổ sung 26D, 27). Hầu hết các loại thảo dược khác được biểu hiện cao trong gan tụy, thể hiện mức độ biểu hiện thấp nhất ở giai đoạn P1 và được biểu hiện cao từ P2 đến giai đoạn tiền lột xác sớm (Hình bổ sung 28). Biểu hiện của các gen liên quan đến hệ thống phenoloxidase rõ ràng đã tăng lên sau khi lột xác (Dữ liệu bổ sung 7) và được phân bổ chủ yếu ở mang, biểu bì, dạ dày, ruột, tế bào máu và gan tụy (Hình bổ sung 26E, F, G). Gần đây, một gen phenoloxidase ở côn trùng được báo cáo là có vai trò trong khả năng miễn dịch của da, bảo vệ vật chủ chống lại nhiễm nấm sau quá trình lột xác. Hầu hết các gen liên quan đến quá trình chết theo chương trình đã được xác định, chủ yếu biểu hiện ở ruột và gan tụy, được biểu hiện cao trong suốt quá trình lột xác, với hai đỉnh ở D2 và D4 (Hình bổ sung 26E, F). Ở giai đoạn trước khi lột xác, một lớp biểu bì mới được tạo ra sau quá trình lột xác, khi lớp biểu bì cũ được tách ra khỏi lớp biểu bì. Các kiểu biểu hiện của các gen liên quan đến quá trình chết theo chương trình chỉ ra rằng chúng có thể liên quan đến quá trình tự hủy chứ không phải là khả năng miễn dịch.
Tóm lại, AMPs (crustin, yếu tố chống lipopolysacarit và penaeidin), PRR (lectin và LGBP) và gen hệ thống phenoloxidase góp phần lớn vào việc bảo vệ miễn dịch trong quá trình phân hủy (Hình bổ sung 26H). Mặc dù các gen liên quan đến miễn dịch này rất quan trọng trong việc bảo vệ vật chủ chống lại mầm bệnh ở môi trường bên ngoài, nhưng biểu hiện cao của chúng trong gan tụy có thể liên quan đến sự ổn định của hệ vi khuẩn đường ruột in vivo của tôm và bảo vệ vật chủ chống lại mầm bệnh trong môi trường bên trong như vi khuẩn, kể cả một số tác nhân gây bệnh có mặt khắp nơi trong gan tụy.
3.8. Tác động của lai tạo
L. vannamei đã trở thành một loài nuôi trồng thủy sản quan trọng trong những năm 1980, và một chương trình nhân giống chọn lọc đã bắt đầu theo “Chương trình nuôi tôm biển của Hoa Kỳ (USMSFP)” vào năm 1989. So với lịch sử thuần hóa lâu dài ở thực vật, gia súc và gia cầm trên cạn, lịch sử nhân giống L. vannamei tương đối ngắn. Tuy nhiên, áp lực chọn lọc ở tôm thẻ chân trắng L. vannamei là rất cao, vì tôm có thể được chọn lọc một thế hệ mỗi năm và một con cái sinh sản duy nhất có thể sinh ra >300.000 con. Để kiểm tra các hậu quả về bộ gen của việc nhân giống chọn lọc chuyên sâu như vậy, chúng tôi đã chọn 22 cá thể để sắp xếp lại bộ gen, bao gồm 8 cá thể từ tự nhiên và 14 cá thể từ năm đàn cá bố mẹ khác nhau (Bảng bổ sung 20). Chúng tôi đã giải trình tự chúng với độ bao phủ bộ gen trung bình >23× (Bảng bổ sung 21) và xác định được 31.993.474 đa hình nucleotide đơn (SNP) trong số tôm (Bảng bổ trợ 22), với mức trung bình là 19 SNP/Kb. Mật độ SNPs trong bộ gen của L. vannamei cao hơn nhiều so với ở gà và lợn, và tương tự như ở hàu, loài có mức độ dị hợp tử rất cao. Hầu hết các SNP nằm ở các vùng liên gen (86,68%) và các vùng mã hóa thể hiện tính đa dạng di truyền thấp hơn nhiều so với các intron. Trong các vùng mã hóa, 261.056 SNP đồng nghĩa và 206.026 SNP không đồng nghĩa đã được xác định (Bảng bổ trợ 23). Khoảng 1400 SNP được đặt tại các vị trí chấp nhận mối nối và 1452 SNP tại các vị trí tài trợ nối. Theo hiểu biết của chúng tôi, đây là tập hợp lớn nhất các SNP chất lượng cao thu được từ tôm thẻ chân trắng L. vannamei và nó sẽ tạo thành một nguồn tài nguyên quý giá cho nghiên cứu và chọn lọc di truyền.
Sự khác biệt đáng kể đã được quan sát giữa sự đa dạng di truyền của tôm tự nhiên và tôm bố mẹ khác nhau. Độ đa dạng nucleotide trung bình (π) ở cấp độ toàn bộ bộ gen của hai nhóm lần lượt là 3,69×10−3 và 2,70×10−3. Các phân tích phát sinh loài dựa trên SNP toàn bộ bộ gen đã tách các cá thể hoang dã khỏi các cá thể trong đàn bố mẹ, sau đó được nhóm thành hai nhánh, với các cá thể ở Ecuador được nhóm tách biệt với các dòng giống thương mại khác, rõ ràng là do dòng trước chỉ trải qua chọn lọc bốn thế hệ (Hình 6a).
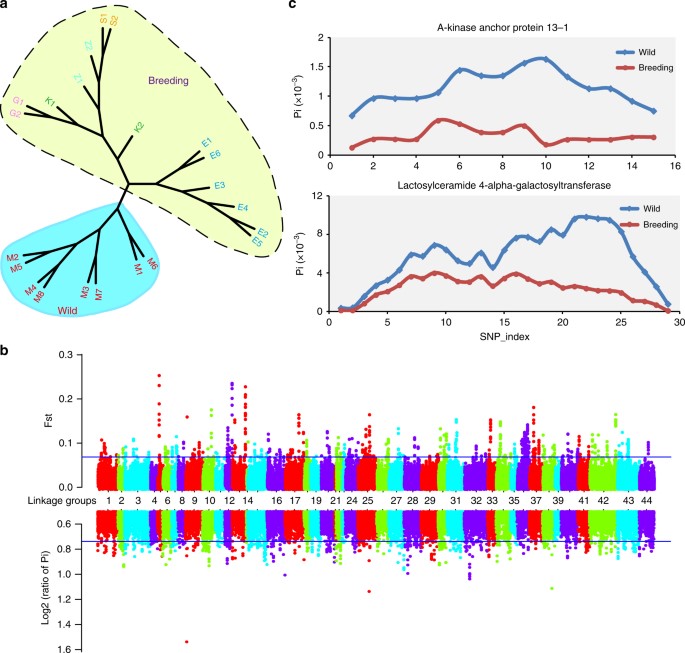
Hình 6. Đa dạng di truyền và phân tích quét chọn lọc ở tôm thẻ chân trắng L. vannamei. a Cây phát sinh gen của tôm giống (màu xanh) và tôm hoang dã (màu vàng) được xây dựng bằng cách sử dụng SNP toàn bộ bộ gen. M1−M8 đại diện cho tôm tự nhiên được thu thập từ Mexico, E1–E6 đại diện cho tôm giống được thu thập từ Ecuador, K1 và K2 đại diện cho giống số 1 Kehai từ Trung Quốc, G1 và G2 đại diện cho giống số 1 Guihai ở Trung Quốc, S1 và S2 đại diện cho tôm bố mẹ Cải tiến tôm ở Hoa Kỳ, Z1 và Z2 đại diện cho tôm bố mẹ Charoen Pokphand ở Thái Lan. b Quan điểm khác biệt trên toàn bộ bộ gen (FST) và giảm tính đa dạng (πhoang dã / π nhân giống) số liệu thống kê liên quan đến tôm tự nhiên và tôm giống. Đường màu xanh biểu thị 1% giá trị cấp xếp hạng cao nhất cho phần trăm theo kinh nghiệm. c Giá trị đa dạng di truyền θπ trong quần thể hoang dã và sinh sản đối với các gen mã hóa protein neo A-kinase 13-1 (AKAP13-1) và Lactosylceramide 4-alpha-galactosyltransferase (A4GALT). Phương pháp tiếp cận sliding-window (khung 2 Kb với gia số 400 bp) đã được sử dụng để tính toán θπ của mọi cửa sổ cho mỗi gen và chỉ số SNP biểu thị cửa sổ trượt của mỗi gen
So sánh chỉ số phân kỳ (FST) và tỷ lệ θπ (πhoang dã / πnhân giống) giữa quần thể hoang dã và quần thể nuôi cấy cho phép chúng tôi xác định 14 vùng (kích thước 1,66 Mb) (Hình 6b, c), chứa 28 gen dự đoán (Bảng bổ sung 24), đang trải qua chọn lọc mạnh mẽ. Các phân tích làm giàu GO và KEGG cho thấy con đường dẫn truyền tín hiệu protein Rho và con đường sinh tổng hợp glycosphingolipid được làm giàu. Hai bản sao của protein cố định A-kinase 13 (AKAP13), tham gia vào quá trình tải nạp tín hiệu protein Rho, được lựa chọn mạnh mẽ (Hình 6c, Hình bổ sung 29). AKAP13 là một protein khung có hoạt tính của yếu tố trao đổi guanine và đóng vai trò kích hoạt NF-κB qua trung gian TLR2, có liên quan đến khả năng miễn dịch bẩm sinh. Gen được chọn trong con đường sinh tổng hợp glycosphingolipid được chú thích là lactosylceramide 4-alpha-galactosyltransferase (A4GALT) (Hình 6c). A4GALT tham gia vào quá trình glycosyl hóa protein và biến đổi protein cần thiết cho quá trình tổng hợp thụ thể đối với độc tố vi khuẩn ở động vật có vú. Hơn nữa, một loại yếu tố kháng lipopolysacarit như protein (ALF) (Hình bổ sung 29) cần thiết để bảo vệ miễn dịch 55cũng được tìm thấy là dưới sự lựa chọn mạnh mẽ. Những dữ liệu này minh họa rằng nhân giống chọn lọc nhân tạo trong điều kiện nuôi ảnh hưởng đến khả năng kháng bệnh của tôm.
4. Thảo luận
Tổ hợp bộ gen chất lượng cao của L. vannamei cung cấp cơ hội để hiểu các quá trình sinh học khác nhau của tôm ở cấp độ bộ gen. Đặc điểm nổi bật nhất của vùng mã hóa trong bộ gen tôm là sự mở rộng của một loạt gen liên quan đến hệ thống thị giác, dẫn truyền tín hiệu thần kinh và lột xác. Những sự mở rộng gen này có thể đã mang lại cho tôm thị lực tuyệt vời và khả năng dẫn truyền tín hiệu thần kinh nhanh chóng, giúp tôm thích nghi tốt hơn với môi trường sống ở đáy. Việc lắp ráp bộ gen của chúng tôi cũng làm sáng tỏ quá trình lột xác và cung cấp bằng chứng quan trọng để khám phá những điểm tương đồng và khác biệt giữa động vật giáp xác và các sinh vật ngoài sinh thể khác, bao gồm cả côn trùng. Là một quá trình quan trọng ở tôm, lột xác có liên quan chặt chẽ với quá trình tăng trưởng, biến thái và sinh sản.
Các phân tích bộ gen của chúng tôi cũng cho thấy rằng gần 30 năm lai tạo đã tác động đáng kể đến bộ gen của tôm bố mẹ L. vannamei. Sự gia tăng sản lượng và hiệu quả nuôi trồng thủy sản có thể đạt được thông qua cải thiện di truyền của đàn nuôi. Bộ gen tôm được lắp ráp và số lượng lớn các dấu hiệu SNP sẽ cung cấp một nguồn tài nguyên hữu ích cho việc áp dụng các nghiên cứu kết hợp trên toàn bộ bộ gen và lựa chọn bộ gen, và do đó đẩy nhanh cải tiến di truyền trong nuôi tôm.
Theo Xiaojun Zhang, Jianbo Yuan, Yamin Sun, Shihao Li, Yi Gao, Yang Yu, Chengzhang Liu, Quanchao Wang, Xinjia Lv, Xiaoxi Zhang, Ka Yan Ma, Xiaobo Wang, Wenchao Lin, Long Wang, Xueli Zhu, Chengsong Zhang, Jiquan Zhang, Songjun Jin, Kuijie Yu, Jie Kong, Peng Xu, Jack Chen, Hongbin Zhang, Patrick Sorgeloos, …Jianhai Xiang
Nguồn: https://www.nature.com/articles/s41467-018-08197-4
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA- CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Không Hợp Lý Khi So Sánh Giá Tôm Việt Nam Và Tôm Ecuador
- Tối Ưu Hóa Tự Động Hóa Thức Ăn: Cải Thiện Hệ Thống Cho Ăn Theo Thời Gian Và Theo Yêu Cầu Trong Nuôi Tôm Thẻ Chân Trắng Litopenaeus Vannamei Trong Ao Nuôi Bán Thâm Canh
- Người Nuôi Tôm Úc Đưa Ra Lời Khuyên Khi Nuôi Tôm Sú Khi Bị WSSV “Gõ Cửa”

 English
English