Nghiên cứu này đánh giá hiệu suất tăng trưởng và khả năng chống oxy hóa in vivo của tôm thẻ chân trắng Litopenaeus vannamei được cho ăn khẩu phần có chứa chiết xuất nho Nho Nor 80. Thử nghiệm gồm một khẩu phần đối chứng chứa 1000 ppm vitamin E mà không thêm chiết xuất nho và 4 khẩu phần ăn khác chứa chiết xuất nho 250, 500, 750 và 1000 ppm. 20 con tôm nặng 0,02 g trong mỗi bể, được phân ngẫu nhiên vào 1 trong 5 khẩu phần ăn điều trị ở trên ba lần và cho ăn ba lần mỗi ngày để no trong sáu tuần. Trọng lượng cuối cùng, tỷ lệ tăng trọng và tốc độ tăng trưởng riêng của ấu trùng tôm được cho ăn khẩu phần chứa 250 và 500 ppm Nho Nor 80 cao hơn đáng kể so với những tôm được cho ăn khẩu phần khác. Mức độ hoạt tính superoxide dismutase của tôm được cho ăn khẩu phần ăn chứa 250 và 500 ppm Nho Nor 80 cao hơn đáng kể so với tôm được cho ăn khẩu phần ăn đối chứng. Mặt khác, mức chất phản ứng với axit thiobarbituric của tôm được cho ăn khẩu phần chứa 250 và 500 ppm Nho Nor 80 thấp hơn đáng kể so với tôm được cho ăn các khẩu phần ăn khác. Hơn nữa, khẩu phần Nho Nor 80 ở mức cao nhất, cụ thể là 750 và 1000 ppm, đã làm giảm hiệu suất tăng trưởng, cũng như mức độ thấp hơn của hoạt động chống oxy hóa in vivo. Do đó, để có hiệu suất tăng trưởng tốt nhất và mức độ hoạt động chống oxy hóa in vivo cao nhất, đã có đề xuất rằng mức tối ưu của Nho Nor 80 trong khẩu phần ăn của tôm thẻ chân trắng nằm trong khoảng từ 250 đến 500 ppm.
1. Giới thiệu
Tôm thẻ chân trắng Litopenaeus vannamei, một loài bản địa phân bố dọc theo bờ biển Đông Thái Bình Dương của Mexico, Trung Mỹ và Peru, hiện đã trở thành loài tôm He nuôi phổ biến nhất trên toàn thế giới (Dugassa và Gaetan, 2018; Lucas và cộng sự, 2019). Năm 2020, sản lượng nuôi tôm thẻ chân trắng toàn cầu là hơn 5.400.000 tấn và con số này chiếm khoảng 80% tổng sản lượng nuôi trồng giáp xác (FAO, 2022). Loại tôm này cho thấy tốc độ tăng trưởng nhanh, khả năng sống sót tốt trong môi trường nuôi mật độ cao và khả năng chịu đựng cao với nhiều độ mặn và nhiệt độ, do đó nó rất phù hợp với các hệ thống nuôi thâm canh. Tôm đã được sử dụng rộng rãi trong thương mại ở Đông Nam Á, bao gồm Ấn Độ, Thái Lan, Việt Nam, Trung Quốc và Đài Loan (Briggs và cộng sự, 2004). Thông thường, tôm thẻ chân trắng cần 5 đến 7 tháng nuôi trồng để đạt kích cỡ thương phẩm từ 15 đến 30 gam (Tacon và cộng sự, 2013). Thức ăn nuôi tôm là một phần của thực tiễn quản lý thức ăn, bao gồm bột cá đắt tiền cung cấp nguồn protein tuyệt vời trong công thức; do đó, chi phí cho những con tôm này ăn có thể lên tới 40% đến 60% tổng chi phí sản xuất khi áp dụng hệ thống bán thâm canh và thâm canh (Hardy và Tacon, 2002).
Để giảm chi phí thức ăn, một số nguồn protein thực vật và động vật đã được sử dụng thành công làm chất thay thế bột cá mà không ảnh hưởng đến sản lượng tôm (Davis và Arnold, 2000; Cummins và cộng sự, 2017). Đối với tôm thẻ chân trắng, hàm lượng protein tối ưu trong khẩu phần ăn dao động từ 32% đến 36% ở các giai đoạn tăng trưởng khác nhau (Lee và Lee, 2018). Tuy nhiên, ảnh hưởng của khẩu phần ăn cho tôm có bổ sung hóa chất thực vật, là thành phần hoạt tính sinh học có nguồn gốc từ thực vật và đồ uống có nguồn gốc thực vật, chẳng hạn như trái cây, rau, ngũ cốc, quả hạch, hạt, trà và rượu vang (Chakraborty và cộng sự, 2013; Encarnação, 2016), vẫn chưa được khám phá đầy đủ. Nhiều chất phytogenics này, được tìm thấy như alkaloid, flavonoid, terpenoid, polyphenol, tinh dầu và sắc tố, đã được khai thác làm phụ gia thức ăn chăn nuôi nhằm cải thiện hiệu suất tăng trưởng của cá (Chakraborty và cộng sự, 2013; Encarnação, 2016; Artés -Hernández và cộng sự, 2021).
Nho giàu polyphenol, có đặc tính như chất chống oxy hóa, kháng khuẩn, chống viêm và chống ung thư (Shi và cộng sự, 2003; Xia và cộng sự, 2010; Doshi và cộng sự, 2013). Thành phần phenolic dồi dào nhất trong hạt nho, chứa 74% đến 78% proanthocyanidin oligomers và 6% flavanol tự do (Shi và cộng sự, 2003; Burdock, 2005), tiếp theo là vỏ nho và cùi nho (Shi và cộng sự, 2003). Điều đáng chú ý là polyphenol từ nho đã được công nhận là có khả năng cải thiện sự hấp thụ chất dinh dưỡng và tăng trưởng sinh học của động vật trên cạn (Viveros và cộng sự, 2011; Aditya và cộng sự, 2018). Gà thịt được cho ăn khẩu phần bổ sung hạt nho, bã nho và chiết xuất bã nho có chứa polyphenol đã được chứng minh là có hiệu suất tăng trưởng cao hơn. Những phát hiện này được cho là nhờ cải thiện hình thái đường ruột và hệ vi sinh vật đường ruột tốt hơn (Viveros và cộng sự, 2011; Abu Hafsa và Ibrahim, 2018; Aditya và cộng sự, 2018). Chiết xuất proanthocyanidin từ hạt nho cũng đã được báo cáo là có tác dụng tăng cường giải phóng cả peptide-1 giống glucagon và peptide YY, hai loại hormone điều chỉnh sự thèm ăn và cân bằng nội môi glucose (Casanova-Marti và cộng sự, 2020). Với động vật thủy sản, hạt nho và chiết xuất từ bã nho được dùng làm chất phụ gia trong khẩu phần ăn để cải thiện sự phát triển của cá rô phi (Oreochromis niloticus) và tôm thẻ chân trắng (Zhai và cộng sự, 2014; Niyamosatha và cộng sự, 2015).
Hạt nho và bã nho dường như hoạt động như những chất chống oxy hóa mạnh giúp loại bỏ các gốc tự do gây ra stress oxy hóa trong tế bào, cả in vitro và in vivo (Bagchi và cộng sự, 1998; Bouhamidi và cộng sự, 1998; Bagchi và cộng sự, 2000; Jayaprakasha và cộng sự, 2003; Shi và cộng sự, 2003). Đặc biệt, khả năng chống oxy hóa của procyanidin trong hạt nho cao gấp 20 lần so với vitamin E (Uchida, 1980; Shi và cộng sự, 2003). Ở một số động vật trên cạn, khẩu phần ăn bao gồm hạt nho hoặc chiết xuất bã nho đã được phát hiện là có khả năng chống oxy hóa được cải thiện, cụ thể là tăng hoạt động superoxide dismutase (SOD) và giảm mức độ các chất phản ứng với axit thiobarbituric (TBARS) hoặc malodialdehyde (MDA) (Garcia và cộng sự, 2002; Park và cộng sự, 2014; Guerra-Rivas và cộng sự, 2016; Zhao và cộng sự, 2017; Aditya và cộng sự, 2018). Ngoài hoạt tính SOD được tăng cường, mức độ TBARS hoặc MDA giảm, các hợp chất phản ứng là kết quả của quá trình peroxid hóa lipid của các axit béo không bão hòa đa, đã được quan sát thấy ở gà thịt được cho ăn khẩu phần có chứa lượng hạt nho và bã nho ngày càng tăng (Abu Hafsa và Ibrahim, 2018; Aditya và cộng sự, 2018). Điều đáng ngạc nhiên là những con cừu đực được nuôi theo khẩu phần ăn có chứa chiết xuất rượu nho thậm chí còn cho thấy mức độ hoạt tính SOD cao hơn đáng kể, cũng như mức MDA trong tinh hoàn thấp hơn khi so sánh với những con được cho ăn khẩu phần ăn không có chiết xuất rượu nho (Zhao và cộng sự, 2017).
Đối với hầu hết động vật, mặc dù chiết xuất nho trong khẩu phần ăn đã được biết là có tác dụng cải thiện hiệu suất tăng trưởng và khả năng chống oxy hóa in vivo (Viveros và cộng sự, 2011; Chamorro và cộng sự, 2013; Park và cộng sự, 2014; Zhai và cộng sự, 2014; Niyamosatha và cộng sự, 2015; Zhao và cộng sự, 2017; Abu Hafsa và Ibrahim, 2018; Aditya và cộng sự, 2018), những điều này dường như cũng có tác động bất lợi đến hiệu suất tăng trưởng, liên quan đến khả năng tiêu hóa protein và axit amin nếu các sản phẩm nho được cung cấp ở mức cao hơn yêu cầu tối ưu của chúng (Chamorro và cộng sự, 2013; Zhai và cộng sự, 2014; Abu Hafsa và Ibrahim, 2018). Gà được cho ăn khẩu phần hạt nho hoặc chiết xuất hạt nho ở mức cao nhất (Chamorro và cộng sự, 2013; Abu Hafsa và Ibrahim, 2018), cũng như cá rô phi (O. niloticus) được cho ăn khẩu phần ăn chứa hàm lượng chiết xuất nho cao nhất (Zhai và cộng sự, 2014), cho thấy hiệu suất tăng trưởng giảm. Trước đây, tôm thẻ chân trắng được cho ăn khẩu phần ăn chứa 150 và 200 ppm Nho Nor 80, một chiết xuất nho thương mại bao gồm 80% polyphenol, được phát hiện có tỷ lệ tăng trọng cao hơn đáng kể so với những khẩu phần ăn có chứa ít hơn 150 ppm nho Nor 80 (Cheng và cộng sự, 2017). Khi lượng Nho Nor 80 trong khẩu phần ăn của tôm được tăng lên mức cao nhất là 200 ppm, thì sự gia tăng SOD và giảm mức TBARS cũng được lần lượt phát hiện (Cheng và cộng sự, 2017). Tuy nhiên, nồng độ Nho Nor 80 tối ưu trong khẩu phần ăn cho tôm thẻ chân trắng xét về hiệu suất tăng trưởng và khả năng chống oxy hóa vẫn chưa được xác định. Mục đích của nghiên cứu này là kiểm tra mức độ thích hợp của chiết xuất nho này để mang lại hiệu quả tăng trưởng tốt nhất cho tôm thẻ chân trắng. Hoạt tính chống oxy hóa in vivo, đặc biệt là hoạt tính SOD và nồng độ TBARS của tôm thẻ chân trắng cũng được đánh giá khi tôm được cho ăn khẩu phần ăn bổ sung Nho Nor 80 ở mức lớn hơn 200 ppm.
2. Vật liệu và phương pháp
5 khẩu phần ăn isonitrogenous (35% protein thô), isolipidic (9% lipid thô) và isoenergetic (300 Kcal/100 g) đã được xây dựng (Bảng 1). Khẩu phần ăn đối chứng chứa 1000 ppm vitamin E, trong khi 4 khẩu phần ăn khác chứa 250 (N250), 500 (N500), 750 (N750) và 1000 ppm (N1000) của chiết xuất Nho Nor 80, một chiết xuất của toàn bộ cây nho Vitis vinefera được cung cấp bởi Kaye Bio-tech Co., Đài Loan. Nho Nor 80 đã được chứng minh là chứa 80% polyphenol trong đó 60% là proanthocyanidin và 0,75% là anthocyanin. Bột cá được sử dụng làm nguồn protein. Hỗn hợp dầu cá và dầu ngô (w/w) theo tỷ lệ 2:1 được sử dụng làm nguồn lipid. Bột mì và tinh bột ngô được sử dụng làm nguồn carbohydrate và cũng đóng vai trò là chất kết dính. Cellulose cũng được đưa vào để cân bằng thành phần của khẩu phần ăn. Khi chuẩn bị khẩu phần thử nghiệm, tất cả các thành phần trong khẩu phần trước tiên được nghiền thành các hạt nhỏ bằng máy nghiền búa và sau đó được đưa qua sàng lưới 250 μm. Các thành phần khô sau đó được trộn kỹ bằng máy để đảm bảo tính đồng nhất trước khi thêm dầu. Hỗn hợp này, sau khi thêm nước cất, được trộn cho đến khi tạo thành một khối bột đồng nhất. Mỗi khẩu phần được ép đùn qua máy băm (đường kính khuôn 3,0 mm) để tạo thành dạng viên. Sau đó, các viên này được nghiền thành các hạt nhỏ (<500 μm) và sấy khô trong lò không khí ở 600℃ trong 12 giờ và cuối cùng 5 khẩu phần thí nghiệm được bảo quản riêng ở 4℃ trong tủ lạnh cho đến khi sử dụng.
Bảng 1. Thành phần thành phần thức ăn cho tôm thẻ chân trắng.
Tôm giống 20 ngày sau khi nở được lấy từ một trang trại nuôi trồng thủy sản địa phương (Pintung, Đài Loan), nơi nhiệt độ nước và độ mặn lần lượt dao động từ 28°C đến 30°C và 30‰ đến 33‰, sau đó được thuần trong môi trường nuôi. Bể sợi thủy tinh 2000L tại Đại học Quốc gia Hải Dương Đài Loan trong một tuần. Trong giai đoạn thuần, tôm được nuôi ở nhiệt độ 26-28°C và cho ăn khẩu phần đối chứng. Khi bắt đầu thử nghiệm cho ăn, tôm có trọng lượng ban đầu là 0,02 g, bị bỏ đói trong 24 giờ trước khi chúng được phân ngẫu nhiên vào 15 bể thủy tinh (57 x 35 x 30 cm), mỗi bể cuối cùng chứa 20 con tôm. Ba nhóm tôm lặp lại được cho ăn 1 trong 5 khẩu phần ăn nghiệm thức 3 lần/ ngày. Họ được cho ăn 30% trọng lượng cơ thể hàng ngày cho đến khi no trong 6 tuần. Bể thí nghiệm là hệ thống khép kín được sục khí liên tục. Một nửa lượng nước trong mỗi bể được thay mới hàng ngày để duy trì chất lượng nước. Nhiệt độ nước, độ mặn, oxy hòa tan và pH dao động lần lượt trong khoảng 25 đến 28°C, 31‰ và 33‰, 5,6 mg/L và 7,0 mg/L và 8,1 và 8,5. Nồng độ tổng nitơ amoniac được duy trì ở mức dưới 0,05 ppm trong toàn bộ thời gian thử nghiệm cho ăn. Thức ăn thừa và phân được loại bỏ ra khỏi mỗi bể hàng ngày. Khi kết thúc thử nghiệm cho ăn, việc cho ăn được dừng lại trong 24 giờ trước khi cân. Từng con tôm được cân riêng, bỏ vào nước đá rồi mổ xẻ cẩn thận. Mô cơ của từng con tôm được nuôi trong cùng một bể được gộp lại, sấy khô và đồng nhất (n=3) để tiến hành phân tích gần đúng 2 lần. Song song đó, gan tụy của tôm từ mỗi bể được phân lập và gộp lại để đo hoạt động SOD và mức TBARS (n=3).
Các thông số tăng trưởng của tôm được tính theo công thức sau:
Tăng trọng (%) = 100 % x (Wt– W0) /W0, Và
Tốc độ tăng trưởng cụ thể (SGR) (%/ ngày) = 100% x [ (ln Wt– ln W0) /t ]
trong đó W0 là trọng lượng cơ thể trung bình ban đầu (g), Wt là trọng lượng cơ thể trung bình cuối cùng (g).
Thành phần của khẩu phần thí nghiệm và mẫu cơ tôm được phân tích theo phương pháp AOAC (1984). Protein thô được xác định bằng hệ thống Kjeldahl (hệ thống Kjeldahl 1002, Tecator, Thụy Điển) sau khi phân hủy bằng axit. Lipid thô được đo bằng phương pháp chiết chloroform và metanol (2:1, v/v) (Folch và cộng sự, 1957). Chất xơ thô được xác định bằng phương pháp phân hủy axit và kiềm bằng hệ thống Fibertec M 1020 (Foss Tecator, Thụy Điển). Độ ẩm và độ tro được xác định bằng phương pháp thông thường bằng cách sử dụng lần lượt lò nung ở nhiệt độ 105℃C và lò múp ở 540℃. Dịch chiết không chứa nitơ (NFE) được tính như sau:
NFE= [100 – (protein thô + lipid thô + chất xơ thô + tro)] %.
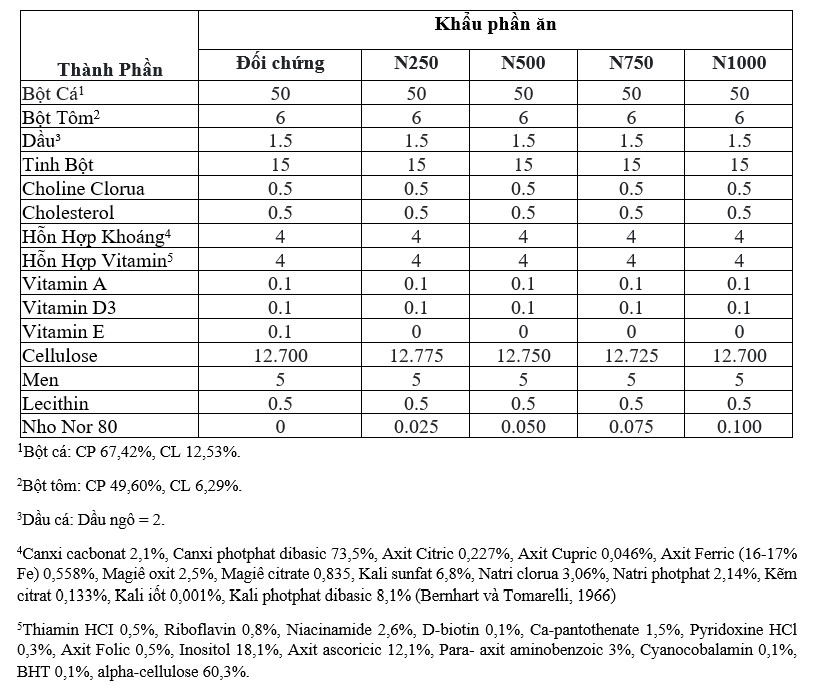
Một phân tích gần đúng về khẩu phần thử nghiệm được trình bày trong Bảng 2. Hàm lượng Protein thô, lipid thô, tro, chất xơ thô và NFE của khẩu phần nghiệm thức lần lượt dao động từ 37,85% đến 38,03%, 8,86% đến 9,03%, 14,11% đến 14,23%, 11,90% đến 12,29% và 26,59% đến 27,77%..
Bảng 2. Thành phần gần đúng của khẩu phần ăn cho tôm thẻ chân trắng.
Hoạt tính SOD của từng mẫu gan tụy gộp được đo bằng bộ xét nghiệm SOD (bộ xác định SOD 19160, Sigma, Hoa Kỳ). Tóm lại, tổng cộng 0,5 g mô gan tụy đã được đồng nhất hóa trong dung dịch đệm phosphat 0,1 M bằng chất đồng nhất T25 (IKA, Đức). Chất đồng nhất sau đó được ly tâm ở tốc độ 3000 vòng/ phút trong 10 phút và phần nổi phía trên được thu thập. Từ thời điểm này trở đi, quy trình được mô tả trong sổ tay hướng dẫn của bộ xét nghiệm SOD đã được tuân theo. Dung dịch làm việc trong bộ sản phẩm, cụ thể là WST-1 (2- (4-iodopheny) – 3- (4-nitophenyl) -5- (2, 4-disulfophenyl) -2 H tetrazolium), phản ứng với các gốc superoxide được tạo ra với sự có mặt của oxy và enzyme xanthine oxidase. Các gốc superoxide sẽ bị giảm và điều này dẫn đến sự hình thành thuốc nhuộm formazan tan trong nước màu vàng. Tuy nhiên, các anion superoxide cũng bị khử bởi SOD và phản ứng như vậy sẽ làm giảm lượng formazan được hình thành. Do đó, sau khi đo mật độ quang ở bước sóng 450 nm bằng máy đo quang phổ (Synergy HT, Biotek, USA), hoạt tính SOD có thể được biểu thị bằng tỷ lệ ức chế phần trăm.
TBARS được đo bằng phương pháp của Kornbrust và Mavis (1980). Tổng cộng 1g mô gan tụy đã được đồng nhất hóa trong dung dịch đệm (0,15M KCL và 5 mM Tris-maleate, pH 7,4) bằng chất đồng nhất T25 (IKA, Đức). Tiếp theo, 1 ml axit ascorbic (2 mM) được thêm vào và hỗn hợp này được ủ ở 370C trong 30 phút. Sau khi thêm 5 ml HCL (0,7 M) và 5 ml axit thiobarbituric (0,05 M), các mẫu được đun sôi trong 25 phút rồi đặt trên đá. Tiếp theo, thêm 5 ml axit trichloroacetic (200 g/L) và sau đó mẫu được ly tâm ở tốc độ 495 g trong 5 phút. Chất nổi phía trên được thu thập để đo lượng TBARS hiện diện bằng máy quang phổ U-1800 (Hitachi, Nhật Bản) ở bước sóng 530nm. Nồng độ TBARS được biểu thị bằng microgam malondialdehyd tương đương trên miligam mô gan tụy. Dung dịch MDA tiêu chuẩn (Sigma T-1642) được sử dụng để tạo đường chuẩn nhằm đo nồng độ MDA trong từng mẫu gan tụy tôm gộp.
Sự khác biệt đáng kể giữa các nghiệm thức được phân tích bằng phân tích phương sai (ANOVA) sau khi xác nhận tính đồng nhất của phương sai bằng thử nghiệm Levene (Snedesign và Cochran, 1980). Phân tích phương sai một chiều được thực hiện để kiểm tra sự khác biệt về tỷ lệ tăng trọng, SGR và tỷ lệ sống trong năm nghiệm thức. Khi quan sát thấy sự khác biệt đáng kể, thử nghiệm phạm vi Turkey được sử dụng để so sánh sự khác biệt giữa các nghiệm thức. Dữ liệu phần trăm tăng trọng được chuyển đổi log trong khi các dữ liệu khác được chuyển đổi arcsine trước khi phân tích thống kê. Các quy trình tương phản đa thức được áp dụng để phát hiện xu hướng tuyến tính và bậc hai giữa các thông số tăng trưởng của tôm và khẩu phần ăn của nho Nor 80. Mức ý nghĩa được đặt ở p<0, 05 và tất cả các phân tích thống kê được thực hiện bằng chương trình phần mềm SAS dành cho Windows (V.9.3., Viện SAS, Cary, NC, Hoa Kỳ).
3. Kết quả
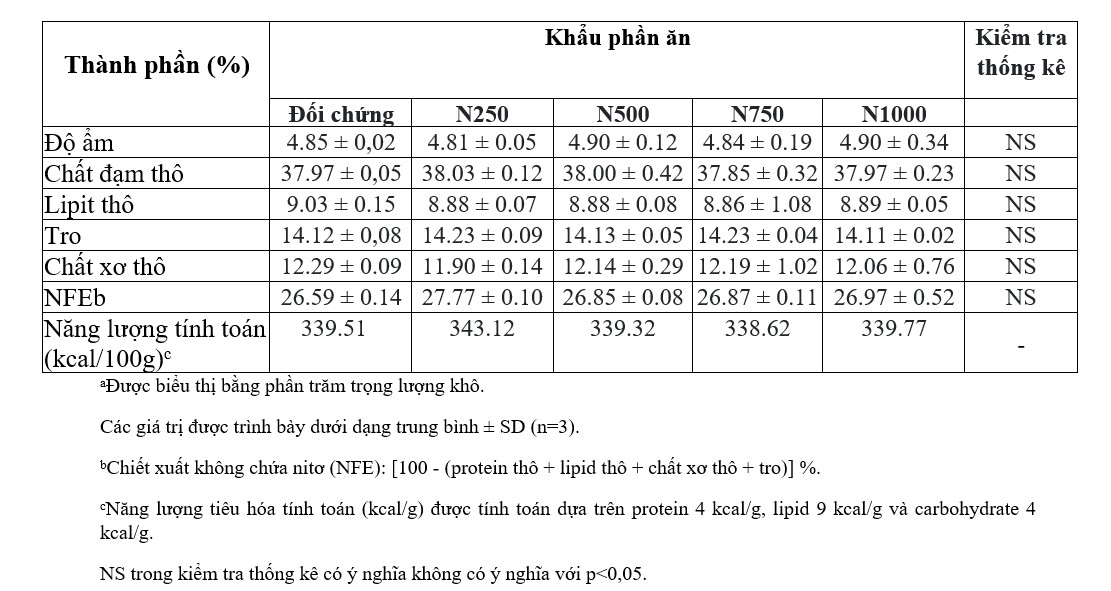
Hiệu suất tăng trưởng và tỷ lệ sống của tôm thẻ chân trắng được cho ăn khẩu phần thử nghiệm trong 6 tuần được thể hiện trong Bảng 3. Tỷ lệ sống của tôm thẻ chân trắng được cho ăn khẩu phần nghiệm thức trong mọi trường hợp đều trên 90%. Tôm được cho ăn khẩu phần ăn chứa các hàm lượng nho Nor 80 khác nhau cho thấy hiệu suất tăng trưởng tốt hơn so với tôm được cho ăn khẩu phần ăn đối chứng có chứa 1000 ppm vitamin E mà không có nho Nor 80. Trọng lượng cuối cùng, tỷ lệ tăng trọng và SGR của tôm thẻ chân trắng được cho ăn khẩu phần ăn có chứa Nho Nor 80. 250 và 500 ppm Nho Nor 80 cao hơn đáng kể so với tôm được cho ăn các khẩu phần ăn khác. Tuy nhiên, không có sự khác biệt đáng kể nào được tìm thấy về trọng lượng cuối cùng, tỷ lệ tăng trọng và SGR của tôm thẻ chân trắng được cho ăn khẩu phần chứa 250 và 500 ppm Nho Nor 80. Chỉ có xu hướng bậc hai được phân tích bằng cách sử dụng quy trình tương phản đa thức giữa các thông số tăng trưởng và hàm lượng Nho Nor 80 cho thấy sự khác biệt đáng kể.
Bảng 3. Trọng lượng ban đầu, trọng lượng cuối cùng, tỷ lệ tăng trọng, SGR và tỷ lệ sống của tôm thẻ chân trắng được cho ăn khẩu phần ăn trong 6 tuần.
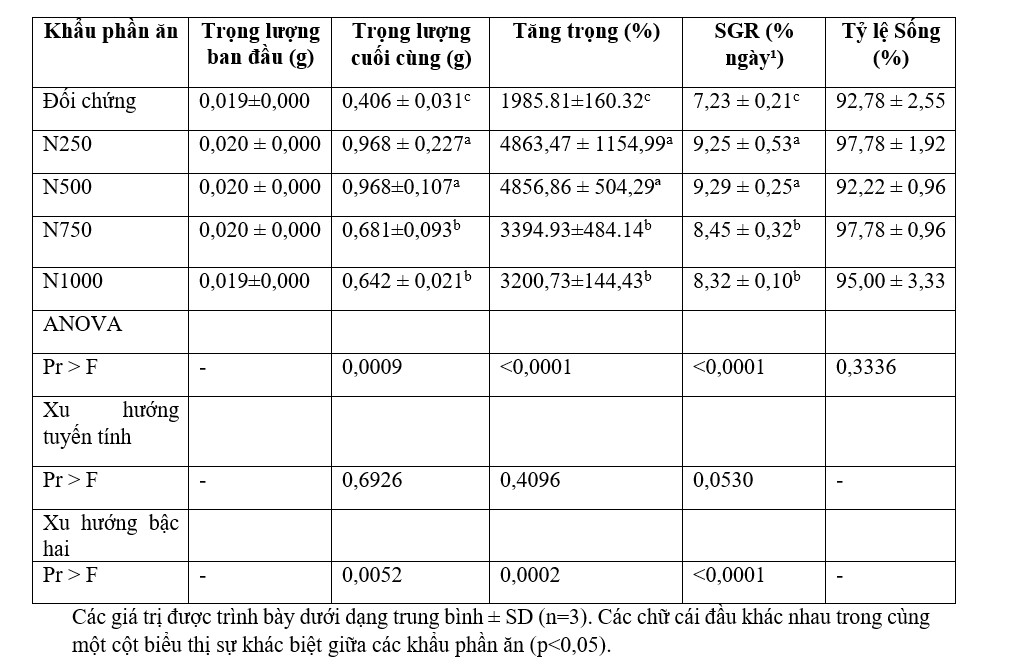
Phân tích gần đúng về cơ của tôm thẻ chân trắng được cho ăn khẩu phần nghiệm thức trong 6 tuần được thể hiện trong Bảng 4. Hàm lượng protein thô trong mô cơ của tôm được nuôi bằng khẩu phần ăn điều trị đều trên 80%. Hàm lượng Lipit thô của cơ tôm ăn khẩu phần xử lý dao động từ 6,81 – 7,38%, hàm lượng tro của mô cơ tôm ăn khẩu phần xử lý dao động từ 6,61 – 6,91%.
Bảng 4. Phân tích gần đúng các mẫu cơ từ tôm thẻ chân trắng được cho ăn theo khẩu phần ăn trong 6 tuần.
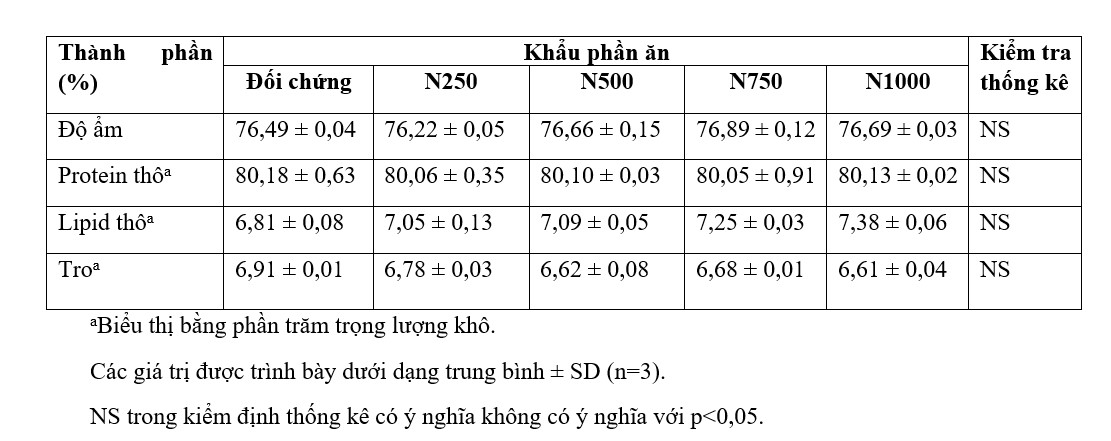
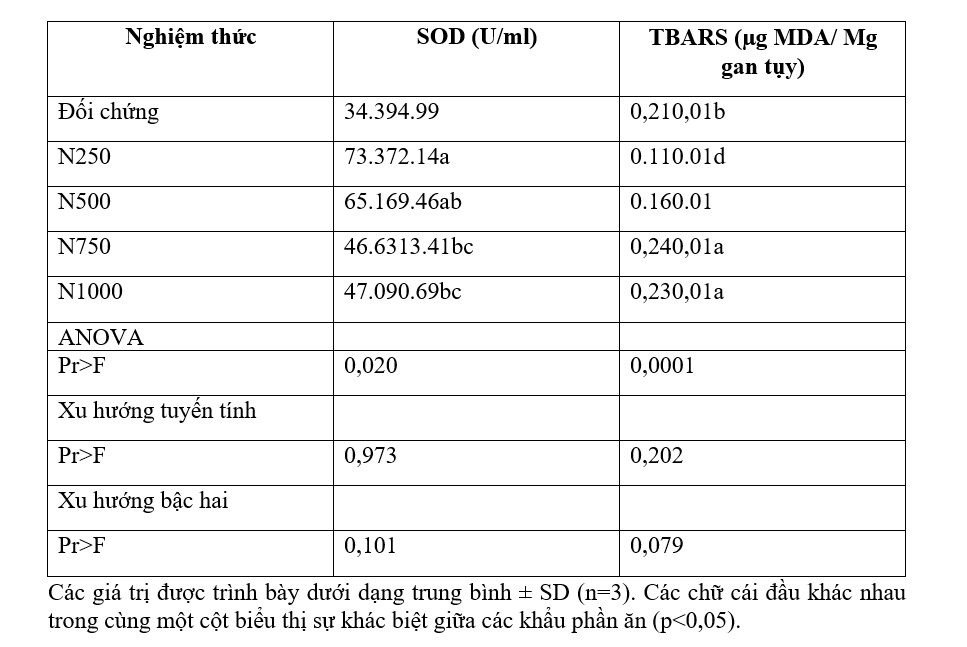
Mức độ hoạt tính SOD và lượng TBARS có trong các mẫu gan tụy của tôm thẻ chân trắng được cho ăn khẩu phần ăn thử nghiệm trong 6 tuần được thể hiện trong Bảng 5. Hoạt tính SOD cao nhất và mức TBARS thấp nhất được tìm thấy trong gan tụy của tôm được cho ăn khẩu phần chứa 250 ppm Nho Nor 80. Cả giá trị SOD và mức TBARS trong gan tụy của tôm được cho ăn khẩu phần ăn chứa 250 ppm Nho Nor 80. Cả giá trị SOD và mức TBARS trong gan tụy của tôm được cho ăn khẩu phần ăn chứa 250 ppm Nho Nor 80 khác biệt đáng kể so với tôm được cho ăn khẩu phần ăn đối chứng có chứa 1000 ppm vitamin E. Tuy nhiên, giá trị SOD gan tụy của tôm được cho ăn khẩu phần ăn chứa 250 và 500 ppm của Nho Nor 80 không khác biệt đáng kể. Ngược lại, mức TBARS trong gan tụy của tôm được cho ăn khẩu phần ăn chứa 250 ppm Nho Nor 80 thấp hơn đáng kể so với tôm được cho ăn các khẩu phần ăn khác. Sự giảm hoạt động SOD và sự gia tăng mức TBARS trong gan tụy của tôm được cho ăn các khẩu phần ăn điều trị mà không so sánh với khẩu phần ăn đối chứng.
Bảng 5. Hoạt tính SOD và nồng độ TBARS trong gan tụy của tôm thẻ chân trắng được cho ăn khẩu phần ăn trong 6 tuần.
4. Thảo luận
Tác động tích cực và tiêu cực của chiết xuất nho đã được quan sát thấy liên quan đến hiệu suất tăng trưởng của tôm thẻ chân trắng. Trong nghiên cứu này, tôm thẻ chân trắng được cho ăn khẩu phần ăn bổ sung 250 và 500 ppm nho Nor 80 cho thấy hiệu suất tăng trưởng tốt nhất tương đương và hiệu suất tăng trưởng giảm được quan sát thấy ở tôm thẻ chân trắng được cho ăn khẩu phần ăn chứa 750 và 1000 ppm nho Nor 80. Cả cá rô phi và tôm được cho ăn khẩu phần ăn bổ sung phụ phẩm từ nho, tùy thuộc vào liều lượng sử dụng, đều cho thấy hiệu suất tăng trưởng được cải thiện hoặc giảm (Zhai và cộng sự, 2014; Rosas và cộng sự, 2022). Ở cá rô phi O. niloticus, mức tăng trọng tăng lên khi khẩu phần chứa lượng proanthocyanidin trong hạt nho ngày càng tăng (0, 200 và 400 ppm) và sau đó là sự giảm khi hàm lượng proanthocyanidin trong hạt nho tăng lên 600 và 800 ppm (Zhai và cộng sự, 2014).). Tương tự, tôm thẻ chân trắng được cho ăn khẩu phần ăn chứa bã nho 2,5 x 104 ppm có thông số tăng trưởng cao nhất, trong khi tôm được cho ăn khẩu phần ăn chứa bã nho 1,5 x 105 ppm cao nhất cho hiệu suất tăng trưởng thấp nhất (Rorass và cộng sự, 2022). Mặc dù polyphenol nho khi được đưa vào khẩu phần ăn với liều lượng thấp hơn, trước đây được mô tả là có lợi cho hiệu suất tăng trưởng của nhiều loại động vật (Dolara và cộng sự, 2005; Rhodes và cộng sự, 2006; Kao và cộng sự, 2010; Tucsek và cộng sự, 2011; Viveros và cộng sự, 2011; Fiesel và cộng sự, 2014; Zhai và cộng sự, 2014; Shimizu, 2017; Abu Hafsa và Ibrahim, 2018; Ao và Kim, 2020), rõ ràng là có những tác động bất lợi đến hiệu suất tăng trưởng của vật nuôi được cho ăn khẩu phần có hàm lượng phụ phẩm nho cao. Điều này có thể là do sự gia tăng các yếu tố kháng dinh dưỡng có trong nho, chẳng hạn như alkaloid, saponin và tannin (Shi và cộng sự, 2003; Iriti và Faoro, 2006), cũng như các tương tác polyphenol-protein nho tăng cường có khả năng làm giảm giá trị dinh dưỡng của protein có trong nền thực phẩm (Shi và cộng sự, 2003). Do đó, chúng tôi đề xuất rằng mức thức ăn của Nho Nor 80 cho 0,02 g tôm thẻ chân trắng không được lớn hơn 500 ppm để ngăn ngừa những tác động bất lợi nêu trên đối với hiệu suất tăng trưởng của tôm.
Trong nghiên cứu này, đã có giả thuyết rằng chiết xuất nho trong khẩu phần ăn giúp tăng cường hiệu suất tăng trưởng của động vật và điều này có thể là do các thành phần phenolic có trong chất bổ sung, có tác dụng thúc đẩy sức khỏe đường ruột. Một số thành phần phenolic trong chiết xuất nho được biết là có hoạt tính kháng khuẩn có thể làm thay đổi hệ vi sinh vật đường ruột (Dolara và cộng sự, 2005; Rhodes và cộng sự, 2006; Kao và cộng sự, 2010; Viveros và cộng sự, 2011; Zhai và cộng sự., 2014; Abu Hafsa và Ibrahim, 2018; Ao và Kim, 2020), cũng như khả năng làm giảm tình trạng viêm ruột (Kao và cộng sự, 2010; Tucsek và cộng sự, 2011;Fiesel và cộng sự, 2014; Shimizu, 2017). Anthocyanin và các chất chuyển hóa của chúng khi tương tác với hệ vi sinh vật đã được báo cáo là có tác dụng tăng cường sự phát triển của Bifidobacteria spp. và Lactobacillus – Enterococcus spp. (Hidalgo và cộng sự, 2012). Ở chuột, gà thịt và vịt Bắc Kinh, việc tiêu thụ polyphenol trong rượu vang đỏ và hạt nho đã được chứng minh là không chỉ làm tăng số lượng vi khuẩn sinh học trong hồi tràng và đại tràng như Lactobacilli và Bifidobacteria spp., mà còn ức chế sự phát triển của vi khuẩn có hại trong ruột, chẳng hạn như Escherichia coli, Clostridia và Streptococcus (Dolara và cộng sự, 2005; Abu Hafsa và Ibrahim, 2018; Ao và Kim, 2020). Ngoài ra, các hợp chất phenolic trong nho đã được phát hiện là có khả năng điều chỉnh hình thái đường ruột ở gia cầm (Viveros và cộng sự, 2011; Ao và Kim, 2020). Ở giai đoạn tôm post của tôm nước ngọt Macrobrachium rosenbergii, hoạt động của các enzyme tiêu hóa đã được quan sát thấy tăng lên khi bã nho được đưa vào khẩu phần ăn (Bhavan và cộng sự, 2013). Hệ vi sinh vật đường ruột chiếm ưu thế của tôm thẻ chân trắng được cho ăn khẩu phần ăn có chứa tannin, một phần của polyphenol có trong nho, gần đây đã được mô tả và phát hiện bao gồm Proteobacteria và Bacteroidota (Bolívar-Ramírez và cộng sự, 2022); đây là những nhóm vi khuẩn thường hiện diện trong đường ruột của tôm khỏe mạnh (Xiong và cộng sự, 2017; Ayiku và cộng sự, 2020; Schleder và cộng sự, 2020). Kết hợp những phát hiện này lại với nhau, chúng tôi cho rằng polyphenol nho cải thiện sự hấp thụ chất dinh dưỡng bằng cách ảnh hưởng trực tiếp đến đường tiêu hóa của động vật và do đó nâng cao hiệu suất tăng trưởng của những động vật này, bao gồm cả tôm thẻ chân trắng trong trường hợp của chúng tôi.
Trước đây, tôm thẻ chân trắng được cho ăn khẩu phần chứa 50 đến 200 ppm Nho Nor 80 đã được chứng minh là có sự gia tăng hoạt tính SOD và giảm mức TBARS (Cheng và cộng sự, 2017). Trong nghiên cứu này, khả năng chống oxy hóa in vivo của gan tụy của tôm thẻ chân trắng được cho ăn khẩu phần chứa 250 đến 1000 ppm Nho Nor 80 cũng cho thấy xu hướng liên quan đến việc giảm hoạt tính SOD và tăng mức TBARS khi mức độ của Nho Nor 80 tăng lên. Cho đến nay, tác dụng phụ của các sản phẩm phụ từ nho trong khẩu phần ăn đối với hoạt động chống oxy hóa in vivo vẫn chưa được nghiên cứu ở động vật trên cạn (Abu Hafsa và Ibrahim, 2018; Aditya và cộng sự, 2018; Ao và Kim, 2020). Vịt Bắc Kinh được cho ăn khẩu phần chứa 0, 0,01 và 0,02% chiết xuất hạt nho cho thấy sự gia tăng các thông số tăng trưởng và nồng độ SOD huyết thanh, đồng thời giảm giá trị TBARS huyết thanh (Ao và Kim, 2020). Sự gia tăng tương tự trong hoạt tính SOD và giảm nồng độ TBARS cũng được tìm thấy trong huyết thanh và thịt của gà thịt được cho ăn khẩu phần bổ sung lượng bã nho và hạt nho ngày càng tăng (Abu Hafsa và Ibrahim, 2018; Aditya và cộng sự, 2018). Mặt khác, Rosas và cộng sự (2022) đã cho thấy sự giảm mức TBARS trong gan tụy của tôm thẻ chân trắng được cho ăn khẩu phần chứa 0, 2,5 và 5% bã nho; điều này đi kèm với sự gia tăng nhẹ mức TBARS trong gan tụy của tôm thẻ chân trắng, do bã nho trong khẩu phần ăn đã tăng từ 5% lên 15%. Do đó, có thể động vật được cho ăn khẩu phần ăn có chứa chiết xuất nho có mức bổ sung tối ưu và vượt quá mức tối ưu này sẽ dẫn đến hiệu suất tăng trưởng giảm và tác động bất lợi đến khả năng chống oxy hóa in vivo.
Các nhà sản xuất thức ăn chăn nuôi đã sử dụng vitamin E làm chất chống oxy hóa trong thức ăn thủy sản trong nhiều thập kỷ qua. Về mức tăng trọng cao nhất, hoạt động SOD tối ưu và mức TBARS thấp nhất, kết quả của nghiên cứu này chỉ ra rằng 250 ppm Nho Nor 80 phù hợp hơn 1000 ppm vitamin E khi sản xuất thức ăn thủy sản cho tôm thẻ chân trắng. Trong nghiên cứu này, mức tăng trọng của tôm được cho ăn khẩu phần ăn bổ sung 250 ppm Nor-nho 80 cao hơn gần 2,5 lần so với tôm được cho ăn khẩu phần ăn chứa 1000 ppm vitamin E. Chiết xuất nho Nor- nho 80 ở mức tối ưu là một chất chống oxy hóa mạnh mẽ không chỉ có khả năng thúc đẩy hiệu suất sinh trưởng và khả năng chống oxy hóa in vivo của tôm thẻ chân trắng, nhưng sử dụng nho Nor-80 cũng sẽ làm giảm chi phí thức ăn cho tôm thẻ chân trắng trong hệ thống nuôi trồng thủy sản. Năm 2022, giá Nho Nor 80 và vitamin E tại thị trường Đài Loan lần lượt là 10 USD/kg và 30 USD/kg. Nếu 1000 ppm vitamin E được thay thế hoàn toàn bằng tối thiểu 250 ppm Nho Nor 80, loại giúp tôm thẻ chân trắng đạt năng suất cao nhất, chi phí thức ăn thủy sản sẽ giảm 27,5 USD/tấn. Không xét đến các vấn đề trên, mức thức ăn tối ưu của Nho Nor 80 cho tôm thẻ chân trắng nằm trong khoảng từ 250 đến 500 ppm sẽ mang lại hiệu suất tăng trưởng tối đa. Đây là một phạm vi rộng và cần có thêm các thử nghiệm cho ăn tôm thẻ chân trắng trên quy mô lớn hơn để xác định chính xác mức khẩu phần ăn tối ưu của Nho Nor 80 giúp tăng trọng tốt nhất.
Theo Angela Chien, Ya Chi Cheng, Shyn Shin Sheen, Palph Kirby
Nguồn: https://www.frontiersin.org/articles/10.3389/fmars.2023.1104870/full
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Acinetobacter venetianus, Một Tác Nhân Tiềm Ẩn Gây Bệnh Đỏ Chân Ở Tôm Thẻ Chân Trắng Penaeus vannamei Nuôi Trong Môi Trường Nước Ngọt
- GSA Dự Báo Sản Lượng Tôm Toàn Cầu Năm 2023 Sẽ Giảm Xuống, Nhưng Sẽ Tăng Gần 6 Triệu Tấn Vào Năm 2024
- Quan Tâm Đến Hệ Vi Sinh Vật: Giải Trình Tự Hệ Vi Sinh Vật Như Một Bước Chuẩn Bị Ban Đầu Của Việc Quản Lý Sản Xuất Thích Ứng

 English
English