TÓM TẮT
Tác dụng của việc bổ sung hỗn hợp probiotic Bacillus subtilis và B. licheniformis vào hệ thống aquaponics đối với chất lượng nước, tăng trưởng và hoạt động của enzyme tiêu hóa ở cá rô phi Mozambique, Oreochromis mossambicus, đã được thử nghiệm. Cá (36,4 g/con ± 0,10; thể tích bể 3,64 kg/m3, 10 con mỗi bể) được nuôi trong hệ thống 386L và cho ăn 2% khối lượng cơ thể/ngày trong 10 tuần. Sản phẩm Bacillus (Sanolife®PRO-W; 5,0 × 1010 CFU/g) được thêm vào 2 lần/tuần. Mỗi nghiệm thức được lặp lại 2 lần. Sản phẩm này làm giảm tổng chất rắn hòa tan và độ dẫn điện, đồng thời làm tăng trọng lượng của cá rô phi Mozambique. Không có sự khác biệt giữa nhóm thử nghiệm và nhóm đối chứng trong phân tích thành phần gần đúng. Ở nghiệm thức Bacillus, hoạt tính của các enzym tiêu hóa α-amylase, protease kiềm và phosphatase kiềm cao hơn so với nghiệm thức đối chứng. Probiotic được sử dụng trong nghiên cứu này đã cải thiện chất lượng nước và tăng tốc độ tăng trưởng của cá.
GIỚI THIỆU
Dân số thế giới ngày càng tăng và nhu cầu bảo tồn tài nguyên thiên nhiên đã dẫn đến sự phát triển của các hệ thống nuôi trồng thủy sản thâm canh thân thiện với môi trường. Hệ thống Aquaponics là hệ thống nuôi trồng thủy sản tuần hoàn kết hợp sản xuất cá và trồng cây không cần đất (Rakocy, Masser và Losordo 2006). Những hệ thống này làm giảm nhu cầu đầu vào về nguồn nước và tài nguyên nông nghiệp thông qua tái chế chất dinh dưỡng (Munguia-Fragozo và cộng sự 2015). Công nghệ này góp phần mang lại sự bền vững cho ngành nuôi trồng thủy sản (Boyd và cộng sự 2020; Yep và Zheng 2019) vì mức tiêu thụ nước thấp hơn so với hệ thống tuần hoàn khép kín (Yep và Zheng 2019). Trong các hệ thống này, cá rô phi là loài thủy sản được nuôi phổ biến nhất, theo báo cáo của 55% số người được hỏi trong một cuộc khảo sát quốc tế (Love và cộng sự 2014). Các loài quan trọng là cá rô phi sông Nile, Oreochromis niloticus và cá rô phi xanh, O. aureus (Somerville và cộng sự 2014), trong khi ở Nam Phi, 82% số người tham gia khảo sát đã nuôi cá rô phi O. mossambicus trong hệ thống aquaponics (Mchunu, Lagerwall và Senzanje 2018).
Nguồn nước cung cấp cho hệ vi sinh vật, cá và thực vật trong một môi trường phải phù hợp với yêu cầu cụ thể của chúng (Lennard và Goddek, 2019), đồng thời giữ cho cá khỏe mạnh để đảm bảo hiệu quả sử dụng thức ăn cao và tăng trưởng nhanh (Yildiz và cộng sự 2019, 2017). Việc sử dụng vi khuẩn probiotic là một phương pháp thân thiện với môi trường để kiểm soát và xử lý sinh học nhằm phát triển ngành nuôi trồng thủy sản bền vững. Probiotic có thể được thêm vào nước hoặc bổ sung vào thức ăn cho cá. Việc tích hợp probiotic vào hệ thống aquaponics có thể làm giảm bớt sự biến động của vi chất dinh dưỡng và cải thiện chất lượng nước (Da Silva Cerozi và Fitzsimmons 2016). Các loài vi khuẩn probiotic giúp tăng cường sự tăng trưởng và cải thiện khả năng miễn dịch của sinh vật trong nước bao gồm Arthrobacter, Bacillus, Enterococcus, Lactobacillus, Lactococcus, Micrococcus, Pediococcus, Aeromonas, Enterobacter, Vibrio, Pseudomonas và Roseobacter (Balcázar và cộng sự 2006; Gatesoupe 1999; Irianto và Austin 2002; Vine, Leukes và Kaiser 2006). Các loài Bacillus tạo ra các hợp chất có hoạt tính chống lại các vi khuẩn có hại (Vine, Leukes và Kaiser 2006). Ngoài ra, chúng cũng tồn tại tốt trong nhiều điều kiện môi trường khác nhau (Kuebutornye, Abarike và Lu 2019) và đóng một vai trò quan trọng bằng cách loại bỏ nitơ khỏi hệ thống nuôi trồng thủy sản. Mặc dù các loài Bacillus nằm trong số những chất kích thích tăng trưởng thực vật được nghiên cứu thường xuyên nhất (Ahmad, Ahmad và Khan 2008; Da Silva Cerozi và Fitzsimmons 2016), nhưng lại có rất ít thông tin về vai trò của chúng đối với sức khỏe của cả cá và thực vật trong hệ thống aquaponics. Probiotic điều chỉnh hệ vi sinh vật đường ruột (Nayak 2010) và tăng khả năng miễn dịch dịch thể (Kuebutornye, Abarike và Lu 2019) ở cá. Chúng cũng ảnh hưởng đến hoạt động của enzyme tiêu hóa ở cá và ảnh hưởng đến khả năng tiêu hóa chất dinh dưỡng và sử dụng thức ăn. Điều này đạt được bằng cách bổ sung sản phẩm vào chế độ ăn theo công thức (Apún-Molina và cộng sự 2009; Elsabagh và cộng sự 2018; Han và cộng sự 2015; Liu và cộng sự 2017; Merrifield và cộng sự 2010; Wu và cộng sự 2012), hoặc bổ sung vào nước ao nuôi cá da trơn (Queiroz và Boyd 1998), hoặc bằng cách giàu hóa thức ăn sống (Suzer và cộng sự 2008). Tuy nhiên, những nghiên cứu này không được thực hiện trong hệ thống aquaponics.
Suzer và cộng sự (2008) đã so sánh việc bổ sung Lactobacillus spp. vào cả thức ăn và nước của hệ thống nước biển tuần hoàn. Các tác giả nhận thấy hoạt tính enzyme ở ấu trùng cá tráp đầu vàng, Sparus aurata chỉ tăng lên khi bổ sung probiotic vào khẩu phần ăn. Queiroz và Boyd (1998) đã thêm một hỗn hợp thương mại của các loài Bacillus vào nước ao và quan sát thấy sự gia tăng sản lượng cá da trơn Ictalurus punctatus, nhưng vì chưa thể giải thích được hiện tượng này nên các tác giả đề xuất tiến hành các nghiên cứu tiếp theo.
Mục tiêu của nghiên cứu này là nghiên cứu việc bổ sung một sản phẩm thương mại vào nước của hệ thống aquaponics có ảnh hưởng như thế nào đến chất lượng nước, cũng như sự tăng trưởng, hiệu quả sử dụng thức ăn, thành phần gần đúng và hoạt động của enzyme tiêu hóa ở cá rô phi O. mossambicus.
VẬT LIỆU VÀ PHƯƠNG PHÁP
Chuẩn mực về đạo đức
Nghiên cứu được thực hiện theo các hướng dẫn đạo đức về sử dụng động vật trong nghiên cứu và đã được phê duyệt bởi Ủy ban đạo đức nghiên cứu động vật (AREC) của Đại học Rhodes, Nam Phi (RU-AREC tài liệu tham khảo 29.102.018 và 2019–1145–2120).
Thiết kế và vận hành hệ thống
Thử nghiệm được thực hiện trong phòng được kiểm soát nhiệt độ tại Khoa Hóa sinh và Vi sinh, Đại học Rhodes. Bốn hệ thống aquaponics thử nghiệm đã được sử dụng, mỗi hệ thống bao gồm một bể cá 100L, một bể chứa 40L với máy bơm chìm, một bể thoát nước 120L để lọc sinh học và một bể nuôi thủy canh nước sâu 126L (Hình 1). Tốc độ dòng nước qua mỗi hệ thống là 180 L/h. Các bể cá và thiết bị nuôi nước sâu được sục khí bằng máy bơm không khí di động cho bể cá. Một thiết kế hoàn toàn ngẫu nhiên đã được sử dụng với hai bể đối chứng (không bổ sung probiotic) và hai bể thử nghiệm, trong đó việc chuẩn bị các loài Bacillus (Sanolife®PRO-W; 5,0×1010 CFU/g, Bacillus subtilis và B. licheniformis, INVE Technologies, Dendermonde, Bỉ) đã được thêm vào. Các bể aquaponics được chỉ định sử dụng sản phẩm chứa Bacillus nhận được 5,31g (0,02 g sản phẩm/L nước hệ thống) 2 lần/tuần cho đến tuần thứ 10. Sản phẩm được hòa tan trong 0,5L nước hệ thống và đưa vào bể chứa của hệ thống.

Hình 1. Sơ đồ biểu diễn hệ thống aquaponics thử nghiệm được sử dụng trong nghiên cứu.
Quản lý bể cá và nuôi cá
Thiết lập bộ lọc sinh học và quá trình phát triển màng sinh học của vi khuẩn được thực hiện theo chiến lược tuần hoàn không có cá trong 25 ngày (DeLong và Losordo 2012). Trong tuần đầu tiên, natri bicarbonate (1,6 g/100L), được bổ sung hàng ngày để cung cấp nguồn carbon hỗ trợ sự phát triển của vi khuẩn. Trong giai đoạn này, tốc độ chu kỳ giảm từ 10 chu kỳ/giờ xuống còn 4 chu kỳ/giờ, được duy trì trong suốt thời gian còn lại của thí nghiệm. Trong tuần thứ hai, amoniac (SeaGro, Premier Fishing, Pty, Ltd., Cape Town, Nam Phi, 25 mL/100L nước) được bổ sung hàng ngày cho đến khi tổng lượng nitơ amoniac đạt khoảng 3 mg/L. Các hệ thống đã được bổ sung bằng FINCO Filter start® có chứa vi khuẩn nitrat hóa (Hikari Japan; do KoiPetCo, Johannseburg, Nam Phi cung cấp) hàng ngày ở mức 0,5 g/100L nước trong suốt 5 ngày.
Cá rô phi Mozambique, Oreochromis mossambicus (trọng lượng trung bình 36,4 ± 0,06 g/con (giá trị trung bình ± sai số chuẩn) được thu thập từ Khoa Khoa học Thủy sản và Ngư học của Đại học Rhodes. Cá được chọn ngẫu nhiên và thả vào hệ thống aquaponics với sinh khối 364,8 ± 0,54 g/100L, được cho ăn theo chế độ ăn thương mại (Avi Products Pty Ltd., cỡ viên 2 mm) 2 lần/ngày vào lúc 09:30 và 16:00 ở mức 2% khối lượng cơ thể mỗi ngày trong 10 tuần. Khẩu phần chứa 40% protein thô, 0,7% phốt pho, 5% chất béo thô, 3% canxi, 2,2% lysine, 2% chất xơ thô và 10% độ ẩm. Thức ăn thừa và phân được hút hàng ngày trước khi cho ăn. Lượng thức ăn được điều chỉnh dựa trên kết quả cân của tất cả cá thể trong mỗi bể 2 tuần/lần.
Cân cá và lấy mẫu để phân tích thành phần gần đúng và hoạt động của các enzyme tiêu hóa
Phân tích thành phần gần đúng được xác định bằng cách chọn ngẫu nhiên 10 con cá từ lô cá ban đầu khi bắt đầu thí nghiệm và 3 con cá trong mỗi bể khi kết thúc thí nghiệm. 2 con cá trong mỗi bể được chọn để lấy mẫu thử nghiệm hoạt động của enzyme tiêu hóa.
Tất cả cá đều được bỏ đói trong 24 giờ trước khi xử lý. Để ghi lại khối lượng cơ thể, mỗi con cá được gây mê bằng dầu đinh hương (Lennon by Aspen Ltd., La Lucia Ridge, Nam Phi, 90% eugenol) đã được hòa tan trong ethanol 100% với tỷ lệ 1mL dầu đinh hương trên 10mL etanol. Nồng độ dầu đinh hương trong nước nuôi cá là 40 mg/L. Cá được đặt riêng lẻ vào thùng chứa dung tích 1L chứa đầy 500mL nước trên cân điện tử (đã trừ khối lượng của thùng chứa và nước) (Adam Equipment, PGL-2002, độ chính xác 0,01g). Cá đã được làm chết để phân tích thành phần gần đúng và kiểm tra hoạt động của enzyme tiêu hóa bằng cách tiếp xúc với nồng độ dầu đinh hương gây chết là 60 mg/L trong 4 phút. Sau đó, chúng được xử lý để phân tích thành phần gần đúng hoặc được mổ trên băng để loại bỏ toàn bộ ruột và kiểm tra hoạt động của enzyme.
Đo chất lượng nước
Nhiệt độ nước, pH, tổng chất rắn hòa tan (TDS) và độ dẫn điện (EC) được đo hàng ngày trong khoảng thời gian từ 08:30 đến 9:00 bằng đầu dò giám sát chất lượng nước đa thông số (PHT-027, Trung Quốc). Nồng độ oxy hòa tan (DO) được đo 3 lần/tuần bằng máy đo oxy hòa tan (Pen–850.045, Sper Scientific Ltd., Scottsdale, Hoa Kỳ). Sử dụng máy đo quang phổ (Merck Spectroquant® Pharo 300, Merck, Darmstadt, Đức), nồng độ Nitrate (NO3-) và tổng nitơ amoniac (TAN) được đo 3 lần/tuần bằng bộ dụng cụ kiểm tra Spectroquant (Merck Pty Ltd., 1.14773.0001 và 1.14752.0001 tương ứng).
Sự tăng trưởng của cá
Phần trăm tăng trọng (WG), tốc độ tăng trưởng cụ thể (SGR, %/ngày), tỷ lệ chuyển đổi thức ăn (FCR), tỷ lệ hiệu quả sử dụng protein (PER), hiệu quả sử dụng thức ăn (FE, %) và tỷ lệ sống (SR) được tính toán bằng cách sử dụng các công thức sau.
WG = 100 × ((FW – IW)/IW)
SGR = ((ln FW – ln IW)/T) ×100
FCR = DM/BMG
PER = BMG/PI
FE = 100 × BMG/MF
SR = 100 × (Nf/Ni)
FW = trọng lượng trung bình cuối cùng (g/con); IW = trọng lượng trung bình ban đầu (g/con); T = số ngày tăng trưởng; DM = chất khô trong thức ăn cung cấp (g); BMG = tăng sinh khối ướt (g); PI = tổng trọng lượng khô của protein thức ăn tiêu thụ (g); MF = Trọng lượng thức ăn cho ăn (g); và Nf và Ni lần lượt là số lượng cá cuối cùng và số lượng cá ban đầu trong mỗi bể.
Phân tích thành phần gần đúng
Phân tích thành phần gần đúng toàn bộ cơ thể cá được thực hiện theo phương pháp của Hiệp hội các nhà hóa học phân tích chính thức (AOAC, 1997). Các mẫu để phân tích được đồng nhất hóa bằng cách ép chúng hai lần qua máy xay (Bosch, CNFW7, Trung Quốc) với đĩa có lỗ 3 mm. Chất đồng nhất được đặt trong các thùng chứa vô trùng và được bảo quản ở 0°C trước khi phân tích trong phòng thí nghiệm. Độ ẩm được xác định bằng cách sấy mẫu trong 12 giờ đến khối lượng không đổi ở 105°C trong tủ sấy. Hàm lượng protein thô (N × 6,25) được ước tính bằng phương pháp Kjeldahl bằng cách sử dụng thiết bị chưng cất (Gerhardt Vapodest 400, Gerhardt GmbH, Königswinter, Đức) và tro được xác định bằng cách đốt các mẫu trong lò nung ở 550°C trong 6 giờ. Tổng năng lượng được xác định bằng cách sử dụng nhiệt lượng kế bom (Bom đo nhiệt lượng đoạn nhiệt Parr 1261; Công ty dụng cụ Parr, IL, Hoa Kỳ). Tổng chất béo được chiết xuất theo phương pháp của Bligh và Dyer (1959) với sự điều chỉnh nhỏ của Kinsella và cộng sự (1977). Các mẫu đã đồng nhất (100g) được giữ trong dung dịch cloroform và metanol (2:1) trong 4 giờ, được lọc và nhũ hóa bằng nước cất và để tách cho đến khi thu được hai lớp dung dịch trong suốt. Dung dịch dầu được cô đặc bằng thiết bị bay hơi quay (Rotavapor® R-215, Thụy Sĩ) ở 60°C trong bình đáy tròn 100mL đã được cân trước.
Hoạt động của enzyme tiêu hóa
Toàn bộ ruột của cá cho từng hệ thống đã được tổng hợp và đồng nhất hóa trong môi trường lạnh (1:3 w/v) 50 mM Tris-HCl (pH = 8). Các mẫu được đồng nhất hóa bằng máy xay điện trong 2 phút. Các chất đồng nhất được ly tâm ở tốc độ 10.000 × g trong 30 phút ở 4°C (máy ly tâm BOECO U-320 R, Đức) để loại bỏ các mảnh vụn mô và lipid. Chất nổi phía trên được thu thập và bảo quản thành các phần nhỏ gồm 1,5 mL và được bảo quản ở -80°C trước khi phân tích. Tất cả các xét nghiệm được thực hiện ba lần bằng máy quang phổ vi đĩa (Epoch, BioTek Instruments, Winooski, Hoa Kỳ) sử dụng đĩa vi mô 96 giếng đáy phẳng Falcon.
Tinh bột khoai tây được sử dụng để xác định hoạt tính của α-amylase bằng cách ước tính lượng đường khử được tạo ra bằng axit dinitrosalicylic (DNS) theo Bernfeld (1955). Hỗn hợp phản ứng bao gồm 300 µL 1,33% (w/v) tinh bột khoai tây hòa tan trong dung dịch đệm Tris-HCl 50 mM, pH 8 và 100 µL chất đồng nhất. Hỗn hợp phản ứng được ủ ở 37°C trong 30 phút sau đó được ly tâm trong 5 phút ở tốc độ 13.000 × g. Chất nổi phía trên (150 µL) của mỗi hỗn hợp phản ứng được thêm vào 300 µL DNS, sau đó đun nóng đến 100°C trong 8 phút. Hỗn hợp này sau đó được làm lạnh trên băng trong 5 phút và 250 µL từ mỗi phần dịch sau đó được chuyển sang đĩa 96 giếng và độ hấp thụ được đọc ở bước sóng 540 nm. Các mẫu trắng không có chất nền, chất kiểm soát cơ chất và enzyme được chạy đồng thời với hỗn hợp phản ứng.
Tổng hoạt tính protease kiềm của chiết xuất thô trong toàn bộ ruột đã được thử nghiệm theo phương pháp của Walter (1984) và Moyano và cộng sự (1996) bằng cách sử dụng quy trình phổ quát đã được sửa đổi của Sigma-Aldrich với casein làm chất nền (Sigma-Aldrich 2013). Hoạt tính protease được đo bằng quá trình thủy phân 0,66% (w/v) casein trong dung dịch đệm Tris-HCl 50 mM ở pH 8. Ba mẫu lặp (50 µL) dịch chiết ruột thô được trộn với 150 µL cơ chất casein ở 37°C. Sau khi ủ trong 30 phút, phản ứng được dừng lại bằng cách thêm 200 µL axit trichloroacetic (TCA) 10% (w/v) và hỗn hợp này được ly tâm ở tốc độ 8.000 × g trong 5 phút. 10 µL phần nổi phía trên được trộn với 50 µL natri cacbonat 2 M, 20 µL thuốc thử phenol của Folin và Ciocalteu và 180 µL nước và phủ giấy bạc cho đến khi ủ ở 37°C trong 3 phút. Hoạt tính của enzyme protease được đo bằng sự thay đổi độ hấp thụ ở bước sóng 765 nm bằng cách sử dụng đầu đọc vi bản. Đối với mẫu trắng, phản ứng được thực hiện như mô tả trước đó, nhưng dịch chiết enzyme được thay thế bằng dung dịch đệm mẫu. Kiểm soát enzyme và kiểm soát cơ chất cũng đã được thực hiện. Đường cong chuẩn L-tyrosine đã được chuẩn bị bằng dung dịch chuẩn nồng độ 10 mM. L-tyrosine được sử dụng làm chất chuẩn và một đơn vị hoạt tính của enzyme được biểu thị bằng 1 µmol tyrosine min-1 mg protein-1.
Để xác định hoạt tính phosphatase kiềm (AP), chất nền p-nitrophenyl phosphate (pNPP) đã được sử dụng (Bessey, Lowry và Brock 1946). Đường cong chuẩn p-nitrophenol được chuẩn bị bằng cách sử dụng dung dịch có nồng độ 1 µmol/mL. Các nồng độ dao động từ 0,001 đến 0,5 µmol/mL, sử dụng ống Eppendorf. Sau khi ủ trong 30 phút ở 37°C, 250 µL natri cacbonat được thêm vào mỗi chất chuẩn. Mỗi hỗn hợp của chất chuẩn (250 µL) được thêm vào các giếng của đĩa microtiter 96 giếng và độ hấp thụ được đọc ở bước sóng 405 nm. Đối với hoạt tính AP, ba mẫu lặp (50 µL) chiết xuất toàn bộ ruột thô được trộn ở 25°C với 195 µL dung dịch đệm và 5 µL chất nền p-nitrophenyl photphat 100 mM. Sau khi ủ trong 10 phút, thêm 250 µL dung dịch natri cacbonat 2 M. Độ hấp thụ được đọc ở bước sóng 405 nm bằng đầu đọc vi bản. Đối với mẫu trắng, phản ứng được thực hiện như mô tả trước đó, trừ việc chiết enzyme được thay thế bằng dung dịch đệm mẫu và natri cacbonat. Kiểm soát enzyme và cơ chất cũng được thực hiện.
Protein toàn phần
Nồng độ protein toàn phần của chất đồng nhất được xác định bằng xét nghiệm Bradford (Bradford, 1976). Đường cong chuẩn albumin huyết thanh bò (BSA) được chuẩn bị bằng cách sử dụng dung dịch nồng độ 10 mg/mL. Các nồng độ được chuẩn bị trong ống Eppendorf, dao động từ 0,05 đến 0,5 mg/mL. Thuốc thử Bradford (230 µL) được trộn với 25 µL chất đồng nhất. Đối với các mẫu trắng, phản ứng được thực hiện như mô tả trước đó, trừ chất đồng nhất được thay thế bằng nước cất. Hỗn hợp này được ủ ở 25°C trong 10 phút trước khi đo độ hấp thụ ở bước sóng 595 nm bằng máy đọc vi bản. Giá trị protein toàn phần này đã được sử dụng trong tất cả các tính toán trên.
Phân tích dữ liệu
Để tránh sai lệch do sao chép giả, giá trị của từng con cá trong bể được tính trung bình trước khi phân tích. Có sự biến động thấp trong các nghiệm thức về dữ liệu tăng trưởng. Trung bình, các giá trị trong các nghiệm thức chỉ khác nhau 0,4% và có sự giống nhau về phương sai (thử nghiệm Levene). Do đó, kiểm định t-test được sử dụng để so sánh các mức tăng trưởng trung bình và thành phần gần đúng của toàn bộ cơ thể giữa các nghiệm thức. Vì không có sự khác biệt đáng kể giữa các nghiệm thức về thành phần gần đúng khi kết thúc thử nghiệm, dữ liệu cuối cùng được tổng hợp và so sánh với giá trị trung bình tương ứng khi bắt đầu thử nghiệm bằng kiểm định t-test một mẫu. Để kiểm tra xem liệu có sự khác biệt đáng kể giữa các nghiệm thức về sự thay đổi chất lượng nước trong khoảng thời gian 10 tuần hay không, phân tích phương sai lặp lại (RM-ANOVA) đã được sử dụng. Khi có sự tương tác đáng kể giữa các tác động chính, thử nghiệm post-hoc HSD của Tukey (Tukey 1960) luôn được sử dụng để so sánh các nghiệm thức. RM-ANOVA được sử dụng vì nó cho phép kiểm tra những thay đổi trong các nghiệm thức theo hàm số của thời gian. Nó cũng được coi là phù hợp trong trường hợp này vì thử nghiệm này có thể tăng sức mạnh thống kê (Guo và cộng sự 2013).
Sự khác biệt giữa các giá trị trung bình được coi là đáng kể khi xác suất lỗi Loại 1 nhỏ hơn 5%, tức là P < 0,05. Tất cả các phân tích được thực hiện bằng gói phần mềm Statistica (TIBCO Software, Palo Alto, USA, phiên bản 13.5.0).
KẾT QUẢ
Thông số chất lượng nước
Nhiệt độ nước dao động từ 21,5 – 26,7°C (Hình 2A). Trong cả hai nghiệm thức, nhiệt độ thay đổi theo cách tương tự theo thời gian (RM ANOVA, nhiệt độ x tương tác giữa các nhóm, P = 0,841). Việc xử lý bằng Bacillus không ảnh hưởng đến mức độ thay đổi nồng độ oxy hòa tan theo thời gian (RM ANOVA, oxy hòa tan x tương tác giữa các nhóm, P = 0,703; Hình 2B). Không có sự khác biệt về độ pH trung bình giữa các nghiệm thức và thời gian, đồng thời cũng không có sự tương tác giữa các nghiệm thức và thời gian (RM-ANOVA, P = 0,25, P = 0,59 và P = 0,47, tương ứng; Hình 2C). Việc bổ sung probiotic dẫn đến sự gia tăng chậm hơn nồng độ tổng chất rắn hòa tan và giá trị độ dẫn điện (Hình 2D và 2E, tương ứng) (RM-ANOVA, số hạng tương tác, P = 0,031 và P < 0,0001, tương ứng).
Trong cả hai nghiệm thức, nồng độ nitrat tăng theo thời gian (RM-ANOVA, P < 0,00001) theo cách tương tự (RM-ANOVA, số hạng tương tác, P = 0,38; Hình 2F). Việc xử lý không có tác dụng đối với các giá trị TAN trung bình (RM ANOVA, P = 0,655) và các giá trị thay đổi theo cách tương tự theo thời gian khi có cá (RM ANOVA, TAN x tương tác giữa các nhóm, P = 0,703; Hình 2G). Giá trị TAN trung bình của dữ liệu tổng hợp từ cả hai nghiệm thức là 0,238 mg/L trong khoảng thời gian từ tuần 1 đến tuần 10.

Hình 2. A-G. Những thay đổi về chất lượng nước trong hệ thống aquaponics ở giai đoạn không có cá và giai đoạn tăng trưởng kéo dài 10 tuần, trong đó cá rô phi con, Oreochromis Mossambicus, được cho ăn chế độ ăn thương mại ở mức 2% khối lượng cơ thể/ngày. Trong nghiệm thức có bổ sung Bacillus, một probiotic thương mại đã được bổ sung hai lần một tuần. Sự tương tác đáng kể giữa các nhóm x thời gian (RM-ANOVA) được tìm thấy đối với các giá trị TDS và EC.
Sự tăng trưởng của cá
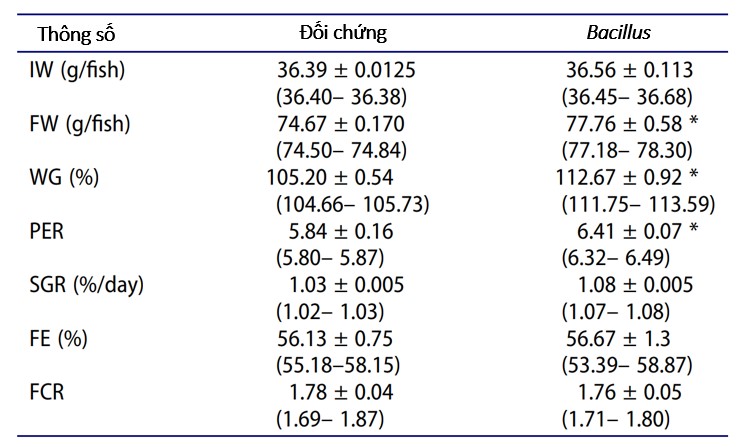
Việc xử lý bằng probiotic có tác dụng đáng kể đối với mức tăng trọng (t-test, Bảng 1). Trọng lượng cá trung bình và tăng trọng trong nghiệm thức bổ sung Bacillus lần lượt cao hơn 4,13% và 7,1% so với nhóm đối chứng (Bảng 1). Giá trị PER từ các hệ thống được xử lý bằng Bacillus cao hơn so với nhóm đối chứng, trong khi không quan sát thấy sự khác biệt đáng kể giữa hệ thống được xử lý Bacillus và đối chứng về giá trị FE và FCR trung bình (t-test, Bảng 1). Tỷ lệ sống trung bình là 80% ở cả nghiệm thức Bacillus và đối chứng.
Bảng 1. Sự tăng trưởng và sử dụng thức ăn của O. Mossambicus từ nghiệm thức đối chứng và nghiệm thức bổ sung Bacillus trong hệ thống aquaponic khi kết thúc thí nghiệm cho ăn 10 tuần. Các giá trị được biểu thị dưới dạng giá trị trung bình ± sai số chuẩn và phạm vi được đặt trong trong ngoặc đơn. Sự khác biệt đáng kể giữa nghiệm thức bổ sung Bacillus và nghiệm thức đối chứng (p < 0,05) được đánh dấu bằng dấu hoa thị.
Thành phần gần đúng
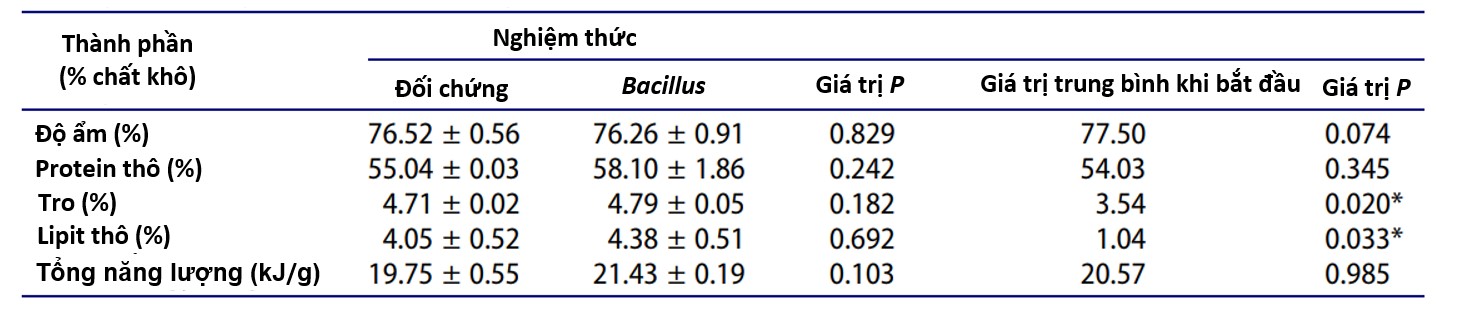
Vào cuối thí nghiệm, không có sự khác biệt đáng kể về giá trị trung bình giữa nghiệm thức bổ sung Bacillus và nghiệm thức đối chứng đối với độ ẩm thân thịt (t = 0,24, P = 0,829). Việc xử lý bằng probiotic không ảnh hưởng đến giá trị trung bình (% chất khô) của protein thô (t = 1,64, P = 0,242), tro (t = 2,01, P = 0,182) và lipid thô (t = 0,45, P = 0,692) cũng như về mức năng lượng tổng (t = 2,86, P = 0,103; Bảng 2). Khi kết thúc nghiên cứu, cả hàm lượng lipid và tro (% chất khô) đều cao hơn so với lúc bắt đầu thí nghiệm (t-test một mẫu, P = 0,020; và P = 0,033, tương ứng, Bảng 2).
Bảng 2. Thành phần toàn bộ cơ thể (tỷ lệ phần trăm chất khô) của cá rô phi Oreochromis Mossambicus trong nghiệm thức đối chứng và nghiệm thức xử lý bằng Bacillus trong hệ thống aquaponics vào cuối thí nghiệm cho ăn 10 tuần. Giá trị được biểu thị dưới dạng giá trị trung bình ± sai số chuẩn. Cột bên phải hiển thị kết quả từ kiểm định t-test một mẫu để so sánh giá trị trung bình tổng của nghiệm thức bổ sung Bacillus và nghiệm thức đối chứng ở cuối nghiên cứu với giá trị trung bình khi bắt đầu thử nghiệm. Dấu * biểu thị sự khác biệt đáng kể giữa giá trị trung bình lúc bắt đầu và kết thúc thử nghiệm (P < 0,05).
Hoạt động của enzyme tiêu hóa
Việc xử lý bằng Bacillus làm tăng đáng kể giá trị hoạt tính trung bình của amylase, protease và phosphatase kiềm trong ruột cá (t-test, P<0,05, Bảng 3).
Bảng 3. Hoạt động cụ thể của amylase, protease và phosphatase kiềm trong toàn bộ ruột của cá rô phi Mozambique được nuôi trong hệ thống aquaponic ở nghiệm thức đối chứng và nghiệm thức được xử lý bằng Bacillus vào cuối thí nghiệm kéo dài 10 tuần. Dấu * biểu thị sự khác biệt đáng kể giữa các giá trị trung bình (P < 0,05).

THẢO LUẬN
Việc bổ sung probiotic không ảnh hưởng đến các giá trị trung bình của pH, TAN, DO và NO3-, tất cả đều ở mức có thể chấp nhận được đối với việc nuôi cá rô phi O. niloticus và O. mossambicus (El-Sayed 2019). Hai loài cá rô phi này chịu được khoảng pH từ 5,5 đến 9,0, nhiệt độ từ 8 đến 32°C với giá trị tối ưu từ 28 đến 30°C, nồng độ DO lớn hơn 3 mg/L và nồng độ TAN dưới 3 mg/L (El-Sayed 2019). Ngoài ra, mặc dù nước giàu chất dinh dưỡng được tuần hoàn giữa các bể cá và các thiết bị thủy canh, nhưng nồng độ NO3– ở mức 10 đến 27,5 mg/L là thấp và có thể chấp nhận được đối với việc nuôi cá rô phi. Matias và cộng sự (2002) đã thử nghiệm tác động của các sản phẩm vi sinh thương mại đến chất lượng nước. Việc bổ sung B. subtilis (nồng độ 108 CFU/mL) vào nước nuôi sẽ duy trì nồng độ các ion nitrit, amoniac và nitrat ở mức chấp nhận được đối với nuôi tôm (Penaeus monodon). Jasmin và cộng sự (2020) đã xem xét các nghiên cứu trong đó các loài Bacillus được sử dụng trong nhiều điều kiện khác nhau để xử lý nước thải nuôi trồng thủy sản, đặc biệt là trong nuôi tôm và các tác giả đã báo cáo rằng các loài Bacillus có thể làm giảm nồng độ amoniac và nitrit. Ngoài ra, trong nghiên cứu hiện tại, giá trị amoniac vẫn ở mức thấp trong cả bể được xử lý bằng Bacillus và bể đối chứng có thể là do thực vật hấp thụ các hợp chất nitơ và chu trình không có cá. Sallenave (2016) cho thấy rủi ro thấp về giá trị TAN cao trong các hệ thống khép kín ở chu trình không có cá, nhưng tác động của phương pháp này đối với nồng độ TAN trong hệ thống có cá vẫn chưa được báo cáo. Kết quả từ thí nghiệm hiện tại chỉ ra rằng nồng độ amoniac có thể được giữ ở mức thấp trong chu kỳ không có cá, do đó phương pháp này có thể được thử nghiệm trong các nghiên cứu trong tương lai.
Mức TDS và EC trong nghiệm thức đối chứng tăng nhanh hơn có thể là do sự tích tụ các ion không được thực vật hấp thụ. Tuy nhiên, mức TDS trong nghiệm thức đối chứng không đủ cao để ảnh hưởng đến quá trình nitrat hóa vì không có sự khác biệt về độ pH và nồng độ amoniac giữa các nghiệm thức. Trong hệ thống aquaponics, các ion có thể tích tụ do quá trình khoáng hóa chất hữu cơ và từ thức ăn chưa ăn hoặc chưa tiêu hóa (Yildiz và cộng sự 2017). Trong nghiên cứu hiện tại, sự tăng trưởng được biểu thị bằng trọng lượng trung bình cuối cùng, phần trăm tăng trọng và tỷ lệ hiệu quả sử dụng protein khác nhau giữa nghiệm thức đối chứng và nghiệm thức Bacillus. Tuy nhiên, sự khác biệt trong việc bài tiết chất thải của cá có thể không đơn thuần là giải thích hiệu quả của việc xử lý đối với sự thay đổi nồng độ của các giá trị TDS và EC theo thời gian. Người ta đưa ra giả thuyết rằng sự hấp thu chất dinh dưỡng của thực vật tăng lên do hoạt động thúc đẩy thực vật của probiotic đã góp phần tạo ra những khác biệt về chất lượng nước. Ví dụ, cây trồng trong nghiệm thức xử lý bằng Bacillus tích lũy khối lượng khô cao gấp 4 lần và lượng phốt pho cao gấp đôi so với cây trồng trong nghiệm thức đối chứng (Da Silva Cerozi và Fitzsimmons 2016). Bacillus spp. cũng có thể cải thiện chất lượng nước bằng cách chuyển đổi chất hữu cơ thành CO2 (Balcázar và cộng sự 2006; Dalmin, Kathiresan và Purushothaman 2001).
Ngoài những tác động tích cực đến một số thông số chất lượng nước, Bacillus còn tác động đến sự phát triển của cá và hoạt động của enzyme tiêu hóa. Cá rô phi O. mossambicus trong nghiệm thức được xử lý bằng Bacillus phát triển tương đối nhanh hơn. Tỷ lệ tăng trọng ở nghiệm thức Bacillus cao hơn so với nghiệm thức đối chứng. PER trung bình ở nghiệm thức Bacillus cao hơn so với nghiệm thức đối chứng. Điều này có thể liên quan đến khả năng Bacillus kích hoạt protease chịu trách nhiệm thủy phân protein (Adorian và cộng sự 2018). Mặc dù giá trị FCR thấp hơn giá trị thường thấy ở các trang trại nhưng chúng có thể được chấp nhận trong điều kiện thí nghiệm với khẩu phần thương mại. Cá có xu hướng tối ưu hóa quá trình tiêu hóa để sử dụng các chất dinh dưỡng trong thức ăn một cách hiệu quả, làm tăng hiệu quả sử dụng thức ăn, đặc biệt là trong điều kiện cho ăn có kiểm soát (Van Ham và cộng sự 2003; Zoccarato và cộng sự 1994). Tác dụng đáng kể của Bacillus đối với tỷ lệ tăng trọng cũng được tìm thấy trong các nghiên cứu khác về sự phát triển của cá rô phi sông Nile, O. niloticus, trong đó có sử dụng probiotic (Ridha và Azad 2012; Adeoye và cộng sự 2016; Elsabagh và cộng sự 2018; Liu và cộng sự al. 2017), nhưng probiotic đã được thêm vào thức ăn cho cá thay vì bổ sung vào nước trong hệ thống như đã được thực hiện trong nghiên cứu hiện tại. Đối với các nghiên cứu trong tương lai, cần kiểm tra xem cá rô phi O. mossambicus có thể tiêu thụ Bacillus ở mức độ nào thông qua việc ăn mảnh vụn, thực vật phù du hoặc động vật phù du. Ví dụ, Bacillus đã được báo cáo là có khả năng thích ứng cao liên quan đến sở thích ăn của chúng vì chúng có thể ăn mảnh vụn (Russell, Thuesen và Thomson 2012) hoặc thay đổi chế độ ăn tùy thuộc vào điều kiện môi trường bằng cách ăn thực vật phù du, periphyton hoặc mảnh vụn (De Moor, Wilkinson và Herbst 1986). Do đó, cá rô phi O. mossambicus được sử dụng trong nghiên cứu này có thể đã ăn phải một số mảnh vụn hỗ trợ việc vận chuyển Bacillus vào đường ruột. Người ta đưa ra giả thuyết rằng điều này có thể góp phần vào những tác động đã quan sát được đối với hoạt động của enzyme tiêu hóa dẫn đến mức tăng trọng tương đối cao hơn. Trong các nghiên cứu trong tương lai, hệ vi sinh vật đường ruột cần được nghiên cứu để kiểm tra xem việc bổ sung các loài Bacillus có thể ảnh hưởng đến thành phần hoặc chức năng của vi khuẩn đường ruột hay không, và nếu có thì ở mức độ nào. Ví dụ, sự tăng trưởng của cá được cải thiện có thể là do khả năng Bacillus xâm chiếm ruột cá dẫn đến sản xuất axit hữu cơ và kích hoạt các enzyme tiêu hóa (Elsabagh và cộng sự 2018; Silva và cộng sự 2015). Bacillus có thể ức chế vi khuẩn gây bệnh trong ruột, tăng khả năng kháng bệnh hoặc cải thiện sự tăng trưởng (Addo và cộng sự 2017; Boyd và cộng sự 2020). Trong các hệ thống aquaponics, việc bổ sung các loài Bacillus đã cải thiện khả năng kiểm soát bệnh ở cá, nhưng cần tiến hành những nghiên cứu sâu hơn về phân loại vi khuẩn và cách sử dụng probiotic (Folorunso và cộng sự 2020).
Việc sử dụng Bacillus thương mại không ảnh hưởng đến thành phần toàn bộ cơ thể của cá rô phi O. mossambicus cho thấy rằng các điều kiện tối ưu để nuôi loài này vẫn được duy trì. Ví dụ, điều kiện môi trường góp phần làm thay đổi thành phần gần đúng của cá (Shearer 1994). Merrifield và cộng sự (2010) cũng báo cáo rằng thành phần thân thịt của cá hồi vân không bị ảnh hưởng bởi chế độ ăn có bổ sung B. licheniformis và B. subtilis sau 10 tuần cho ăn. Tuy nhiên, ở cả hai nghiệm thức, hàm lượng lipid thô và tro đều tăng vào cuối thí nghiệm. Shearer (1994) cũng báo cáo rằng hàm lượng lipid trong cá nuôi tăng theo kích cỡ cá trong khi hàm lượng protein tăng tương đối thấp. Sự gia tăng đáng kể hàm lượng tro theo thời gian có thể là do khối lượng xương tăng lên và quá trình khoáng hóa ở vảy tăng lên khi cá phát triển theo thời gian (Breck 2014).
Việc xử lý bằng Bacillus làm tăng hoạt động của amylase, protease và phosphatase kiềm. Các hoạt động mạnh hơn được quan sát thấy trong nghiệm thức được xử lý bằng Bacillus có thể là do các enzyme được tổng hợp bởi vi khuẩn tham gia vào quá trình tiêu hóa, hoặc có thể Bacillus đã kích thích sản xuất các enzyme nội sinh ở cá. Hoạt động của amylase và protease trong ruột tăng lên có thể tạo điều kiện thuận lợi cho quá trình tiêu hóa và sử dụng carbohydrate và protein. Điều này có thể đã góp phần làm tăng trọng lượng cá rô phi cao hơn trong nghiệm thức Bacillus. Ngoài ra, hoạt động của phosphatase kiềm rất quan trọng để duy trì sức khỏe đường tiêu hóa vì enzyme này hạn chế tình trạng viêm do vi khuẩn gây ra (Lallès 2019). Hoạt động của enzyme tiêu hóa ở cá đã được chứng minh là bị ảnh hưởng bởi nhiệt độ (Apún-Molina và cộng sự 2009; Munilla-Morán và Saborido-Rey 1996), độ pH (Solovyev và cộng sự 2015) và nồng độ oxy hòa tan (Lallès 2019). Tuy nhiên, các biến số này không khác nhau giữa các nghiệm thức. Do đó, người ta cho rằng Bacillus trong ruột có thể tăng cường hoạt động và tăng trưởng của enzyme tiêu hóa. Việc tăng cường hoạt động của enzyme tiêu hóa của Bacillus cũng được báo cáo bởi Silva và cộng sự (2015) khi bổ sung probiotic vào chế độ ăn cho cá rô phi sông Nile, O. niloticus.
Cần nghiên cứu sâu hơn để kiểm tra xem việc bổ sung Bacillus vào các hệ thống khác nhau (bể cá, bể nước sâu, bể chứa hoặc bộ lọc sinh học) ảnh hưởng như thế nào đến sự phát triển của cá và thực vật.
Tóm lại, việc bổ sung hỗn hợp thương mại của Bacillus subtilis và B. licheniformis đã làm tăng trọng lượng ở cá rô phi O. mossambicus và giảm độ dẫn điện cũng như mức TDS trong hệ thống nước. Do đó, việc sử dụng Bacillus như một probiotic có thể được xem là có lợi. Những phát hiện này cho thấy nghiên cứu trong tương lai về việc sử dụng probiotic trong hệ thống aquaponics nên bao gồm nghiên cứu các phương pháp ứng dụng và tầm quan trọng của chúng đối với hoạt động của enzyme tiêu hóa đối với sức khỏe và sự phát triển của cá.
Theo Nasser Kasozia, Brendan Wilhelmia và Horst Kaiserc
Nguồn: https://www.tandfonline.com/doi/full/10.1080/10454438.2021.1986192
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Các Lựa Chọn Thay Thế Kháng Sinh Để Kiểm Soát Bệnh Do Vi Khuẩn Trong Nuôi Trồng Thủy Sản
- Phương Án Đưa Ra Các Giải Pháp Quản Lý Nước Thải Trong Nuôi Tôm Dựa Vào Thiên Nhiên
- Tôm Sạch Mầm Bệnh: Tiến Bộ Của Ngành Nuôi Tôm

 English
English