Tôm thẻ chân trắng Litopenaeus vannamei là loài được nuôi phổ biến nhất trong công nghệ biofloc siêu thâm canh (BFT) không thay nước. Trong BFT, độ pH có thể giảm do độ kiềm giảm và lượng carbon dioxide hòa tan tăng. Nghiên cứu này đánh giá tác động của canxi hydroxit, natri cacbonat và bicarbonate trong việc duy trì chất lượng nước trong quá trình nuôi tôm thẻ L. vannamei trong BFT. Kết quả cho thấy tôm ở nghiệm thức đối chứng (không bổ sung chất điều chỉnh pH) có hiệu suất tăng trưởng thấp hơn so với tôm ở các nghiệm thức khác. Vôi ngậm nước và natri bicarbonate tỏ ra có hiệu quả trong việc bổ sung độ kiềm, trong khi tro soda thì không. Natri cacbonat có hiệu quả trong việc nâng cao độ pH và hỗ trợ bổ sung độ kiềm. Kết quả nghiên cứu cho thấy việc sử dụng canxi hydroxit, natri cacbonat hoặc natri bicarbonate có thể giúp duy trì chất lượng nước trong quá trình nuôi tôm thẻ chân trắng L. vannamei trong BFT. Trong đó, natri cacbonat là chất điều chỉnh pH hiệu quả nhất.
Nuôi trồng thủy sản không thay nước là phương pháp nuôi thủy sản mới, có nhiều ưu điểm như thân thiện với môi trường, giảm chi phí sản xuất, tăng năng suất. Tuy nhiên, trong hệ thống BFT, độ kiềm có xu hướng giảm trong quá trình nuôi, dẫn đến giảm hiệu suất nuôi tôm.
Độ kiềm là khả năng đệm của nước, giúp duy trì pH ổn định. Tôm biển phát triển tốt nhất ở độ pH từ 7 đến 9. Độ pH dưới 6,5 hoặc trên 9,5 có thể làm giảm sự phát triển của tôm. Các nghiên cứu đã chỉ ra rằng việc bổ sung các hợp chất kiềm hóa, chẳng hạn như natri bicarbonate, có thể giúp duy trì độ kiềm ổn định trong hệ thống BFT. Điều này có thể cải thiện hiệu suất nuôi tôm, đặc biệt là ở mật độ nuôi cao. Để cải thiện kỹ thuật nuôi tôm trong hệ thống BFT, điều quan trọng là phải thực hiện các thí nghiệm đánh giá tác động của các hợp chất kiềm hóa đến chất lượng nước và hiệu suất chăn nuôi của tôm thẻ chân trắng L. vannamei trong hệ thống BFT.
Thiết lập nghiên cứu
Tôm thẻ chân trắng L. vannamei được nuôi trong hệ thống BFT với mật độ dưới 300 con/m2 cho đến khi tôm đạt trọng lượng trung bình 6 g. Sau đó, tôm được chuyển sang các ô thí nghiệm (150 L), với mật độ 50 con/bể (tương đương 1 con/3 L hoặc 333 con/m3). Thiết kế thí nghiệm bao gồm bốn nghiệm thức với ba lần lặp lại, mỗi nghiệm thức: T1 – Na2CO3 – trong đó độ pH được duy trì trên 7,5 thông qua việc sử dụng natri cacbonat; T2 – Ca(OH)2 – trong đó độ pH được duy trì trên 7,5 và độ kiềm trên 100 mg CaCO3/L thông qua việc sử dụng canxi hydroxit; T3 – NaHCO3 – trong đó độ kiềm được duy trì trên 100 mg CaCO3/L thông qua việc sử dụng natri bicarbonate; và T4 – đối chứng – trong đó cả độ pH và độ kiềm đều không được điều chỉnh trong thí nghiệm 60 ngày. Tôm được cho ăn khẩu phần ăn thương mại (Guabi/38 Active – 38% protein thô, 8% lipid, cỡ viên 2 mm) thông qua việc sử dụng khay cho ăn (lúc 07:00 và 17:00). Tỷ lệ cho ăn ban đầu với sự điều chỉnh theo mức tiêu thụ được quan sát trong khoảng thời gian 24 giờ và kết quả trọng lượng trung bình của tôm đánh bắt hàng tuần thông qua sinh trắc học.
Hiệu quả của các hợp chất hóa học được sử dụng để điều chỉnh độ pH và độ kiềm được phân tích trong nước biển có các khối vi sinh vật và không có tôm. Các thử nghiệm đã được thực hiện, với hai lần lặp lại, trong các bể nhựa (thể tích hữu ích là 2 L) với mỗi bể có một đá khí để cung cấp sục khí. Độ pH và độ kiềm được đo trước khi sử dụng (độ pH ban đầu là 7,0 và độ kiềm ban đầu là 100 mg CaCO3/L), 1 giờ sau khi sử dụng và 24 giờ sau khi sử dụng các hợp chất hóa học. Các hợp chất hóa học được thử nghiệm cũng như liều lượng, mục đích sử dụng và mức tăng độ pH, độ kiềm được trình bày trong Bảng 1. Số lượng các hợp chất hóa học cần thiết để điều chỉnh độ pH và độ kiềm được tính theo các phương trình dưới đây:
K = Nf−Ni (1)
trong đó K là mức cần tăng (pH hoặc mg CaCO3/L); Nf là mức mong muốn (pH hoặc mg CaCO3/L); và Ni là mức hiện tại (pH hoặc mg CaCO3/L).
Y = W* K /Z (2)
trong đó Y là nồng độ hợp chất hóa học được sử dụng (g/L); W là nồng độ sử dụng trong phép thử (g/L); và Z là khả năng của W trong việc tăng thông số (pH hoặc độ kiềm).
Q = Y *V (3)
trong đó Q là lượng hợp chất hóa học được sử dụng (g); Y là nồng độ của hợp chất hóa học (g/L); và V là thể tích hữu ích của bể (L).
Bảng 1 Các hợp chất hóa học được sử dụng để điều chỉnh độ pH và độ kiềm trong nuôi tôm L. vannamei trong các phương pháp xử lý bằng Na2CO3 để điều chỉnh độ pH, NaHCO3 để điều chỉnh độ kiềm và Ca(OH)2 để điều chỉnh cả hai.
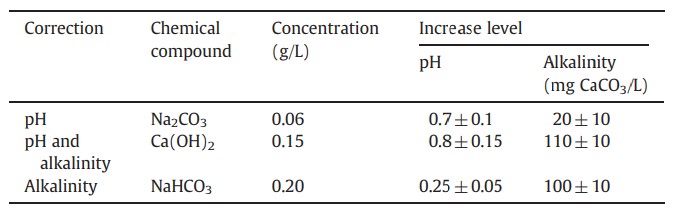
Số liệu tương ứng với giá trị trung bình của 2 lần lặp lại± độ lệch chuẩn.
Các khối vi sinh vật được cấy từ môi trường nuôi tôm có nguồn gốc với tỷ lệ 30% khối lượng hữu ích của các đơn vị thí nghiệm và trong quá trình thí nghiệm không thay nước. Cần bổ sung phân hữu cơ để điều chỉnh tỷ lệ cacbon:nitơ (15:1). Việc bổ sung mật mía (37,46% C và 0,57% N) vào nguồn carbon cho thấy cần 6 g C để chuyển hóa tổng 1 g nitơ amoni (TA-N) thành sinh khối vi khuẩn. Việc bổ sung mật mía được thực hiện khi nồng độ TA-N bằng hoặc lớn hơn 0,8 mg/L.
Chu kỳ sáng là 12 giờ tối, sau đó là 12 giờ sáng (độ sáng nhân tạo 50 lx). Nhiệt độ của nước được duy trì ở 27°C thông qua việc sử dụng máy sưởi có bộ điều chỉnh nhiệt (VisiTherm – Italy). Sục khí được cung cấp thông qua ống mềm và đá khí. Độ mặn được duy trì ở mức 33‰ bằng cách bổ sung nước ngọt khi cần thiết.
Nhiệt độ, pH và oxy hòa tan được đo hai lần mỗi ngày và độ mặn được đo 3 ngày/ lần. Nồng độ TA-N và nitrit (NO2-N) được đo 3 lần/ tuần. Lượng carbon dioxide hòa tan (CO2) cũng được tính toán. Độ kiềm được phân tích 3 lần/ tuần, và orthophosphate (PO43–– P) và nitrat (NO3–N) được đo 7 ngày/ lần. Tổng chất rắn lơ lửng (TSS) được xác định 7 ngày/ lần. Giá trị TSS được ước tính bằng chênh lệch giữa trọng lượng cuối cùng và trọng lượng ban đầu của mỗi bộ lọc (AOAC, 2000). Khối lượng bông bùn vi sinh vật (MFV) thu được thông qua việc sử dụng nón Imhoff (Avnimelech, 2007).
Ban đầu và cứ sau 7 ngày, mẫu 10 con tôm từ mỗi bể được cân bằng cân chính xác. Vào ngày thử nghiệm thứ 60, tất cả tôm sống đều được định lượng và cân để đánh giá tốc độ tăng trưởng và tỷ lệ sống ở mỗi nghiệm thức. Các chỉ số sau đây đã được xác định: tỷ lệ sống, trọng lượng cuối cùng, tăng cân, tăng cân/tuần, sinh khối cuối cùng, tỷ lệ chuyển đổi thức ăn và năng suất.
Kết quả
Các thông số vật lý, hóa học và hiệu suất chăn nuôi
Các thông số vật lý và hóa học được trình bày trong Bảng 2. Giá trị trung bình của MFV cao hơn đáng kể (P<0,05) đối với T1, T2 và T3. Sự tiến triển của MFV được thể hiện trong Hình 1. Giá trị trung bình PO4 3– –P cao hơn đáng kể (P<0,05) đối với T4, tiếp theo là T1, T3 và T2. Các giá trị trung bình của độ kiềm, pH và CO2 được thể hiện trong Bảng 2. Độ pH khác nhau đáng kể (P<0,05) giữa các nghiệm thức, với giá trị trung bình cao nhất được ghi nhận ở T2, tiếp theo là T1, T3 và T4. Độ kiềm cho thấy sự khác biệt đáng kể giữa các nghiệm thức (P<0,05), với giá trị trung bình cao nhất được tìm thấy ở T2, tiếp theo là T3, T1 và T4. T4 cho thấy lượng CO2 hòa tan cao nhất (P<0,05), tiếp theo là T3, T1 và T2. Sự tiến triển của các giá trị trung bình của độ kiềm và pH được thể hiện trong Hình 2. Các thông số hiệu suất chăn nuôi được thể hiện trong Bảng 3. Giá trị trung bình của FW và WG cao hơn đáng kể ở T1 (P<0,05), trong đó T4 có giá trị trung bình thấp nhất. FB cao hơn đáng kể ở T1 và T2 (P<0,05). Giá trị trung bình WG/W và FCR tốt nhất đáng kể ở T1, T2 và T3. Giá trị P trung bình cao hơn đáng kể (P<0,05) ở T1 và T2, tiếp theo là T3 và T4.
Bảng 2 Giá trị trung bình ± độ lệch chuẩn của các thông số chất lượng nước trong quá trình nuôi (60 ngày) tôm thẻ chân trắng L. vannamei ở các nghiệm thức thí nghiệm khác nhau1.
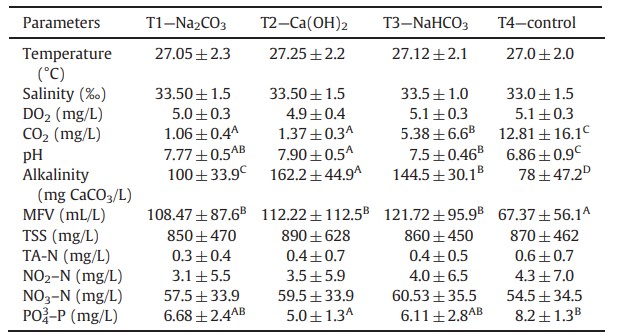
1Dữ liệu tương ứng với giá trị trung bình của 3 lần lặp lại ± độ lệch chuẩn. Các chỉ số trên khác nhau trong cùng một hàng chỉ ra rằng các giá trị trung bình khác nhau một cách đáng kể (P<0,05). Oxy hòa tan (DO2), carbon dioxide hòa tan (CO2), thể tích bông vi sinh vật (MFV), tổng chất rắn lơ lửng (TSS), tổng nitơ amoni (TA-N), nitrit (NO2–N), nitrat (NO3–N) và orthophotphat (PO43 –P).
Bảng 3 Các thông số kỹ thuật chăn nuôi của tôm thẻ chân trawsng L. vannamei được nuôi trong quá trình xử lý thử nghiệm kéo dài 60 ngày với sự điều chỉnh độ pH (T1—Na2CO3), pH và độ kiềm (T2—Ca(OH)2), độ kiềm (T3—NaHCO3) và không điều chỉnh độ pH và độ kiềm (T4—đối chứng).
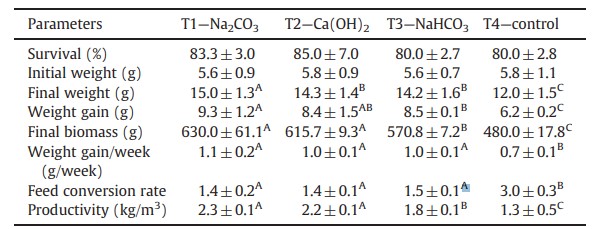
Dữ liệu tương ứng với giá trị trung bình của 3 lần lặp lại ± độ lệch chuẩn. Các chỉ số trên khác nhau trong cùng một hàng chỉ ra rằng các giá trị trung bình khác nhau một cách đáng kể (P<0,05).

Hình 1. Nồng độ trung bình của 3 lần lặp lại thể tích khối vi sinh vật trong nuôi tôm thẻ chân trắng Litopenaeus vannamei ở các điều kiện thí nghiệm khác nhau (T1—Na2CO3, T2—Ca(OH)2, T3—NaHCO3, T4—đối chứng) trong suốt 60 ngày điều trị.
Việc hiệu chỉnh độ kiềm và pH được thực hiện ở các giá trị tương ứng là 100 mg CaCO3/L và ≤7,5. T2 được điều chỉnh độ pH và độ kiềm ba lần: vào ngày thử nghiệm thứ 20, 39 và 56 (Hình 2A). T3 được điều chỉnh độ kiềm ba lần: vào ngày thử nghiệm thứ 20, 37 và 50 (Hình 2A). T1 được điều chỉnh độ pH năm lần: sau ngày thử nghiệm thứ 27 và sau đó cứ 8 ngày một lần (Hình 2B). T4 không có sự điều chỉnh độ pH và độ kiềm dẫn đến giảm cả hai (Hình 2A và B).
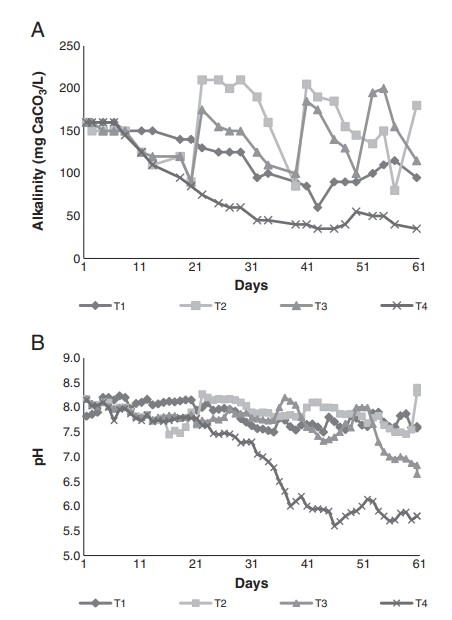
Hình 2. Nồng độ trung bình của độ kiềm (A) và pH (B) trong nuôi tôm thẻ chân trắng Litopenaeus vannamei non ở các điều kiện thí nghiệm khác nhau (T1—Na2CO3, T2—Ca(OH)2, T3—NaHCO3, T4—đối chứng) trong 60 ngày điều trị.
Thảo luận
Trong nghiên cứu này, nhiệt độ thấp nhất là trên 23,6°C và trung bình là 27°C. Nhiệt độ vẫn nằm trong phạm vi khuyến nghị để tôm con phát triển và sống sót tốt nhất. Tỷ lệ sống và tăng trưởng tốt nhất của tôm thẻ chân trắng L. vannamei ở độ mặn từ 33 đến 40‰. Độ mặn trung bình trong thí nghiệm này là 33,5‰. Nồng độ oxy hòa tan trong nghiên cứu này phải cao hơn 5,0 mg/L.
TA-N từ sự bài tiết và phân hủy chất hữu cơ có thể ảnh hưởng đến năng suất ở nồng độ trên 3,95 mg/L và ở độ mặn 35‰, gây chết. NO2–N là hợp chất được tích lũy trong quá trình nuôi cấy. Ở độ mặn 35‰, giá trị từ 25,7 mg/L trở lên có thể làm giảm sự phát triển của L. vannamei. NO3–N là sản phẩm cuối cùng của quá trình nitrat hóa amoniac và là hợp chất nitơ ít gây hại nhất cho Penaeidae, an toàn ở mức trên 60 mg/L. Trong quá trình thí nghiệm, có sự biến động lớn về nồng độ TA-N của T4. Điều này cho thấy cần phải bón phân hữu cơ nhiều hơn.
Giá trị nitrit vẫn ở mức thích hợp (dưới 25,7 mg/L ở 35‰) đối với nuôi tôm thẻ chân trắng L. vannamei non (Lin và Chen, 2003), và không có sự khác biệt đáng kể giữa các nghiệm thức (P<0,05). Nồng độ ban đầu là 10 mg/L đã tăng lên do các giá trị và chuỗi vi sinh vật đã được cấu trúc sẵn của vật liệu cấy bio-floc. Ngay cả ở T4, nơi độ pH nằm dưới phạm vi khuyến nghị 7-9 để vi khuẩn nitrat hóa hoạt động tốt nhất. Sự mất cân bằng trong quá trình oxy hóa NO2–N-NO3–N không đo được. Việc sử dụng 0,1–0,2 g/L canxi hydroxit ban đầu có tác dụng diệt khuẩn do áp lực gây ra bởi sự tăng pH và sự thay đổi trạng thái cân bằng CO2–HCO3 −–CO3 2−.
Ở T2, liều lượng canxi hydroxit được sử dụng lên tới 0,16 g/L; tuy nhiên không có sự ức chế hoặc mất kiểm soát của các nhóm vi khuẩn nitrat hóa vì quá trình nitrat hóa tương tự như T1 và T3. NO3–N tích lũy trong quá trình thí nghiệm ở tất cả các nghiệm thức và nồng độ trung bình vẫn dưới 60 mg/L; tuy nhiên, tất cả các nghiệm thức đều cho thấy giá trị tối đa trên 60 mg/L. Tác động tiêu cực của NO3–N đối với sự tăng trưởng và tỷ lệ sống của L. vannamei khi ở nồng độ N220 mg/L và ở độ mặn thấp (≈11‰). Ở T4, NO3–N giảm trong 20 ngày qua. Đây có thể là kết quả của quá trình khử nitrat, trong đó vi khuẩn kỵ khí chuyển đổi nitrat thành khí nitơ.
Nồng độ PO43– –P vẫn ở dưới mức 40 mg/L, nhưng cao hơn giá trị trong các nghiên cứu khác về hệ thống BFT. Sự tích tụ phốt pho là do thức ăn không được ăn vào và sự phân hủy chất bài tiết, tạo điều kiện thuận lợi cho quá trình phú dưỡng. Sự tích tụ này không ảnh hưởng trực tiếp đến sự phát triển của tôm nhưng có thể tạo điều kiện thuận lợi cho vi khuẩn lam dạng sợi phát triển, có thể gây tắc nghẽn mang tôm và sản sinh ra các độc tố có hại. Sự tích tụ phốt pho và các floc vi sinh vật trong nuôi tôm thẻ L. vannamei và Farfantepenaeus paulensis trong hệ thống BFT không có khả năng giữ lại số lượng lớn phốt pho, nên cần loại bỏ phốt pho dư thừa.
Giá trị TSS tăng lên trong thời gian thử nghiệm ở tất cả các nghiệm thức và mức trung bình này cao hơn mức 643 mg/L được báo cáo bởi Avnimelech (2007). Mô hình tương tự đã được xác minh đối với MFV, với nồng độ cao hơn 100 mL/L, ngoại trừ ở T4, cho thấy mức trung bình là 67 mL/L. Các điều kiện pH nhỏ hơn 7 và độ kiềm dưới 100 mg CaCO3/L có thể góp phần làm giảm sự phát triển của các khối vi sinh vật quan sát được ở T4. Giá trị nồng độ TSS và MFV lên tới 500 mg/L và 10 mL/L.
Có mối quan hệ nghịch đảo giữa vật chất hạt lơ lửng và quá trình quang hợp, trong đó độ đục cao làm giảm sự thâm nhập ánh sáng và do đó làm giảm quá trình quang hợp. MFV có thể đã bị ảnh hưởng bởi độ sáng thấp (50 lx) của phòng thí nghiệm vì quần thể vi sinh vật ổn định hơn và ít phụ thuộc vào độ sáng hơn (Avnimelech, 2006). Trong nghiên cứu này, có thể giá trị TSS và MFV cao đã ảnh hưởng tiêu cực đến hiệu suất chăn nuôi thông qua sự tắc nghẽn mang tôm. Khi TSS và MFV vượt quá mức khuyến nghị, cần phải thực hiện các biện pháp để giảm MFV. Trong các bể đã loại bỏ TSS, TSS giảm 59%, NO3–N 60%, PO4 3 –P 61% và độ kiềm tăng 33%. Để giảm TSS, có thể sử dụng lốc xoáy thủy lực NO3–N và PO4 3 –P và thiết bị làm sạch.
CO2 hòa tan trong hệ thống BFT chưa được nghiên cứu kỹ. CO2 gây độc cho sinh vật dưới nước vì nó làm giảm khả năng vận chuyển oxy của hemolymp, do đó axit hóa hemolymp và gây ra căng thẳng trao đổi chất. Giá trị CO2 dưới 5 mg/L là lý tưởng, 20 mg/L là chấp nhận được, 20–60 mg/L không gây chết nhưng gây cản trở quá trình trao đổi CO2 trong mang tôm và N60 mg/L có thể gây tôm chết.
Sự tích tụ CO2 trong hệ thống BFT xảy ra thông qua quá trình hô hấp của sinh khối sống (tôm và vi sinh vật) và thiếu trao đổi nước, khi tăng độ kiềm và mức độ pH giảm thì nồng độ CO2 tăng lên. Ở đây, sự tích lũy CO2 hòa tan trong T4 cao hơn làm ảnh hưởng đến sự phát triển của tôm, vì nồng độ CO2 vẫn nằm trong phạm vi có hại cho loài này (Van Wyk và Scarpa, 1999). Ở T3, trong đó độ pH gần trung tính nhưng độ kiềm cao, giá trị CO2 tăng lên và nằm trong phạm vi chấp nhận được đối với loài (Van Wyk và Scarpa, 1999). T1 và T2 cho thấy nồng độ CO2 thấp nhất và hiệu suất chăn nuôi có lẽ không bị ảnh hưởng tiêu cực. L. vannamei cần giá trị độ kiềm cao hơn 100 mg CaCO3/L để phát triển tốt. Tuy nhiên, trong các hệ thống trao đổi nước hạn chế, độ kiềm phải nằm trong khoảng từ 100 đến 150 mg CaCO3/L. Trong nghiên cứu này, nồng độ kiềm giảm ở tất cả các nghiệm thức. Ở T4, nó giảm từ 160 xuống 35 mg CaCO3/L trong 60 ngày, trong khi ở T1 (cũng không thực hiện điều chỉnh), giá trị tối thiểu là 55 mg CaCO3/L đã được quan sát. Trong nghiệm thức này, nồng độ kiềm cao hơn ở T4 vì vật liệu cacbonat được sử dụng để tăng độ pH đã làm tăng độ kiềm khoảng 20 mg CaCO3/L.
Những dữ liệu này đã khẳng định rằng các giá trị độ kiềm có thể giảm xuống dưới 20 mg CaCO3/L nếu không sử dụng vật liệu cacbonat. Canxi cacbonat không hiệu quả trong việc tăng độ kiềm, nhưng natri bicarbonate và canxi hydroxit có độ tinh khiết cao lại có hiệu quả trong việc kiểm soát độ kiềm của tôm nuôi được xử lý bằng ozone. Việc điều chỉnh độ kiềm thông qua việc sử dụng natri bicarbonate và canxi hydroxit, trái ngược với natri cacbonat, có hiệu quả trong việc tăng độ kiềm trong môi trường nuôi cấy BFT.
Tôm biển phát triển tốt nhất trong môi trường nuôi có pH từ 7,0 đến 9,0 (Van Wyk và Scarpa, 1999). Việc giảm nồng độ kiềm trong T4 ảnh hưởng tiêu cực đến giá trị pH, vẫn ở dưới mức lý tưởng để nuôi cấy trong 28 ngày thử nghiệm vừa qua (Van Wyk và Scarpa, 1999). Điều này cũng ảnh hưởng tiêu cực đến năng suất tôm. Ở T1, nồng độ kiềm giảm xuống dưới mức thích hợp cho loài (Ebeling và cộng sự, 2006). Tuy nhiên, nó không ảnh hưởng tiêu cực đến độ pH vì chúng được điều chỉnh bằng natri cacbonat và do đó vẫn nằm trong phạm vi lý tưởng cho loài này (Van Wyk và Scarpa, 1999). Vì vậy, hiệu quả của natri cacbonat trong việc tăng độ pH đã được xác minh. T3 và T2 không có độ kiềm dưới mức thích hợp cho sự phát triển tốt của loài (Van Wyk và Scarpa, 1999); tuy nhiên, nồng độ pH ở T3 cho thấy giá trị dưới 7 trong 8 ngày thử nghiệm vừa qua, trong khi đó độ pH ở T2 vẫn nằm trong phạm vi lý tưởng để cá con phát triển tốt nhất. Thông thường trong các hệ thống dị dưỡng, độ pH giảm trong quá trình nuôi cấy ở T4. Độ pH giảm tương ứng với sự gia tăng hô hấp trong hệ thống BFT. Tỷ lệ sống là kết quả tương tự với Ray và cộng sự (2010), khi nuôi tôm thẻ L. vannamei (460 con/m3) là 71±8%.
Để tăng cân và cân nặng cuối cùng, kết quả tốt nhất thu được ở T1. T2 và T3 không khác biệt đáng kể nhưng lớn hơn T4. Ở T4, có sự tăng trưởng không đạt yêu cầu ở cả quy mô phòng thí nghiệm và quy mô thương mại. Liên quan đến mức tăng cân/tuần, có sự khác biệt đáng kể (P<0,05) ở T1, T2 và T3 (lần lượt là 1,1, 1,0 và 1,01 g) khi so sánh với T4 (0,73 g). Tỷ lệ chuyển đổi thức ăn được xác minh trong các nghiệm thức không sử dụng các hợp chất kiềm hóa tương tự với giá trị tương ứng là 1,27 và 1,49. Tuy nhiên, tỷ lệ chuyển đổi thức ăn được đăng ký trong T4 cao hơn khoảng hai lần. Vì vậy, giá trị của tỷ lệ chuyển đổi thức ăn này không đủ cho nuôi tôm thẻ chân trắng L. vannamei thương mại trong hệ thống BFT.
Giá trị cao nhất của sinh khối cuối cùng và năng suất được quan sát thấy ở T1 và T2, tiếp theo là T3 và T4. Trong tài liệu, tỷ lệ năng suất tốt thường vào khoảng 7,5 kg/m3 (Otoshi và cộng sự, 2007). Tuy nhiên, để đạt được những giá trị này cần phải sử dụng các phương pháp công nghệ bổ sung như bơm oxy lỏng, sử dụng men vi sinh, chất nền nhân tạo, bộ lọc bên ngoài để loại bỏ và kiểm soát tổng chất rắn lơ lửng, khẩu phần ăn cân bằng đặc biệt cho hệ thống BFT và/hoặc tôm được chọn lọc về mặt di truyền để có tiềm năng tăng trưởng cao hơn (đường tốc độ).
Kết luận
Dữ liệu thu được trong nghiên cứu này chứng minh rằng canxi hydroxit và natri bicarbonate là những hợp chất hiệu quả để tăng độ kiềm trong môi trường nuôi cấy BFT, trong khi natri cacbonat không có hiệu quả trong việc tăng độ kiềm. Tuy nhiên, natri cacbonat có hiệu quả trong việc tăng độ pH và góp phần làm tăng độ kiềm. Điều này cho thấy rõ ràng, qua kết quả thu được từ T4, mức độ kiềm và pH giảm, trong khi nồng độ CO2 tăng trong hệ thống BFT siêu thâm canh sử dụng hợp chất kiềm hóa. Ngoài ra, chất lượng nước và hiệu quả kỹ thuật chăn nuôi bị ảnh hưởng tiêu cực khi nồng độ kiềm duy trì dưới 100 mg CaCO3/L và pH 7 trong thời gian dài. Vì vậy, trong hệ thống nuôi BFT, cần tăng mức độ kiềm và pH thông qua việc sử dụng các hợp chất kiềm hóa.
Theo Plínio S. Furtado, Luís H. Poersch, Wilson Wasielesky Jr.
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Dự Án Sử Dụng Cảm Biến Sinh Học Chi Phí Thấp Để Phát Hiện Mầm Bệnh
- Thu Hồi Chất Dinh Dưỡng Lãng Phí Từ Nuôi Tôm Thông Qua Nuôi Kết Hợp Polychaetes Và Halophytes
- WSSV ở Úc

 English
English