Hoạt động xử lý sinh học và sản xuất sinh khối của các sinh vật chiết xuất hữu cơ (polychaetes Arenicolamarina, Hediste diversicolor và halophyte Salicornia ramosissima) đã được đánh giá trong môi trường nuôi trồng thủy sản đa dinh dưỡng tổng hợp (IMTA). Các thử nghiệm nuôi cấy được thực hiện ngoài trời bằng cách sử dụng nước thải giàu chất dinh dưỡng từ một trang trại nuôi tôm sử dụng hệ thống nuôi trồng thủy sản tuần hoàn. Hiệu quả xử lý sinh học tương tự đạt được trong các môi trường nuôi cấy sử dụng một bể nuôi ghép đơn (1T) hoặc hai bể nuôi riêng biệt (2T; ≈ 0,3 và 0,6 m2 diện tích hoạt động), với mức giảm 74–87% đối với chất hữu cơ dạng hạt ( POM), 56–64% đối với nitơ vô cơ hòa tan (DIN) và 60–65% đối với phốt pho vô cơ hòa tan (DIP). Hediste diversicolor thích nghi tốt với điều kiện nuôi cấy, đạt mật độ lên tới 5.000 ind./ m2 (≈ 78–98 g/m2). Arenicola marina không thể đối phó với nhiệt độ nước vượt quá giới hạn nhiệt của loài, cho thấy tỷ lệ sống < 10% (20 °C thường được coi là ngưỡng nhiệt tối đa đối với loài này). Năng suất của S. ramosissima ở 1 T gấp khoảng hai lần so với 2 T (≈ 150–170 và ≈ 60–90 g FW/ m2 sinh khối ăn được trên mặt đất). Màu hơi vàng của cây trồng có thể là do quá trình oxy hóa hóa học và xử lý sơ bộ bằng phương pháp lọc cát nhanh áp dụng cho nước ngầm lợ được sử dụng trong cơ sở nuôi trồng thủy sản, loại bỏ sắt (và có thể cả các nguyên tố thiết yếu khác). Nhìn chung, thiết kế 1 T kết hợp H. diversicolor và S. ramosissima cho thấy hiệu suất xử lý sinh học và sản xuất sinh khối tốt nhất, đồng thời cho phép giảm một nửa diện tích hoạt động cần thiết để triển khai mô hình IMTA này.
Nuôi trồng thủy sản đa dinh dưỡng tổng hợp (IMTA) là một phương pháp tiếp cận dựa trên hệ sinh thái, trong đó các loài có cấp độ dinh dưỡng khác nhau được nuôi chung trên cùng một khu vực, nhằm tối đa hóa khả năng phục hồi các chất dinh dưỡng được đưa vào hệ thống sản xuất, đồng thời giảm thiểu tác động môi trường của nuôi trồng thủy sản. Nuôi trồng thủy sản nước mặn (biển và nước lợ) là một lĩnh vực quan trọng của nuôi trồng thủy sản, chiếm khoảng 56% và 46% tổng khối lượng và giá trị được tạo ra từ nuôi trồng thủy sản toàn cầu (giá trị toàn cầu trên 114 triệu tấn và 263 tỷ USD). Tuy nhiên, nuôi trồng thủy sản nước mặn cũng gây ra một số vấn đề môi trường, chẳng hạn như ô nhiễm nước do chất thải từ các trang trại nuôi trồng thủy sản. Hạn chế này có thể được khắc phục nếu lượng chất dinh dưỡng dư thừa đó được chiết xuất, ví dụ, thông qua xử lý sinh học, từ nước thải nuôi trồng thủy sản nước mặn.
Hệ thống nuôi trồng thủy sản tuần hoàn hiện đại (RAS) cho phép nuôi các loài nước mặn ở khắp mọi nơi, nhưng cần phải quản lý và xử lý nước thải có chứa chất dinh dưỡng. Các chất dinh dưỡng trong nước thải nuôi trồng thủy sản, bao gồm chất hữu cơ dạng hạt (POM), chất hữu cơ hòa tan (DOM) và dưới dạng chất dinh dưỡng vô cơ hòa tan (DIN). Việc thu hồi các chất dinh dưỡng vô cơ hòa tan có thể thực hiện bằng cách sử dụng các sinh vật sản xuất sơ cấp như các loài chiết xuất, chẳng hạn như vi tảo, rong biển và halophytes, trong khi việc phục hồi POM có thể được thực hiện bằng cách sử dụng các loài ăn cặn và các loài ăn lọc, như giun nhiều tơ và động vật hai mảnh vỏ. Việc tích hợp nhiều loài từ các bậc dinh dưỡng khác nhau trong cùng một thiết kế IMTA cho phép thu hồi các chất dinh dưỡng dạng hạt và hòa tan. Điều này đã được chứng minh trong các nghiên cứu trước đây. Nhìn chung, hầu hết các thiết kế IMTA được đề cập cho đến nay đều ủng hộ việc nuôi cấy các loài khai thác khác nhau trong các bể riêng biệt. Điều này đòi hỏi diện tích hoạt động lớn hơn, thường là một trong những hạn chế chính để phát triển thành công mô hình IMTA. Để giảm thiểu diện tích hoạt động cần thiết, cần nỗ lực phát triển các thiết kế IMTA để có thể sản xuất các loài chiết xuất khác nhau bằng cách sử dụng các phương pháp đổi mới.
Một thách thức lớn đối với hệ thống nuôi trồng thủy sản RAS hiện đại là sử dụng nước ngầm nhiễm mặn thường siêu bão hòa với nitơ, argon và carbon dioxide. Các hợp chất này có hại cho các loài cá có vây và động vật giáp xác được nuôi, vì vậy cần phải loại bỏ chúng trước khi đưa nước vào hệ thống. Quá trình này có thể loại bỏ các vi chất dinh dưỡng cần thiết cho các loài chiết xuất như halophytes.
Giun polychaete, chẳng hạn như Hediste diversicolor và Arenicola marina có thể giúp thu hồi các chất dinh dưỡng lãng phí từ POM có trong nước thải nuôi trồng thủy sản, các loài halophyte như Salicornia ramosissima có thể giúp thu hồi các chất dinh dưỡng vô cơ hòa tan (chủ yếu là nitơ và phốt pho). Do đó, nghiên cứu này đã đánh giá hiệu suất xử lý sinh học và sản xuất sinh khối của nuôi cấy kết hợp polychaetes và halophytes, cụ thể là A. marina và S. ramosissima (Amar + Sram) và H. diversicolor và S. ramosissima (Hdiv + Sram) bằng cách sử dụng nước thải từ hệ thống RAS tôm được vận hành bằng nước ngầm mặn đã được xử lý trước (khoảng 20 g/ L muối). Các thiết kế IMTA khác nhau này đã được thử nghiệm bằng cách sử dụng các khu vực hoạt động khác nhau được chỉ định là bể nuôi ghép đơn (1T) và hai bể nuôi riêng biệt ở cấp độ dinh dưỡng (2T) (lần lượt là 0,3 và 0,6 m2 diện tích hoạt động).
Nguyên liệu và phương pháp
Các loài khai thác được lựa chọn
Tất cả các loài khai thác được thử nghiệm trong nghiên cứu hiện tại bao gồm giun Polychaete H. diversicolor, Polychaete A. marina, Salicornia ramosissima đều có thể dễ dàng thu thập và rất phong phú tại địa điểm nghiên cứu, đầm phá ven biển Ria de Aveiro (Bồ Đào Nha 40°44′21.1″N 8°39′ 40.1″ W).
Giun Polychaete. Polychaete H. diversicolor, thường được gọi là giun phấn, phân bố rộng rãi dọc theo vùng biển nông và nước lợ của các cửa sông châu Âu và Bắc Mỹ. Sự sinh sản của loài này kéo theo cái chết của giun bố mẹ (loài giống). Quá trình trưởng thành mất từ 1 đến 2 năm trước khi sinh sản. Nó được coi là loài săn mồi tích cực thể hiện thói quen ăn tạp, được xếp vào nhóm chức năng giun nhiều tơ ăn ký sinh. Khả năng xáo trộn sinh học và sinh khối có giá trị cao (giàu axit béo thiết yếu) khiến loài polychaete này trở thành loài thích hợp cho IMTA.
Polychaete A. marina, thường được gọi là giun lugworm, phân bố rộng rãi ở các bờ biển phía tây bắc châu Âu, từ Quần đảo Anh đến Bán đảo Iberia, với giới hạn phân bố phía nam của nó là gần 40° N61. Loài này sinh sản nhiều lần trong suốt vòng đời (loài lưỡng tính) đạt đến độ trưởng thành về giới tính ở 2–3 tuổi, tách giới tính và thực hiện thụ tinh bên ngoài, với các quần thể khác nhau giải phóng trứng và tinh trùng trong khoảng thời gian đồng bộ là 2 tuần kéo dài từ Tháng 10 đến tháng 11. Nó ăn các mảnh vụn và vi sinh vật có trong trầm tích, để lại một vết lõm đặc trưng trên đỉnh trầm tích (“lỗ thổi”). Trong tự nhiên, những polychaetes này có thể đạt mật độ từ 100–150 ind./ m2 và chịu được độ mặn từ 12 đến 35. Con trưởng thành có thể đạt chiều dài từ 120 đến 200 mm, giun lug worm được coi là mồi cao cấp cho người câu cá và được xem như một chất thay thế đầy hứa hẹn cho máu người và sử dụng trong các giải pháp bảo quản nội tạng) khiến loài polychaete này trở thành một loài thực vật ứng cử viên đầy triển vọng cho IMTA.
Cây halogenua. Salicornia ramosissima là một loại cây halophyte thường được gọi là samphire xanh, phân bố rộng rãi ở các vùng đầm lầy muối ở bán đảo Iberia, miền tây nước Pháp và Serbia. Những loại cây này được coi là một sản phẩm dành cho người sành ăn với các đầu cành tươi khi loại cây này cũng được sử dụng để khử nước và nghiền thành các chế phẩm có thể thay thế muối truyền thống như muối xanh. Thành phần dinh dưỡng của S. ramosissima phù hợp cho con người sử dụng, cho thấy hàm lượng protein cao (5,20 g/100 g DW), axit béo không bão hòa đa n-3 và n-6 (chủ yếu là axit α-linolenic và linoleic) và khoáng chất (như natri, kali, canxi, magie, sắt và mangan). Những cây này cũng thể hiện khả năng chống oxy hóa và chống viêm đáng kể do tổng hàm lượng phenolics. Ngoài ra, hạt Salicornia spp. chứa hàm lượng dầu và protein đáng kể (ví dụ hạt Salicornia bigelovii có 26–33% dầu và 31% protein). Cây trồng cho dầu rất quan trọng đối với tăng trưởng kinh tế của ngành nông nghiệp, với nhiều axit béo có trong hạt giống cây trồng đang được yêu cầu cao cho một số ngành công nghiệp (ví dụ: nhựa, dệt may, dược phẩm, mỹ phẩm). Tiềm năng xử lý sinh học được thể hiện bởi Salicornia spp. liên quan đến tiềm năng tạo ra sinh khối khai thác có giá trị khiến những loài thực vật này trở thành ứng cử viên chính cho IMTA.
Thiết kế IMTA
Nghiên cứu hiện tại được thực hiện từ tháng 6 đến tháng 9 năm 2018 tại RiaSearch Lda. (Bồ Đào Nha), sử dụng RAS để nuôi tôm thẻ chân trắng (Penaeus vannamei) và vận hành bằng nước ngầm nước lợ đã được xử lý trước thông qua quá trình oxy hóa hóa học và lọc cát nhanh để loại bỏ sắt. Tôm được cho ăn 2 lần/ ngày với khẩu phần ăn thương mại dành cho cá dẹt có 62% protein thô, 18% chất béo thô và 0,3% chất xơ thô (WINFlat—SPAROS). Thức ăn thừa và phân được hút từ bể nuôi được thu thập và tập trung vào một bể chứa (130 L) được trang bị một máy bơm được lập trình để hoạt động 5 phút/ giờ nhằm thúc đẩy quá trình đồng nhất hóa và tránh điều kiện yếm khí. Nước tập trung trong hồ chứa này được bổ sung 3 ngày/ lần vào bể chảy ra (0,34 m3), từ đó nó được bơm qua tháp nhỏ giọt bằng nhựa lắp đặt phía trên bể chảy vào (0,34 m3). Từ bể cấp nước này, nước được dẫn đến các bể nơi thực hiện các thiết kế IMTA khác nhau sử dụng bộ lọc cát hỗ trợ polychaete (PASF) và halophytes trong aquaponics.

Hình 9. Sơ đồ biểu diễn (1a) và phân bố (1b) của các thiết kế IMTA khác nhau được thử nghiệm trong nghiên cứu này bằng cách sử dụng các loài chiết xuất polychaetes (Arenicola marina—Amar—và Hediste diversicolor—Hdiv) và halophytes (Salicornia ramosissima—Sram) được nuôi cấy trong cùng một bể (1 T—thiết kế A và C) hoặc trong hai bể riêng biệt (2 T—thiết kế B và D): (A) 1 T Amar + Sram; (B) 2 T Amar + Sram; (C) 1 T Hdiv + Sram; (D) 2 T Hdiv + Sram; và (E) bể đối chứng.
Sơ đồ biểu diễn các thiết kế IMTA khác nhau được thử nghiệm trong nghiên cứu nàyđược hiển thị trong Hình 9a. Các mẫu 1TAmar + Sram và 2TAmar + Sram được thả chứa polychaete A. marina và halophyte S. ramosissima, trong khi các mẫu 1 T Hdiv + Sram và 2 T Hdiv + Sram được thả chứa polychaete H. diversicolor và halophyte S. ramosissima. Các thiết kế với polychaetes và halophyte nuôi cấy 1 T trong cùng một bể (diện tích hoạt động ≈ 0,3 m2), với rễ của S. ramosissima được duy trì trong cột nước của PASF. Thiết kế 2 T nuôi cả hai loài khai thác trong các bể riêng biệt (diện tích hoạt động ≈ 0,6 m2) với nước đi qua lớp cát sau đó được dẫn đến thiết bị aquaponics. Trong thiết kế 1 T, nước chảy vào bể PASF thông qua một đường ống có đáy kết thúc thấp hơn tấm đỡ halophyte 0,1 m để bảo vệ rễ khỏi các chất hữu cơ dạng hạt và cũng được áp dụng tương tự trong thiết kế 2 T. Mỗi thiết kế đều được đánh giá bằng cách sử dụng 5 lần lặp lại, được phân bổ như được trình bày trong Hình 9b. 5 đơn vị đối chứng không có polychaetes và halophyte cũng được đưa vào thiết kế thử nghiệm. Mỗi bể PASF có thể tích 0,05 m3 và diện tích bề mặt 0,3 m2 và được hình thành bởi cột cát 150 mm (cỡ hạt 0,5–0,7 mm) ở đáy bể và cột nước bề mặt 150 mm. Những bể này được trang bị một ống thoát nước ở đáy để cho phép nước thấm hoàn toàn qua cột cát. Bể aquaponic được sử dụng trong thiết kế 2 T có thể tích nước là 0,05 m3 và diện tích bề mặt là 0,3 m2. Mỗi bể chứa các thiết kế IMTA khác nhau được thử nghiệm nhận được dòng nước liên tục 25 L/giờ, với nước chảy ra được chuyển hướng đến bể chảy ra chung và được tuần hoàn. Hệ thống được lắp ráp để thực hiện nghiên cứu này có tổng thể tích là 2 m3 và mỗi tuần, khoảng 3% thể tích này được bổ sung dưới dạng nước ngọt để bù đắp cho lượng thất thoát do bay hơi.
Nuôi cấy và giám sát các loài chiết xuất IMTA.
Bể nuôi được cấy với mật độ thả ban đầu là ≈ 67 con/ m2 A. marina và 290 con/ m2 của H. diversicolor (≈ 130 g FW/ m2 đối với cả 2 loài polychaete) và được phân phối ngẫu nhiên 15 ngày trước khi bắt đầu thí nghiệm để thích nghi.
Hạt giống của các cây S. ramosissima được gieo vào khay chứa hỗn hợp xơ dừa và cát và luôn được để ngoài trời trong điều kiện nhiệt độ và quang kỳ tự nhiên. Trong 3 tháng, xơ dừa được duy trì độ ẩm thông qua tưới bằng nước lợ đã được xử lý trước bằng quá trình oxy hóa hóa học và lọc cát nhanh nước biển ở độ mặn 20 g/L. Sau giai đoạn này, các cây có trọng lượng tương tự (0,5–0,6 g) được chọn ngẫu nhiên và phân bổ trên mỗi bể của các thiết kế IMTA khác nhau (25 cây trên mỗi bể = 83 cây/ m2) để bắt đầu 2 tuần thích nghi.
Cây trồng trong aquaponics được thu hoạch 60 ngày sau khi bắt đầu thí nghiệm để xác định tổng sinh khối thực vật, cũng như sinh khối ăn được trên mặt đất (chồi) và sinh khối dưới mặt đất (rễ). Do việc phát hiện ấu trùng H. diversicolor trong PASF 60 ngày sau khi bắt đầu thí nghiệm, thời gian thử nghiệm được kéo dài thêm 60 ngày nữa (tổng cộng là 120 ngày) nhưng không có bất kỳ loài chịu mặn nào. Trong 60 ngày bổ sung này, việc bổ sung nước giàu dinh dưỡng cũng như tất cả các hoạt động theo dõi và bảo dưỡng đều được thực hiện chính xác như trong 60 ngày đầu tiên. Vào cuối thí nghiệm (120 ngày), toàn bộ cột cát của mỗi PASF được sàng và vận chuyển ngay đến phòng thí nghiệm trong điều kiện lạnh để phân loại, đếm và cân.
Giám sát IMTA
Trong toàn bộ thời gian thí nghiệm, độ pH, nhiệt độ, oxy hòa tan (DO) và độ mặn được theo dõi hàng tuần và các mẫu nước được thu thập sau 15, 30, 45, 60, 90 và 120 ngày kể từ ngày bắt đầu thí nghiệm. Các mẫu nước đi vào tất cả các thiết kế IMTA được thu thập sau khi nước giàu dinh dưỡng chứa trong bể chứa đã được thêm vào bể chảy ra và được đồng nhất hóa trong ít nhất 20 phút trước khi cấp vào bể chảy vào (tổng thể tích nước giàu dinh dưỡng = 0,68 m3). Các mẫu nước thoát ra theo thiết kế 1 T và 2 T được thu thập lần lượt là 2 và 4 giờ sau khi bổ sung nước giàu dinh dưỡng. Phân tích nước được thực hiện bằng máy phân tích dòng chảy liên tục tự động (Skalar San ++) để xác định TN, TP, NH4 -N, NOx-N và PO4-P. Các bộ lọc chứa SPM được xử lý theo phương pháp EPA 160.2. Các mẫu từ bể điều khiển không được xem xét vì trong thời gian nghiên cứu, cát ở đáy các bể này bị tắc do vật liệu dạng hạt và nước tràn vào. Các mẫu trầm tích từ mỗi bộ lọc cát được thu thập ba lần vào lúc bắt đầu và kết thúc thí nghiệm để xác định hàm lượng chất hữu cơ (OM) trong trầm tích bằng cách sử dụng phương pháp đốt cháy (LOI%; đốt trong 5 giờ ở 450°C chất nền được sấy khô trước đó ở 90°C, cho đến khi đạt được trọng lượng không đổi).
Xác định sắc tố quang hợp của loài Salicornia ramosissima
Các mẫu từ phần trên không ăn được của S. ramosissima (n = 5) được thu thập từ bốn thiết kế IMTA sau 60 ngày. Các mẫu cũng được thu thập từ các thực vật được sử dụng khi bắt đầu thí nghiệm (n = 5) và từ các loài cùng loài được thu thập từ tự nhiên (n = 5). Tất cả các mẫu được đông lạnh trong nitơ lỏng và giữ ở -80°C cho đến khi đông khô. Các mẫu được nghiền bằng cối và chày và cân 7–8 mg cho vào ống Eppendorf. Các sắc tố được chiết xuất bằng cách sử dụng 0, 5 mL metanol đệm lạnh 95% (2% amoni axetat), sau đó siêu âm 45 giây và ủ 20 phút ở -20°C trong bóng tối. Dịch chiết được lọc qua bộ lọc màng PTFE 0,2 μm và 50 µL ngay lập tức được tiêm vào hệ thống HPLC bằng máy dò mảng photodiode SPD-M20A (Shimadzu, Kyoto, Nhật Bản). Việc phân tách sắc ký được thực hiện bằng cột Supelcosil C18 (dài 25 cm; đường kính 4,6 mm; hạt 5 µm; Sigma-Aldrich, St. Louis, MO, USA). Các sắc tố được xác định từ quang phổ hấp thụ và thời gian lưu cũng như nồng độ được tính toán bằng phương trình hồi quy tuyến tính thu được từ các chất chuẩn tinh khiết (DHI, Hørsolm, Đan Mạch).
Phân tích thống kê
Phân tích phương sai hai chiều (ANOVA) được sử dụng để đánh giá sự khác biệt đáng kể giữa các thiết kế IMTA khác nhau (1 T và 2 T) và các loài polychaete khác nhau (A. marina và H. diversicolor). Phân tích phương sai (ANOVA) được sử dụng để đánh giá sự khác biệt giữa các nguồn sinh khối khác nhau (S. ramosissima được nuôi trong thiết kế 1 T và 2 T, ở các cây ban đầu được thả trong hệ thống thí nghiệm và các loài cùng loài được thu thập từ tự nhiên). Thử nghiệm của Anderson, Darling, Bartlett’s và Levene được sử dụng để kiểm tra tính quy phạm và tính đồng nhất của phương sai. Các bài kiểm tra HSD của Tukey post-hoc để so sánh các phương tiện riêng lẻ. Dữ liệu biến đổi Johnson được sử dụng khi điều kiện chuẩn không được xác minh. Sự khác biệt đáng kể luôn được xem xét ở mức p < 0,05.
Kết quả
Đặc điểm của điều kiện phi sinh học và thành phần nước chảy vào
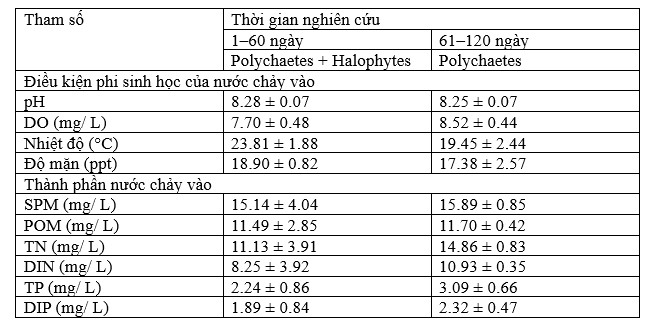
Các giá trị trung bình của các điều kiện và thành phần phi sinh học trong nước chảy vào được theo dõi trong quá trình thí nghiệm được tóm tắt trong Bảng 1. Chất hữu cơ dạng hạt (POM) và nitơ vô cơ hòa tan và phốt pho (DIN và DIP) được theo dõi trong nước chảy vào chiếm 75% tổng lượng chất dạng hạt lơ lửng (SPM), 70–75% tổng nitơ (TN) và 75–85% tổng lượng phốt pho (TP). Trong thử nghiệm nuôi ghép kết hợp polychaetes và halophyte (60 ngày), ước tính mỗi bể lọc được 490 L nước thải, chứa ≈ 5,6 g POM, 5,5 g TN (74% DIN) và 1,1 g TP (84% DIP). Trong giai đoạn thứ hai (60–120 ngày), nơi chỉ nuôi polychaetes, ước tính mỗi bể lọc 462 L nước thải, chứa ≈ 5,4 g POM, 6,9 g TN (74% DIN) và 1,4 g TP (75% DIP).
Xử lý sinh học các chất hữu cơ dạng hạt (POM) và tạo ra sinh khối polychaetes
Nồng độ POM được định lượng trong nước chảy vào và chảy ra của thiết kế IMTA khác nhau không khác biệt đáng kể với hiệu suất lưu giữ từ 84 đến 87%.
Nồng độ OM trong chất nền của các bộ lọc cát hỗ trợ polychaetes (PASF) được thả cùng với A. marina và H. diversicolor được hiển thị trong Hình 2. 2a, b. Không có sự khác biệt đáng kể giữa các nghiệm thức được tìm thấy trong hàm lượng OM được theo dõi ở lớp 20 mm hàng đầu (Tukey HSD hậu hoc, p > 0,05) và các lớp nền 20–100 mm (ANOVA hai chiều, p > 0,05), với các giá trị nằm trong khoảng 0,25 –0,34 và 0,27–0,30% LOI.
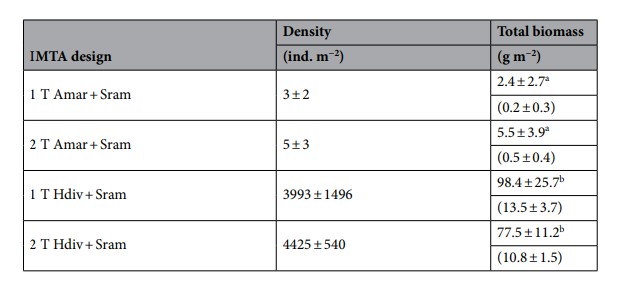
Các giá trị trung bình (± SD) của sinh khối và mật độ của A. marina và H. diversicolor được xác định khi kết thúc thí nghiệm được hiển thị trong Bảng 2. A. marina có tỷ lệ chết cao (90-95%), cho thấy loài giun nhiều tơ này không thích nghi tốt với điều kiện thí nghiệm. H. diversicolor có mật độ cuối cùng cao hơn đáng kể A. marina thu với mật độ cuối cùng là ≈ 14–15 lần so với giá trị ban đầu. Sinh khối của H. diversicolor cao hơn đáng kể so với sinh khối do A. marina tạo ra độc lập với thiết kế vận hành được thử nghiệm (Tukey HSD post-hoc, p < 0,05). Giữa các thiết kế 1T và 2 T thả cùng một loài polychaete, không có sự khác biệt đáng kể nào được tìm thấy về sinh khối được tạo ra (Tukey HSD post-hoc, p > 0,05).
Bảng 1. Các điều kiện phi sinh học (pH, oxy, nhiệt độ và độ mặn) và thành phần [chất hạt lơ lửng (SPM), chất hữu cơ dạng hạt (POM; %LOI trong SPM), tổng nitơ (TN), tổng phốt pho (TP), vô cơ hòa tan nitơ (DIN) và phốt pho (DIP)] được đo trong nước chảy vào. Giá trị trung bình ± SD (n = 5).
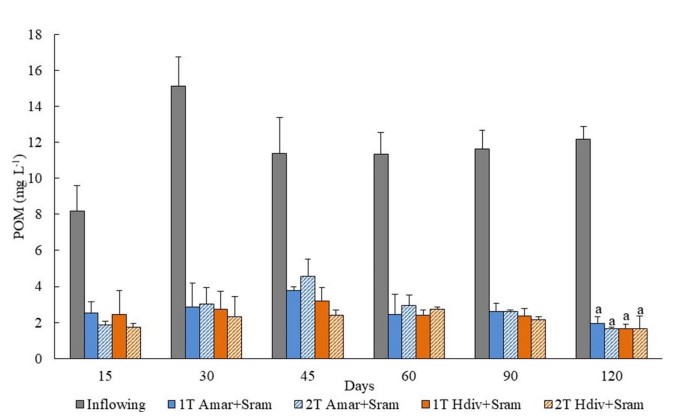
Hình 1. Chất hữu cơ dạng hạt (POM) được định lượng trong dòng chảy vào và dòng chảy ra của thiết kế IMTA được thử nghiệm trong nghiên cứu này bằng cách sử dụng các loài chiết xuất polychaetes (Arenicola marina—Amar—và Hediste diversicolor—Hdiv) và halophytes (Salicornia ramosissima—Sram) được nuôi cấy trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T). Giá trị trung bình ± SD (n = 5). Phân tích thống kê chỉ được thực hiện sau 120 ngày khi đánh giá sinh khối của các loài khai thác. Không có sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA được quan sát.

Hình 2. Hàm lượng chất hữu cơ (OM) được xác định trong các lớp nền 20 mm và 20–100 mm trên cùng của các thiết kế IMTA được thử nghiệm trong nghiên cứu này bằng cách sử dụng các loài polychaetes chiết xuất (Arenicola marina—Amar— và Hediste diversicolor—Hdiv) và halophytes (Salicornia ramosissima—Sram) được nuôi trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T). Giá trị trung bình ± SD (n = 5). Không có sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA được quan sát.
Bảng 2. Mật độ và tổng sinh khối của giun nhiều tơ (Arenicola marina—Amar—và Hediste diversicolor—Hdiv) được nuôi trong cùng bể với halophytes (Salicornia ramosissima—Sram) (1 T) hoặc trong hai bể riêng biệt (2 T) ở ngày thứ 120 Giá trị trung bình ± SD (n = 5). Các chữ cái khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA. Các giá trị trong ngoặc biểu thị sinh khối trọng lượng khô.

Hình 3. Con non Hediste diversicolor được tạo ra sau 120 ngày nuôi cấy.
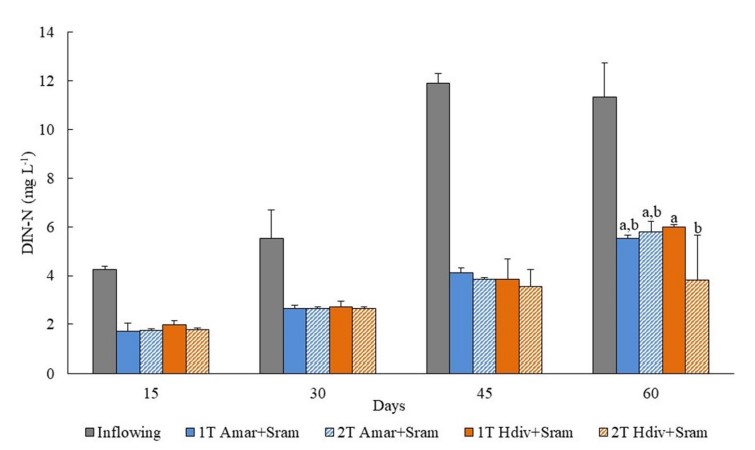
Hình 4. Nitơ vô cơ hòa tan (DIN) được định lượng trong dòng chảy vào và dòng ra của các thiết kế IMTA được thử nghiệm trong nghiên cứu này bằng cách sử dụng các loài chiết xuất polychaetes (Arenicola marina—Amar—và Hediste diversicolor—Hdiv) và halophytes (Salicornia ramosissima—Sram) được nuôi cấy trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T). Giá trị trung bình ± SD (n = 5). Phân tích thống kê chỉ được thực hiện trong khoảng thời gian 120 ngày khi sinh khối được đánh giá. Các chữ cái khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA.
Chiết xuất nitơ vô cơ hòa tan và phốt pho (tương ứng là DIN và DIP) và tạo ra sinh khối Salicornia ramosissima.
Nồng độ DIN và DIP được theo dõi trong dòng chảy vào và dòng ra của thiết kế IMTA 1 T và 2 T chứa Amar + Sram và Hdiv + Sram vào ngày 60 được hiển thị trong Hình 4 và 5. Nồng độ DIN được giám sát trong nước chảy ra của 2 T Hdiv + Sram thấp hơn đáng kể so với nồng độ được thể hiện bởi 1 T Hdiv + Sram (Post-hoc Tukey HSD, p < 0,05), trong khi giữa các thiết kế IMTA còn lại không tìm thấy sự khác biệt đáng kể (Post-hoc Tukey HSD, p < 0,05). Không tìm thấy sự khác biệt đáng kể về nồng độ DIP đo được trong nước chảy ra của các thiết kế IMTA khác nhau (ANOVA hai chiều, p > 0,05). Hiệu suất xử lý sinh học lần lượt là 48–66% và 52–56% đối với dòng DIN và DIP.
Trọng lượng trung bình của S. ramosissima được nuôi cấy theo các thiết kế IMTA khác nhau thả Amar + Sram và Hdiv + Sram được hiển thị trong Hình 6. Vào ngày thứ 60, các cây được trồng trên các thiết kế 1 T cho thấy trọng lượng trung bình cao hơn đáng kể (≈ 2 lần) cao hơn so với những kết quả được báo cáo trong 2 thiết kế T độc lập với các loài polychaete được thả nuôi (Tukey HSD hậu hoc, p < 0,05). Bảng 3 tóm tắt các giá trị trung bình (± SD) của mật độ và tổng sinh khối được báo cáo vào ngày thứ 60. Trong giai đoạn này, 36–40% và 44–56% số cây ban đầu được trồng ở cả hai thiết kế IMTA 1 T và 2 T bước vào giai đoạn già hóa và tương ứng được coi là không khả thi đối với tài khoản sinh khối. Không có sự khác biệt đáng kể nào được xác minh về mật độ cây cuối cùng được báo cáo trong thiết kế 1 T và 2 T. Tổng sinh khối thực vật và sinh khối vốn có trên mặt đất được tạo ra bởi cả hai thiết kế 1 T cao hơn đáng kể so với thiết kế được báo cáo trong 2 T, ngoại trừ giữa 2 T Hdiv + Sram và 1 T Amar + Sram. Sinh khối dưới mặt đất được tạo ra cao hơn trong các thiết kế 1 T, với các giá trị thu được trong 1 T Amar + Sram cao hơn đáng kể so với các giá trị thu được trong 2 T Amar + Sram (Tukey HSD hậu hoc, p < 0,05). Sinh khối cuối cùng được báo cáo trong thiết kế 1 T và 2 T lần lượt cao hơn ≈ 4,0–5,1 và 1,9–2,5 lần so với giá trị thả giống ban đầu. Sinh khối trọng lượng tươi trên mặt đất (FW) chiếm 70–80% tổng sinh khối thực vật được sản xuất, trong khi sinh khối trọng lượng khô (DW) của chúng tương ứng với khoảng 8% giá trị FW. Cây có màu hơi vàng trong nghiên cứu (Hình 7a–c) có dấu hiệu của giai đoạn già hóa.
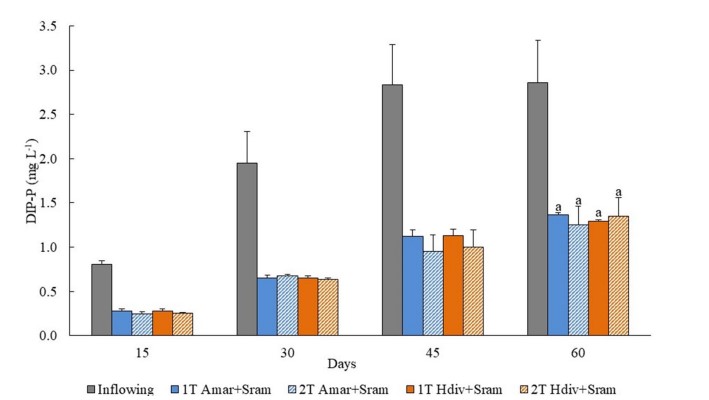
Hình 5. Định lượng phốt pho vô cơ hòa tan (DIP) trong nước thải vào và ra của các thiết kế IMTA được thử nghiệm sử dụng các loài chiết xuất polychaetes (Arenicola marina—Amar—và Hediste diversicolor— Hdiv) và halophytes (Salicornia ramosissima—Sram) được nuôi trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T). Giá trị trung bình ± SD (n = 5). Phân tích thống kê chỉ được thực hiện sau 120 ngày khi đánh giá sinh khối của các loài khai thác. Không có sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA được quan sát.

Hình 6. Trọng lượng tươi của Salicornia ramosissima (Sram) ở ngày thứ 1 và ngày thứ 60 được nuôi trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T) so với giun nhiều tơ (Arenicola marina—Amar—và Hediste diversicolor—Hdiv). Trung bình ± SD (n = 5). Các chữ cái khác nhau trong mỗi khoảng thời gian cho thấy sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA.
Bảng 3. Mật độ cuối cùng, tổng sinh khối trọng lượng tươi thực vật, sinh khối trọng lượng tươi trên mặt đất và dưới mặt đất của loài halophytes (Salicornia ramosissima—Sram) được nuôi trong cùng một bể (1 T) hoặc trong các bể riêng biệt (2 T) với giun nhiều tơ (Arenicola marina—Amar —và Hediste diversicolor—Hdiv) ở ngày thứ 60. Giá trị trung bình ± SD (n = 5). Các chữ cái khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) giữa các thiết kế IMTA. Các giá trị trong ngoặc biểu thị sinh khối trọng lượng khô.
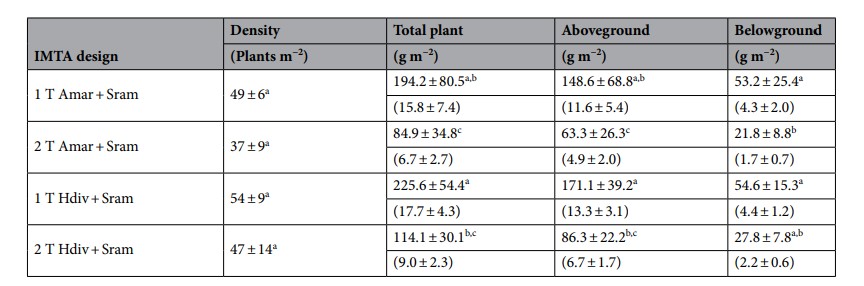

Hình 7. Sự phát triển màu sắc của Salicornia ramosissima trong thời gian thí nghiệm: (a) cây ở ngày thứ 1; (b) cây vào ngày thứ 30 và (c) cây vào ngày thứ 60.
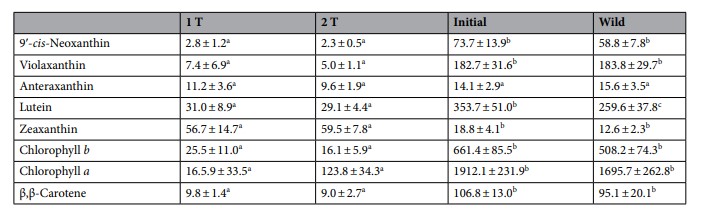
Đặc điểm sắc tố của Salicornia ramosissima được nuôi cấy theo thiết kế IMTA 1 T và 2 T. Các sắc tố được ghi nhận ở S. ramosissima ban đầu được thả, nuôi cấy và thu thập từ tự nhiên là các carotenoid 9′-cis-neoxanthin, violaxanthin, antheraxanthin, lutein, zeaxanthin và β, β-carotene và chlophyll a và b (Chl a và Chl b) (Bảng 4). Các giá trị trung bình (± SD) của nồng độ sắc tố được xác định trong S. ramosissima được nuôi cấy theo thiết kế IMTA 1 T và 2 T, cũng như đặc điểm của các cây thả giống ban đầu và các loài hoang dã cùng loài được trình bày trong Bảng 5. Nồng độ 9′-cis- neoxanthin, violaxanthin, lutein, β, β-carotene, Chl a và b cao hơn đáng kể khi thả giống ban đầu và cây hoang dã so với cây được nuôi dưới 1 T và 2 T. Mặt khác, nồng độ zeaxanthin cao hơn đáng kể đã được quan sát thấy ở thực vật được nuôi dưới 1 T và 2 T khi so sánh với thực vật thả giống ban đầu và thực vật hoang dã. Không có sự khác biệt đáng kể về thành phần sắc tố được xác nhận giữa các cây được nuôi theo thiết kế 1 T và 2 T. Tỷ lệ Chl b/Chl a của cây trồng thấp hơn so với cây được thả ban đầu và cùng loài hoang dã (thấp hơn 2 lần), trong khi tỷ lệ tổng carotenoid/diệp lục và zeaxanthin/carotenoid cao hơn (≈ 2,2–3,4 và 36–46 lần) (Hình 8a-c). Sự khác biệt đáng kể được tìm thấy ở các tỷ lệ nêu trên giữa cây trồng, cây thả giống ban đầu và cây cùng loài hoang dã.
Thảo luận
Nghiên cứu này nhằm so sánh hiệu suất xử lý sinh học và sản xuất sinh khối thông qua nuôi cấy kết hợp giữa A. marina và S. ramosissima (Amar + Sram) và H. diversicolor và S. ramosissima (Hdiv + Sram) bằng cách sử dụng một bể nuôi ghép đơn (1 T) và hai bể riêng biệt cấp dinh dưỡng (2 T), IMTA thiết kế với diện tích hoạt động khác nhau (tương ứng là 0,3 và 0,6 m2). Thí nghiệm được thực hiện ngoài trời và độ biến thiên lớn đã được xác minh đối với độ mặn và nhiệt độ nước (khoảng 12–20 g muối/ L, 16–28 °C), trong khi các giá trị pH và oxy hòa tan (DO) ổn định hơn là được báo cáo (lần lượt là 8,1–8,4 và 6,8–9,5 mg/ L). Mặc dù có sự thay đổi, tất cả các thông số này đều nằm trong phạm vi giá trị được theo dõi trong các bể nước và vùng thủy triều của đầm phá ven biển Aveiro được sử dụng trong nghiên cứu này.
Bảng 4. Danh sách các sắc tố phát hiện được trong halophytes (Salicornia ramosissima) với thời gian lưu và thời gian hấp thụ trung bình (λ max).
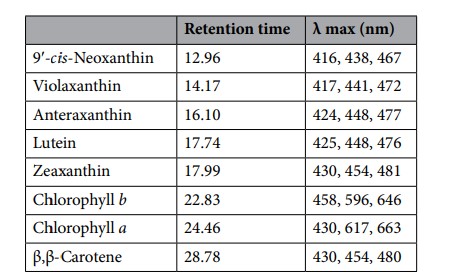
Bảng 5. Nồng độ sắc tố (µg/ g sinh khối DW) được ghi nhận trong halophytes (Salicornia ramosissima) được nuôi trong cùng một bể (1 T) hoặc trong các bể riêng biệt (2 T) với polychaetes (Arenicola marina— Amar— và Hediste diversicolor— Hdiv), cũng như các loài thực vật ban đầu được thả giống từ tự nhiên. Giá trị trung bình ± SD (n = 5). Các chữ cái khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) giữa các mẫu.
Cả hai thiết kế IMTA 1 T và 2 T đều có hiệu suất xử lý sinh học cao, với hiệu suất lưu giữ từ 74 đến 87% POM, 56 đến 64% DIN và 60 đến 65% DIP. Lớp cát của PASF đóng một vai trò rất quan trọng bằng cách giữ lại và duy trì OM để duy trì sự phát triển của giun nhiều tơ, trong khi các sinh vật này thúc đẩy quá trình xáo trộn sinh học (tái hoạt động trầm tích và tưới sinh học, cho phép oxy hòa tan tiếp cận các lớp sâu hơn của chất nền), giúp tránh tắc nghẽn hệ thống và duy trì sự thấm của nước qua lớp cát. Hiệu suất xử lý sinh học của các thiết kế IMTA giảm khi tỷ lệ tử vong của giun nhiều tơ tăng lên. Trong nghiên cứu này, tỷ lệ tử vong của loài giun nhiều tơ A. marina rất cao, lên tới 90%. Điều này có thể do nhiệt độ nước cao hơn mức tối ưu cho loài này. Ngoài ra, nhiệt độ nước là một yếu tố quan trọng ảnh hưởng đến khả năng sống sót và tăng trưởng của giun nhiều tơ. Các nghiên cứu trước đây đã chỉ ra rằng nhiệt độ nước trên 20°C có thể làm suy giảm khả năng nuôi thành công của loài A. marina.
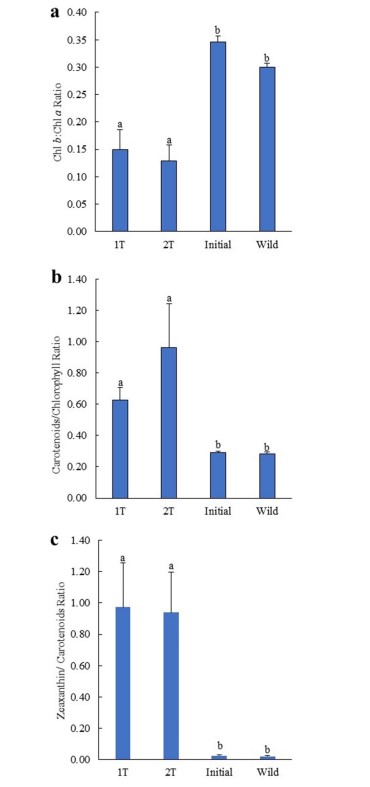
Hình 8. Tỷ lệ diệp lục b:chlorophyll a (Chl b/Chl a), tổng carotenoid/diệp lục và tỷ lệ zeaxanthin/carotenoid đo được ở cá Salicornia ramosissima nuôi trong cùng một bể (1 T) hoặc trong hai bể riêng biệt (2 T) so với cá polychaetes (Arenicola marina và Hediste diversicolor). Giá trị trung bình ± SD (n = 5). Các chữ cái khác nhau biểu thị sự khác biệt đáng kể (p < 0,05) giữa các mẫu.
Mật độ cuối cùng của H. diversicolor trong các thiết kế IMTA 1 T và 2 T gấp khoảng 15 lần mật độ thả giống ban đầu (mật độ cuối cùng ≈ 4000–5000 ind./ m2). Sinh khối FW của H. diversicolor ở cuối thí nghiệm thấp hơn giá trị có ở lúc bắt đầu thí nghiệm, nhưng điều này là do các mẫu vật ở cuối thí nghiệm tương ứng với một quần thể cá con mới được tạo ra, mới bắt đầu phát triển và chưa đạt được kích thước thương mại. Trong một nghiên cứu được thực hiện trong khoảng thời gian dài hơn (≈ 150 ngày), các kết quả tương tự với kết quả được ghi lại trong nghiên cứu hiện tại đã thu được về mức tăng mật độ giun nhiều tơ, từ ≈ 400 đến 7000 ind./ m2, trong PASF được thả H. diversicolor được cung cấp nước thải giàu hữu cơ được tạo ra bởi RAS thương mại siêu thâm canh sản xuất Solea senegalensis. Nghiên cứu của các nhà khoa học đã chứng minh tiềm năng của giun nhiều tơ Hediste diversicolor trong việc ứng dụng trong hệ thống IMTA. Giun này có khả năng sinh trưởng và phát triển nhanh chóng, có thể xử lý các chất thải hữu cơ trong nước thải, góp phần giảm thiểu ô nhiễm môi trường và nâng cao hiệu quả kinh tế của hệ thống IMTA.
Liên quan đến hiệu suất tăng trưởng của halophytes, trọng lượng trung bình cao hơn đáng kể (cao hơn 2 lần) đã được báo cáo đối với cây được nuôi theo thiết kế 1 T, độc lập với các loài polychaete được thả giống. Tổng sinh khối được báo cáo ở thiết kế 1 T và 2 T sau 60 ngày thử nghiệm chiếm 5–5,7 và 1,7–2,4 lần so với sinh khối thả ban đầu tương ứng với ≈ 150–170 và 60–90 g/ m2. Các giá trị này thấp hơn so với giá trị thu được trong các nghiên cứu trước, nhưng vẫn có giá trị thương mại. Tuy nhiên, điều kiện nuôi cấy làm suy giảm sự phát triển của S. ramosissima. Trong thử nghiệm thời gian đầu, thực vật bắt đầu phát triển màu hơi vàng, thậm chí một số còn có dấu hiệu già hóa rõ rệt. Vào cuối giai đoạn thử nghiệm, khoảng 40 đến 60% số cây không còn khả năng sống sót. Sự phát triển của màu hơi vàng rất có thể liên quan đến việc thiếu sắt, vì tất cả nước mặn được sử dụng trong hệ thống nuôi tôm và thiết kế RAS-IMTA đều được bơm từ lỗ khoan và xử lý trước thông qua quá trình oxy hóa hóa học. Quá trình xử lý này thúc đẩy quá trình kết tủa và loại bỏ sắt, cùng với các nguyên tố khác như Mg, P, Ca và Mn. Một lời giải thích khác cho màu hơi vàng và sự già hóa sớm có thể liên quan đến thực tế là nước giàu dinh dưỡng được sử dụng trong nghiên cứu này được lưu trữ trong 3 ngày trong bể chứa không có sục khí (máy bơm chìm chỉ trộn nước 5 phút mỗi giờ). Những điều kiện này có thể đã tạo điều kiện thuận lợi cho việc sản sinh ra các khí độc, chẳng hạn như hydro sunfua (H2S), khí này trong thực vật đã được chứng minh là có vai trò quan trọng trong việc điều hòa sự sinh trưởng, phát triển và lão hóa của thực vật. Cây được nuôi cấy trong thiết kế IMTA 1 T và 2 T thể hiện hàm lượng chl a, b và tổng số carotenoids thấp hơn (lần lượt là ≈ 124–166, 16–26 và 118–128 µg/ g DW sinh khối) so với cây được ghi nhận khi chúng ban đầu được thả giống, cũng như các loài cùng loài từ tự nhiên (≈ 1912–1695, 508–661 và 625–749 µg/ g sinh khối DW). Hàm lượng sắc tố giảm cũng có thể là do việc sử dụng nước giếng khoan đã được xử lý trước bằng quá trình oxy hóa hóa học. Tuy nhiên, mức zeaxanthin được định lượng cao hơn ở thực vật nuôi cấy có lẽ là kết quả của việc kích hoạt chu trình violaxanthin, một chu trình gồm hai bước trong đó violaxanthin được chuyển đổi đầu tiên thành antheraxanthin và sắc tố sau được chuyển đổi thành zeaxanthin. Việc kích hoạt chu trình này có tính chất bảo vệ quang học và được kích hoạt bởi cường độ ánh sáng cao, nhưng nó cũng có thể được kích hoạt bởi các yếu tố gây căng thẳng phi sinh học khác (ví dụ như thiếu oxy và nhiệt độ cao). Mặt khác, hàm lượng zeaxanthin cao này đáng được nghiên cứu thêm vì carotenoid này đóng một vai trò quan trọng trong việc ngăn ngừa các bệnh về mắt liên quan đến tuổi tá. Halophytes thể hiện mức độ zeaxanthin được tăng cường có thể có giá trị cao hơn trên thị trường thực phẩm chức năng.
Nhìn chung, thiết kế thử nghiệm 1 T thể hiện hiệu suất tốt nhất (nghĩa là hiệu suất xử lý sinh học và polychaetes tương tự và năng suất halophyte tốt nhất). Hơn nữa, nó cũng cho phép giảm một nửa diện tích hoạt động cần thiết. Nghiên cứu này cũng cho thấy những việc nuôi cấy một số loài khai thác ngoài trời có thể do các điều kiện phi sinh học, chẳng hạn như nhiệt độ nước. Trong nghiên cứu này, nhiệt độ nước không được kiểm soát, điều này đã làm giảm khả năng sinh sản của polychaete A. marina. Mặt khác, nghiên cứu của cũng cho thấy nước thải từ hệ thống nuôi sử dụng nước ngầm lợ đã được xử lý để loại bỏ sắt thông qua quá trình oxy hóa hóa học và lọc cát nhanh có thể làm giảm việc sử dụng một số loài chiết xuất cho IMTA. Việc thiếu sắt (và cuối cùng là các nguyên tố vi lượng khác bị loại bỏ trong quá trình oxy hóa hóa học và lọc cát nhanh) có thể cản trở quá trình sản xuất thành công cây S. ramosissima và các cây chịu mặn có giá trị khác.
Theo Daniel Jerónimo, Ana Isabel Lillebø, Javier Cremades, Paulo Cartaxana1 & Ricardo Calado
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Giảm Thiểu Dịch Bệnh Để Cải Thiện Năng Suất
- Nhiễm Trùng Enterocytozoon hepatopenaei Ở Tôm: Chẩn Đoán, Can Thiệp Và Hướng Dẫn An Toàn Thực Phẩm
- Các Liệu Pháp Dựa Trên RNAi chống Lại Bệnh Do Virus Ở Tôm Như Thế Nào?

 English
English