Tóm tắt
Vi bào tử trùng Enterocytozoon hepatopenaei (EHP) trong gan tụy là một mầm bệnh mới nổi ảnh hưởng đến tôm thẻ chân trắng Penaeus vannamei ở một số quốc gia Đông Nam Á, bao gồm Trung Quốc, Việt Nam, Thái Lan, Indonesia, Ấn Độ và Malaysia. Nhiễm trùng EHP thường đi kèm với các loài Vibrio spp. cơ hội. Các thí nghiệm trong phòng thí nghiệm và nghiên cứu bệnh chứng đã được thực hiện để kiểm tra ảnh hưởng của vi bào tử EHP đối với hai bệnh do Vibrio: bệnh hoại tử gan tụy cấp tính (AHPND) và hoại tử gan tụy (SHPN). Hai lần cảm nhiễm đã được thực hiện độc lập để xác định ảnh hưởng của vi bào tử EHP đối với AHPND. Tôm nhiễm EHP (nhóm EHP-AHPND) và tôm khỏe mạnh (nhóm AHPND) đã được thử nghiệm với 2,4 × 105 CFU/mL vi khuẩn Vibrio parahaemolyticus gây bệnh AHPN. Kết quả từ các thử nghiệm này cho thấy nhóm EHP-AHPND có tỷ lệ chết cao hơn (60 và 44%) so với nhóm AHPND (0 và 18%). Các tác động bệnh lý của nhóm AHPND và nhóm EHP-AHPND được so sánh trong 12 giờ đầu tiên sau khi nhiễm bệnh, 57% nhóm EHP-AHPND có biểu hiện hoại tử gan tụy nặng và bong tróc (đặc trưng của nhiễm AHPND) trong khi chỉ có 11% nhóm AHPND thể hiện những đặc điểm này. Điều này cho thấy tôm nhiễm EHP có khả năng nhiễm AHPND cao hơn. Để xác định ảnh hưởng của vi bào tử EHP đối với SHPN, chúng tôi đã kiểm tra mô bệnh học của các mẫu được thu thập tại vị trí nhiễm EHP. Một nghiên cứu bệnh chứng đã được thực hiện để xác định mối liên hệ giữa SHPN và EHP. Chúng tôi đã so sánh từng con tôm có dấu hiệu mô học của SHPN với tôm từ cùng một ao không có các dấu hiệu này. Mối liên hệ chặt chẽ đã được tìm thấy giữa SHPN và EHP, cho thấy rằng tôm đã nhiễm EHP thì có khả năng bị nhiễm SHPN cao hơn. Những phát hiện này cho thấy rằng nhiễm EHP là một yếu tố nguy cơ khiến tôm dễ nhiễm AHPND và SHPN.
1/ Giới thiệu
Từ năm 2003, tình trạng nhiễm vi bào tử trùng (HPM) đã được báo cáo trong nuôi tôm sú Penaeus ở Thái Lan. Những con tôm này có biểu hiện hội chứng tăng trưởng chậm monodon (MSGS) và bị đồng nhiễm với các mầm bệnh cơ hội như vi rút monodon baculovirus (MBV), vi rút parvovirus gan tụy (HPV) và Vibrio spp. (Chayaburakul và cộng sự, 2004). Vài năm sau, nhóm ký sinh trùng này được đặt tên là Enterocytozoon hepatopenaei (EHP) (Tourtip và cộng sự, 2009) và nó đã được báo cáo trong P. monodon (Ha và cộng sự, 2010) và P. vannamei culture (Tangprasittipap và cộng sự, 2013) ở các nước Đông Nam Á như Trung Quốc, Indonesia, Malaysia, Việt Nam, Thái Lan và Ấn Độ (Ha và cộng sự, 2010; Tang và cộng sự, 2015, 2016; Rajendran và cộng sự, 2016).
Dấu hiệu lâm sàng chính của bệnh nhiễm trùng gan tụy do EHP gây ra là chậm phát triển (Sritunyalucksana và cộng sự, 2014; Newman, 2015), và kích thước tôm không đồng đều. Ở giai đoạn nặng hơn, tôm nhiễm EHP thường có biểu hiện vỏ mềm, lờ đờ, giảm ăn và bỏ ăn. EHP hiện được chẩn đoán bằng phương pháp xét nghiệm mô học, lai tại chỗ và PCR (Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2015). EHP là một loại ký sinh trùng nội bào nhân lên trong tế bào chất của các tế bào biểu mô ống gan tụy. Phân tích mô học của các mô bị nhiễm bệnh cho thấy nhiều giai đoạn phát triển, bao gồm các thể ưa bazơ trong tế bào chất của các tế bào biểu mô gan tụy, dường như là giai đoạn hình thành bào tử plasmodium. Ngoài ra, sự bong tróc nhẹ của các tế bào biểu mô hình ống và các bào tử được giải phóng vào lòng ống cũng được quan sát thấy (Tourtip và cộng sự, 2009).
Trong giai đoạn 2009-2012, một loại bệnh mới xuất hiện được gọi là bệnh hoại tử gan tụy cấp tính (AHPND) còn được gọi là “Hội chứng tôm chết sớm (EMS)” bắt đầu gây ra thiệt hại sản lượng đáng kể ở hầu hết các quốc gia nơi EHP đã được báo cáo như Trung Quốc, Việt Nam, Malaysia, Thái Lan, Mexico (Lightner và cộng sự, 2012; Trần và cộng sự, 2013; Flegel, 2012; Leaño và Mohan, 2012) và sau đó là Philippines (Leobert và cộng sự, 2015). Trong một số trường hợp, AHPND đã được báo cáo trong trường hợp đồng nhiễm với EHP (Ha và cộng sự, 2010; FAO, 2015, Chang, 2016).
Các tác nhân gây bệnh của AHPND được xác định là vi khuẩn Vibrio bao gồm V.parahaemolyticus (Han và cộng sự, 2015; Lee và cộng sự, 2015), V. campbellii (Han và cộng sự, 2017) và V. harveyi (Kondo và cộng sự, 2015) có chứa độc tố nhị phân PirABvp và đã được phát hiện là yếu tố gây độc lực cho căn bệnh này. Các gen pirABvp này nằm trong một plasmid lớn (69-70 kb) trong các chủng này (Han và cộng sự, 2015, Lee và cộng sự, 2015; Sirikharin và cộng sự, 2015).
AHPND xuất hiện trong 20 đến 30 ngày đầu nuôi và gây ra tỷ lệ tử vong tới 100% trong những trường hợp nặng. Ở giai đoạn cấp tính, gan tụy bị nhiễm bệnh có biểu hiện thoái hóa biểu mô ống. Nó tập trung và tách lớp tế bào biểu mô ống ra khỏi màng đáy và giải phóng các tế bào này vào lòng ống. Ở giai đoạn cuối, gan tụy có biểu hiện tụ máu, các ống dẫn bị dãn ra, dẫn đến rối loạn chức năng gan tụy và nhiễm trùng Vibrio thứ phát nghiêm trọng (Lightner và cộng sự, 2012; Tran và cộng sự, 2013).
Mặt khác, các nước Đông Nam Á, đặc biệt là Ấn Độ và Indonesia, đã bị ảnh hưởng bởi EHP (Tang và cộng sự, 2016; Rajendran và cộng sự, 2016), và cho đến nay chưa có trường hợp nào của AHPND được báo cáo. Ở các quốc gia này, đã có sự gia tăng các vấn đề về vi khuẩn góp phần gây ra bệnh Vibriosis gan tụy, được biết đến với nhiều tên khác nhau bao gồm hội chứng tôm tử vong liên tục (RMS) và hội chứng phân trắng. Tôm bị ảnh hưởng bởi những bệnh này có biểu hiện hoại tử gan tụy (SHPN) (Mastan và Begum, 2016; Ramsden, 2015; Tang và cộng sự, 2016).
Dựa trên thực tế là EHP đã và đang ảnh hưởng đến ngành nuôi tôm trước khi bùng phát dịch AHPND, có thể EHP góp phần vào việc hình thành AHPND và các bệnh do vi khuẩn khác như SHPN. Để xác định mối quan hệ giữa EHP với AHPND và SHPN, chúng tôi đã đánh giá các yếu tố nguy cơ của EHP đối với các bệnh này, thông qua kiểm tra thực nghiệm cảm nhiễm AHPND và phân tích bệnh chứng SHPN.
2/ Vật liệu và phương pháp
2.1 Mẫu tôm
Tôm thẻ chân trắng Penaeus vannamei sạch bệnh (SPF) (Hệ thống cải tiến tôm, Islamorada, FL) đã được sử dụng. Tất cả các trường hợp lây nhiễm thử nghiệm đều được thực hiện trong Phòng thí nghiệm Bệnh lý Nuôi trồng Thủy sản (APL) tại Đại học Arizona.
2.2 Cảm nhiễm EHP
Tôm nhiễm EHP từ Thái Lan đã được sử dụng để nhân giống nhiễm EHP trên tôm SPF tại APL (Tang và cộng sự, 2015). Các mô gan tụy băm nhỏ từ tôm bị nhiễm bệnh đã được sử dụng để làm thức ăn cho quần thể SPF, với lượng bằng 10% trọng lượng cơ thể của chúng; sau ba tuần, tình trạng nhiễm EHP đã được xác nhận bằng phương pháp PCR và mô bệnh học.
2.3 Các chủng vi khuẩn AHPND và cách nuôi cấy
Một đột biến của Vibrio parahaemolyticus 13-028/A3 (chủng AHPND), đã được sử dụng cho nghiên cứu này. Dựa trên mục đích của nghiên cứu này, chúng tôi gọi nó là VPAHPND. Đột biến này mang một plasmid mã hóa một transferase acetyl chloramphenicol (CAT) và một protein huỳnh quang màu đỏ. Để nuôi cấy chủng này phải sử dụng nước dùng đậu nành thử nghiệm (TSB) có chứa 2% NaCl (TSB +) và chloramphenicol (15 μg / mL), nuôi qua đêm ở 28°C với độ lắc nhẹ (100 vòng / phút) để đạt 1,5 × 109 CFU / mL.
2.4 Thử nghiệm sinh học và mô bệnh học gây bệnh AHPND
Hai trường hợp thử nghiệm lây nhiễm AHPND đã được thực hiện để so sánh khả năng gây bệnh của VPAHPND trên tôm con trước khi bị nhiễm EHP. Nhóm “AHPND” không bị nhiễm EHP trước khi gây nhiễm VAHPND, trong khi nhóm “EHP-AHPND” đã bị nhiễm EHP 3 tuần. “Nhóm đối chứng âm tính của EHP” là nhóm tôm chỉ tiếp xúc với EHP và không tiếp xúc với AHPND. “SPF” là một nhóm tôm sạch bệnh, không tiếp xúc với EHP hoặc VPAHPND . Đối với lần thử nghiệm cảm nhiễm đầu tiên, năm lần xử lý được thực hiện trong năm bể chứa 90L và đối với lần thử nghiệm cảm nhiễm thứ hai, năm lần xử lý với mười bể chứa 90L (2 lần lặp lại) được chứa đầy nước biển nhân tạo (độ mặn 25 ppt và nhiệt độ ở 28°C), và 5 ± 1 và 10 ± 1 P. Vannamei SPF (trọng lượng: 2,0-3,0 g) được thả lần lượt trong mỗi bể thử nghiệm số 1 và số 2 . Các nhóm AHPND và EHP-AHPND đã được thử nghiệm bằng cách ngâm với VPAHPND, bằng cách thêm nước đã xử lý vào bể nuôi, nuôi qua đêm để thu được nồng độ cuối cùng là 2,4 × 105 VPAHPND CFU / mL (liều thấp). Đối chứng dương đã được cảm nhiễm với VPAHPND để có được nồng độ cuối cùng là 2,4 × 106 VPAHPND CFU / mL (liều cao). Chi tiết về các nhóm cảm nhiễm được thể hiện trong Bảng 1. Tỷ lệ chết được ghi nhận hàng ngày kể từ khi bắt đầu thử nghiệm. Năm con tôm nhiễm EHP đã được khử trùng trước khi thử nghiệm gây nhiễm AHPND. Những con tôm suy yếu đã được cố định trong dung dịch cố định AFA của Davidson (Bell và Lightner, 1988). Các mẫu tôm chết được thu thập để xác định sự hiện diện của EHP và AHPND bằng phương pháp PCR. Thời gian thử nghiệm đối với thử nghiệm số 1 và số 2 lần lượt là 10 và 14 ngày.
Bảng 1:
Tỷ lệ chết so sánh giữa tôm tiền nhiễm (EHP-AHPND) và không tiền nhiễm (AHPND) với EHP trước khi gây cảm nhiễm với VPAHPND
| Thử nghiệm | Nhóm | Nghiệm thức | Liều lượng (CFU/ mL) | Số lượng tôm chết/ tổng số tôm | Tỉ lệ chết (%) |
| 1 | AHPND | Liều thấp | 2,4 x 105 | 0/5 | 0% |
| EHP-AHPND | Liều thấp | 2,4 x 105 | 3/5 | 60% | |
| Đối chứng dương | Liều cao | 2,4 x 106 | 5/6 | 83% | |
| Đối chứng | EHP
Đối chứng âm |
0 | 0/5 | 0.0% | |
| Đối chứng | SPF
Đối chứng âm |
0 | 0/5 | 0.0% | |
| 2 | AHPND | Liều thấp | 2,4 x 105 | 2/11 | 18% |
| EHP-AHPND | Liều thấp | 2,4 x 105 | 4/9 | 44% | |
| Đối chứng dương | Liều cao | 2,4 x 106 | 7/11 | 64% | |
| Đối chứng | EHP
Đối chứng âm |
0 | 0/5 | 0.0% | |
| Đối chứng | SPF
Đối chứng âm |
0 | 0/5 | 0.0% |
2.5 Số lượng vi bào tử và thử nghiệm mô bệnh học trong quá trình lây nhiễm kéo dài 12 giờ
Một nghiên cứu về quá trình lây nhiễm kéo dài 12 giờ đã được thực hiện để xác định những thay đổi về mô bệnh học và các đơn vị hình thành khuẩn lạc (CFU) trong hai nhóm thử nghiệm (EHP-AHPND và AHPND). Hai mươi con tôm từ mỗi nhóm được thả trong các bể nuôi và thử nghiệm bằng cách ngâm trong VPAHPND với liều lượng cao (2,4 × 106 CFU/mL nước). Các mẫu tôm 2-4 được thu thập để thử nghiệm mô bệnh học vào các thời điểm 3 giờ, 6 giờ, 9 giờ và 12 giờ sau khi nhiễm AHPND (h.p.i). Ngoài ra, 5 mẫu được phân tích vào lúc 6 giờ và 12 giờ trưa để đo CFU g-1 trong gan tụy. Từ mỗi con tôm, sau khi tách đường tiêu hóa (đường GI) và dạ dày ra khỏi gan tụy, gan tụy được cắt dọc theo đường chỉ giữa. Một nửa được bảo quản trong dung dịch cố định của Davidson; nữa còn lại của gan tụy được dùng để đếm khuẩn.
2.6 Mối liên hệ giữa bệnh nhiễm vi bào tử trùng (HPM) và bệnh hoại tử gan tụy (SHPN) ở cấp trang trại
Một nghiên cứu bệnh chứng đã được thực hiện để xác định mối liên hệ có thể có giữa HPM và SHPN. Đối với điều này, hồ sơ của 19 ao nuôi thương phẩm từ các trang trại từng nhiễm EHP được lấy mẫu từ năm 2015-2016 đã được phân tích. Tổng cộng có 100 mẫu tôm giống P. Vannamei đã được phân tích mô bệnh học. Tỷ lệ giữa mẫu nhiễm : đối chứng là 1:4. Tôm giống thẻ P. Vannamei được chẩn đoán nhiễm SHPN đã được chọn làm mẫu nhiễm. Để làm đối chứng, các con từ cùng một trang trại không có sự xuất hiện mô bệnh học của SHPN đã được chọn. Vì một trong những dấu hiệu lâm sàng chính của EHP là sự thay đổi kích thước, biến “trọng lượng cơ thể trung bình (ABW)” không được đề cập trong phân tích này. Chẩn đoán SHPN bằng thử nghiệm mô bệnh học được xác nhận bằng biểu hiện teo toàn thân của ống gan tụy với hoại tử đa ổ, nốt tan máu và một số nấm Melanize (Lightner, 1996). Việc chẩn đoán EHP được thực hiện bằng thử nghiệm mô bệnh học và được xác nhận bằng phương pháp lai tại chỗ hoặc PCR.
2.7 Thử nghiệm mô bệnh học và lai tại chỗ (ISH) cho EHP
Các mẫu được cố định trong dung dịch cố định (AFA) của Davidson đã được xử lý, nhúng trong parafin và được cắt nhỏ (dày 4 μm) theo các phương pháp tiêu chuẩn (Lightner, 1996). Sau khi nhuộm bằng hematoxylin và eosin (H&E), các mặt cắt được phân tích bằng kính hiển vi quang học. Mức độ nghiêm trọng của nhiễm trùng/tổn thương được sắp xếp từ G0 đến G4 theo Lightner (1996). G0 cho biết là không có bệnh và G4 cho thấy sự hiện diện của các tổn thương nặng và sự phá hủy mô nâng cao. Đối với thử nghiệm ISH, các phần mô có độ dày từ 4 đến 5 μm được điều chế từ các mô tôm nhúng parafin và dung dịch cố định của Davidson. Sử dụng phương pháp đo màu của các mẫu đầu dò được gắn nhãn digoxigenin và của kháng thể anti-DIG Fab fragment (liên hợp alkaline phosphatase) với tetrazolium nitroblue và X-phosphate. Việc sử dụng đầu dò EHP được mô tả trong Tang và cộng sự. (2015).
2.8 Kiểm tra EHP và AHPND bằng PCR
Để phát hiện EHP bằng PCR, mồi oligonucleotide EHP-510F (5 ′- GCC TGA GAG ATG GCT CCC ACG T) và EHP-510R (5 ′-GCG TAC TAT CCC CAG AGC CCG A) với bộ khuếch đại 510 bp, đã được sử dụng trong phân tích PCR thông thường (Tang và cộng sự, 2015). Để phát hiện AHPND bằng PCR, mồi oligonucleotide PirB-F (5 ′-TGA TGA AGT GAT GGG TGC TC) và AHPND PirB-R (5 ′-TGT AAG CGC CGT TTA ACT CA) với bộ khuếch đại 392 bp, đã được sử dụng trong phân tích PCR thông thường (Han và cộng sự, 2015). Ống PCR dùng trong xét nghiệm RTG (GE Healthcare) đã được sử dụng. Khuếch đại cho EHP và AHPND được thực hiện với các thông số theo chu kỳ sau: biến tính ban đầu ở 94°C trong 3 phút, tiếp theo là 35 chu kỳ 94°C trong 30 giây, 60°C trong 30 giây và 72°C trong 30 giây và cuối cùng khuếch đại ở 72°C trong 5 phút. Sau khi khuếch đại, các sản phẩm PCR được điện di trong gel agarose 1,5% chứa 0,5 μg / mL ethidium bromide và được hiển thị dưới tia cực tím UV và được chụp ảnh kỹ thuật số bằng máy AlphaImager (Alpha Innotech).
2.9 Phân tích thống kê
So sánh tải lượng bào tử trung bình giữa hai nhóm được xác định bằng phương pháp tailed t-test cả hai mặt (α = 0,05) bằng phần mềm GraphPad. Sự khác biệt trong các đường cong sinh tồn được phân tích bằng tỷ lệ sống sót Kaplan-Meir bằng sử dụng phần mềm Med Calc 16.8.4. Mối liên hệ giữa SHPN và EHP được xác định bằng cách tính Tỷ lệ chênh lệch (OR) và khoảng tin cậy (CI) 95% bằng phần mềm OpenEpi (Dean và cộng sự, 2013).
3/ Kết quả
3.1 Cảm nhiễm EHP
Trước khi nhiễm AHPND, EHP đã được kiểm tra bằng phương pháp mô bệnh học trong các mẫu tôm tiền nhiễm EHP và trong nhóm đối chứng âm tính với EHP. Kiểm tra mô học các mẫu tôm thẻ P. vannamei bị nhiễm EHP cho thấy các thể ưa bazơ trong tế bào chất của các tế bào biểu mô ống gan tụy, có thể ở giai đoạn plasmodium (Tourtip và cộng sự, 2009). Các tế bào biểu mô hình ống bị bong tróc nhẹ được quan sát thấy trong gan tụy của tôm bị cảm nhiễm, và các bào tử được giải phóng trong lòng ống cũng được quan sát thấy. Mức độ nghiêm trọng của tôm bị ảnh hưởng dao động trong khoảng từ G1 đến G2 theo thang đo bán định lượng (Lightner, 1996). Nhiễm trùng rõ rệt hơn ở vùng giữa và vùng gần hơn so với vùng xa. Không quan sát thấy tổn thương AHPND ở bất kỳ con tôm nào trước khi nhiễm bệnh thử nghiệm.
3.2 Thử nghiệm cảm nhiễm AHPND
Kết quả của các ca nhiễm VPAHPND thử nghiệm được trình bày trong Bảng 1. Không có tỷ lệ chết nào được quan sát thấy trong các bể đối chứng âm trong hai thí nghiệm. Vi khuẩn VPAHPND được sử dụng trong thí nghiệm này đã gây ra bệnh AHPND ở tôm và được thử nghiệm bằng phương pháp PCR và mô bệnh học. Tỷ lệ chết cao (83% và 64%) xảy ra ở các nhóm tiếp xúc V.parahaemolyticus với liều lượng cao. Tôm con thuộc nhóm EHP-AHPND được thử nghiệm với liều thấp cho thấy tỷ lệ chết cao hơn so với nhóm AHPND: lần lượt là 60% so với 0% và 44% so với 18% trong thí nghiệm số 1 và số 2. So sánh các đường cong sinh tồn giữa nhóm AHPND và EHP-AHPND đã được thực hiện và nhận thấy một sự khác biệt đáng kể (P < 0,05) (Hình 1).
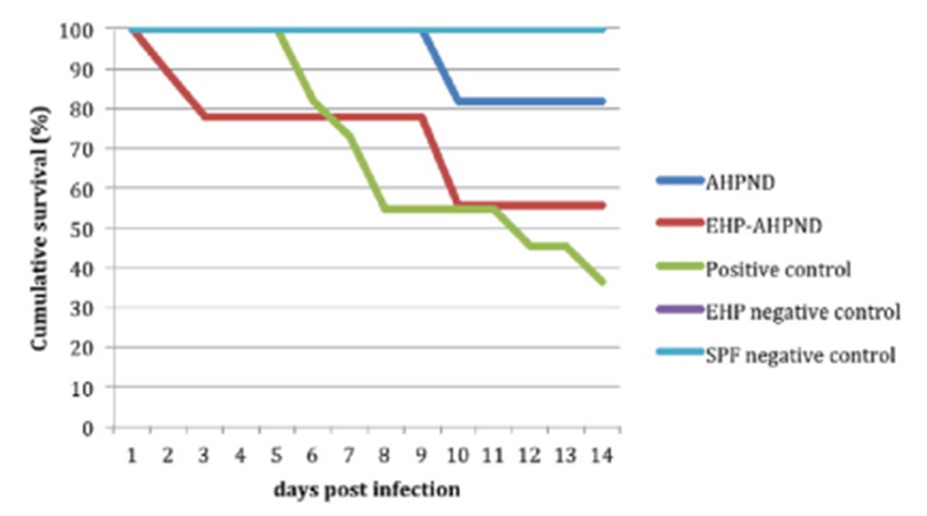
Hình 1. So sánh đường cong sinh tồn tích lũy giữa các nhóm AHPND so với EHP AHPND bị nhiễm AHPND. Thử nghiệm số 2.
Về mặt mô học, tôm chết cho thấy các tổn thương AHPND điển hình, bao gồm sự bong tróc lớn các tế bào biểu mô ống gan tụy ở vùng giữa và gần của gan tụy và dần lan ra xa hơn. Các tế bào R và F biểu mô ống bị ảnh hưởng xuất hiện các nốt sần. Giai đoạn cuối được đặc trưng bởi SHPN điển hình đã được quan sát thấy ở một số con tôm. Ở tôm nhiễm EHP, giai đoạn plasmodium và bào tử đã được quan sát thấy.
Những con tôm chết được phân tích bằng PCR để tìm AHPND và EHP. Trong nhóm AHPND và các bể đối chứng dương tính, chỉ có kết quả dương tính của AHPND được tìm thấy. Trong nhóm EHP-AHPND, tôm dương tính với cả hai: AHPND và EHP. Vào cuối thí nghiệm, tôm sống sót cho thấy không có bất kỳ tổn thương mô bệnh học nào của AHPND.
3.3 Mô bệnh học và số lượng vi khuẩn trong quá trình nhiễm trùng trong thời gian 12 giờ
Trong 6 giờ đầu tiên sau khi lây nhiễm (h.p.i), không có tổn thương mô học nào của AHPND được tìm thấy trong nhóm AHPND. Chỉ giảm nhẹ nồng độ lipid gan tụy. Vào lúc 12 giờ trưa, giai đoạn đầu hai con tôm có biểu hiện tổn thương AHPND với mức độ nghiêm trọng G1 (Bảng 2); những thay đổi mô học bao gồm bong tróc các tế bào ống và hoại tử khu trú của vùng gần giữa (Hình 2A, B, C). Trong nhóm EHP-AHPND, lúc 0 giờ, chỉ phát hiện có các tổn thương nhẹ của EHP và phát hiện bằng phương pháp ISH (Hình 2G), tuy nhiên nồng độ lipid gan tụy nằm ở mức bình thường (G3) (Hình 2D). Các tổn thương mô bệnh học nhẹ của AHPND đã được quan sát thấy trong 6 giờ đầu tiên bao gồm giảm các giọt lipid, các nhân tế bào mở rộng, tế bào biểu mô gan tụy chảy máu và bong tróc vừa phải của các tế bào ống, (Hình 2E). So với ISH, không phải tất cả các tế bào bị bong tróc đều có phản ứng dương tính với EHP, điều này cho thấy rằng sự bong tróc có mặt trong các tế bào bị nhiễm EHP và các tế bào không bị nhiễm EHP. Vào lúc 12 giờ tối, không có tế bào B, hoại tử tiến triển về phía vùng xa và xảy ra bong tróc lớn (Hình 2F). Điều thú vị là hầu hết các tế bào bị bong tróc là các tế bào bị nhiễm EHP vì nó đã được phát hiện bằng phương pháp ISH (Hình 2I). Vào lúc 12 giờ trưa, 57% con tôm trong nhóm EHP-AHPND hiển thị AHPND so với 11% từ nhóm AHPND. Không tìm thấy dấu hiệu mô học của AHPND ở nhóm tôm đối chứng âm tính (Bảng 2).
Bảng 2: Kết quả mô bệnh học của nhóm AHPND và EHP-AHPND tiếp xúc với VPAHPND với liều cuối cùng là 2,4 × 106 CFU mL-1 nước.
| Thời gian nhiễm (giờ) | Nhóm | Số lượng tôm kiểm tra | Mô nhiễm AHPND | Mô nhiễm tích lũy AHPND |
| 0 | AHPND | 2 | 0 | 2/18 |
| 3 | AHPND | 4 | 0 | (11.1%) |
| 6 | AHPND | 4 | 0 | |
| 9 | AHPND | 4 | 1 (G1) | |
| 12 | AHPND | 4 | 1 (G1) | |
| 0 | EHP-AHPND | 2 | 0 | 8/14 |
| 3 | EHP-AHPND | 3 | 1 (G1) | (57.1%) |
| 6 | EHP-AHPND | 3 | 2 (G1) | |
| 9 | EHP-AHPND | 3 | 2 (G1) | |
| 12 | EHP-AHPND | 3 | 2 (G2) |
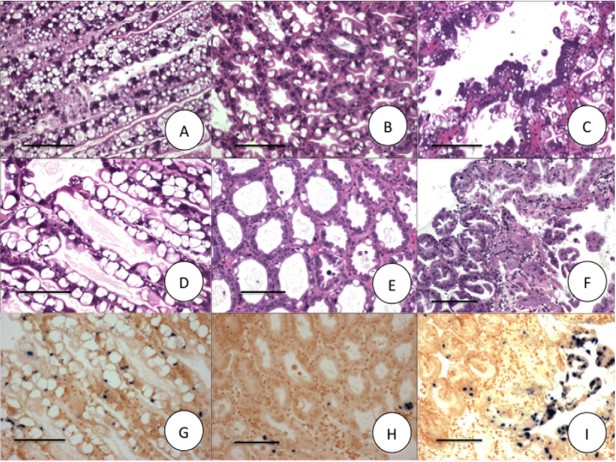
Hình 2. Mô học H&E (Mayer–Bennet hematoxylin và eosin-phloxine) và lai tạo tại chỗ AHPND và Enterocytozoon hepatopenaei (EHP) ở tôm bị nhiễm bệnh. (A–F) Nhuộm H&E mô gan tụy của tôm thẻ Penaeus vannamei. (G–I) Lai tạo tại chỗ với đầu dò EHP có nhãn digoxigen. Sự hiện diện của kết tủa màu xanh đậm cho thấy sự hiện diện của EHP. (A-C) Nhuộm H&E P. vannamei được thử với VPAHPND ở 0 (A), 6 (B) & 12 (C) h.p.i.; (D-F) Nhuộm H&E của tôm thẻ chân trắng bị nhiễm trước EHP và thử thách với VPAHPND ở 0 (D), 6 (E) & 12 (F) h.p.i. Thanh tỷ lệ = 100 μm.
Dữ liệu CFU được thể hiện trong Hình 3. Không phát hiện VPAHPND CFU g-1 của gan tụy lúc 0 giờ. Nó chỉ ra rằng không có vi khuẩn kháng chloramphenicol nào khác xuất hiện trong các mẫu. Không có bất kỳ sự khác biệt đáng kể nào về CFU giữa hai nhóm, AHPND và EHP-AHPND lúc 6 giờ (1,1 × 108 so với 3,4 × 107 CFU g-1 gan tụy) và 12 giờ (5,9 × 106 so với 2,0 × 106 CFU g-1 gan tụy) (P>0,05). Tuy nhiên, khi kết hợp CFU của hai nhóm ở 6 và 12 giờ, lại có sự khác biệt đáng kể về tải lượng bào tử cao hơn lúc 6 giờ với mức trung bình là 7,2 × 107 so với 4,0 × 106 CFU g-1 gan tụy ở 12 giờ (P<0,05) (Hình 3).
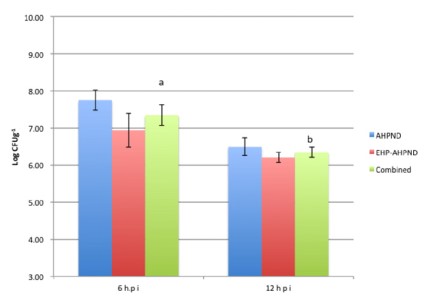
Hình 3. So sánh VPAHPND CFU g-1 HP ở tôm phơi nhiễm lúc 6 giờ và 12 giờ. Dữ liệu đại diện cho giá trị trung bình ± SE. Các chữ cái khác nhau (a và b) cho thấy sự khác biệt đáng kể (P<0,05)
3.4 Nghiên cứu đối chứng giữa EHP và SHPN ở cấp trang trại
Trong giai đoạn 2015-2016, hồ sơ 100 con tôm thẻ chân trắng P. vannamei từ 19 ao nuôi của các trang trại ở Đông Nam Á có tiền sử nhiễm EHP đã được phân tích. Dựa trên dữ liệu trong Bảng 3, có mối liên hệ chặt chẽ giữa các trường hợp SHPN và tôm nhiễm EHP: tỷ lệ chênh lệch (OR) = 4,2; CI 95%: 1,1-15,4. Tần suất nhiễm SHPN ở tôm có EHP cao hơn so với những con không nhiễm EHP.
Bảng 3: Các trường hợp SHPN và biện pháp kiểm soát và mối liên kết với EHP trong nuôi tôm thẻ chân trắng con ở Đông Nam Á từ năm 2015-2016.
| Ca nhiễm SHPN | Đối chứng | Tổng | ||
| EHP | Có | 17 | 46 | 63 |
| Không | 3 | 34 | 37 | |
| Tổng | 20 | 80 | 100 |
4/ Thảo luận
Kết quả nghiên cứu bằng hai phương pháp độc lập với nhau cho thấy tôm thẻ chân trắng P. vannamei bị nhiễm EHP đã làm tăng tính nhạy cảm với các bệnh Vibrio liên quan đến AHPND và SHPN .
Trong các thử nghiệm có đối chứng trong phòng thí nghiệm, những con giống bị nhiễm EHP trước khi tiếp xúc với VPAHPND có các tổn thương mô bệnh học nặng hơn so với những con không bị nhiễm (Hình 2F). Sự bong tróc của các tế bào ống gan tụy là nghiêm trọng nhất ở nhóm EHP, và ảnh hưởng của EHP tăng lên khi nhiễm khuẩn Vibrio xảy ra. Vào lúc 6 giờ tối, các tế bào bị bong tróc có cả tế bào bị nhiễm EHP và không bị nhiễm, nhưng đến 12 giờ, hầu như tất cả các tế bào bị bong tróc đều bị nhiễm EHP (Hình 2I). Điều thú vị là CFU của VPAHPND lúc 6 giờ tối cao hơn khoảng 18 lần so với 12 giờ, mặc dù tỷ lệ chết không được ghi nhận cho đến 12 giờ tối. Không có lý do cơ bản khiến CFU suy giảm trong suốt quá trình thử nghiệm là rõ ràng; tuy nhiên, tổn thương gan tụy đủ nghiêm trọng để làm tôm chết. Những quan sát tương tự cũng được thực hiện bởi những người khác (Lee và cộng sự, 2015; Lai và cộng sự, 2015).
Những tác động mạnh mẽ của đồng nhiễm rất có thể được giải thích bởi các tác động hiệp đồng của các mầm bệnh ký sinh trùng và vi bào tử trên các mô của gan tụy. Là một phần của quá trình hoại tử, cả EHP và AHPND đều gây ra sự bong tróc bằng cách tách các tế bào biểu mô ra khỏi màng đáy (Lightner và cộng sự, 2012; Tran và cộng sự, 2013). Tuy nhiên, hai mầm bệnh này lại gây ra bong tróc theo những cách khác nhau. Các tế bào bị nhiễm EHP chứa plasmodia hoặc bào tử trong tế bào chất, và ký sinh trùng sử dụng các chất dinh dưỡng của tế bào để tái tạo. Điều này làm cạn kiệt các chất dinh dưỡng của tế bào, cuối cùng dẫn đến tế bào chết và vỡ ra. Ngược lại, sự bong tróc do VPAHPND gây ra là do ảnh hưởng của độc tố lên các protein tế bào xương (như vi ống, sợi actin) tham gia vào quá trình gắn tế bào vào màng đáy. Trong trường hợp này, toàn bộ tế bào bong ra với một nhân rõ ràng còn nguyên vẹn. Do tác động tổng hợp của chúng, đồng nhiễm VPAHPND và EHP làm tăng đáng kể tổn thương cho gan tụy, dẫn đến gây ra suy mô toàn phần và dịch bệnh lan rộng .
Thông qua việc sử dụng một phương pháp khác, một nghiên cứu bệnh chứng cho thấy các tác động tương tự của EHP trên tôm nhạy cảm với SHPN. Đây là một bệnh khác do nhiễm khuẩn Vibrio spp. (Lightner, 1996). Mối liên hệ chặt chẽ mà chúng tôi tìm thấy giữa các trường hợp SHPN và EHP, cho thấy rằng EHP làm tăng tính nhạy cảm của tôm đối với nhiễm khuẩn Vibrio, được biết đến là mầm bệnh cơ hội gây bệnh khi sức khỏe của tôm bị tổn hại (Lightner, 1996). Nhiễm trùng EHP phá vỡ các tế bào của ống gan tụy và cho phép các loài Vibrio spp. hiện diện để xâm chiếm các tế bào bị bong tróc và để lộ lớp màng đáy tế bào ra ngoài.
Những phát hiện này có thể làm sáng tỏ các mô hình xuất hiện của các đợt bùng phát dịch bệnh ở các trang trại nuôi tôm trên toàn thế giới. Ví dụ, các quốc gia ở Đông Nam Á như Trung Quốc, Việt Nam, Thái Lan và Malaysia đã phải đối mặt với sự bùng phát dịch EHP trong mười năm qua trước khi bị AHPND tấn công. Các quốc gia khác như Indonesia và Ấn Độ gần đây đã báo cáo sự hiện diện của EHP nhưng không xảy ra bùng phát dịch AHPND. Tuy nhiên, ở Indonesia, một căn bệnh mới nổi được gọi là hội chứng phân trắng xuất hiện do đồng nhiễm EHP với các loài vi khuẩn vibrio spp. gây ra SHPN (Tang và cộng sự, 2016; Briggs, 2012). Tương tự như vậy, hội chứng tử vong liên tục (RMS) (Ramsden, 2015) gần đây đã được báo cáo ở Ấn Độ, trên tôm có các tổn thương mô bệnh học nghiêm trọng của gan tụy, bao gồm bong tróc tế bào biểu mô ống và viêm hồng cầu (Mastan và Begum, 2016).
Việc phát triển các biện pháp ngăn chặn EHP hoặc xử lý ao bị ảnh hưởng có thể làm giảm đáng kể thiệt hại về sản lượng trong nuôi tôm. Các nghiên cứu hướng tới mục tiêu này nên được khuyến khích.
Theo Luis Fernando Aranguren, Jee Eun Han, Kathy F.J. Tang
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
Từ khóa: Enterocytozoon hepatopenaei (EHP), Bệnh hoại tử gan tụy cấp tính (AHPND), Bệnh hoại tử gan tụy (SHPN), Tôm thẻ chân trắng Penaeus vannamei.
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Phần 1 – BỆNH DO VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) GÂY RA TRÊN TÔM: Sinh thái, Bệnh học, Chẩn đoán và Kiểm soát
- Phần 1 – BIỂU HIỆN LÂM SÀNG CỦA HỘI CHỨNG PHÂN TRẮNG White feces syndrome (WFS) VÀ MỐI LIÊN QUAN CỦA NÓ VỚI VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) TRONG CÁC TRANG TRẠI NUÔI TÔM THẺ CHÂN TRẮNG THƯƠNG PHẨM: MỘT CUỘC ĐIỀU TRA BỆNH HỌC
- Đặc Điểm Của Chất Kích Thích Miễn Dịch Ở Tôm

 English
English