Mục tiêu: Nghiên cứu sử dụng tổ hợp vi khuẩn như probiotic để phân hủy sinh học các chất hữu cơ và kiểm soát sự bùng phát bệnh do vi khuẩn trong ao nuôi tôm
Phương pháp:
- Lấy mẫu nước từ các ao nuôi tôm ở Miền Nam Ấn Độ.
- Phân tích tính chất lý hóa của nước, bao gồm pH, nhiệt độ và màu sắc.
- Phân lập vi khuẩn và kiểm tra các hoạt tính enzyme khác nhau.
- Đánh giá các chủng vi khuẩn được phân lập (MSWS24, MSWS30 và MSWS19) và tối ưu hóa các thông số lý hóa để đạt sản lượng enzyme tối đa.
- Kiểm tra khả năng phân hủy mầm bệnh bằng hỗn hợp vi khuẩn.
- Phân tích chất lượng nước ở 4 cơ sở khác nhau và đo lường lượng chất hữu cơ tích tụ.
- Cuối cùng, theo dõi tỷ lệ sống của tôm và tổng sản lượng tôm.
Kết quả: Nghiên cứu này đã phân lập được các chủng Bacillus subtilis, Bacillus licheniformis, Bacillus Firmus từ nước ao nuôi tôm, lấy theo tỷ lệ bằng nhau và được sử dụng làm probiotic trong nuôi tôm thẻ chân trắng. Việc tối ưu hóa hoạt tính enzyme của ba chủng vi khuẩn cho thấy một thông số đặc biệt có năng suất cao. Khi so sánh với nhóm đối chứng không dùng probiotic, nhóm dùng probiotic có tỷ lệ sống của tôm cao hơn đáng kể. Tỷ lệ sống của tôm trong bể không dùng probiotic T1 là 40% trong khi ở bể T2 là 80%.
Kết luận: Nghiên cứu này cho thấy việc sử dụng Bacillus consortium trong nước nuôi tôm có tác dụng cải thiện chất lượng nước, thúc đẩy tôm tăng trưởng, tăng cường khả năng kháng bệnh và tỷ lệ sống của tôm.
Ngành nuôi tôm đóng vai trò quan trọng và mang lại lợi nhuận kinh tế, sản lượng nuôi tôm đã tăng trưởng vượt bậc trong những năm gần đây nhờ áp dụng các phương pháp nuôi thâm canh và bán thâm canh, đáp ứng nhu cầu lương thực ngày càng tăng của thế giới. Tuy nhiên, sự phát triển của ngành nuôi tôm cũng gây ra nhiều vấn đề sinh thái kinh tế, và xã hội. Một trong những vấn đề lớn nhất đối với ngành nuôi tôm là dịch bệnh. Trong những năm gần đây, dịch bệnh do vi rút hội chứng đốm trắng (WSSV) đã lan rộng trên toàn thế giới và gây thiệt hại kinh tế to lớn cho ngành nuôi tôm. Một vấn đề khác đối với ngành nuôi tôm là chất lượng nước. Sự phát triển của vi khuẩn lam trong ao có thể dẫn đến hiện tượng “tảo tàn”, làm cạn kiệt oxy trong nước và gây hại cho tôm. Để giải quyết các vấn đề này, các nhà khoa học đang nghiên cứu và ứng dụng các biện pháp sinh học, chẳng hạn như sử dụng probiotics và enzyme để cải thiện chất lượng nước và kiểm soát dịch bệnh. Probiotics là các vi sinh vật có lợi, có thể giúp phân hủy chất hữu cơ, giảm nồng độ amoniac và nitrit trong nước, và kiểm soát dịch bệnh. Enzyme là các chất xúc tác sinh học có thể giúp phân hủy chất hữu cơ, cải thiện chất lượng nước và tăng cường khả năng miễn dịch của tôm. Các nghiên cứu đã cho thấy rằng probiotics và enzyme có thể mang lại nhiều lợi ích cho ngành nuôi tôm, bao gồm:
- Cải thiện chất lượng nước
- Kiểm soát dịch bệnh
- Tăng cường khả năng miễn dịch của tôm
- Tăng trưởng và sản lượng tôm
Việc ứng dụng probiotics và enzyme trong nuôi tôm là một hướng đi đầy tiềm năng để giải quyết các vấn đề của ngành nuôi tôm và góp phần phát triển bền vững ngành này.
Nghiên cứu này đã phân lập và đánh giá hiệu quả của ba chủng vi khuẩn Bacillus sp. (B. subtilis, B. licheniformis và B. Firmus) trong việc kiểm soát sự phát triển của vi khuẩn gây bệnh Vibrio sp., Pseudomonas sp. và Aeromonas sp. trong nước ao nuôi tôm bị bệnh.
Các chủng vi khuẩn được phân lập từ mẫu nước ao nuôi tôm bị bệnh dựa trên có chỉ số phân giải protein (PI), chỉ số phân giải tinh bột (AI) và chỉ số phân giải cellulose (CI) cao đã được chọn và được đặt tên là MSWS24, MSWS30 và MSWS19.
Tôm thẻ chân trắng P. vannamei (PL15) khỏe mạnh được thích nghi trong bể 3 ngày trước khi bắt đầu thử nghiệm, chia đều với 10 con PL15 thành ba nhóm, mỗi nhóm được nuôi trong bể 60 L và các thí nghiệm được thực hiện bằng cách sử dụng 2 bể thử nghiệm cùng với 1 bể đối chứng, C1: tôm + thức ăn công nghiệp, T1: tôm + thức ăn công nghiệp + vi khuẩn gây bệnh, T2: tôm + thức ăn công nghiệp + vi khuẩn gây bệnh + tổ hợp probiotic.
Thức ăn thương mại chất lượng tốt với 32% protein được cho ăn 4 lần/ ngày (6 giờ sáng, 11 giờ sáng, 5 giờ chiều và 10 giờ tối) và áp dụng theo lịch cho ăn của nhà sản xuất. Việc thu thập mẫu nước để ước tính số lượng vi khuẩn và mức độ dinh dưỡng đã được thực hiện. Bể T2 được xử lý bằng Bacillus consortium MSWS24, MSWS30 và MSWS19 trong 90 ngày. Sau khi thích nghi, tôm được cảm nhiễm nhân tạo với vi khuẩn gây bệnh Vibrio sp., Pseudomonas sp., và Aeromonas sp.
Trước và sau khi thả giống, chất lượng nước được đánh giá ở mức tiêu chuẩn, vì sau khi thả giống, vi khuẩn có thể ảnh hưởng đến việc giảm lượng chất hữu cơ. Cuối cùng, phân tích ban đầu về chất lượng nước được so sánh với điều kiện nước tối ưu của tôm trong 25, 50, 75, 90 ngày nuôi.
Việc quan sát bể và mức tiêu thụ thức ăn, sức khỏe tôm và hình dáng tôm cũng được theo dõi hàng ngày. Tỷ lệ tăng trưởng và tỷ lệ sống hàng tuần (tổng số tôm sống) được ước tính mỗi tuần một lần. Để phân tích thành phần trong ruột, tôm được lấy mẫu ngẫu nhiên từ một bể mới được cho ăn khỏe mạnh, được nuôi dưỡng tốt. Sau đó, tôm được kiểm tra xem có đường ruột (ruột giữa) chạy dọc theo chiều dài toàn bộ đuôi có đầy thức ăn hay không. Một cấp độ bằng số (chỉ số độ đầy của ruột) có thể được sử dụng để định lượng độ đầy của ruột.
Sự thay đổi màu sắc ở phần phụ và tế bào sắc tố của tôm đã được theo dõi và kiểm tra mức độ hội chứng co cơ trên tôm. Mức độ xuất hiện tình trạng cơ trắng hoặc mờ đục đã được quan sát. Tình trạng viêm mô ở các phần phụ hoặc các chi của tôm và sự hoàn hảo về mặt giải phẫu như râu cong, chủy tốt, đầy đủ răng chủy, đường ruột thẳng, đốt đuôi và lớp biểu bì mịn đã được kiểm tra.
Tất cả các chủng phân lập từ các mẫu được bảo quản trong môi trường thạch dinh dưỡng ở 4°C. Ba trong số 22 loại vi khuẩn tiềm năng được phân lập đã được chọn lọc bằng hoạt tính thủy phân là MSWS24 phân giải protein (PI 62 mm), MSWS30 phân giải tinh bột (AI 63 mm) và MSWS19 phân giải cellulose (CI 45 mm). Từ đường cong tăng trưởng, có thể thấy rõ rằng pha chậm của các chủng này là từ 0 đến 2 giờ, pha tiến triển là từ 2 đến 12 giờ và pha tĩnh là từ 12 đến 18 giờ, tương đối dài hơn (Bảng 1). Những sinh vật có pha tĩnh dài hơn có khả năng trao đổi chất nhiều hơn những sinh vật khác.
Bảng 1 Các khuẩn lạc vi khuẩn phân lập từ ao nuôi tôm.
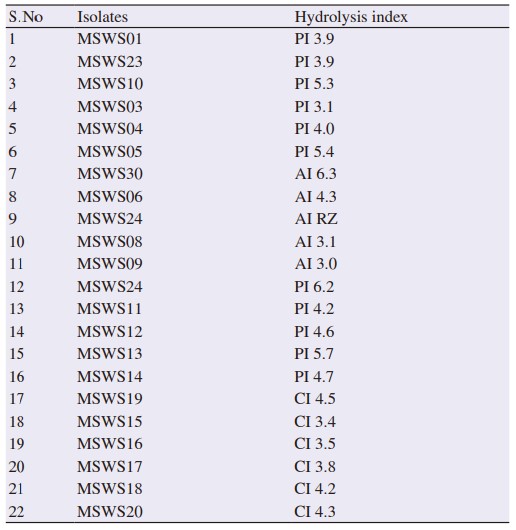
Các chủng phân lập MSWS24, MSWS30 và MSWS19 được chọn được xác định là vi khuẩn gram dương, vi khuẩn di động và hình thành nội bào tử, và dựa trên các kết quả sinh hóa, các phân lập này lần lượt được xác nhận là B. subtilis, B. licheniformis và B. Firmus. Các vi khuẩn gây bệnh được phân lập trên môi trường chọn lọc được xác định là Vibrio sp., Pseudomonas sp., và Aeromonas sp. (Bảng 2 và 3).
Bảng 2 Đặc điểm hình thái và sinh hóa
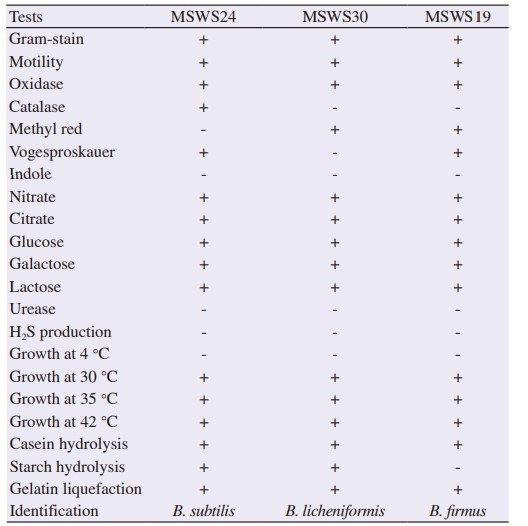
Bảng 3 Xác định vi khuẩn gây bệnh BP1, BP2, BP3 trong nước ao nuôi tôm
Ba dòng phân lập được tối ưu hóa ở các thông số vật lý khác nhau để kiểm tra thông số cụ thể tạo ra lượng enzyme cao hơn. Sản lượng protease tối đa của B. subtilis được quan sát thấy ở pH 7,5 là 87,60 IU/mL, ở nhiệt độ 35°C là 74,66 IU/mL, ở thời gian ủ 36 giờ là 79,14 IU/mL trong khi nguồn carbon như glucose cho thấy 83,20 IU /mL và nguồn nitơ tức là pepton cho thấy 81,28 IU/mL. Tương tự, các điều kiện tối ưu để B. licheniformis sản sinh tối đa amylase khi được tối ưu hóa ở pH 8,0 cho thấy hoạt tính enzyme là 104,60 IU/mL, ở nhiệt độ 35°C là 129,60 IU/mL, thời gian ủ ở 36 giờ là 102,40 IU/mL trong khi nguồn carbon từ cám lúa mì là 119,80 IU/mL và nguồn nitơ từ chiết xuất thịt bò là 120,60 IU/mL. Độ pH, nhiệt độ, thời gian ủ, nguồn carbon và nguồn nitơ tối ưu để B. Firmus sản xuất cellulase tối đa được quan sát thấy ở pH 8,0 là 62,80 IU/mL, ở 35 °C là 65,20 IU/mL, ủ 36 giờ là 80,10 IU /mL, trong khi sử dụng galactose làm nguồn carbon cho hiệu suất tương ứng là 78,70 IU/mL và nguồn nitơ, chiết xuất nấm men tương ứng là 80,50 IU/mL (Hình 1–5).
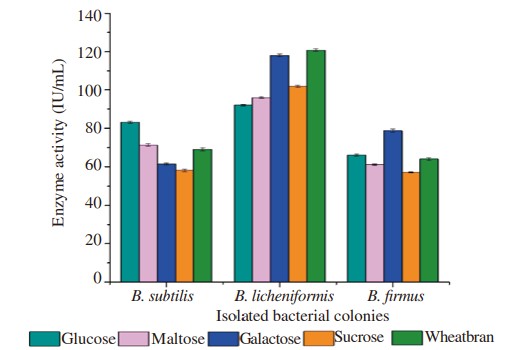
Hình 1. Ảnh hưởng của nguồn carbon khác nhau đến quá trình sản xuất enzyme.
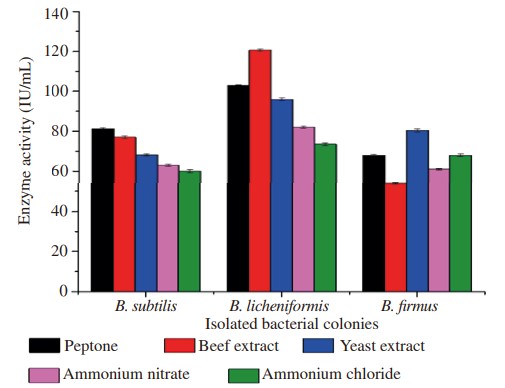
Hình 2. Ảnh hưởng của các nguồn nitơ khác nhau đến quá trình sản xuất enzyme
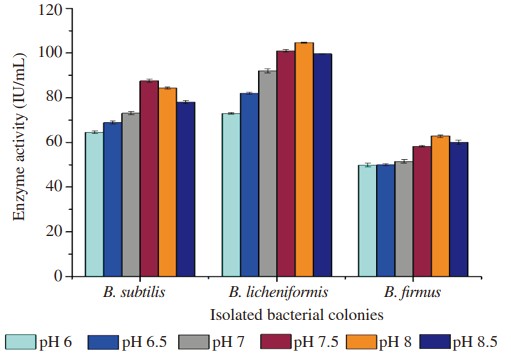
Hình 3. Ảnh hưởng của độ pH khác nhau đến quá trình sản xuất enzyme.
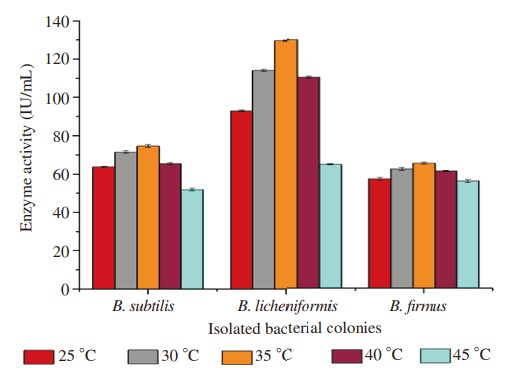
Hình 4. Ảnh hưởng của nhiệt độ khác nhau đến quá trình sản xuất enzyme.
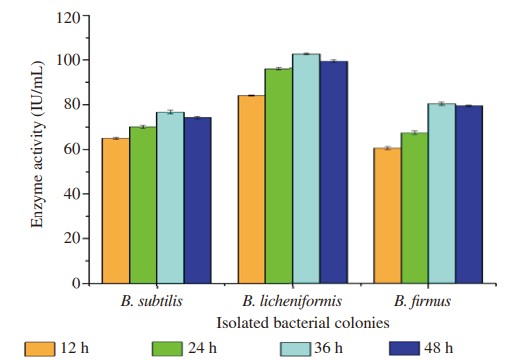
Hình 5. Ảnh hưởng của khoảng thời gian khác nhau đến quá trình sản xuất enzyme.
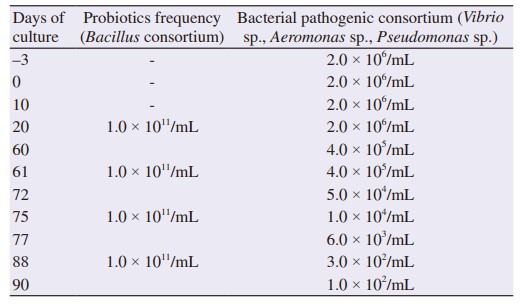
Quần thể probiont có mật độ tế bào 1,0 × 1011 tế bào/mL được áp dụng cách nhau 20 ngày cho các bể T1 và T2. Thay nước 40% trong 90 ngày nuôi vì mật độ tế bào có thể ảnh hưởng đến chất lượng nước (Bảng 4). Trong 90 ngày nuôi, sự tăng trưởng của tôm được quan sát ở mỗi bể thử nghiệm và bể đối chứng. Bể đối chứng C1 cho thấy trọng lượng tôm trung bình là 18,13 g, bể T1 là 14,02 g và bể T2 là 16,83 g. Sự phát triển của vi khuẩn gây bệnh được phân tích trong mỗi bể thử nghiệm và bể đối chứng. Bể T1 cho thấy số lượng tập đoàn vi khuẩn gây bệnh là 6,0 × 102 tế bào/mL và bể T2 cho thấy 3,0 × 102 tế bào/mL.
Bảng 4 Tần suất sử dụng vi khuẩn và vi khuẩn gây bệnh trong nuôi tôm.
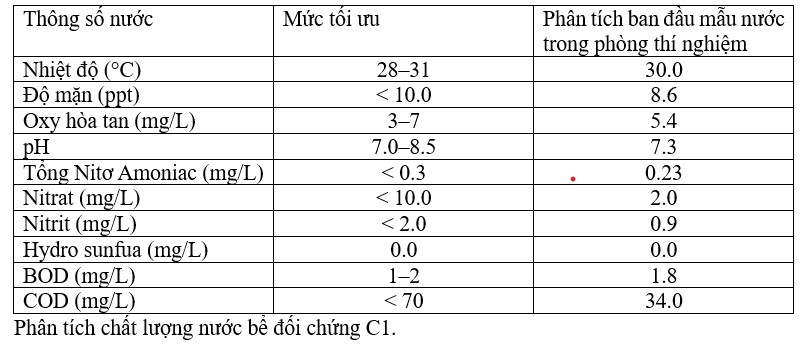
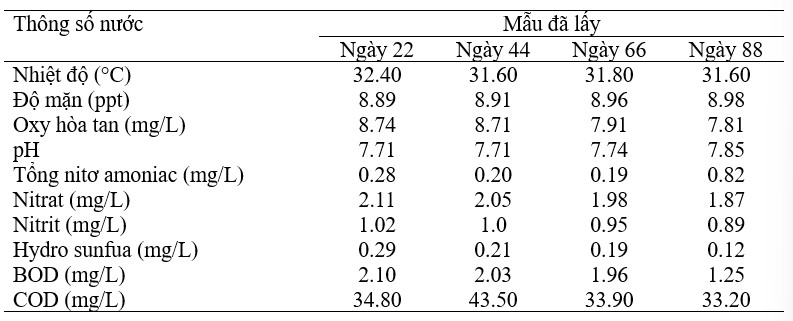
Phân tích ban đầu về chất lượng nước được so sánh với các điều kiện chất lượng nước tiêu chuẩn cho nuôi tôm. Điều kiện chất lượng nước tiêu chuẩn là nhiệt độ 28–31 °C, độ mặn < 10 ppt, oxy hòa tan 3,0–7,0 mg/L, pH 7,0–8,5, tổng nitơ amoniac < 0,3 mg/ L, nitrat < 10,0 mg/L, nitrit < 2,0 mg/L, hydro sunfua 0,0 mg/ L, BOD 1–2 mg/L, COD < 70 mg/L. Phân tích nước cho thấy nhiệt độ 30°C, độ mặn 8,6 ppt, oxy hòa tan 5,4 mg/L, pH 7,3, tổng nitơ amoniac 0,23 mg/L, nitrat 2,0 mg/L, nitrit 0,9 mg/L, hydro sunfua 0,0 mg/ L, BOD 1,8 mg/L, COD 34,0 mg/L (Bảng 5). Tải lượng hữu cơ trong nước sau khi khoáng hóa được xác nhận bằng phân tích chất lượng nước trong 90 ngày nuôi tôm. Sau khi thả giống, vi khuẩn probiont có thể ảnh hưởng đến việc giảm lượng chất hữu cơ.
Bảng 5 Phân tích mẫu nước trong thời gian nuôi
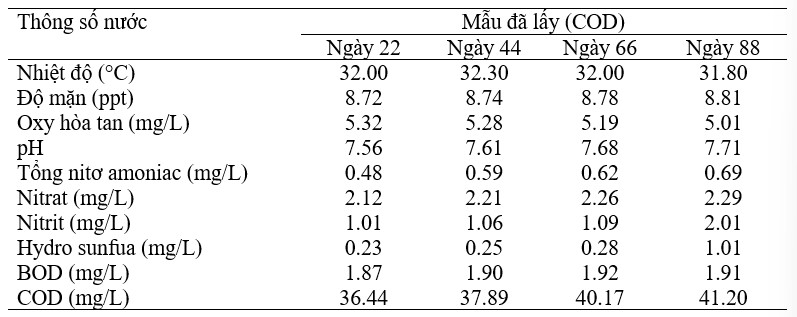
Các mẫu nước được thu thập đều đặn trong khoảng thời gian 22 ngày vào (ngày 22, 44, 66, 88) từ mỗi bể để đo sự suy giảm tải lượng hữu cơ. Khi đo các thông số chất lượng nước, mẫu từ bể C1 cho thấy nhiệt độ trung bình 32,0°C, độ mặn 8,76 ppt, oxy hòa tan 5,2 mg/L, pH 7,6, tổng nitơ amoniac 0,59 mg/L, nitrat 2,22 mg/L, nitrit 1,29 mg/L, hydro sunfua 0,44 mg/L, BOD 1,90 mg/L và COD 38,90 mg/L (Bảng 6). Mẫu nước bể T1 có nhiệt độ trung bình 32,0°C, độ mặn 8,9 ppt, oxy hòa tan 5,3 mg/L, pH 7,79, tổng nitơ amoniac 0,35 mg/L, nitrat 2,57 mg/L, nitrit 1,34 mg/L, hydro sunfua 0,43 mg/L, BOD 2,40 mg/L, COD 39,48 mg/L (Bảng 7). Bể T2 có nhiệt độ trung bình 31,90°C, độ mặn 8,9 ppt, oxy hòa tan 8,29 mg/L, pH 7,75, tổng nitơ amoniac 0,37 mg/L, nitrat 2,0 mg/L, nitrit 0,96 mg/L, hydro sunfua 0,20 mg /L, BOD 1,83 mg/L và COD 36,35 mg/L (Bảng 8). Khi so sánh với phân tích mẫu nước ban đầu, các mẫu từ bể được xử lý bằng probiont đáp ứng thông số chất lượng nước tối ưu cho nuôi tôm.
Bảng 6 Thông số chất lượng nước của nhóm đối chứng C1 (tôm + thức ăn công nghiệp)
Bảng 7: Thông số chất lượng nước của T1 (tôm + thức ăn công nghiệp + vi khuẩn gây bệnh).
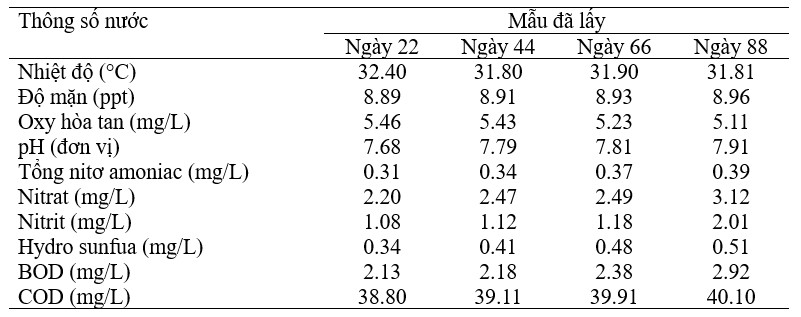
Bảng 8 Thông số chất lượng nước xử lý vi khuẩn T2
Tỷ lệ sống của tôm được tính toán cho từng bể thử nghiệm và bể đối chứng. Bảng 9 cho thấy tỷ lệ sống của nuôi tôm ở C1, T1 và T2 lần lượt là 60%, 40% và 80%. Tôm bơi lội bình thường ở đáy bể cho thấy lượng oxy hòa tan trong bể tốt. Chất lượng nước tốt cho thấy mức tiêu thụ thức ăn của tôm và quan sát đường ruột (ruột giữa) của tôm khỏe mạnh, được nuôi dưỡng tốt. Có thể nhìn thấy phần ruột chạy dài suốt đuôi chứa đầy thức ăn. Một cấp độ bằng số (chỉ số độ đầy của ruột) được sử dụng để định lượng độ đầy của ruột. Bể T2 cho thấy ruột đầy 85% và được coi là cấp 2. Bể C1 đối chứng cho thấy ruột rỗng đầy và được coi là cấp 0.
Bảng 9 Tỷ lệ sống của nuôi tôm

Tôm nuôi bình thường có đường ruột nhạt, có màu nâu vàng và không quan sát thấy sự thay đổi màu sắc ở các phần phụ và tế bào sắc tố của tôm. Mức độ hội chứng chuột rút đuôi khoảng 5%, cho thấy nhiệt độ bình thường, kiểm soát nhiễm trùng từ mầm bệnh (vi khuẩn) và cân bằng khoáng chất tốt. Nuôi cấy không gây căng thẳng được biểu thị bằng mức độ chấp nhận được của tình trạng cơ trắng hoặc mờ đục là 2%. Tôm không bị viêm mô ở các phần phụ hoặc tứ chi và các đặc điểm giải phẫu hoàn hảo như râu cong, chủy tốt, răng chủy hoàn hảo, đường ruột thẳng, các đoạn đuôi đều, lớp biểu bì mịn cho thấy tôm hoạt động tốt (Hình 6).
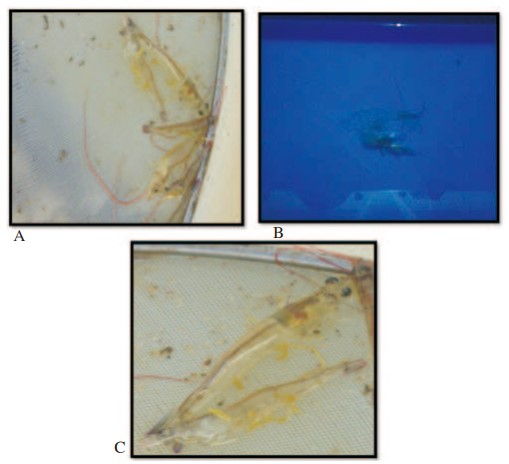
Hình 6. Hoạt động của tôm trong 90 ngày nuôi (A), độ mềm bình thường ngay sau giai đoạn sau lột xác (B) và không bị viêm mô ở phần phụ hoặc tứ chi của tôm (C).
Để tôm thẻ chân trắng P. vannamei tăng trưởng và sống sót tối ưu, cần duy trì chất lượng nước tốt trong suốt quá trình nuôi tôm như lượng oxy đầy đủ, mức độ chuyển hóa hạn chế và giảm đáng kể các ion amoniac, nitrit và nitrat. Thức ăn dư thừa, phân và chất chuyển hóa sẽ gây ảnh hưởng to lớn đến chất lượng nước ao nuôi tôm. Nghiên cứu này đề cập đến việc lựa chọn ba chủng vi khuẩn Bacillus sp. (các chủng B. subtilis, B. licheniformis và B. Firmus) có hoạt tính cao hơn của các enzyme amylase, protease và cellulase ngoại bào đã được phân lập, lấy với tỷ lệ bằng nhau và dùng với liều 1 × 1011/mL probiotic để khoáng hóa (phân hủy sinh học) của chất hữu cơ trong nước nuôi tôm, làm tăng đáng kể lượng oxy hòa tan, kiểm soát amoniac, nitrat và nitrit và duy trì độ pH và độ mặn. Những nghiên cứu trước đây đã báo báo cáo Bacillus sp. có thể phân hủy vật liệu hữu cơ và kiểm soát mầm bệnh vi khuẩn, cải thiện đáng kể sự tăng trưởng và tỷ lệ sống của tôm post, tăng vi khuẩn có lợi trong tôm và nước nuôi, đồng thời nâng cao chất lượng nước (độ pH, amoniac và nitrit) của nước nuôi. Những tác dụng này cũng đã được chứng minh ở cá chép Ấn Độ (Labeo rohita). Probiotic vi khuẩn giúp tăng cường sự phát triển của tôm bằng cách giải phóng các enzyme có liên quan và các yếu tố tăng trưởng khác giúp cung cấp chất dinh dưỡng cho vật chủ và tăng hiệu quả sử dụng thức ăn của tôm P. vannamei và tạo ra khả năng kháng lại các bệnh do vi khuẩn và kiểm soát sự lây nhiễm của vi khuẩn bằng cách ức chế cạnh tranh, giúp nâng cao tỷ lệ sống của tôm. Do hạn chế về không gian và nguồn lực, nuôi trồng thủy sản truyền thống đã được thay thế thành các hệ thống lưới với mật độ thả giống cao, dẫn đến môi trường nhân tạo hỗ trợ sự phát triển của vi khuẩn gây bệnh và tạo ra các chất chuyển hóa độc hại. Để giảm thiểu tải lượng chất hữu cơ trong ao nuôi trồng thủy sản cần có quá trình khoáng hóa. Trong quá trình này, các phân tử vĩ mô được chuyển đổi thành các phân tử nhỏ hơn và hòa tan kém hiệu quả nhờ các enzyme protease, amylase và cellulase. Những phân tử này sau đó thường xuyên bị loại bỏ bằng cách thay nước trong khoảng thời gian 2 ngày trong quá trình canh tác.
Trong nghiên cứu này, khẩu phần ăn bổ sung probiotic đã làm tăng trọng lượng cuối cùng của tôm, tăng hiệu suất tăng trưởng của tôm, giảm đáng kể các ion amoniac, nitrit và nitrat trong nước nuôi tôm, và có khả năng kiểm soát nhiễm vi khuẩn hiệu quả do có sự khác biệt đáng kể về tỷ lệ sống của tôm đã được ghi nhận trong các bể thử nghiệm được xử lý. Trong nghiên cứu này, tỷ lệ sống của tôm trong bể T1 chưa được xử lý là 40% trong khi ở bể T2 là 80%. Những kết quả này cho thấy rằng việc sử dụng Bacillus consortium trong nước nuôi tôm có tác dụng có lợi đối với chất lượng nước, sự tăng trưởng của tôm, khả năng kháng bệnh và tỷ lệ sống của tôm
Theo Dhanasekar Ramu, Santhosh Sigamani, Hemalatha Venkatachalam, Panneerselvam Bommannan, Dhandapani Ramamurthy
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ý Tưởng Thiết Kế Hệ Thống Nuôi Tôm Trong Ao Bền Vững
- Phương Pháp Nuôi Tôm Thẻ Chân Trắng Peneaus vannamei Bền Vững Gần Đây
- Tác Dụng Của Chiết Xuất Polyphenol Tự Nhiên Từ Mía (Saccharum oflcinarum) Đến Tăng Trưởng, Tỷ Lệ Sống Và Hiệu Quả Sử Dụng Thức Ăn Của Tôm Sú (Penaeus monodon) Giai Đoạn Juvenile

 English
English 中文 (中国)
中文 (中国)