Tóm tắt đơn giản
Tôm thẻ chân trắng là một trong những loài thủy sản được thương mại hóa phổ biến nhất trong nuôi trồng thủy sản toàn cầu. Tuy nhiên, ngành sản xuất tôm này đang đối mặt với nhiều thách thức, bao gồm sự thiếu hụt và giá thành cao của bột cá – nguồn protein chính trong thức ăn tôm, cũng như sự bùng phát thường xuyên của hội chứng tôm chết sớm (EMS). Nghiên cứu này đánh giá tiềm năng sử dụng bột giun vàng đã khử chất béo như một giải pháp thay thế cho bột cá trong sản xuất tôm thương mại. Kết quả cho thấy bột giun vàng có thể thay thế hoàn toàn hoặc một phần bột cá trong khẩu phần ăn của tôm, với hiệu quả tối ưu đạt được khi thay thế 50% bột cá. Tôm được cho ăn bột giun vàng có hiệu suất tăng trưởng và chuyển hóa thức ăn tốt hơn so với tôm được cho ăn thức ăn truyền thống. Bột giun vàng giúp tăng cường khả năng chống chịu của tôm đối với vi khuẩn gây bệnh EMS, cải thiện tỷ lệ sống sót và giảm tình trạng ức chế miễn dịch. Chúng tôi kết luận rằng bột côn trùng bao gồm giun Tenebrio molitor là một lựa chọn thay thế phù hợp cho bột cá trong sản xuất tôm thương mại vì bột có giá trị protein cao và sự hiện diện của chitin/các hoạt chất sinh học khác giúp chống lại sự lây nhiễm mầm bệnh.
Tóm tắt
Nguồn cung cấp bột cá (FM) – nguồn protein chính cho tôm – đang bị ảnh hưởng bởi các vấn đề sinh thái và kinh tế. Nghiên cứu này đánh giá tác động của việc thay thế FM bằng ŸnMealTM (YM) – bột côn trùng đã khử chất béo, bao gồm giun vàng (Tenebrio molitor) – đối với tôm thẻ chân trắng (Litopenaeus vannanmei) chưa trưởng thành. Các thông số tăng trưởng và miễn dịch của tôm thẻ chân trắng (Litopenaeus vannanmei) chưa trưởng thành được so sánh sau thử nghiệm cho ăn kéo dài 8 tuần. Tôm được nuôi trong bể với mật độ 60 và 40 con/m2 và cho ăn 1 trong 5 khẩu phần trong đó một phần FM được thay thế bằng YM. Tất cả các khẩu phần đều là isoproteic, isoenergetic và cân bằng lysine và methionine. Sau thử nghiệm cho ăn, tôm được cảm nhiễm với vi khuẩn gây bệnh (Vibrio parahaemolyticus). Các thông số tăng trưởng và chuyển hóa thức ăn được cải thiện khi YM được đưa vào khẩu phần ăn của tôm; với mức tăng trọng cao nhất và hệ số chuyển hóa thức ăn (FCR) tốt nhất đạt được khi 50% FM được thay thế bằng YM so với khẩu phần đối chứng không chứa YM (khối lượng ban đầu: 1,60 g/tôm; tăng trưởng: 5,27 so với 3,94 g/tôm; FCR 1,20 so với 1,59). Ở tôm bị cảm nhiễm, tỷ lệ chết thấp hơn đáng kể ở các nhóm nhận được YM, với tỷ lệ chết thấp hơn 76,9% ở nhóm thay thế 50% FM so với nhóm đối chứng.
Giới thiệu
Tôm thẻ chân trắng (Litopenaeus vannamei) là một trong những loài tôm được nuôi trồng phổ biến nhất trên thế giới, với sản lượng hơn 3,67 triệu tấn vào năm 2014. Bột cá (FM) đóng vai trò quan trọng trong nuôi trồng thủy sản, cung cấp nguồn protein thiết yếu cho nhiều loài. Tuy nhiên, do ảnh hưởng của các vấn đề sinh thái và kinh tế, nguồn cung cấp FM đang dần khan hiếm, dẫn đến việc tìm kiếm các nguồn protein thay thế. FM chứa các axit amin, khoáng chất và nucleotide thiết yếu cần thiết cho các loài nuôi trồng thủy sản ăn thịt được sản xuất thương mại và do đó FM là thành phần thiết yếu trong khẩu phần ăn của cá và tôm để duy trì năng suất, tăng trưởng và sức khỏe nói chung.
Theo Tổ chức Lương thực và Nông nghiệp (FAO) của Liên hợp quốc, Bột côn trùng là một giải pháp tiềm năng cho vấn đề này. Bột côn trùng cung cấp nguồn axit amin, lipid, khoáng chất, vitamin và năng lượng dồi dào, có thể thay thế cho FM trong thức ăn của các loài thủy sản ăn thịt. Giai đoạn ấu trùng của giun vàng (Tenebrio molitor) là một ứng cử viên sáng giá cho việc thay thế bột cá. Giun vàng có hàm lượng protein cao và dễ nuôi, phù hợp để sản xuất thức ăn cho tôm thẻ chân trắng. Ngành công nghiệp côn trùng đang phát triển nhanh chóng trên toàn cầu. Nền tảng Quốc tế về Côn trùng làm Thực phẩm và Thức ăn chăn nuôi ước tính sản lượng côn trùng hiện tại là 6000 tấn, tương ứng với khoản đầu tư toàn cầu hàng năm là 355 triệu euro.
Các nghiên cứu về việc thay thế bột cá (FM) bằng bột côn trùng đầy đủ chất béo cho tôm và cá thương mại cho thấy kết quả tăng trưởng không đồng nhất trong cùng một loài. Lý do có thể do sự khác biệt trong quá trình chế biến thức ăn và/hoặc xây dựng khẩu phần ăn. Chất lượng dinh dưỡng của bột protein động vật phụ thuộc trực tiếp vào quá trình chế biến và độ tươi của nguyên liệu thô. Ví dụ, ở cá hồi vân, một nghiên cứu cho thấy bữa ăn của ấu trùng ruồi lính đen có thể thay thế 50% FM mà không ảnh hưởng đến sự tăng trưởng. Tuy nhiên, hiệu quả sử dụng protein đã giảm lại giảm so với thức ăn có FM. Bột ruồi lính đen (Hermetia illucens) đầy đủ chất béo có thể thay thế tới 25% FM mà không ảnh hưởng đến sự phát triển của tôm. Tương tự, khẩu phần ăn giàu chất béo T. molitor bổ sung methionine cho tôm thẻ chân trắng có giá trị dinh dưỡng và hiệu suất tăng trưởng tương tự hoặc vượt trội so với khẩu phần ăn dựa trên FM.
Ngoài những yếu tố đã đề cập, dịch bệnh bùng phát cũng là một vấn đề ảnh hưởng lớn đến sản xuất tôm. Việc tốc độ tăng trưởng giảm và tỷ lệ chết cao thường liên quan đến sự xuất hiện của vi khuẩn Vibrio spp. trong nước ao nuôi. Bệnh hoại tử gan tụy cấp tính do Vibrio parahaemolyticus gây ra đã gây thiệt hại nặng nề cho ngành nuôi tôm trong nhiều thập kỷ qua. Do tôm không có hệ thống miễn dịch thích ứng để chống lại bệnh tật, việc tăng cường hệ thống miễn dịch bẩm sinh là vô cùng quan trọng, đặc biệt trong môi trường nuôi thâm canh. Sức khỏe của tôm và việc tăng cường hệ thống miễn dịch bẩm sinh của chúng là mối quan tâm hàng đầu của người nuôi. Khẩu phần ăn chứa chitin và nhuyễn thể (giàu chitin) đã được chứng minh là có khả năng điều chỉnh hệ thống miễn dịch của cá và tôm. So với FM, bột côn trùng có chứa chitin – một polyme liên kết b-1,4 của N-acetyl-d-glucosamine. Chitin là một trong những polysaccharide phổ biến nhất trong tự nhiên và là thành phần chính của bộ xương côn trùng, vỏ giáp xác và thành tế bào nấm.
Hiện nay, ngành nuôi trồng thủy sản đang tìm kiếm các nguồn protein thay thế cho nuôi tôm thương phẩm. Mục tiêu là tìm ra những loại protein phù hợp để duy trì hiệu suất tăng trưởng tích cực cũng như cải thiện khả năng miễn dịch và khả năng kháng bệnh của tôm. Do đó, bột côn trùng có thể đóng một vai trò quan trọng trong tính kinh tế và tính bền vững của nghề nuôi tôm so với cả khẩu phần ăn dựa trên bột cá và bột thực vật. Thật vậy, Quá trình sản xuất bột côn trùng đòi hỏi ít đất, nước và năng lượng hơn so với sản xuất protein thực vật, giúp giảm thiểu tác động đến môi trường.
Mục tiêu của nghiên cứu này là đánh giá tác động của bột giun vàng (T. molitor) đã qua chế biến và khử chất béo trong khẩu phần ăn đối với tôm con. Nghiên cứu cũng đánh giá phản ứng miễn dịch và khả năng miễn dịch với vi khuẩn gây bệnh phổ biến V. parahaemolyticus.
Chuẩn bị nghiên cứu
Tôm và điều kiện thí nghiệm
Thí nghiệm được thực hiện tại Phòng thí nghiệm Dinh dưỡng và Thức ăn Thủy sản, Khoa Nuôi trồng Thủy sản, Khoa Thủy sản, Đại học Kasetsart, Thái Lan. Ấu trùng tôm thẻ chân trắng (L. vannamei) có trọng lượng 0,5 g (PL-25) được lấy từ một dòng tôm sạch bệnh tại tỉnh Samutsakhon, Thái Lan. Sau 21 ngày thích nghi, tôm con nặng 1,5–1,6 g được phân ngẫu nhiên vào các bể 100 L với mật độ 60 con/m2 (15 con/bể). Mỗi bể chứa 80 L nước muối 15 ppt với độ pH dao động từ 7,0–7,5 và tổng nitơ amoniac dưới 0,02 mg/L NH3-N. Oxy được cung cấp liên tục trong mỗi bể và duy trì ở nồng độ cao hơn 5 mg/L. Tôm được cho ăn 3 lần mỗi ngày với lượng thức ăn bằng 3-5% trọng lượng cơ thể trong 8 tuần. Thức ăn và phân chưa sử dụng được hút hàng ngày và 20% lượng nước được thay mới 3 ngày/lần. Nhiệt độ dao động trong khoảng 26 đến 30℃. Mỗi nghiệm thức được lặp lại 6 lần.
Thiết kế thí nghiệm và chuẩn bị khẩu phần ăn
Thành phần khẩu phần ăn giun vàng
Bột giun vàng được cung cấp bởi Ÿnsect (Damparis, Pháp). Nó là một sản phẩm thương mại có tên ŸnMealTM (YM), là một loại bột khô thu được bằng cách chế biến ấu trùng T. molitor được nuôi trên nguyên liệu thức ăn thực vật. YM đã được khử chất béo và thành phần gần đúng của loại bột côn trùng này được trình bày chi tiết trong Bảng 1.
Bảng 1. Thành phần gần đúng của bột giun vàng (ŸnMealTM) (% trọng lượng khô).

Chuẩn bị khẩu phần ăn
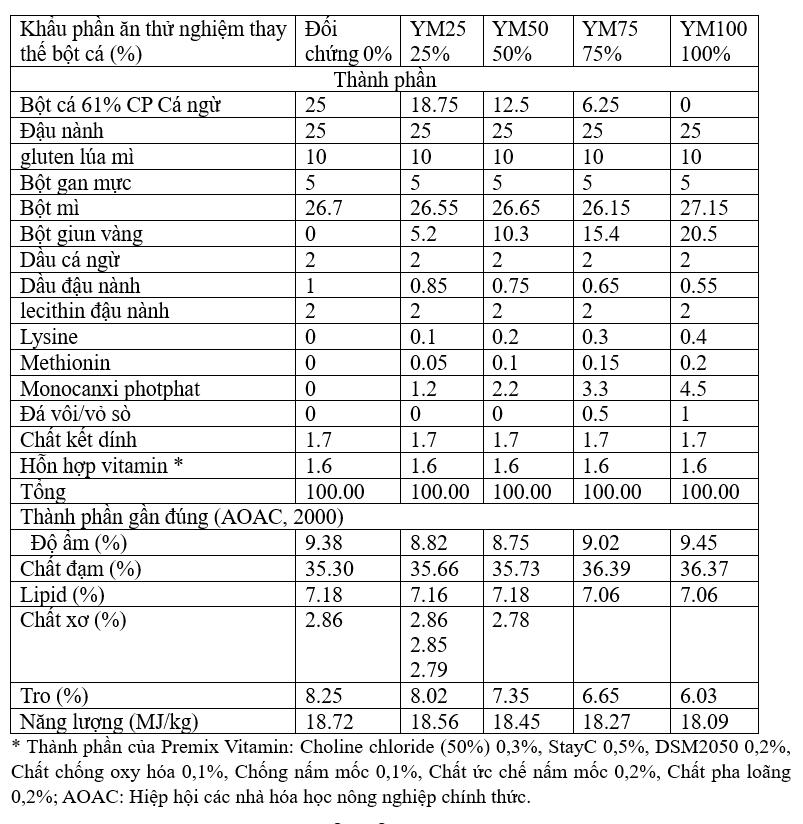
5 khẩu phần ăn thử nghiệm được thiết kế để giảm dần tỷ lệ FM, đồng thời tăng hàm lượng YM. FM được thay thế ở các mức sau: 0% (đối chứng), 25%, 50%, 75% và 100% (thay thế hoàn toàn) bằng YM trong khi hàm lượng dầu đậu nành và bột mì được điều chỉnh. Tất cả các khẩu phần ăn được xây dựng theo công thức isoproteic và isolipidic, tuân theo các khuyến nghị của lysine và methionine của NRC 2011. Công thức thức ăn và thành phần gần đúng của khẩu phần được trình bày chi tiết trong Bảng 2.
Nguyên liệu thức ăn được nghiền đến 150–250 micron, trộn với nhau và sau đó được làm ẩm nhẹ để đạt độ ẩm 25%. Hỗn hợp ướt thu được được đưa qua máy xay Hobart để tạo thành các viên 2 × 2 mm (đường kính và chiều dài). Sấy khô viên thức ăn trong không khí ở nhiệt độ 65℃ trong 12 giờ để đạt độ ẩm khoảng 10%. Bảo quản viên thức ăn khô ở −20℃ trong túi nhựa đóng gói chân không và kín.
Bảng 2. Công thức khẩu phần thí nghiệm và thành phần gần đúng (% trọng lượng khô).
Đánh giá tăng trưởng và chuyển đổi thức ăn
Trong thời gian thử nghiệm, lượng thức ăn được cung cấp đã được ghi lại và thức ăn thừa được cân sau khi hút, lọc và sấy khô. Những dữ liệu này được sử dụng để tính toán lượng thức ăn tiêu thụ. Tôm được lấy mẫu hai tuần một lần cho đến hết 8 tuần để đánh giá tăng trưởng. Tỷ lệ chết được theo dõi hàng ngày. Hiệu suất tăng trưởng được ước tính thông qua việc đánh giá mức tăng cân, mức tăng cân trung bình hàng ngày, tốc độ tăng trưởng cụ thể (SGR) và tỷ lệ chết. Hiệu suất sử dụng thức ăn được ước tính bằng tỷ lệ chuyển đổi thức ăn (FCR) và hiệu quả sử dụng protein (PER).

trong đó Wt là trọng lượng mỗi con tôm trong bể thu được tại thời điểm t; WG: tăng cân; ADG: mức tăng trung bình ngày; PER: tỷ lệ hiệu quả protein.
Thử nghiệm cảm nhiễm sử dụng Vibrio Parahaemolyticus
Khả năng kháng vi khuẩn V. parahaemolyticus của tôm thẻ chân trắng được đánh giá sau 8 tuần thử nghiệm cho ăn với các khẩu phần ăn khác nhau. Chủng gây bệnh được cung cấp bởi Trung tâm Nghiên cứu và Phát triển Nuôi trồng Thủy sản Ven biển 2 (Samutsakhorn), Cục Thủy sản, Bộ Nông nghiệp và Hợp tác xã, Thái Lan. Ba lần lặp lại 10 con tôm trong mỗi nghiệm thức được lấy mẫu ngẫu nhiên từ thử nghiệm cho ăn và sử dụng cho thử nghiệm cảm nhiễm. Thử nghiệm cảm nhiễm được thực hiện bằng cách tiêm vào cơ 4,3 × 105 CFU/mL V. parahaemolyticus vào từng con tôm. Số lượng tôm tương tự trong mỗi nghiệm thức cũng được lấy mẫu ngẫu nhiên sau đó tiêm nước muối (0,85%) để làm đối chứng. Tôm thí nghiệm được nuôi trong cùng bể và điều kiện nuôi như mô tả trước đây. Mỗi nghiệm thức được lặp lại 3 lần. Tỷ lệ chết được theo dõi trong 10 ngày.
Thông số miễn dịch
Tình trạng miễn dịch của tôm được đánh giá vào cuối thử nghiệm cho ăn và 16 giờ sau cảm nhiễm với V. parahaemolyticus bằng cách đo tổng số lượng tế bào máu (THC), mức protein hemolymp (HPL), hoạt tính phenoloxidase (PO) và khả năng thanh thải. Chín con tôm được thu hoạch từ mỗi nghiệm thức, 3 cá thể từ mỗi lần lặp lại, để lấy mẫu hemolymp. Các mẫu hemolymp này được lấy riêng lẻ từ gốc của chân bơi thứ ba bằng cách sử dụng ống tiêm có chứa chất chống đông máu (môi trường KC-199 cộng với HEPES 2,38 g/L, bổ sung 5% L-cysteine, Itami và cộng sự, 1994). Hỗn hợp thu được gồm hemolymp và chất chống đông máu được sử dụng để đo các thông số miễn dịch (THC, HPL và PO) như được mô tả dưới đây.
Tổng số lượng tế bào máu
0,1 mL hemolymp từ ba con tôm được chọn ngẫu nhiên trong mỗi nghiệm thức được trộn với 0,5 mL môi trường KC-199 cải tiến (Itami và cộng sự, 1994) trước khi thêm dung dịch trypan blue và sau đó trộn nhẹ nhàng. Các tế bào máu sống được đếm và tính toán dưới dạng tế bào/mL bằng cách sử dụng máy đo huyết sắc tố dưới kính hiển vi ánh sáng ở độ phóng đại 400 ×.
Xét nghiệm hoạt tính phenoloxidase
Hoạt tính PO đã được thử nghiệm bằng phương pháp đo quang phổ bằng cách sử dụng L-3, 4-dihydroxyphenylalanine (L-DOPA; Sigma, Saint Louis, MO, USA) làm cơ chất và trypsin (Sigma, cat. No. T0646) làm chất kích thích theo phương pháp được mô tả bởi Smith và Soderhall (1991). Trộn 0,1 mL hemolymp tôm với 0,4 mL chất chống đông trung bình KC-199 cải tiến, sau đó ly tâm ở 2500 vòng/phút trong 10 phút ở 4℃. Rửa tế bào máu và thu thập trong dung dịch đệm cacodylate (CAC) lạnh ở pH 7,0. Chất siêu âm lysate hemocyte (HLS) đã được điều chế bằng cách sử dụng máy siêu âm ở đầu ra microtip 5, chu kỳ 50% trong 3 giây, trước khi ly tâm ở tốc độ 15.000 vòng / phút trong 20 phút ở 4℃. Chất nổi phía trên (HLS) được sử dụng làm nguồn enzyme cho xét nghiệm. Thử nghiệm hoạt tính PO được tiến hành trên tổng số 200 µL HLS được ủ với 200 µL trypsin 0,1% trong đệm CAC ở nhiệt độ phòng trong 30 phút và trộn với 200 µL L-DOPA 0,3% trong đệm CAC. Mỗi hỗn hợp phản ứng được pha loãng thêm với 600 µL dung dịch đệm CAC sau đó trộn đều và đo mật độ quang ở bước sóng 490 nm. Các phép đo độ hấp thụ được thực hiện dựa trên mẫu trắng bao gồm đệm CAC, L-DOPA, và chất kích thích để kiểm soát quá trình oxy hóa tự phát của riêng chất nền. Một đơn vị hoạt động của enzyme được định nghĩa là sự gia tăng độ hấp thụ 0,001/phút/mg protein.
Protein hemolymp
Hàm lượng protein hemolymp trong HLS được đo bằng phương pháp Lowry sử dụng albumin huyết thanh bò làm protein tiêu chuẩn (Lowry và cộng sự, 1951).
Khả năng thanh thải
Khi kết thúc thử nghiệm cho ăn, khả năng loại bỏ tế bào vi khuẩn khỏi hệ thống tuần hoàn máu của mỗi con tôm được đo bằng phương pháp sửa đổi của Martin và cộng sự (1993). Tiêm 0,1 mL huyền phù vi khuẩn V. parahaemolyticus (4,3 × 105 cfu/mL; 4,6 log cfu/mL) vào cơ đuôi của mỗi con tôm và sau đó giữ trong bể bằng nước biển trong 3 giờ. Hemolymp được thu thập từ mỗi con tôm và sau đó nhỏ 30 µL máu toàn phần vào môi trường thạch TCBS và pha loãng máu toàn phần gấp hai lần bằng dung dịch NaCl 2,6% vô trùng. Số lượng vi khuẩn được đếm trên TCBS ở trên và báo cáo bằng log cfu/mL.
Theo Constant Motte, Alfredo Rios, Thomas Lefebvre, Hong Do, Morgane Henry, Orapint Jintasataporn
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Nghiên Cứu Tỷ Lệ Mắc Bệnh Mờ Đục Hậu Ấu Trùng (TPD) Ở Trung Quốc
- Xác Định Thành Phần Vi Mô Biofloc Như Là Phương Pháp Xử Lý Sinh Học Tự Nhiên Trong Quá Trình Không Thay Nước Của Tôm Thẻ Chân Trắng Penaeus vannamei Nuôi Trong Hệ Thống Trại Giống Khép Kín
- Công Nghệ Mới Biofloc Và Bệnh Tôm Trong Nuôi Trồng Thủy Sản Siêu Thâm Canh

 English
English 中文 (中国)
中文 (中国)