3. Kết quả
3.1. Thông số chất lượng nước
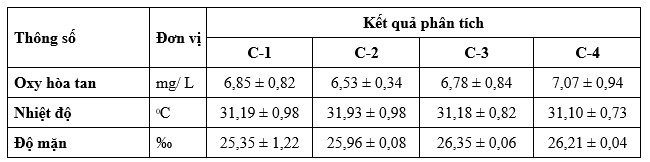
Kết quả về các thông số chất lượng nước trong các thử nghiệm cho ăn thương mại và nuôi trong môi trường có kiểm soát được thể hiện tương ứng trong Bảng 2, Bảng 3. Chất lượng nước đo được tại các thử nghiệm cho ăn thương mại đã chứng minh rằng các thông số như oxy hòa tan (DO), nhiệt độ, độ mặn và độ pH vẫn nằm trong phạm vi chấp nhận được đối với nuôi tôm. Amoniac (NH3 -N) trong 12% CFP cao hơn so với ao đối chứng. Ngoài ra, mức độ nitrit (NO2-N) vẫn cao hơn trong ao 12% CFP so với ao đối chứng. Các thông số khác, chẳng hạn như nitrat (NO3-N), phốt phát (PO4-N), độ kiềm, canxi và magie dao động giữa các ao nuôi. Liên quan đến thử nghiệm cho ăn trong môi trường có kiểm soát, chất lượng nước đo được theo DO; nhiệt độ; độ mặn; độ pH; NH3-N; NO2-N; NO3-N; và PO4 vẫn nằm trong ngưỡng tối ưu cho nuôi tôm.
Bảng 2. Dữ liệu chất lượng nước trong quá trình thử nghiệm cho ăn thương mại trong 85 – 86 ngày ở các ao ngoài trời, Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn (phạm vi).
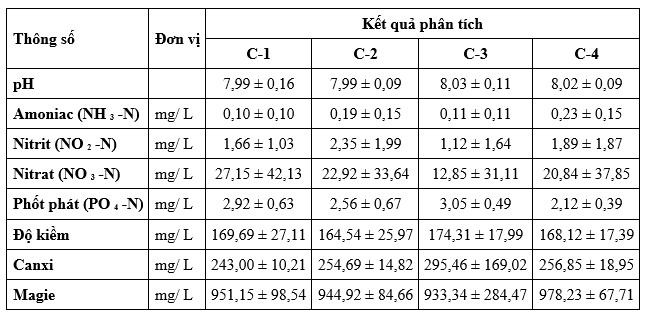
Bảng 3. Dữ liệu chất lượng nước trong quá trình thử nghiệm cho ăn có kiểm soát trong 60 ngày trong bể thủy sinh, Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn (phạm vi).

3.2. Thử nghiệm cho ăn
3.2.1. Thử nghiệm thức ăn công nghiệp
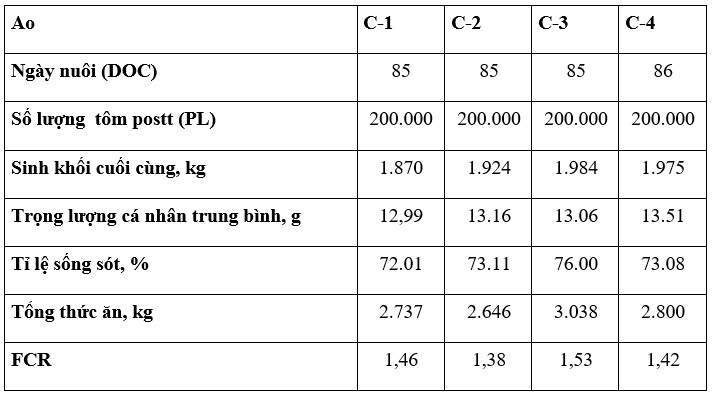
Lần đầu tiên, nông dân tham gia nghiên cứu này đã có thể thu hoạch thành công tôm từ ao C-2 và C-4 bị nhiễm mầm bệnh nặng với tỷ lệ sống trên 70%. Trong thử nghiệm tăng trưởng này, quan sát thấy rằng trọng lượng trung bình của từng cá thể được cải thiện ở nhóm tôm được cho ăn 12% CFP (13,16 – 13,51 g) so với nhóm thương mại (12,99 – 13,06g; Bảng 4). FCR thấp nhất cũng được quan sát thấy ở nhóm tôm được cho ăn 12% CFP so với khẩu phần ăn công nghiệp. Có sự nhất quán về tỷ lệ sống trong nhóm tôm được cho ăn 12% CFP với lượng sinh khối tương đương giữa các khẩu phần ăn.
Bảng 4. Hiệu suất tăng trưởng của tôm thẻ chân trắng được cho ăn khẩu phần ăn công nghiệp (ao C-1 và C-3) hoặc khẩu phần ăn có chứa 12% CFP (ao C-2 và C-4) trong 85 – 86 ngày trong hệ thống ao.
3.2.2. Thử nghiệm tăng trưởng trong môi trường được kiểm soát
Đối với thử nghiệm tăng trưởng có kiểm soát, quan sát thấy rằng tôm được cho ăn 12% CFP có sinh khối cuối cùng lớn hơn đáng kể (P = 0,03) so với đối chứng với các phương pháp điều trị trung gian là 6% và 18% (Bảng 5). Trọng lượng trung bình cuối cùng (FMW) lớn hơn về mặt thống kê (P <0,01) đối với tôm được cho ăn tất cả các khẩu phần ăn có chứa CFP so với đối chứng. Không có sự khác biệt (P = 0,63) về khả năng sống sót của tôm giữa các nghiệm thức, tuy nhiên, tôm ăn khẩu phần ăn có chứa CFP có tỷ lệ sống sót cao hơn 5,48% so với tôm ăn khẩu phần ăn đối chứng (trung bình lần lượt là 92,59 so với 87,78). Tương tự như FMW, tôm được cho ăn bất kỳ loại bổ sung nào (6%, 12% hoặc 18%) CFP có mức tăng trọng lớn hơn, FCR được cải thiện và hệ số tăng trưởng nhiệt cao hơn (P < 0,01) so với tôm được nuôi bằng nghiệm thức đối chứng. Khi kết thúc thử nghiệm tăng trưởng, đã có sự cải thiện đáng kể về năng suất tăng trưởng khi 12% CFP được sử dụng để thay thế việc sử dụng SBM và bột gluten ngô trong khẩu phần ăn. (Hình 1).
Bảng 5. Hiệu suất tăng trưởng của tôm thẻ chân trắng (trọng lượng ban đầu trung bình 1,04 ± 0,05 g) được cho ăn các khẩu phần ăn thử nghiệm trong 60 ngày, Kết quả trong cùng một hàng với các ký tự chỉ số trên khác nhau thì khác biệt có ý nghĩa thống kê (P < 0,05) dựa trên phân tích phương sai theo sau là bội số Tukey kiểm tra so sánh. 
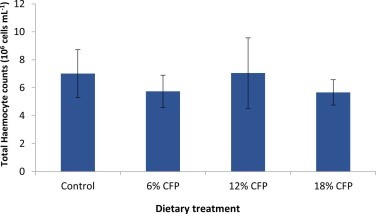
Hình 1. Tổng số lượng tế bào máu (THC) của tôm thẻ chân trắng Litopenaeus vannamei (106 tế bào m/L) vào cuối thử nghiệm tăng trưởng 60 ngày (điều kiện đối chứng), Không quan sát thấy sự khác biệt giữa các nghiêmj thức (giá trị P: 0,5028). Các thanh lỗi cho biết độ lệch chuẩn.
3.3. Thử nghiệm cảm nhiễm
Tôm chết trong khoảng thời gian từ 12 giờ đến 36 giờ sau khi nhiễm bệnh với các biểu hiện yếu, bơi thụ động trên mặt nước, cơ bụng màu trắng sữa, chán ăn, kém ăn, gan tụy có màu vàng đỏ, tốc độ tăng trưởng giảm. Tôm được cho ăn 12% CFP có tỷ lệ sống cao nhất (P < 0,05) với 6% và 18% CFP là trung bình, và đối chứng dương tính có tỷ lệ sống thấp nhất trong số 4 nghiệm thức thử nghiệm (Hình 2).

Hình 2. Tỷ lệ sống trung bình khi kết thúc thử nghiệm cảm nhiễm Vibrio harveyi ở liều 5 × 104 CFU/ tôm. Các chữ cái khác nhau cho thấy sự khác biệt có ý nghĩa thống kê (p <0,05) giữa các khẩu phần ăn. Các thanh lỗi cho biết độ lệch chuẩn.
3.4. Thông số miễn dịch của tôm
3.4.1. Tổng số lượng tế bào máu khi kết thúc 60 ngày thử nghiệm và thử nghiệm cho ăn
Các nghiệm thức bằng khẩu phần ăn không ảnh hưởng đáng kể đến tổng số tế bào máu sau 60 ngày thử nghiệm cho ăn (Hình 1) và khi kết thúc thử nghiệm cảm nhiễm (Hình 3). Tuy nhiên, về số lượng, THC trong nhóm tôm được cho ăn 12% CFP sau 60 ngày thử nghiệm cho ăn cao hơn so với khẩu phần ăn khác. Khi kết thúc thử nghiệm cảm nhiễm, tất cả tôm được nuôi bằng CFP đều cho thấy số lượng THC tăng lên so với nghiệm thức đối chứng (Hình 3).

Hình 3. Tổng số lượng tế bào máu (THC) của tôm thẻ chân trắng Litopenaeus vannamei (106 tế bào m/L) khi kết thúc thử nghiệm cảm nhiễm. Các thanh lỗi cho biết độ lệch chuẩn.
3.4.2. Hoạt tính thực bào (PA) – chỉ số thực bào (PI)
Hoạt động thực bào và chỉ số thực bào của tôm sau cảm nhiễm có thể được xem tương ứng trong Hình 4, Hình 5. Tôm được cho ăn khẩu phần ăn chứa 6% và 12% CFP có hoạt động thực bào cao hơn đáng kể (P <0,01) với 18% CFP là trung bình và nghiệm thức đối chứng là thấp nhất. Các chỉ số thực bào của tôm sau thử nghiệm cảm nhiễm cao hơn đáng kể ở tôm được cho ăn 12% CFP, trung bình với 6% CFP và đối chứng, và thấp nhất ở nghiệm thức 18% CFP (P = 0,0187)

Hình 4. Tỷ lệ phần trăm trung bình hoạt động thực bào trong tế bào máu tôm sau thử nghiệm cảm nhiễm với vibrio harveyi ở liều 5 × 104 CFU/ tôm. Các chữ cái khác nhau cho thấy sự khác biệt có ý nghĩa thống kê (P=0,0041) giữa các khẩu phần ăn. Các thanh lỗi cho biết độ lệch chuẩn.
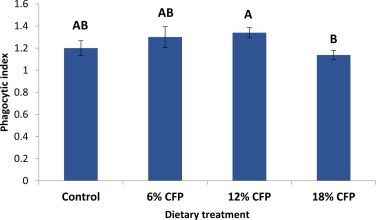
Hình 5. Chỉ số thực bào trong tế bào máu của tôm sau khi cảm nhiễm với Vibrio harveyi ở liều 5 × 104 CFU/ tôm. Các chữ cái khác nhau cho thấy sự khác biệt có ý nghĩa thống kê (P= 0,0187) giữa các khẩu phần ăn. Các thanh lỗi cho biết độ lệch chuẩn.
3.4.3. Hoạt tính phenoloxidase (PO)
Hoạt tính PO của tôm sau cảm nhiễm có thể được quan sát trong Hình 6. Hoạt tính PO cao nhất được thể hiện ở nhóm tôm được cho ăn 6% CFP, trung bình với 12% và 18% CFP và thấp nhất ở nghiệm thức đối chứng (P < 0,05).
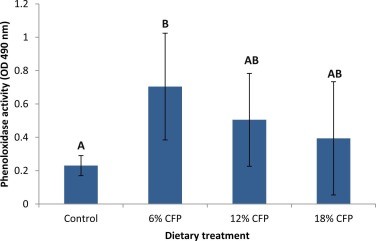
Hình 6. Hoạt tính phenoloxidase của tôm thí nghiệm sống sót sau khi cảm nhiễm với Vibrio harveyi ở liều 5 × 104 CFU/ tôm. Các chữ cái khác nhau cho thấy sự khác biệt có ý nghĩa thống kê (P<0,05) giữa các khẩu phần ăn. Các thanh lỗi cho biết độ lệch chuẩn.
4. Thảo luận
Nghiên cứu này đã chứng minh rằng protein lên men từ ngô (CFP) có thể đóng góp hiệu quả vào công thức thức ăn của tôm thẻ chân trắng L. Vannamei. Hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn của tôm được nuôi bằng CFP được nuôi trong ao bị nhiễm mầm bệnh nặng, bao gồm vi rút gây bệnh đốm trắng (WSSV) và bệnh hoại tử gan tụy cấp tính (AHPND) cho thấy hiệu suất tương tự với tôm nuôi trong ao bình thường và được cho ăn bằng thức ăn thức ăn thương mại được sử dụng thường xuyên ở Indonesia. Trên khắp châu Á, sản lượng tôm nuôi ở các khu vực AHPND đã giảm đáng kể (xuống 60%) và gây thiệt hại kinh tế lớn (Kua và cộng sự, 2016, Kumar và cộng sự, 2019, Lee và cộng sự, 2015; Shinn và cộng sự, 2018). Ngoài ra, nhiễm WSSV có thể gây chết 100% trong 2 – 10 ngày (Wu và cộng sự, 2005). Trong nghiên cứu này, mặc dù nhận được nguồn nước tương tự nhưng tôm nuôi trong ao C-2 và C-4 (12% CFP) cũng có hàm lượng NH3-N và NO2-N cao hơn trong suốt thời gian nuôi so với ao có khẩu phần ăn thương mại. Việc sản xuất thành công tôm đạt kích cỡ tiêu thụ có thể là do có sẵn men trong sản phẩm CFP kích thích phản ứng miễn dịch của tôm chống lại các tác nhân gây bệnh và môi trường. Các nghiên cứu trước đây từ McLean và cộng sự (2006) cho thấy rằng việc sử dụng protein dựa trên nấm men có thể chứng nhận hữu cơ thay thế thành phần FM trên cơ sở protein đơn vị sử dụng các ao thương mại có thể đạt được mức tăng trưởng tương đương với L. vannamei được cho ăn khẩu phần ăn tôm thương mại. Hơn nữa, nghiên cứu từ Chen và cộng sự (2020) đã chứng minh rằng việc bổ sung men thủy phân có tác động tích cực làm tăng khả năng kháng amoniac của tôm thẻ chân trắng L. Vannamei trong suốt thời gian nuôi. Do đó, các cuộc nghiên cứu này chỉ ra rằng việc sử dụng men kết hợp với các thành phần thay thế chi phí thấp có thể tăng cường sự tăng trưởng và tỷ lệ sống của tôm và đạt được hiệu suất tương tự hoặc tốt hơn với tôm được nuôi bằng các thành phần biển hoặc chi phí cao.
Trong môi trường được kiểm soát, hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn được đo bằng tăng trọng và FCR là điển hình cho tôm trong điều kiện thí nghiệm. Nghiên cứu trước đây đã chỉ ra rõ ràng rằng tôm thể hiện hiệu suất tổng thể vượt trội khi khẩu phần ăn bao gồm tới 18% protein lên men từ ngô (Novriadi và cộng sự, 2022, Davies và cộng sự, 2021, Davies và cộng sự, 2022). Nhiều nghiên cứu tương tự như vậy đã được báo cáo để đánh giá giá trị sinh học của DDGS và sản phẩm ngô cao cấp gần đây hơn, chẳng hạn như CFP, ở cả cá và tôm. Trước đây, Deng và cộng sự (2012) đã nghiên cứu tác động của một chất phụ gia dựa trên nấm men đối với sự tăng trưởng và phản ứng miễn dịch của tôm thẻ chân trắng cho thấy những tác động thuận lợi đối với năng suất như tăng sinh khối và chuyển đổi thức ăn.
Trong cuộc nghiên cứu này với L. vannamei, tất cả các thông số về năng suất đều được xác nhận trong các nghiên cứu đã báo cáo về loài này trong ngưỡng dự kiến. Ngoài ra, sau cảm nhiễm với mầm bệnh cụ thể V. harveyi, chúng tôi đã quan sát thấy bằng chứng mạnh mẽ rằng sản phẩm này có thể có hiệu quả trong việc tăng cường cơ chế phòng thủ và miễn dịch nói chung ở tôm chống lại nhiễm trùng. Thật thích hợp để quan sát rằng về số lượng, sự gia tăng tổng số lượng tế bào máu ở tôm được cho ăn với một số mức độ bao gồm CFP sau khi cảm nhiễm. Điều này có thể cho thấy mức độ dung nạp gây ra bởi chức năng của các thành phần chức năng chính trong sản phẩm thương mại, do đó có thể kích hoạt nhu cầu ngày càng tăng đối với hoạt động của tế bào máu do ngăn chặn các tác động của bệnh đối với các điều kiện viêm nhiễm.
Trong nghiên cứu này, mức độ thực bào trong hemolymp của tôm đã tăng lên đáng kể ở các nhóm được cho ăn CFP cho thấy có sự trung gian trực tiếp của hoạt động tế bào bẩm sinh đồng thời với chỉ số thực bào tổng thể cao hơn ở nhóm tôm được cho ăn CFP so với nhóm đối chứng. Điều này có thể được giải thích là khả năng của CFP để tăng cường các phản ứng bảo vệ tế bào ở tôm. Nghiên cứu từ Rairat và cộng sự (2022) đã chứng minh rằng hoạt động thực bào của tôm thẻ chân trắng L. vannamei tăng đáng kể ở nhóm tôm được cho ăn bằng khẩu phần ăn có bổ sung một số mức độ nucleotide có nguồn gốc từ nấm men và RNA có nguồn gốc từ nấm men so với khẩu phần ăn cơ bản. Kết quả của nghiên cứu hiện tại cũng phù hợp với quan sát được thực hiện bởi Pope và cộng sự (2011) trong đó các tế bào máu từ tôm được tiêm V. harveyi cho thấy mức độ thực bào tăng cao, những tình huống này dẫn đến khả năng tiêu diệt mầm bệnh nội bào ở tôm L. vannamei.
Hoạt tính PO gia tăng là một quan sát thú vị. Phần lớn hoạt tính PO (hơn 90%) là trong tế bào máu của tôm. Hoạt tính của enzyme có thể được bắt đầu bằng các thành phần chọn lọc của thành tế bào vi sinh vật, chẳng hạn như lipo-polysacarit (LPS) và-1,3-glucans, cho thấy sự liên quan trong quá trình không tự nhận biết. Chúng tôi biết rằng ngũ cốc lên men như ngô cũng sẽ chứa nấm men và các thành phần thành tế bào nấm men, đặc biệt là galactomannans và β-glucans giống như những thành phần được tìm thấy trong cấu trúc của các loại vi khuẩn (Soltanian và cộng sự, 2009). Do đó, các cơ chế tương tự có thể tồn tại để kích thích sự gia tăng chung của các hoạt động liên quan đến miễn dịch. Chúng tôi cũng thấy sự kích thích hoạt tính của enzyme PO trong L. vannamei nhận tất cả các khẩu phần ăn có chứa CFP. Những phát hiện tương tự đã được báo cáo đối với PO bởi các nhà nghiên cứu khác khi đánh giá các chất bổ sung thức ăn khác nhau cho tôm. Sự kích thích đáp ứng miễn dịch và liên quan đã được quan sát thấy ở tôm thẻ chân trắng bởi Xu và cộng sự (2021). Ảnh hưởng của β-1,3-glucan trong khẩu phần ăn đối với hiệu suất tăng trưởng, sử dụng thức ăn, khả năng chống oxy hóa và tình trạng miễn dịch của tôm thẻ chân trắng L. vannamei đã được báo cáo trước đó bởi Vargas-Albores và Yepiz-Plascencia (2000). Các nhà nghiên cứu này đã tuyên bố rằng protein liên kết β-glucan (BGBP) trong tôm có thể phản ứng với β-glucans và phức hợp glucan–BGBP. Điều này có thể gây ra thoái hóa cảm ứng và kích hoạt prophenoloxidaza (proPO). Tuy nhiên, Huang và cộng sự (2000) lại xem việc đo lường phenoloxidase như một dấu hiệu đánh giá khả năng miễn dịch ở tôm do sự thay đổi và không nhất quán của phản ứng với các chất kích thích trong khẩu phần ăn. Do đó, các nhà nghiên cứu này đã đề xuất xem xét lại việc xác định hoạt tính phenoloxidase ở tôm thẻ chân trắng L.vannamei
Tóm lại, nghiên cứu này đã chứng minh khả năng của một thành phần mới giàu protein có thể thay thế hiệu quả một số thành phần thức ăn thông thường chính trong khẩu phần ăn công thức cho tôm thẻ chân trắng L. vannamei và hỗ trợ giải quyết thách thức toàn cầu nhằm đáp ứng nhu cầu protein bằng một giải pháp thay thế bền vững. Ngoài ra, lợi ích của các phụ phẩm có nguồn gốc từ quá trình lên men như CFP để cải thiện sức khỏe của tôm đem lại lợi ích quan trọng về hiệu quả chi phí , giảm nhu cầu hóa trị liệu và kháng sinh , hạn chế thách thức về môi trường cũng như tình trạng kháng kháng sinh (AMR). Việc sử dụng các thành phần phụ phẩm ethanol sinh học đáp ứng nền kinh tế sinh học tuần hoàn và sản xuất nuôi trồng thủy sản có đạo đức. Cuối cùng, xét về lợi ích kinh tế, điều quan trọng là phải thực hiện một phương pháp có lợi ích chi phí để đánh giá lợi nhuận và lợi nhuận tăng lên khi tôm được cho ăn sản phẩm CFP có bổ sung tới 18% trong khẩu phần ăn, nhấn mạnh vào tăng sinh khối, hiệu quả chuyển đổi thức ăn, chi phí thức ăn và khả năng sống sót tổng thể như là yếu tố không thể thiếu. Điều này có tầm quan trọng tối cao trong các tình huống thực tế khi có bệnh mãn tính và khi các thành phần thức ăn chức năng đặc biệt như CFP giúp tôm kháng lại mầm bệnh và cải thiện phúc lợi vật nuôi.
Theo Romi Novriadi, Indah Istiqomah, Alim Isnansetyo, Derek Balk, Melissa Jolly-Breithaupt, Simon Davies
Nguồn: https://www.sciencedirect.com/science/article/pii/S2352513423001102
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phần 1: Việc Mất Cân Bằng Môi Trường Ao Nuôi Và Cân Bằng Nội Môi Hệ Vi Sinh Vật Đường Ruột Có Liên Quan Đến Sự Bùng Phát Bệnh Mờ Đục (TDP) Trên Hậu Ấu Trùng Tôm Thẻ Chân Trắng
- Phần 2: Việc Mất Cân Bằng Môi Trường Ao Nuôi Và Cân Bằng Nội Môi Hệ Vi Sinh Vật Đường Ruột Có Liên Quan Đến Sự Bùng Phát Bệnh Mờ Đục (TDP) Trên Hậu Ấu Trùng Tôm Thẻ Chân Trắng
- Hiện Trạng Sử Dụng Trứng Artemia Và Sản Xuất Bền Vững Trong Tương Lai

 English
English 中文 (中国)
中文 (中国)