Tóm tắt
Hệ thống lọc cát kiêm nuôi giun nhiều tơ (PASF) có 2 công dụng chính là loại bỏ chất dinh dưỡng từ nước thải ao nuôi thủy sản và sử dụng để sản xuất giun nhiều tơ. Giun nhiều tơ là loài được những người câu cá giải trí rất ưu chuộng. Đây còn là nguồn bổ sung dưỡng chất vào khẩu phần ăn để cải thiện khả năng sinh sản của tôm bố mẹ. Mặc dù nuôi giun nhiều tơ trong các hệ thống PASF giúp giảm tác động của việc khai thác tự nhiên, nhưng việc sử dụng nước thải từ các ao nuôi tôm như sú Penaeus monodon lại dẫn đến nguy cơ mất an toàn sinh học khi mầm bệnh có thể truyền và phát tán thông qua giun nhiều tơ. Để đánh giá nguy cơ lây truyền vi-rút hoại tử dưới vỏ và cơ quan tạo máu (IHHNV), các hệ thống PASF nhóm 3 hoặc 4 có nuôi giun cát (Perinereis helleri) sử dụng nước thải từ các ao P. monodon bị nhiễm IHHNV tải lượng cao hoặc tải lượng thấp. Bằng phương pháp TaqMan realtime qPCR đã xác định được mức nhiễm thấp của IHHNV (≤878 đoạn DNA IHHNV 200/ ng TNA) trong hầu hết các con giun từ các hệ thống PASF có nước thải từ ao tải lượng cao. IHHNV không được phát hiện hoặc phát hiện trong các giới hạn độ nhạy của xét nghiệm qPCR ở giun từ các luống được cung cấp nước thải từ ao tải lượng thấp. Đường ruột của giun thu hoạch được làm sạch trong nước biển tinh khiết trong 2 ngày làm giảm đáng kể tải lượng IHHNV. Việc chuyển các luống PASF sang nước biển sạch trong 8 tuần trước khi thu hoạch cũng làm giảm đáng kể tải lượng giun nhiễm IHHNV. Việc bổ sung lợi khuẩn hàng ngày lên bề mặt đáy cát trong 4 tuần trước khi sử dụng nước biển sạch không mang lại lợi ích rõ ràng nào trong việc loại bỏ IHHNV. Mặc dù giun nhiều tơ có khả năng mang IHHNV, nhưng các biện pháp khắc phục được được xem xét cho thấy tiềm năng cải thiện nguy cơ mang mầm bệnh của P. helleri.
1. Giới thiệu
Perinereis helleri (Polychaeta, Nereididae) là một loài giun cát biển ăn tạp phân bố rộng khắp khu vực Ấn Độ Dương- Thái Bình Dương. Các mẫu vật đã được ghi nhận từ đường bờ biển ở miền Bắc Úc (tiểu bang New South Wales đến Tây Úc), Philippines, Indonesia, rạn san hô Đảo Ambon, Ấn Độ, Chile, Quần đảo Marshall, Hawaii và Quần đảo Ryukyu (Okinawa) của Nhật Bản (Hutchings và cộng sự, 1991; Reish, 1956; Kohn và Orians, 1962; Okuda, 1940).
Chúng có màu nâu đỏ thẫm và có thể dài tới 200 mm (hoặc hơn), trọng lượng 2g tùy thuộc vào môi trường sống và nguồn thức ăn. Giữa đầu và đuôi của chúng có tới 139 đoạn giống hệt nhau về hình thái (Palmer, 2010), mỗi đoạn chi bên để vận động và hô hấp và một tập hợp các cơ quan cơ thể thiết yếu. Nếu bị tổn thương hoặc bị cắt cụt, sự nhân lên các thành phần cơ thể thiết yếu này thường tạo điều kiện cho sự sống sót và khả năng mọc cơ quan mới. Đầu giun có vòi và một cặp hàm săn mồi được sử dụng để bắt các mảnh thức ăn và được cấu tạo từ một loại protein có histidine (Broomell và cộng sự, 2008), và một cơ hầu họng với các đoạn paragnaths được lót bằng kitin giúp hỗ trợ đào hang và kiếm ăn. Phần phụ ở đầu chuyển thức ăn đến thực quản, sau đó chuyển sang ruột kéo dài đến hậu môn ở chóp đuôi.
Perinereis helleri sống ở nhiều loại đá vụn vỏ sò và bãi cát trong cả môi trường rạn san hô và rừng ngập mặn, thường định cư và đào hang ở những khu vực có trầm tích hiếu khí và kỵ khí hỗn hợp (Hutchings và cộng sự, 1991; Palmer, 2010). Giống như các loài Nereidids khác, nó là loài semelparous (chỉ sinh sản một lần trước khi chết) và thường được tìm thấy gần xảy ra ở vùng nước ngọt, nơi độ mặn dao động và giảm vừa phải (xem Prevedelli, 1991; Zipperle và Reise, 2005). Nó sống trong hang bằng chất nhầy trong suốt vòng đời và có thể tồn tại trong thời gian dài sau khi bị đưa ra khỏi môi trường sống tự nhiên (quan sát PJ Palmer).
Hệ thống lọc cát có nuôi polychaete (PASF) được báo cáo lần đầu tiên vào năm 2010 như một phương tiện loại bỏ chất dinh dưỡng từ nước thải ao nuôi tôm thủy sản, đồng thời cung cấp cho giun một nguồn thức ăn giàu chất dinh dưỡng (Palmer, 2010). Không giống như các hệ thống lọc cát thụ động khác, các luống PASF không cần phải xả ngược lại vì giun nhiều tơ ăn trên bề mặt cát, giúp loại bỏ và tiêu hóa vi tảo, mảnh vụn và các chất hữu cơ khác bão hòa và ngăn chặn sự xâm nhập của nước. Các luống PASF đã được chứng minh có khả năng loại bỏ tới 84% chất rắn lơ lửng, 92% chất diệp lục, 46% nitơ và 63% phốt pho từ nước thải ao nuôi tôm, vượt xa hiệu suất của các hoạt động xử lý nước thải hiện tại bằng cách sử dụng các ao lắng, giúp giảm đáng kể diện tích đất cần thiết cho việc này (Campos và cộng sự, 2002; Palmer, 2010; Palmer và cộng sự, 2014, 2016, 2018).
Mặc dù ngành tôm ở Úc chỉ sản xuất ~ 5000 tấn tôm nuôi hàng năm trị giá 86 triệu AUD trong năm 2016–17 (Mobsby, 2018), ngành này vẫn hỗ trợ hàng trăm việc làm ở các cộng đồng nông thôn và dự kiến sẽ tăng trưởng đáng kể (URL1). Hầu hết các trang trại tồn tại dọc theo bờ biển Queensland và chủ yếu nuôi tôm sú (Penaeus monodon) cũng như số lượng tôm Bạc Thẻ (Penaeus merguiensis) và tôm Kuruma (Penaeus japonicus) thấp hơn. Khi ngành công nghiệp chuyển đổi từ việc sử dụng tôm bố mẹ hoang dã sang loài gia hóa, các thành phần thức ăn được biết là thúc đẩy khả năng sinh sản của tôm bố mẹ ngày càng trở nên quan trọng. Việc sử dụng giun nhiều tơ bao gồm giun cát và giun máu đã được chứng minh là rất quan trọng cho mục đích này, vì giun sống có hiệu quả hơn so với giun đông lạnh khi được bổ sung vào khẩu phần ăn (Meunpol và cộng sự, 2005, 2007; Palmer và cộng sự, 2014, 2018). Với nhu cầu về giun nhiều tơ, hệ thống PASF rất hấp dẫn vì tiềm năng cung cấp các loại giun sống chất lượng nhất quán đáng tin cậy với chi phí hợp lý mà không ảnh hưởng đến quần thể hoang dã. Tuy nhiên, nếu các luống PASF được cho ăn bằng nước thải từ các ao sản xuất tôm, có nguy cơ giun ăn phải vật liệu có chứa mầm bệnh tiềm ẩn, chẳng hạn như vi-rút hội chứng đốm trắng (WSSV) hoặc vi-rút hoại tử cơ quan tạo máu và cơ quan biểu mô (IHHNV), và hoạt động như một vật mang vi-rút nếu được những người câu cá giải trí sử dụng làm mồi nhử hoặc như một chất bổ sung khẩu phần ăn để thúc đẩy khả năng sinh sản tôm bố mẹ (Vijayan và cộng sự, 2005; Haditomo và Chilmawati, 2012; Desrina và cộng sự, 2013; Desrina, 2014; Haryadi và cộng sự, 2014).
Ở đây, chúng tôi mô tả dữ liệu qPCR thời gian thực TaqMan kiểm tra tiềm năng của P. helleri được nuôi trong các luống PASF để tích tụ IHHNV từ chất bị ô nhiễm có trong nước thải ao nuôi tôm. Nghiên cứu tập trung vào IHHNV, một loại virus ssDNA nhỏ có giá trị thương mại cũng được mô tả là Penaeus stylirostris densovirus (PstDNV) được phân loại là loài điển hình của chi Penstyldensovirus trong phân họ Densovirinae của họ Parvoviridae (Saksmerprome và cộng sự, 2010; Rai và cộng sự, 2011; Tang và Lightner, 2002; Shike và cộng sự, 2000; King và cộng sự, 2012; Cotmore và cộng sự, 2014). Nghiên cứu đã sử dụng các luống PASF tiếp cận với nước thải từ các ao được sử dụng trong một thử nghiệm để xác định tác động của nhiễm IHHNV tải lượng cao đối với hiệu suất tăng trưởng và tỷ lệ sống sót của tôm sú (Sellars và cộng sự, 2019). Dữ liệu qPCR được sử dụng để nghiên cứu P. helleri như vật mang mầm bệnh IHHNV và các biện pháp khắc phục có thể được sử dụng trong các môi trường công nghiệp (ví dụ: thanh lọc ngắn hạn và dài hạn và men vi sinh) để cải thiện tỷ lệ giun PASF lây truyền IHHNV nếu được sử dụng làm mồi nhử hoặc làm thức ăn bổ sung cho tôm bố mẹ.
2. Vật liệu và phương pháp
2.1. Thiết kế và vận hành luống lọc cát có nuôi của Polychaete (PASF)
Một hệ thống PASF thử nghiệm kết hợp với luống cát có diện tích 10 × 54 m2, được cung cấp nước thải từ 2 ao thí nghiệm lót bạt 0,16 ha nuôi P. monodon (Hình 1). Các quy trình quản lý luống tiêu chuẩn đã được sử dụng (Palmer và cộng sự, 2016, 2018) ngoại trừ nước thải PASF liên tục được xả thay vì tuần hoàn trở lại ao. Hoạt động của PASF bắt đầu vào ngày 28/11/2016 (Ngày 0), khoảng 1 tháng (mo) sau khi thả ấu trùng vào ao như được mô tả dưới đây. P. helleri chưa trưởng thành (1 tháng tuổi) đã được thả xuống vào ngày 29 và 30 tháng 11 ở ~ 2350 con giun/ m2, giun phát triển với tốc độ phù hợp với các thử nghiệm trước đây sử dụng nước thải ao tôm làm nguồn dinh dưỡng và chất hữu cơ.
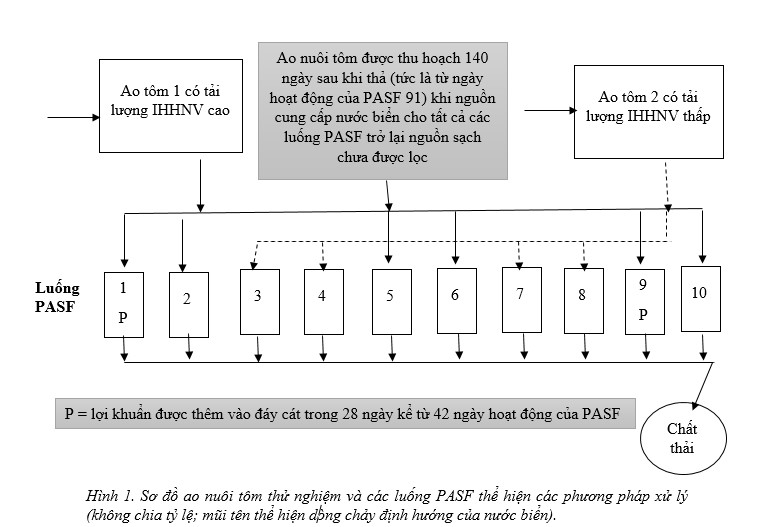
Nước thải ao nuôi tôm được phân phối đến mỗi luống PASF với khối lượng và tốc độ dòng chảy bằng nhau hàng ngày (~400 L/ m2/ ngày). Mô hình và tốc độ cung cấp nước trong quá trình hoạt động bình thường trong thời tiết khô hạn đòi hỏi đến việc phơi nắng bề mặt luống mỗi chiều giữa các dòng nước thải ban ngày.
Nước thải ao tôm 1 được cung cấp cho luống PASF 1, 2, 5, 6, 9 và 10, và nước thải ao tôm 2 được cung cấp cho PASF luống 3, 4, 7 và 8. Giun từ luống 3 đã được sử dụng trong các hoạt động chiết xuất TNA thí điểm, có thể việc cải tiến phương pháp chiết xuất (xem Phần 2.9) và sau đó bị loại khỏi phân tích dữ liệu. Từ ngày 9 tháng 1 năm 2017 (Ngày hoạt động của PASF 42), chế phẩm sinh học PondToss™ (Keeton Industries) đã được áp dụng cho luống 1, 5 và 9 bằng cách rắc bột khô (trộn đồng nhất với cát khô để có thể trải đều hơn) trên bề mặt luống mỗi chiều trước khi cấp nước thải buổi tối. Trong ứng dụng mới này, PondToss™ đã được áp dụng ở mức 0,08 g m2/ ngày, gấp 4 lần tỷ lệ được khuyến nghị sử dụng trong các ao nuôi trồng thủy sản (1 kg/ ha cứ sau 5 ngày), trong khoảng thời gian 4 tuần khi lượng chất bị ô nhiễm IHHNV trong nước thải ao 1 dự kiến sẽ cao. Điều này đã điều tra tiềm năng của việc sử dụng chế phẩm sinh học để giảm tải IHHNV trong giun vào thời điểm chúng có thể được thu hoạch trong các hoạt động nuôi tôm thương phẩm.
Vào ngày 27 tháng 2 năm 2017 (Ngày 91 hoạt động của PASF), tất cả các luống PASF đã được chuyển sang sử dụng nguồn nước biển sạch, chưa qua lọc từ các ao khô và được bổ sung gần đây, với tỷ lệ và mô hình cung cấp tương tự như được sử dụng với nước thải ao tôm tiếp tục trong 8 tuần (tức là cho đến Ngày 147).
2.2. Ao nuôi tôm
Mỗi ao nuôi tôm rộng 0,16 ha sâu 1,5 m, được lót hoàn toàn bằng nhựa polyetylen mật độ cao, được trang bị máy sục khí 2 bánh guồng để cung cấp lưu thông nước và sục khí, và chứa 2,4 ML nước. Các ao được duy trì trong điều kiện phát triển thương mại mô phỏng cho P. monodon và được thả giống với các lô tôm post (PL15) có nguồn gốc từ tôm bố mẹ đánh bắt tự nhiên được xác định bởi các phân tích qPCR thời gian thực của TaqMan vào các thời điểm khác nhau trước và sau khi sinh sản (Cowley và cộng sự, 2018) bị nhiễm IHHNV ở các mức độ nghiêm trọng khác nhau (Sellars và cộng sự, 2019). Do sự khác biệt về tải lượng IHHNV ở bố mẹ, nhóm tôm thả vào ao 1 nhanh chóng nhiễm IHHNV tải lượng cao với tỷ lệ hiện mắc 100% (Sellars và cộng sự, 2019). Ngược lại, nhóm tôm gia hóa thả vào Ao 2 chỉ đạt tỷ lệ nhiễm trùng 100% vào cuối đợt tăng trưởng và tải lượng nhiễm IHHNV vẫn ở tải lượng thấp đến trung bình. Nước thải được bơm không liên tục từ cống thoát nước của mỗi ao thông qua 2 hệ thống phân phối riêng biệt cung cấp tốc độ nước đo được cho các nhóm luống PASF khác nhau.
2.3. Tỷ lệ thấm nước thải qua các luống PASF
Tỷ lệ thấm nước cho tất cả các luống PASF đã được đánh giá vào ngày 8 tháng 2 năm 2017, 2 ngày sau khi ngừng sử dụng chế phẩm sinh học PondToss™ cho các luống 1, 5 và 9. Dữ liệu này được sử dụng như một phương tiện đại diện để xác định xem chế phẩm sinh học có đẩy nhanh quá trình phân hủy chất hữu cơ để có khả năng làm giảm lượng vật liệu có chứa IHHNV hay không. Sự thấm nước trước đây đã được chứng minh là tương quan với hàm lượng chất hữu cơ đáy cát (Palmer, 2010), và với tải lượng hạt hữu cơ tương đối cao trong nước thải ao, tốc độ thẩm thấu cao hơn qua PASF do không gian lỗ rỗng rõ ràng hơn sẽ hỗ trợ quá trình phân hủy nhanh. Tốc độ thẩm thấu tối đa có thể cho mỗi luống được đánh giá thể tích bằng cách áp dụng một đầu nước 60 cm trên toàn bộ luống (được đo tại điểm xả có lưới) và sau đó bằng cách đo thể tích nước thải ra trong khoảng thời gian 10 giây (ngoại suy đến L nước/ phút).
2.4. Lấy mẫu sâu, làm sạch, thanh lọc và bảo quản
Vào ngày 91 và 147 hoạt động của PASF, giun được lấy mẫu từ các luống được chọn bằng cách sử dụng xẻng để lật cát thừa trong một phần nhỏ trên luống. 30 con giun đầu tiên được nhìn thấy, không xét đến kích thước, đã được thu thập vào một cái xô chứa nước biển sạch. Để loại bỏ cặn và mảnh vụn chứa đầy chất nhầy, giun từ mỗi xô được lắng đọng vào các cái rây ẩm (lỗ vuông 4 mm) được đặt trên các thùng chứa 30 L nước biển sạch để lôi kéo chúng chui qua rây.
Giun được làm sạch và thanh lọc trong xô chứa nước biển có độ trong cao (lọc cát 10 μm, độ mặn 34–35 ppt, 26–27°C, pH 8,0–8,1). Để thanh lọc đường ruột của chúng, 15 con giun đã được làm sạch từ mỗi luống PASF đã được duy trì trong 2 ngày mà không cần cho ăn trong thùng 60 L chứa nước biển được sục khí nhẹ nhàng, nước biển chảy qua chậm (1 L/ phút).
Chỉ làm sạch hoặc làm sạch và thanh lọc giun từ các luống và nghiệm thức khác nhau được bảo quản trong 5 mL RNAlater™ (Ambion) trong 2 ngày ở 4° C trước khi chuyển sang tủ đông −20°C cho đến khi rã đông để chế biến.
2.5. Thiết kế thử nghiệm
Giun từ tất cả các luống PASF không nhận được men vi sinh đã được lấy mẫu vào ngày 27/2/2017 (Ngày hoạt động của PASF 91) ngay trước khi nguồn cung cấp nước thải ao nuôi tôm được thay đổi thành nước biển sạch. Các mẫu này cung cấp một nguồn tài nguyên so sánh tải lượng IHHNV chỉ trong những con giun đã được làm sạch hoặc làm sạch và thanh lọc được thu thập từ PASF luống 2, 6 và 10 hoặc luống 4, 7 và 8 được cung cấp nước thải lần lượt từ IHHNV tải lượng cao 1 hoặc IHHNV ao 2 tải lượng thấp. Vào ngày 24/4/2017 (Ngày hoạt động của PASF 147) khi các luống PASF đã nhận được nước biển sạch trong 8 tuần, 15 con giun được chọn ngẫu nhiên từ mỗi luống 2, 6 và 10 (mà không có chế phẩm sinh học nào được áp dụng), hoặc luống 1, 5 và 9 (mà chế phẩm sinh học đã được áp dụng trong 4 tuần cuối cùng, những luống này đã nhận được nước thải từ Ao 1 tải lượng cao IHHNV), một lần nữa được thu thập, làm sạch và bảo quản trong RNAlater. Các mẫu này cung cấp một nguồn tài nguyên để so sánh tải lượng IHHNV trong giun đã được làm sạch từ luống 2, 6 và 10 được lấy mẫu trước và sau khi được cung cấp nước biển sạch trong 8 tuần, và tương tự đối với giun đã được làm sạch từ luống 1, 5 và 9 được xử lý bằng men vi sinh vào thời điểm tỷ lệ hiện mắc IHHNV và tải lượng trong P. monodon được nuôi trong Ao 1 rất cao (Sellars và cộng sự, 2019). Nguồn cung cấp nước biển sạch trong 8 tuần cũng mô phỏng cách các luống PASF có thể được vận hành ở Úc với các ao nuôi tôm được thu hoạch tốt trước khi cần có giun sống trong khẩu phần ăn trưởng thành tôm bố mẹ.
2.6. Giải phẫu giun
Các giun nhiều tơ được bảo quản đã được mổ xẻ để cung cấp một loại mô và khối lượng được tiêu chuẩn hóa để chiết xuất tổng axit nucleic (TNA). Sau khi rã đông, giun được lấy ra khỏi RNAlater bằng kẹp vô trùng và sắp xếp trên một thớt sạch song song với thước kẻ để đo chiều dài của chúng (mm), sau đó thấm nhanh trên khăn giấy thấm để loại bỏ chất lỏng dư thừa. Một lưỡi dao mổ vô trùng sau đó đã được sử dụng để mổ xẻ các phần 5 mm (i) ngay sau đầu giun để tránh các bộ phận miệng cứng có thể ảnh hưởng đến quá trình chiết xuất hoặc chứa các hợp chất ức chế PCR và (ii) ở khu vực giữa của thân cơ thể, với các phần dài hơn một chút của khối lượng tương tự ước tính được mổ xẻ từ (iii) chóp đuôi bao gồm râu đuôi và hậu môn (Hình 2).
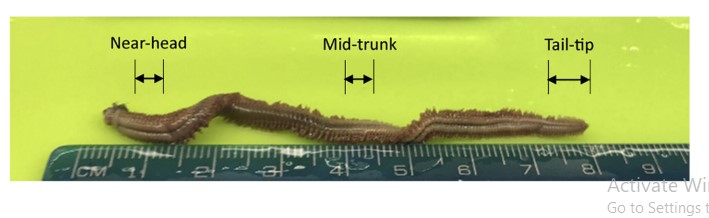
Hình 2. Hình ảnh của một perinereis helleri được bảo quản được nuôi trong luống PASF xác định các vùng gần đầu, giữa và đầu đuôi được sinh thiết để chiết xuất TNA và phân tích qPCR.
2.7. Tổng lượng chiết xuất axit nucleic (TNA = DNA + RNA)
Các phần mô sinh thiết được chuyển vào giếng của một đĩa 96 giếng nằm trên đá. TNA sau đó được chiết xuất bằng bộ RNA MagJET (Thermo Scientific) bằng cách sử dụng phương pháp được sửa đổi một chút từ các hướng dẫn do nhà sản xuất chỉ định, bao gồm bỏ qua bước tiêu hóa DNase 1 (Sellars và cộng sự, 2019). Tóm lại, bộ đệm RLT (QIAGEN) đã được thêm vào và các mô bị phá vỡ do đập hạt trong 90 giây trong Retsch MM300 TissueLyser (Dụng cụ MEP). Đĩa được ly tâm ở tốc độ 3000 vòng/ phút trong 5 phút để tạo thành các mảnh vụn và tạo bọt. Chất siêu lỏng Lysate sau đó được xử lý bằng Bộ xử lý hạt từ tính KingFisher Flex và TNA được loại bỏ khỏi các hạt từ tính trong nước không chứa 80 μL RNase/ DNase. Một aliquot 2 μL của eluate đã được phân tích bằng máy đo quang phổ UV Nanodrop ND8000 (Thermo Scientific) để định lượng năng suất và độ tinh khiết của TNA. Một aliquot của mỗi TNA đã được chuẩn hóa trong một tấm mới thành 50 ng/ μL bằng cách sử dụng nước không có RNase, và các đĩa dự trữ và TNA chuẩn hóa được bảo quản ở -80°C.
2.8. Phát hiện và định lượng DNA IHHNV bằng thử nghiệm qPCR thời gian thực TaqMan
DNA IHHNV trong mỗi mẫu TNA chuẩn hóa được phát hiện và định lượng bằng cách sử dụng xét nghiệm thời gian thực IHHNV q309 TaqMan như được mô tả trước đây (Cowley và cộng sự, 2018) ngoại trừ khuếch đại 20 μL thể tích phản ứng. Tóm lại, mỗi PCR (25 μL) bao gồm 12,5 μL 2 x SensiFAST™ thăm dò Lo-ROX mastermix (Bioline), 4 μL DNA (200 ng) mẫu, 1,25 μL (0,9 μM) mỗi mồi IHHNV-q309F1 và IHHNV-q309R1, 1,25 μL (0,25 μM) Đầu dò TaqMan IHHNV-q309Pr1 và 4,75 μL nước. Một aliquot 20 μL của mỗi PCR đã được khuếch đại trong đĩa PCR 384 giếng bằng cách sử dụng hệ thống qPCR Viia7 (Hệ thống sinh học ứng dụng) sử dụng 40 chu kỳ của cấu hình chu kỳ nhiệt tiêu chuẩn (Cowley và cộng sự, 2018). Các pha loãng nối tiếp gấp 10 lần của mẫu dsDNA IHHNV tuyến tính tổng hợp của các bản sao được tính toán từ 800.000 đến 0,8 bản sao cho mỗi phản ứng cũng được phân tích trong mỗi đĩa để tạo ra một đường cong tiêu chuẩn mà từ đó giá trị ngưỡng chu kỳ (Ct) có thể được chuyển đổi thành IHHNV dsDNA sao chép 200 ng TNA bằng phần mềm QuantStudio v1.3 (Thermo Fisher Scientific; Cowley và cộng sự, 2018).
2.9. Phương pháp chiết xuất TNA và qPCR sửa đổi
Năng suất TNA trong các lần chiết xuất mô thí điểm ban đầu thay đổi rõ rệt (3,8 đến 403,0 ng/ μL) và UV (A260/280 nm; Tỷ lệ quang phổ A260/ 230 nm) xác định độ tinh khiết của nhiều mẫu năng suất thấp là không lý tưởng. Các giá trị CT của IHHNV được xác định bằng xét nghiệm qPCR cũng cao hơn mức lý tưởng, với nhiều giá trị đạt đến giới hạn phát hiện thử nghiệm trong đó độ chính xác kỹ thuật trở nên kém tin cậy hơn. Chiết xuất TNA lặp đi lặp lại bằng cách sử dụng lượng mô xấp xỉ gấp đôi kết hợp với thể tích nước bị giảm từ 80 xuống 60 μL gây khó khăn cho việc khai thác trầm trọng hơn do tăng độ nhớt lysate mô càng ảnh hưởng đến năng suất và tính đồng nhất của TNA. Để khắc phục vấn đề này, một aliquot của mỗi lysate mô đã được pha loãng 6 đến 8 lần với dung dịch đệm Lysis (thể tích cuối cùng 800 μL) trước khi chiết xuất. Điều này dẫn đến năng suất TNA được cải thiện đáng kể, độ tinh khiết và tính đồng nhất giữa các chiết xuất mô giun (46–184 ng/ μL).
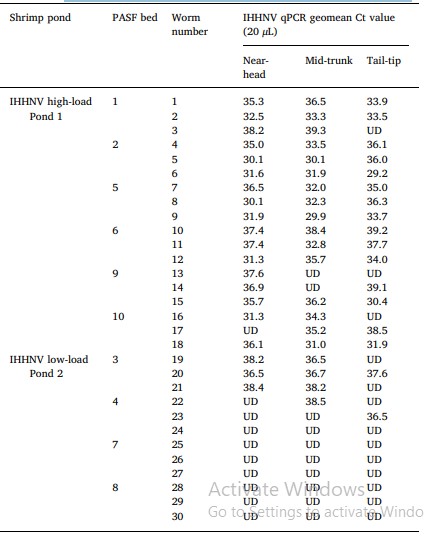
Dữ liệu qPCR của IHHNV về các vùng gần đầu, giữa thân và chóp đuôi của 30 con giun được thử nghiệm trong 2 nghiên cứu thí điểm (để xác định các phương pháp phân tích mạnh mẽ) đã xác định không có sự khác biệt đáng kể về lượng DNA IHHNV giữa các phần khác nhau của cùng một con giun (Bảng 1). Dựa trên phát hiện này cùng với năng suất và độ tinh khiết TNA được cải thiện bằng cách sử dụng lượng lysate mô pha loãng, chiết xuất TNA đã được tiêu chuẩn hóa để sử dụng một lượng mô được cân và giảm (40–60 mg) được mổ xẻ từ khu vực ngay sau đến đầu giun.
Bảng 1. Dữ liệu qPCR về sự hiện diện và tải lượng DNA IHHNV trong các phần mô gần đầu, giữa thân và đầu đuôi bao gồm theo dõi đường tiêu hóa của các nhóm 18 hoặc 12 con giun được lấy mẫu từ các luống PASF cung cấp nước thải từ ao 1 hoặc 2 nuôi P. monodon với nhiễm IHHNV tải lượng cao hoặc thấp.
2.10. Phân tích thống kê
Đối với những con giun được phát hiện có DNA IHHNV bằng phương pháp qPCR, một trung bình địa lý (trung bình hình học) của tải lượng DNA IHHNV của chúng (đoạn dsDNA IHHNV/ 200 ng TNA) được xác định cho mỗi nghiệm thức được lấy mẫu tại mỗi thời điểm kiểm tra. Dữ liệu được phân tích bằng cách sử dụng mô hình tuyến tính tổng quát có điều kiện gồm 2 phần (GLM; McCullagh và Nelder, 1989, MacNeil và cộng sự, 2009) trong GenStat, 2018. Phần 1 đã sử dụng GLM nhị thức với hàm liên kết logit để xác định % giun dương tính và Phần 2 sử dụng gamma GLM có điều kiện với liên kết nhật ký để đánh giá tải IHHNV giới hạn ở giun dương tính qPCR. Tỷ lệ thấm nước trung bình không được chuyển đổi được so sánh bằng cách sử dụng ANOVA 1 chiều.
Theo Siyi Liu, Min Rao, Jeff A. Cowley, Jess A.T. Morgan, Andrew C. Barnes, Paul J. Palmer
Nguồn: https://sci-hub.hkvisa.net/10.1016/j.aquaculture.2020.735560
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phương Pháp Mới Có Giá Trị Trong Việc Phát Hiện Virus Hội Chứng Đốm Trắng
- Đối Mặt Với Nhu Cầu Nuôi Hải Sản Bền Vững Ngày Càng Tăng, Oman Cho Thử Nghiệm Nguồn Nước Nuôi Tôm Trên Sa Mạc
- Nấm Men Biến Đổi Gen – Nguồn Astaxanthin Đầy Hứa Hẹn Cho Thức Ăn Tôm

 English
English 中文 (中国)
中文 (中国)