Tóm tắt
Nghiên cứu này đánh giá hiệu quả của ba loại chất nền thực vật: cám lúa mì (WB), cám yến mạch (OB) và hạt rau dền (AS) đối với chất lượng nước, thành phần biofloc và năng suất của tôm thẻ chân trắng Penaeus vannamei trong giai đoạn tiền tăng trưởng. Thí nghiệm kéo dài 5 tuần. Các thông số chất lượng nước (nhiệt độ, pH, độ mặn và oxy hòa tan) được theo dõi 2 lần/ngày; các hợp chất nitơ (TAN, NO2-N, NO3-N) và tổng chất rắn lơ lửng (TSS) được ghi lại hàng tuần. Tăng trọng và tỷ lệ sống của cá con được theo dõi mỗi tuần. Thành phần hóa học của biofloc và hàm lượng vi khuẩn dị dưỡng được ghi lại vào cuối thử nghiệm. Kết quả cho thấy không có sự khác biệt đáng kể về thông số chất lượng nước hoặc hợp chất nitơ giữa các nhóm. TSS cao hơn ở nhóm sử dụng chất nền so với đối chứng. WB ở nhóm xử lý cho thấy hàm lượng vi khuẩn dị dưỡng cao nhất. Chất hữu cơ trong bioflocs dao động từ 58,3 đến 62,4%, protein từ 33,4 đến 37,6%, lipid từ 0,4 đến 0,5% và carbohydrate từ 17,1 đến 25,5%, không có sự khác biệt đáng kể giữa các nghiệm thức. Trọng lượng cuối cùng trung bình dao động từ 1,10 đến 1,38 g, tốc độ tăng trưởng cụ thể từ 5,83 đến 6,43%/ngày, cao nhất ở nhóm OB. Trọng lượng cuối cùng trung bình dao động từ 1,10 đến 1,38 g, tốc độ tăng trưởng cụ thể từ 5,83 đến 6,43%/ngày, cao nhất ở nhóm OB. Hệ số chuyển hóa thức ăn thay đổi từ 0,92 đến 1,20 với giá trị OB thấp nhất so với đối chứng. Kết quả cho thấy việc bổ sung chất nền không có tác động tiêu cực đến chất lượng nước nhưng có tác động tích cực đến phản ứng năng suất của tôm trong thời kỳ tiền trưởng thành, trong đó cám yến mạch là thích hợp nhất.
Giới thiệu
Mặc dù đạt hơn 73,8 triệu tấn vào năm 2014 (FAO, 2016), sản lượng tôm thẻ chân trắng thường xuyên bị ảnh hưởng bởi các dịch bệnh như WSSV và EMS. Ví dụ, bang Sonora, Mexico, đã chứng kiến sản lượng giảm từ 80.000 tấn xuống còn 35.000 tấn chỉ trong năm 2013.
Một trong những giải pháp thay thế đa dạng được triển khai trên toàn thế giới để đối mặt với vấn đề này là sử dụng các hệ thống khép kín hoặc bán kín an toàn sinh học. Hệ thống này giúp kiểm soát dịch bệnh hiệu quả hơn nhờ khả năng tuần hoàn và thay nước thấp hoặc không thay nước. Hầu hết các hệ thống này hiện đang kết hợp công nghệ biofloc (BFT) sử dụng sinh khối vi sinh vật để duy trì chất lượng nước, cung cấp dinh dưỡng và tăng cường sức khỏe cho tôm.
Công nghệ Biofloc sử dụng hiệu quả sinh khối vi sinh vật liên quan đến chất nền cố định hoặc nổi để mang lại nhiều lợi ích so với các công nghệ truyền thống bao gồm giảm lượng nước cần thiết và kiểm soát mầm bệnh.
Bioflocs có thể được hình thành mà không cần cung cấp thêm chất nền, vì một số vi khuẩn có thể sử dụng các hạt nổi trong nước (phân, xác tôm, thức ăn thừa) để phát triển. Tuy nhiên, việc bổ sung chất nền với tỷ lệ thích hợp có thể giúp biofloc phát triển nhanh hơn. Cần lưu ý rằng tổng lượng chất rắn lơ lửng không được vượt quá mức an toàn để tránh gây ra sự cố trong hệ thống.
Thành phần sinh hóa của biofloc có thể thay đổi tùy thuộc vào thời gian nuôi cấy, điều kiện canh tác, sinh vật nuôi, tỷ lệ và nguồn carbon và nitơ cũng như chất nền được sử dụng.
Chất xơ thực vật là nguồn cung cấp carbon quan trọng cho vi sinh vật tạo biofloc. Các nguyên liệu đa dạng từ nguồn gốc thực vật đã được sử dụng làm chất nền cho biofloc, bao gồm cám lúa mì, bã nhà máy bia, bã mía, v.v. Biofloc có hàm lượng protein cao (23-38%) và lipid (8%) và giàu axit béo omega-3 (PUFA) và axit béo omega-6 (HUFA), giúp bổ sung dinh dưỡng cho tôm và các sinh vật thủy sản khác.
Nghiên cứu này được thực hiện để đánh giá tác động của việc bổ sung ba chất nền thực vật khác nhau lên thành phần sinh hóa gần đúng của biofloc, đến chất lượng nước của hệ thống và phản ứng năng suất của tôm nuôi thâm canh.
Chuẩn bị nghiên cứu
Nghiên cứu được thực hiện trong 36 ngày tại đơn vị nuôi trồng thủy sản của Đại học Estatal de Sonora, Mexico. Một thiết kế thử nghiệm hoàn toàn ngẫu nhiên và một yếu tố với ba lần lặp lại cho mỗi lần điều trị đã được thực hiện. Các nghiệm thức bao gồm ba chất nền nổi thực vật khác nhau được thêm vào cột nước: cám lúa mì (WB), hạt rau dền (AS) và cám yến mạch (OB), được so sánh với đối chứng (C) không có chất nền.
Đơn vị thí nghiệm là các bể nhựa có thể tích hoạt động là 200 L. Nước biển (độ mặn 36‰) được lọc (5µ), khử trùng bằng clo (1 ppt) và trung hòa bằng amoni thiosulfate. Một ngày trước khi bắt đầu thí nghiệm, các bể đã được đổ đầy nước và mức độ của các biến số môi trường chính đã được điều chỉnh. Nhiệt độ của nước được duy trì ở khoảng 28°C với bộ gia nhiệt titan Via Aqua (150 W, 110-120 V; bao gồm bộ điều chỉnh nhiệt), chu kỳ quang là 12:12. Sục khí liên tục được cung cấp bằng máy thổi điện (Nước ngọt; Hệ sinh thái thủy sinh 1/3 HP, 115 V) được trang bị bộ lọc không khí, để đạt được mức oxy hòa tan (DO) trên 5 mg/L. Trong quá trình thí nghiệm, độ mặn được duy trì bằng cách thay thế lượng nước mất do bay hơi bằng nước ngọt đã khử trùng.
Mỗi đơn vị thí nghiệm được thả 200 tôm post (1.000 tôm post/ m3) Penaeus vannamei (12 con, với trọng lượng trung bình là 12 mg). Tôm post được cho ăn ba lần một ngày bằng khẩu phần thương mại (Agribrand Purina 35% CP). Tỷ lệ cho ăn được điều chỉnh ở mức 20% tổng sinh khối mỗi ngày khi bắt đầu thử nghiệm, giảm dần xuống còn 15% vào cuối thử nghiệm. Vào ngày 1, 7 và 14, mỗi đơn vị được cung cấp chất nền tương ứng với tỷ lệ 0,15 g/L để thúc đẩy sự hình thành biofloc. Cung cấp thêm đường chưa tinh luyện để đạt tỷ lệ C:N khoảng 12:1.
Trong quá trình bổ sung cơ chất (ngày 1, 7 và 14), thành phần dinh dưỡng của cơ nền được coi là duy trì tỷ lệ C:N khoảng 12:1. Vì vậy, lượng đường bị hạn chế trong các nghiệm thức chất nền. Trong tính toán, thành phần dinh dưỡng của các chất nền được xem xét như sau: cám lúa mì (protein 16,2%, lipid 0,4%, carbohydrate 30,0% và chất xơ 38,0%; Nascimento và cộng sự, 2014); rau dền (protein 65,6%, lipid 0,9%, carbohydrate 7,7% và chất xơ 22,4%; Chen và cộng sự, 1988); và cám yến mạch (protein 5,5%, lipid 1,0%, carbohydrate 56,6% và chất xơ 26,4%; Nascimento và cộng sự, 2014).
Các biến chất lượng nước chính được theo dõi hai lần một ngày. Nhiệt độ và DO bằng máy đo DO kỹ thuật số YSI model 55 và độ pH với máy đo pH kỹ thuật số Denver. Tổng chất rắn lơ lửng được ghi lại hàng tuần theo phương pháp 8006 (Hach, 2007) sử dụng máy quang phổ Hach DR/2800. Thiết bị tương tự được sử dụng để xác định tổng nitơ amoni (TAN) bằng phương pháp salicylat (855), nitrit bằng phương pháp diazot hóa (8507), và nitrat bằng phương pháp khử và diazot hóa (8171); những phép đo này được thực hiện hàng tuần.
Vào cuối cuộc thử nghiệm, các mẫu bioflocs từ mỗi đơn vị thí nghiệm được thu thập bằng cách sử dụng nón Imhoff; sau đó chất biofloc được khử nước trong bếp kỹ thuật số Shell Lab ở 70°C trong 72 giờ. Thành phần sinh hóa được đánh giá như sau: độ ẩm theo chênh lệch trọng lượng sau khi khử nước; tro bằng cách nung trong lò muffle và có tính đến chênh lệch trọng lượng; protein bằng phương pháp micro-Kjeldahl theo kỹ thuật 8075 của máy quang phổ Hach DR2800; lipid được đo bằng thiết bị Soxtec Avanti 800, với ete dầu mỏ làm dung dịch chiết. Carbohydrate (CHO) được tính bằng chênh lệch theo phương trình sau: % CHO = (100 – [protein (%) + lipid (%) + tro (%)]) / (100)
Các mẫu nước từ mỗi đơn vị thí nghiệm được thu thập vào cuối thí nghiệm, trong túi nhựa tiệt trùng (Whirl-PakMR) để thực hiện phân tích vi khuẩn bằng cách phân tán bề mặt trong môi trường thạch biển (môi trường 226, DIFCOMR) theo phương pháp của Greenberg và cộng sự (1992). Các đĩa được ủ ở 30 ± 2°C trong 24 giờ. Các khuẩn lạc được đếm và biểu thị bằng đơn vị hình thành khuẩn lạc trên mililit (CFU/ mL).
Một mẫu gồm 20 con tôm từ mỗi đơn vị được thu thập hàng tuần để đánh giá các thông số sản xuất và cân trên cân phân tích Scientech (ZSA 210), để tính trọng lượng trung bình trong mỗi lần xử lý. Vào cuối cuộc thử nghiệm, tỷ lệ sống được ghi lại bằng cách đếm số tôm từ mỗi đơn vị.
Tốc độ tăng trưởng cụ thể được tính như sau:
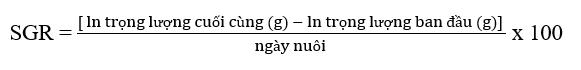
Tỷ lệ chuyển đổi thức ăn được ước tính là:
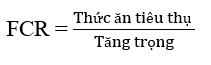
Đối với các phân tích thống kê, tất cả dữ liệu được gửi tới các thăm dò về tính quy phạm và tính đồng nhất của phương sai. Khi họ vượt qua cả hai đầu dò, ANOVA một chiều được thực hiện để phát hiện sự khác biệt giữa các nghiệm thức. Khi sự khác biệt là đáng kể, thử nghiệm Tukey đã được áp dụng (Tukey, 1949) để sắp xếp và xếp hạng các phương tiện. Những phân tích này được thực hiện bằng cách sử dụng phần mềm Statistica 5.1 cho Windows (Statsoft Inc.®).
Kết quả
Không có sự khác biệt đáng kể nào được tìm thấy trong các biến số chất lượng nước cơ bản giữa các nghiệm thức (Bảng 1). Nhiệt độ trung bình dao động từ 27,7 đến 28,0°C và lượng oxy hòa tan dao động từ 5,0 đến 5,3 mg/ L. Giá trị pH được ghi nhận từ 8,1 đến 8,2.
Bảng 1. Giá trị trung bình và (phạm vi) của các biến chất lượng nước cơ bản được ghi lại trong các nghiệm thức và đối chứng trong quá trình thử nghiệm. DO: oxy hòa tan, TSS: tổng chất rắn lơ lửng, C: đối chứng, WB: cám lúa mì, AS: hạt rau dền, OB: cám yến mạch. Chỉ số trên khác nhau trong một cột có nghĩa là sự khác biệt có ý nghĩa ở mức P < 0,05.
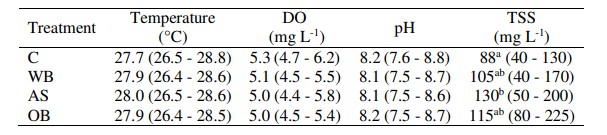
Tổng chất rắn lơ lửng cao hơn đáng kể trong các nghiệm thức bằng chất nền so với đối chứng. Nồng độ trung bình cao hơn được ghi nhận ở hạt rau dền xử lý (AS) (130 mg/L) và thấp nhất ở đối chứng (88 mg/L).
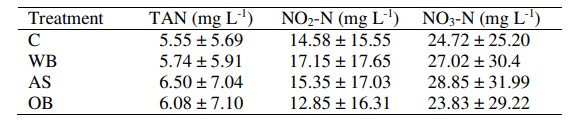
Trong tất cả các nghiệm thức, hàm lượng nitơ amoni tổng số (TAN) tăng lên từ đầu thí nghiệm, với mức trung bình tối đa (14-17 mg/L) giữa ngày 14 và 21, sau đó giảm xuống 1 mg/L vào ngày 28, được duy trì cho đến khi kết thúc thí nghiệm (Hình 1). Hàm lượng NO2-N tăng từ ngày 14 lên ngày 28, sau đó giảm nhẹ về cuối nghiên cứu. Nồng độ NO3-N tăng từ ngày 14 đến cuối nghiên cứu. Thử nghiệm ANOVA cho thấy không có sự khác biệt đáng kể giữa các phương pháp điều trị. Giá trị trung bình toàn cầu của TAN thay đổi từ 5,5 mg/ L (đối chứng) đến 6,5 mg/ L (nghiệm thức AS) (Bảng 2). Giá trị trung bình cao nhất của NO2-N (17,1 mg/L) được ghi nhận ở nghiệm thức WB và thấp nhất (12,8) ở nghiệm thức OB. Giá trị trung bình cao nhất của NO3-N được quan sát thấy ở nghiệm thức AS (28,8 mg/ L) và thấp nhất ở nghiệm thức OB (23,8 mg/ L).
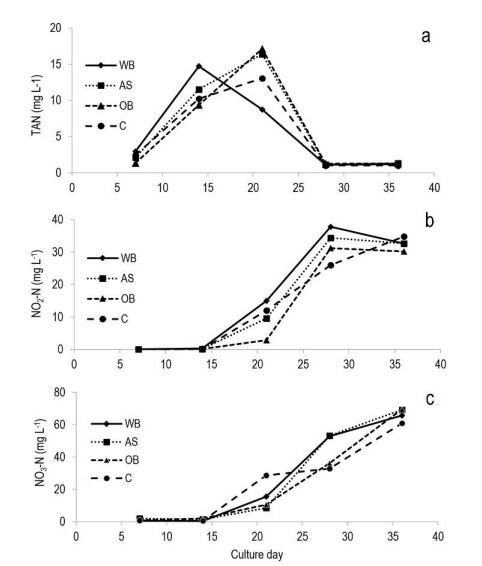
Hình 1. Giá trị trung bình của a) tổng nitơ amoniac, b) nitơ nitrit và c) nitơ nitrat (mg/ L) trong quá trình thí nghiệm. WB: cám lúa mì, AS: hạt rau dền, OB: cám yến mạch, C: đối chứng.
Bảng 2. Giá trị trung bình (± SD) của các hợp chất chứa nitơ được ghi nhận ở các nghiệm thức và đối chứng trong quá trình thử nghiệm. TAN: tổng nitơ amoni, C: đối chứng, WB: cám lúa mì, AS: hạt rau dền, OB: cám yến mạch. Không có cột nào có sự khác biệt đáng kể được xác định ở mức P < 0,05.
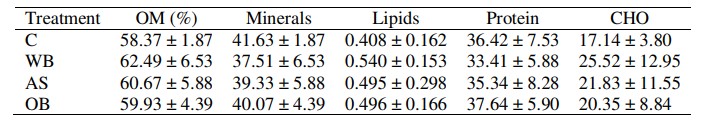
Bảng 3. Thành phần sinh hóa gần đúng (% chất khô; trung bình ± SD) của biofloc được lấy mẫu ở các nghiệm thức và đối chứng khi kết thúc thử nghiệm. OM: chất hữu cơ, CHO: carbohydrate, C: đối chứng, WB: cám lúa mì, AS: hạt rau dền, OB: cám yến mạch. Không có cột nào có sự khác biệt đáng kể được xác định ở mức P < 0,05.
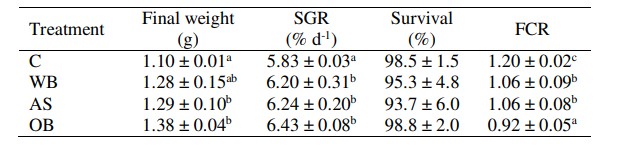
Bảng 4. Các thông số sản xuất (trung bình ± SD) của tôm thẻ chân trắng nuôi ở nghiệm thức và đối chứng. OM: chất hữu cơ, C: đối chứng, WB: cám lúa mì, AS: hạt rau dền, OB: cám yến mạch. Chỉ số trên khác nhau trong một cột có nghĩa là sự khác biệt có ý nghĩa ở mức P < 0,05. SGR: tốc độ tăng trưởng cụ thể, FCR: hệ số chuyển đổi thức ăn.
Liên quan đến thành phần sinh hóa gần giống bioflocs, không có sự khác biệt đáng kể về chất hữu cơ hoặc bất kỳ chất dinh dưỡng nào giữa các nghiệm thức (Bảng 3). Hàm lượng chất hữu cơ trung bình dao động từ 58,4% ở nghiệm thức đối chứng đến 62,5% ở nghiệm thức WB. Hàm lượng protein dao động từ 33,4% ở WB đến 37,6% ở OB. Nồng độ lipid thay đổi từ 0,4% ở đối chứng đến 0,5% ở WB. Hàm lượng CHO dao động từ 17,1% ở đối chứng đến 25,5% ở WB.
Sự phong phú của vi khuẩn dị dưỡng liên quan đến bioflocs khi cám lúa mì được sử dụng làm chất nền trung bình là 9,120×106 CFU/ mL, một giá trị cao hơn đáng kể so với 3,4×106 CFU/ mL được ghi nhận trong đối chứng và hai nghiệm thức khác (Hình 2).
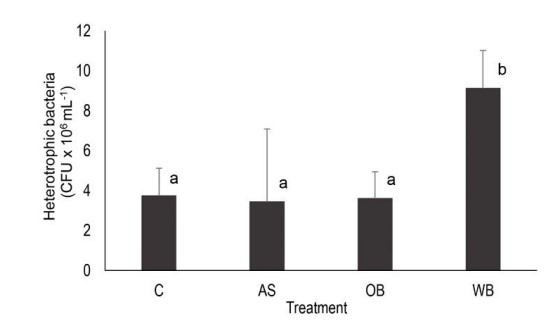
Hình 2. Sự phong phú của vi khuẩn dị dưỡng liên quan đến biofloc trong các nghiệm thức và đối chứng. C: đối chứng, AS: hạt rau dền, OB: cám yến mạch, WB: cám lúa mì. Chữ cái khác nhau trong các thanh biểu thị sự khác biệt đáng kể ở P <0, 05.
Một số khác biệt đã được quan sát thấy trong phản ứng sản xuất của tôm giữa các nghiệm thức (Bảng 4). Tỷ lệ sống dao động từ 93,7% ở đối chứng đến 98,8% ở OB, nhưng sự khác biệt không đáng kể. Trọng lượng cuối cùng và SGR cao hơn đáng kể ở OB (lần lượt là 1,38 g và 6,43%/ngày), so với đối chứng (1,10 g và 5,83%/ngày). FCR thấp hơn đáng kể ở OB (0,92) so với hai chất nền khác (1,06), vẫn thấp hơn so với đối chứng (1,20).
Thảo luận
Việc bổ sung các chất nền thực vật không ảnh hưởng đáng kể đến chất lượng nước. Các biến số chính (pH, DO, TSS) trong tất cả các nghiệm thức và đối chứng đều nằm trong phạm vi phù hợp cho nuôi tôm thâm canh. Xu hướng của các hợp chất chứa nitơ (TAN, NO2-N và NO3-N) được ghi nhận trong thí nghiệm cũng tương tự như các nghiên cứu trước đây. TAN tăng trong những ngày đầu tiên, sau đó chuyển hóa thành NO2-N và NO3-N bởi vi khuẩn oxy hóa amoniac và nitrit.
Loại chất nền được thêm vào có ảnh hưởng đáng kể đến nồng độ vi khuẩn dị dưỡng liên quan đến biofloc. Cám lúa mì thúc đẩy sự phát triển của vi khuẩn dị dưỡng mạnh nhất, gấp 3 lần so với đối chứng và các chất nền khác.
Thành phần sinh hóa của biofloc tương tự nhau ở tất cả các nghiệm thức và đối chứng. Lượng chất hữu cơ trong WB lớn hơn một chút, có thể là do mật độ vi khuẩn cao hơn. Hàm lượng protein cao hơn một chút trong OB, do hàm lượng protein cao hơn của cám hạt rau dền. Hàm lượng lipid trong biofloc thấp ở tất cả các nghiệm thức, dao động từ 0,4 đến 0,5%. Các nghiên cứu đa dạng đã chỉ ra rằng hàm lượng lipid có thể rất khác nhau trong biofloc, tùy thuộc vào nhiều yếu tố như nguồn carbon (Brito và cộng sự, 2016) và loại vi khuẩn liên quan (Martínez-Córdova và cộng sự, 2015). Ở đây, hàm lượng lipid trong biofloc dựa trên vi khuẩn dị dưỡng thường thấp (Xu & Pan, 2012; Long và cộng sự, 2015), trong khi hàm lượng lipid trong biofloc quang tự dưỡng cao hơn (Becerra-Dorame và cộng sự, 2012), chủ yếu là do sự đóng góp của các loại vi tảo đa dạng bao gồm cả tảo cát, những nguồn cung cấp thêm PUFA và HUFA (Martins và cộng sự, 2016).
Tỷ lệ sống của tôm trong tất cả các nhóm nghiên cứu đều cao hơn 93%, tương tự như kết quả mà Xu và cộng sự (2018) đã báo cáo trong hệ thống biofloc. Tôm trong nhóm thí nghiệm OB (nuôi bằng biofloc) có trọng lượng cuối cùng và tốc độ tăng trưởng (SGR) cao hơn đáng kể so với nhóm đối chứng (nuôi truyền thống). Ví dụ, Kim và cộng sự (2014) cũng ghi nhận ấu trùng P. vannamei tăng trưởng nhiều hơn trong hệ thống biofloc (BFT) so với hệ thống nuôi truyền thống.
Tương tự, Emerenciano và cộng sự (2012) báo cáo mức tăng trưởng cao hơn ở tôm Farfantepenaeus brasiliensis nuôi trong môi trường biofloc so với nước sạch. FCR của nhóm OB thấp hơn so với nhóm đối chứng, cho thấy hiệu quả sử dụng thức ăn tốt hơn. FCR cũng được chấp nhận đối với hai chất nền còn lại và tốt hơn so với FCR thu được ở đối chứng. Brito và cộng sự (2016) và Becerra-Dorame và cộng sự (2012) cũng ghi nhận FCR thấp hơn ở tôm P. vannamei nuôi trong hệ thống BFT.
Việc bổ sung chất nền thực vật vào môi trường nuôi tôm có thể thúc đẩy sự phát triển của vi khuẩn có lợi, dẫn đến cải thiện các thông số năng suất. Một số chất xơ trong chất nền thực vật có tác dụng prebiotic, kích thích sự phát triển của vi khuẩn có lợi, giúp cải thiện dinh dưỡng và sức khỏe cho tôm (Guergoletto và cộng sự, 2010). Các nghiên cứu proteomics trong tương lai có thể giúp làm sáng tỏ các quá trình trao đổi chất liên quan đến sự ảnh hưởng của chất nền thực vật đến tôm.
Cuối cùng, nghiên cứu này cho thấy bổ sung bất kỳ chất nền nào trong ba chất nền được nghiên cứu (cám lúa mì, cám yến mạch, và bã đậu nành) đều không ảnh hưởng tiêu cực đến các thông số cơ bản về chất lượng nước. Cám lúa mì là chất nền hiệu quả nhất trong việc gắn kết vi khuẩn dị dưỡng và chất hữu cơ. Tuy nhiên, cám yến mạch là chất nền hiệu quả nhất để giảm tiêu thụ thức ăn, dẫn đến tăng trưởng tốt hơn và tỷ lệ chuyển đổi thức ăn (FCR) thấp hơn.
Theo Cecilia Peiro-Alcantar, Martha E. Rivas-Vega, Marcel Martínez-Porchas, Jesús A. Lizárraga-Armenta, Anselmo Miranda-Baeza & Luis R. Martínez-Córdova
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Tác Dụng Chức Năng Của Tannin Thủy Phân Đến Sự Tăng Trưởng, Tình Trạng Sức Khỏe Và Gan Tụy Mô Học Của Tôm Thẻ Chân Trắng Penaeus Vannamei Được Nuôi Trong Điều Kiện Ao Thương Phẩm
- Ảnh Hưởng Của Các Phụ Phẩm Nông Nghiệp Như Một Nguồn Carbon Trong Hệ Thống Dựa Trên Biofloc Đến Hiệu Suất Tăng Trưởng, Hoạt Tính Của Enzyme Tiêu Hóa, Mô Học Gan Tụy Và Tải Lượng Vi Khuẩn Đường Ruột Của Tôm Post Litopenaeus Vannamei
- Quản Lý Bệnh Trên Tôm: Châu Á Và Châu Mỹ

 English
English