Tóm tắt
Việc phát triển các chiến lược quản lý hiệu quả nhằm giảm tỷ lệ mắc bệnh trong nuôi trồng thủy sản bị cản trở do thiếu kiến thức về vi sinh vật sinh thái của các hệ thống này. Trong nghiên cứu này, động lực học và các quá trình tập hợp cộng đồng chiếm ưu thế trong nước nuôi của các bể ấu trùng Litopenaeus vannamei đã được xác định. Ngoài ra, sự đóng góp của các vi sinh vật ngoại vi, chẳng hạn như thức ăn sống hoặc khô, vào hệ vi sinh vật trong nước nuôi đều được định lượng. Tập hợp cộng đồng ở khu vực nước nuôi của trại giống được đặc tính bởi tính ngẫu nhiên theo thời gian, điều này giải thích sự không đồng nhất quan sát được giữa các lần nuôi lặp lại. Cộng đồng trải qua hai thay đổi phù hợp với động lực học sự phong phú của tảo trong nước nuôi. Phân tích theo dõi nguồn gốc cho thấy rằng 37% tổng số vi khuẩn trong nước nuôi trại giống được đưa vào bằng thức ăn sống hoặc khô hoặc trong quá trình thay nước. Hệ vi sinh vật từ tảo đóng góp nhiều nhất, tiếp theo là Artemia, thay nước và thức ăn khô. Những phát hiện của chúng tôi cung cấp cơ bản kiến thức về quá trình lắp ráp và động lực học của hệ vi sinh vật nước nuôi và minh họa tầm quan trọng vai trò của các hệ vi sinh vật ngoại vi này trong việc duy trì sức khỏe của hệ vi sinh vật trong nước nuôi.
1. Giới thiệu
Sự bùng phát dịch bệnh do vi khuẩn đã đặt ra một trong những trở ngại chính cho sự phát triển bền vững của ngành nuôi trồng thủy sản (Stentiford và cộng sự, 2017; Shinn và cộng sự, 2018). Những thay đổi phức tạp trong cấu trúc cộng đồng vi sinh vật được cho là có liên quan đến sự bùng phát dịch bệnh (Xiong và cộng sự, 2014a, b; Lemire và cộng sự, 2015; Dai và cộng sự, 2020; Huang và cộng sự, 2020). Ngành nuôi trồng thủy sản đang cần các chiến lược quản lý vi sinh vật hiệu quả để giảm tỷ lệ mắc bệnh do vi khuẩn. Việc phát triển và cải tiến các chiến lược này hiện đang bị cản trở do kiến thức hạn chế về hệ sinh thái vi sinh vật của các hệ thống này (De Schryver và Vadstein, 2014; Bentzon-tilia và cộng sự, 2016).
So với nông nghiệp trên cạn, các sinh vật dưới nước tồn tại trong mối quan hệ chặt chẽ hơn với các hệ vi sinh vật xung quanh (De Schryver và Vadstein, 2014). Nhiều nghiên cứu phân tử đã tìm thấy mối liên hệ giữa hệ vi sinh vật của vật chủ và môi trường nuôi (Chen và cộng sự, 2017; Zheng và cộng sự, 2017; Sun và cộng sự, 2019; Angthong và cộng sự, 2020). Các sinh vật được nuôi trồng tái tạo và làm phong phú thêm các loài cụ thể từ môi trường (Bakke và cộng sự, 2015; Yan và cộng sự, 2016; Li và cộng sự, 2017; Xiong và cộng sự, 2019; Zhang và cộng sự, 2019). Đối với nhiều loài thủy sản, các hệ vi sinh vật liên quan đến ấu trùng được báo cáo giống với các hệ vi sinh vật trong nước nuôi hơn so với các hệ vi sinh vật trong thức ăn sống hoặc khô (Mcintosh và cộng sự, 2008; Bakke và cộng sự, 2013; Giatsis và cộng sự, 2015). Những nghiên cứu này minh họa tầm quan trọng của hệ vi sinh vật trong nước nuôi trong việc thúc đẩy tương tác giữa vật chủ và hệ vi sinh vật.
Các nghiên cứu phân tử về hệ vi sinh vật trong nước nuôi dưỡng cho thấy thành phần cộng đồng của các hệ thống này thay đổi theo thời gian (Xiong và cộng sự, 2014a, b; Zheng và cộng sự, 2017; Yan và cộng sự, 2020) và thể hiện sự biến đổi lớn giữa các phương pháp canh tác nhân rộng (Schmidt và cộng sự, 2017; Chun và cộng sự, 2018; Almeida và cộng sự, 2019; Li và cộng sự, 2019; Dahle và cộng sự, 2020). Hệ vi sinh vật trong nước thường xuyên bị xáo trộn thông qua việc bổ sung thức ăn sống và khô, men vi sinh và thay nước, mỗi yếu tố đều mang lại hệ vi sinh vật riêng. Phần lớn mức độ phân loại vi sinh vật xâm nhập vào nước nuôi có thể sinh sôi, hoặc phát triển mạnh vẫn chưa biết rõ (Vadstein và cộng sự, 2018). Các sản phẩm thức ăn và phân động vật gây ra hiện tượng phú dưỡng nước và do đó kích thích sự phát triển của vi khuẩn (Lucas và cộng sự, 2010; Chen và cộng sự, 2017). Zheng và cộng sự (2017) đề xuất rằng việc chuyển từ thức ăn chăn nuôi sống sang loại khác có thể là nguyên nhân gây ra những thay đổi được quan sát thấy trong nuôi hệ vi sinh vật nước, làm tăng khả năng phát triển của vi khuẩn từ các nguồn này. Nguồn thức ăn trực tiếp có liên quan đến các gen bệnh lý cơ hội tiềm ẩn và vi khuẩn kháng kháng sinh (Mcintosh và cộng sự, 2008; Hurtado và cộng sự, 2020; Turgay và cộng sự, 2020); do đó, điều quan trọng là phải hiểu được sự đóng góp của những vi khuẩn đến hệ vi sinh vật nước nuôi. Ngoài ra, cường độ và tần suất xáo trộn, chẳng hạn như sốc dinh dưỡng, đã được chứng minh là làm thay đổi quá trình tập hợp cộng đồng (tức là cân bằng ngẫu nhiên/xác định, Jiang và Patel, 2008; Chu và cộng sự, 2014; Santillan và cộng sự, 2018). Do đó, chế độ của những xáo trộn này có thể là động lực quan trọng cho tập hợp cộng đồng trong nước nuôi.
Hầu hết các nghiên cứu về hệ vi sinh vật trong nước nuôi được đặc trưng bởi quyết định lấy mẫu một mẫu vài ngày 1 lần hoặc hiếm khi nghiên cứu các phương pháp canh tác lặp lại. Do đó, độ phân giải của chúng không thể hiện toàn bộ động lực học của hệ vi sinh vật. Ngoài ra, những nghiên cứu này chủ yếu điều tra thành phần quần thể vi khuẩn hoặc mật độ vi khuẩn, chứ không phải cả hai. Như đã được báo cáo trước đây, điều quan trọng là phải đo lường cả mức độ phong phú tuyệt đối và tương đối của các phân loại vi sinh vật để đảm bảo giải thích chính xác dữ liệu khảo sát (Props và cộng sự, 2017). Cũng trong bối cảnh quản lý bệnh do vi khuẩn trong nuôi trồng thủy sản, sự phong phú tuyệt đối là một yếu tố quan trọng vì độc lực của các mầm bệnh cơ hội, chẳng hạn như một số chủng Vibrio, Aeromonas và Edwardsiella (Henke và Bassler, 2004; Bi và cộng sự, 2007; Zhang và cộng sự, 2008), có thể phụ thuộc vào mật độ thông qua việc điều chỉnh các yếu tố độc lực bằng cảm biến đại biểu (quorum sensing). Ngoài ra, việc định lượng mức độ phong phú tuyệt đối là điều quan trọng để hiểu được khả năng phát triển vượt bậc của vi sinh vật xâm nhập, vì mật độ xâm nhập là một yếu tố dự báo quan trọng cho sự thành công của quá trình xâm nhập (Jones và cộng sự, 2017; Kinnunen và cộng sự, 2018).
Để có thể điều khiển một cách hiệu quả các hệ vi sinh vật hướng tới các hệ sinh thái có năng suất và tăng cường sức khỏe, cần nâng cao hiểu biết về sự tập hợp, động lực thời gian và động lực của các cộng đồng vi sinh vật này. Chúng tôi đã thực hiện một chiến dịch lấy mẫu trên nuôi ấu trùng tôm thẻ chân trắng Litopenaeus vannamei và nghiên cứu mức độ mà các loài vi khuẩn có trong nước nuôi có nguồn gốc từ thức ăn sống và thức ăn khô hoặc từ thay nước (tức là nước biển được sử dụng để thay thế một phần nước nuôi để duy trì chất lượng nước tốt). Chúng tôi đã xác định thêm các yếu tố thúc đẩy sự năng động của cộng đồng và xác định các quy trình tập hợp cộng đồng bằng cách sử dụng khuôn khổ sinh thái đã được thiết lập.
2. Quy trình thí nghiệm
2.1. Nuôi ấu trùng tôm
Các thí nghiệm được tiến hành tại một trung tâm nghiên cứu nuôi trồng thủy sản ở tỉnh Chonburi, Thái Lan. Các nhân viên thực hiện thử nghiệm có giấy phép của Hội đồng Nghiên cứu Quốc gia Thái Lan để làm việc với động vật vì mục đích khoa học. Ấu trùng L. vannamei được mua từ một cơ sở nuôi tôm bố mẹ thương mại ở cùng tỉnh. Khi đến nơi, ấu trùng được khử trùng theo quy trình hai bước (iốt và formalin) được thực hiện ở khu vực riêng biệt. Ấu trùng được nuôi trong 18 ngày (giai đoạn sống zoea N5 đến PL10). Ấu trùng được nuôi trong nhà theo các quy trình an toàn sinh học nghiêm ngặt tại phòng ương ấu trùng với 60 bể sục khí và 175 bể I. 5 bể thử nghiệm được chọn ngẫu nhiên từ các bể khác trong cơ sở. Nước biển được đổ đầy các bể khi bắt đầu, để thay nước và bắt đầu nuôi tảo và Artemia được thu thập từ Vịnh Thái Lan. Nó được lưu trữ trong một bể chứa bê tông và được xử lý bằng máy tách protein, lọc cát, ozon hóa, than hoạt tính và tia cực tím. Việc sục khí gây ra sự xáo trộn trong bể (Video thông tin hỗ trợ S1). Trong quá trình nuôi, ấu trùng được cho ăn 3 giờ/lần bằng thức ăn sống và/hoặc thức ăn khô. Một loạt các sản phẩm thức ăn sống và thức ăn khô đã được sử dụng (Hình 1). Từ ngày thứ 5 đến ngày thứ 10, Artemia bị giết bằng nhiệt (tức là ngâm trong nước đun sôi cho đến khi chúng không cử động) được sử dụng làm thức ăn sống. Từ ngày thứ 5 trở đi, Artemia sống được sử dụng. Từ ngày 1 đến ngày thứ 10 ấu trùng được bổ sung tảo Chaetoceros calcitrans 2 lần/ngày. Tổng cộng có 5 sản phẩm thức ăn khô đã được sử dụng, được dán nhãn là thức ăn 1-5. Không có bổ sung thêm thuốc kháng sinh hoặc men vi sinh thương mại.
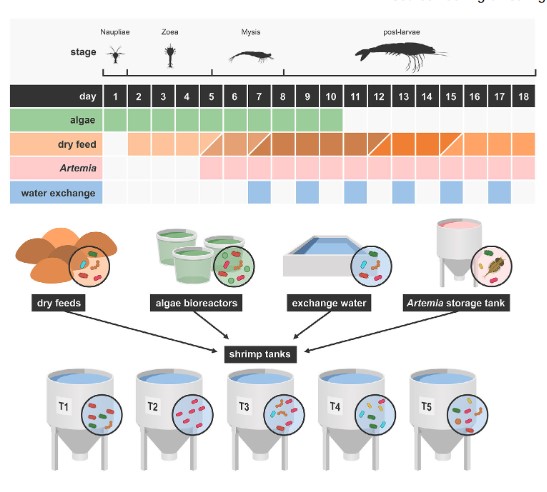
Hình 1. Tổng quan về thiết lập thử nghiệm. 5 bể nuôi ấu trùng Litopenaeus vannamei tái tạo và tất cả các nguồn dự kiến sẽ đóng góp vào hệ vi sinh vật nước nuôi, bao gồm năm thức ăn khô, Artemia, tảo và nước thay thế, đã được theo dõi trong 18 ngày (giai đoạn sống N5 đến PL10). Phần trên của hình minh họa thời điểm bổ sung từng nguồn bên ngoài vào nước nuôi. Đối với thức ăn khô, các sắc thái màu nâu khác nhau được sử dụng cho các sản phẩm khác nhau. [Hình màu có thể được xem tại wileyonlinelibrary.com]
Khoảng 2 ngày một lần, chất lượng nước lý hóa được đánh giá trong các bể (Bảng thông tin hỗ trợ S6). Để duy trì chất lượng nước tốt, thực hiện thay nước từ 30% đến 50% thể tích bể cách ngày từ ngày thứ 7 trở đi. Sức khỏe ấu trùng được đánh giá (bán định lượng) bằng cách nhân viên trang trại kiểm tra trực quan hàng ngày (Thông tin hỗ trợ Hình S1). Hai bể đạt tỷ lệ chết ấu trùng 100% trong quá trình nuôi (tức là T4 ở ngày thứ 10 và T1 ở ngày thứ 13).
2.2. Nuôi thức ăn sống
Tảo được nuôi cấy trên môi trường F2 trong các lò phản ứng sinh học trong suốt, hình trụ, 200 I trong phòng được kiểm soát nhiệt độ (28°C). Các bể được chiếu sáng liên tục từ bên cạnh (giá trị Lux trung bình là 2430) và sục khí (nồng độ dưới 5 mg O2/L). Tảo được nuôi trong 3-4 ngày. Mỗi ngày, một lò phản ứng sinh học duy nhất được sử dụng để cho ấu trùng ăn hai lần (tức là vào lúc 8 giờ sáng và 5 giờ chiều). Sau đó, bể được rửa sạch bằng Sanocare PUR (INVE Aquaculture), theo hướng dẫn của nhà sản xuất, và đổ đầy lại để bắt đầu nuôi cấy mới. Mỗi ngày, một mẻ trứng Artemia mới được ấp theo hướng dẫn của nhà sản xuất. Sau 20 giờ, ấu trùng được chuyển vào tủ lạnh và bảo quản ở nhiệt độ 4°C để sử dụng làm thức ăn sống cho ấu trùng tôm trong 24 giờ tiếp theo. Mỗi mẻ được chuẩn bị để sử dụng từ 11 giờ sáng ngày đầu tiên cho đến 8 giờ sáng ngày hôm sau. Sau đó, bể được súc rửa bằng Sanocare PUR (INVE Aquaculture), theo hướng dẫn của nhà sản xuất.
2.3. Lấy mẫu
Thu thập 1 ml mẫu nước để phân tích tế bào theo dòng chảy dưới bề mặt bể nuôi ấu trùng trước và sau sau mỗi lần cho ăn (tức là độ phân giải 3 giờ). Kể từ khi tải lượng vi khuẩn được thêm vào thông qua việc cho ăn thấp so với lượng vi khuẩn đã có sẵn trong bể chứa (tức là đối với tảo, tải trọng hàng ngày được đưa vào là 0,07% mật độ vi khuẩn trung bình trong quá trình nuôi nước, và lần lượt 0,07%, 0,05% và 0,0008% đối với Artemia, thức ăn khô và nước thay thế), tác động trực tiếp cho ăn không đáng kể và việc đo lường trước và sau mỗi lần cho ăn có thể được coi là lần lặp lại (tức là sự khác biệt trung bình về lượng vi khuẩn trước và sau khi cho ăn lần lượt là 0,44% và -0,34%). Nước của bể chứa Artemia được lấy mẫu ở mỗi lần cho ăn, sử dụng rây để đảm bảo không Artemia được đưa vào mẫu. Phản ứng sinh học của tảo đã được lấy mẫu, khi tảo được thêm vào bể canh tác (tức là 2 lần/ ngày). Các mẫu từ nước thay thế được lấy ở mỗi lần thay nước. 5 phần thức ăn khô được lấy mẫu từ hộp đã được sử dụng tại trang trại. Tất cả các mẫu cho tế bào dòng chảy được cố định bằng 5 µl glutaraldehyde (20%, vol/vol) mỗi ml và được bảo quản ở 4°C trước khi vận chuyển. Tất cả các mẫu được vận chuyển đến Bỉ bằng đá khô để phân tích phòng thí nghiệm.
Vào ngày thứ nhất, ấu trùng được thêm vào nước vào buổi tối và 1 ml mẫu để giải trình tự 16S rRNA được dán nhãn là ‘ngày 1’ được lấy vài phút sau đó. Các ngày tiếp theo, mẫu bể ương để giải trình tự được lấy vào mỗi buổi sáng, nguồn Artemia và phản ứng sinh học của tảo được lấy mẫu để giải trình tự cùng một lúc. Một mẫu từ nước thay thế được lấy ở mỗi lần thay nước. Tất cả thức ăn khô đều được lấy mẫu 1 lần. Các mẫu giải trình tự được bảo quản ở -20°C trước khi vận chuyển. Tất cả các mẫu được vận chuyển đến Bỉ dưới dạng đá khô để phân tích trong phòng thí nghiệm.
2.4. Phân tích tế bào theo dòng chảy
Trước khi phân tích FCM, các lô mẫu được rã đông, để ở nhiệt độ phòng và pha loãng gấp 10 lần trong dung dịch Instant OceanⓇ vô trùng và lọc 0.22 μm (35 g/l; Aquarium Systems, USA). Các mẫu được nhuộm bằng 1% thể tích SYBR® Green I (SG, cô đặc 100 lần trong DMSO đã lọc 0,22 μm; Invitrogen) và ủ trong bóng tối ở 37°C trong 20 phút. Chúng được phân tích ngay sau khi ủ trên máy đo tế bào BD Accuri C6 Plus (BD Bioscatics, Erembodegem, Bỉ), được trang bị bốn máy dò huỳnh quang (533/30 nm, 585/40 nm, >670 nm và 675/25 nm), hai máy dò tán xạ và một tia laser 20 mW 488 nm. Các mẫu được phân tích ở chế độ thể tích cố định (30 µl). Máy đo tế bào dòng chảy được vận hành bằng nước Milli-Q (MerckMillipore, Bỉ) vì hiệu suất của chất lỏng và dụng cụ vận hành được xác minh hàng ngày bằng cách sử dụng Hạt CS&T RUO (BD Bioscatics, Erembodegem, Bỉ). Đối với các mẫu thức ăn, một phương pháp sửa đổi đã được sử dụng (xem Quy trình thử nghiệm thông tin hỗ trợ).
Một tập hợp con gồm 553 mẫu được đo tại chỗ, ngay sau khi lấy mẫu và trước khi cố định, để xác minh độ tin cậy của quy trình cố định. Các phép đo này được thực hiện trên máy Accuri C6 (BD Bioscatics, Bangkok, Thái Lan) với bốn máy dò huỳnh quang (533/30 nm, 585/40 nm, > 670 nm và 675/25 nm), hai máy dò tán xạ và một máy dò 20- mW laser 488nm. Mối tương quan Pearson giữa mật độ vi khuẩn và tảo trong các mẫu được đo tươi (tại chỗ) và cố định (ngoài hiện trường) lần lượt là 0,9 và 0,9 (Thông tin hỗ trợ Hình S11).
2.5. Trình tự Illumina
Các phần 1 ml để tách chiết DNA được rã đông và tạo thành dạng viên (25 phút, 18.200 g, 4°C). DNA được chiết xuất ngay lập tức từ viên bằng cách sử dụng Bộ công cụ Microprep DNA ZymoBIOMICS (Zymo Research, Hoa Kỳ). Chiết xuất DNA bộ gen (10 μl) đã được gửi đến BaseClear B.V. (Leiden, Hà Lan) để chuẩn bị dữ liệu và giải trình tự vùng siêu biến V3-V4 của gen 16S rRNA. Tóm lại, các bộ khuếch đại có mã vạch từ vùng V3-V4 của gen 16S rRNA được tạo ra bằng phương pháp PCR hai bước. Mồi có nguồn gốc từ Klindworth và cộng sự (2013), với một sửa đổi nhỏ đối với lớp sơn lót ngược bằng cách đưa vào một vị trí thoái hóa khác (K) để làm cho nó trở nên phổ quát hơn, được sử dụng: 341F (5′-CCT ACG GGN GGC WGC AG-3′) và 785Rmod (5′-GAC TAC HVG GGT ATC TAA KCC-3′). Khoảng 10-25 ng genome (g) DNA đã được sử dụng làm khuôn mẫu cho PCR đầu tiên với tổng thể tích 50 μl sử dụng mồi gắn với Illumina trình tự bộ điều hợp trong 25 chu kỳ ở nhiệt độ ủ 55°C. Khi mật độ tảo cao, trình tự 16S có nguồn gốc từ DNA lục lạp có thể chiếm diện tích lớn các trình tự thu được. Vì áp lực sự tồn tại của quần thể tảo trong một phần mẫu, PCR kép đã được thêm vào hỗn hợp PCR để chặn lục lạp khuếch đại (Lundberg và cộng sự, 2013). Các sản phẩm PCR được tinh chế bằng hạt Ampure XP theo quy trình hướng dẫn của nhà sản xuất và kích thước của sản phẩm PCR đã được kiểm tra trên Fragment analyzer (phân tích nâng cao) và định lượng bằng phân tích huỳnh quang. Sản phẩm PCR tinh khiết được sử dụng cho lần PCR thứ hai vào mẫu cụ thể kết hợp với mồi có mã vạch dành riêng cho từng mẫu (Bộ chỉ số Nextera XT, Illumina) trong sáu chu kỳ mỗi lần ủ là 55°C. Sau đó, sản phẩm PCR được tinh sạch bằng Hạt Ampure XP theo hướng dẫn của nhà sản xuất, được kiểm tra trên máy phân tích mảnh (Nâng cao phân tích) và định lượng, tiếp theo là ghép kênh, phân cụm và giải trình tự trên Illumina MiSeq với Giao thức và mục lục 300 bp kết nối (2x) 300 bp. Các quá trình giải trình tự được phân tích bằng Illumina CASAVA đường ống (v1.8.3) với tính năng phân kênh dựa trên mẫu cụ thể. Dữ liệu trình tự thô được tạo ra đã được xử lý để loại bỏ các lần đọc trình tự có chất lượng quá thấp (chỉ chọn các lần đọc ‘bộ lọc vượt qua’) và loại bỏ các lần đọc thẻ chứa các trình tự bộ điều hợp hoặc kiểm soát PhiX bằng giao thức lọc nội bộ. Chất lượng đánh giá trên các lần đọc còn lại được thực hiện bằng cách sử dụng công cụ kiểm soát chất lượng FASTQC phiên bản 0.10.0.Extra các mẫu, bao gồm một loạt pha loãng của cộng đồng giả và một ô trống, được đưa vào làm biện pháp kiểm soát chất lượng (xem Thông tin hỗ trợ thủ tục thí nghiệm).
2.6. Phân tích dữ liệu
Phân tích tế bào theo dòng chảy. Dữ liệu tế bào học dòng chảy được nhập vào R (v3.6.3) (R Core Team, 2020) bằng gói flowCore (v1.52.1) (Hahne và cộng sự, 2009). Dữ liệu được chuyển đổi bằng hàm hyperbol arcsine và nền được loại bỏ bằng cách tạo cổng trên các kênh huỳnh quang chính theo cách thủ công. Các quần thể vi khuẩn và tảo được phân tách dựa trên kiểu huỳnh quang (Thông tin hỗ trợ Hình S11). Hammes và cộng sự (2008) đã xác định giới hạn định lượng là 100 tế bào/ mL. Vì tất cả các mẫu được pha loãng 10 lần nên giới hạn định lượng là 103 tế bào/ mL đã được sử dụng.
Phân tích trình tự khuếch đại gen 16S rRNA. Phân tích dữ liệu khuếch đại được thực hiện với MOTHUR (v.1.42.3) (Schloss và cộng sự, 2009). Các liên kết được tạo bằng cách hợp nhất các lần đọc kết thúc dựa trên phương pháp phỏng đoán điểm chất lượng Phred và được căn chỉnh với cơ sở dữ liệu SILVA v123. Các trình tự không tương ứng với vùng V3-V4 cũng như các trình tự chứa các bazơ không rõ ràng hoặc nhiều hơn 12 homopolyme đã bị loại bỏ. Các trình tự căn chỉnh đã được lọc và các lỗi trình tự được loại bỏ bằng lệnh pre.cluster. UCHIME đã được sử dụng để loại bỏ chimera (Edgar và cộng sự, 2011) và các trình tự được nhóm lại trong OTUS với độ tương tự 97% với lệnh cluster.split (thuật toán lân cận trung bình). OTUS sau đó được xếp vào loại được định cỡ bằng cơ sở dữ liệu SILVA v123.
Bảng OTU đã được phân tích sâu hơn trong R (v3.6.3) (Nhóm R Core, 2020). Sự phong phú của OTU đã được điều chỉnh lại bằng cách tính tỷ lệ của chúng và nhân chúng với cỡ mẫu tối thiểu có trong tập dữ liệu. Sự đa dạng alpha và beta được đánh giá lần lượt bằng cách sử dụng các gói phyloseq (Mcmurdie và Holmes, 2013) (v1.30.0) và thuần chay (Oksanen và cộng sự, 2019) (v2.5-6). Sự khác biệt của Bray-Curtis được phân chia thành biến thể doanh thu và độ phong phú, sử dụng gói betapart (v1.5.1) (Baselga và Orme, 2012). Sự khác biệt giữa các nhóm trong phân tích đa dạng beta được đánh giá bằng phương pháp ANOVA đa biến hoán vị (PERMANOVA, 999 hoán vị) của ma trận độ khác biệt Bray-Curtis, sau khi xác nhận tính đồng nhất của phương sai trong các nhóm. Các thành phần hệ vi sinh vật cốt lõi được xác định bằng cách sử dụng gói hệ vi sinh vật (v1.8.0) (Lahti và Shetty, 2019). Ngưỡng phổ biến được sử dụng để phát hiện các thành viên cốt lõi là 0,75 (tức là các đơn vị phân loại được phát hiện trong 75% số mẫu được coi là thành viên của lõi). Sự phong phú tuyệt đối của OTU được tính toán dựa trên mật độ vi khuẩn được xác định thông qua phương pháp phân tích tế bào theo dòng chảy.
Theo dõi nguồn. Với mỗi ngày i, sự phong phú tuyệt đối của OTUS trong nước nuôi của mỗi bể được tính toán dựa trên mật độ tế bào trong bể vào ngày hôm đó, sự phong phú tương đối của OTU trong bể trên đó ngày và thể tích bể. Đối với mỗi OTU, sự phong phú tuyệt đối này được so sánh với ngày hôm trước i-1. Nếu như trung bình có sự gia tăng từ ngày thứ nhất đến ngày thứ i trong tất cả các bể, và sự gia tăng này được quan sát thấy ở ít nhất một nửa số các bể, OTU này được giữ lại. Tiêu chí được dựa trên tối thiểu một nửa số bể để cho phép một số biến thể sinh học, vì hệ vi sinh vật từ nuôi trồng thủy sản nhân rộng được biết là rất khác nhau. Đối với mỗi OTU được giữ lại, sự phong phú của các nguồn đã được thêm vào bể trong suốt ngày i-1 đến ngày i được xác minh. Nếu OTU hiện diện trong một nguồn cụ thể, độ phong phú tuyệt đối đã được thêm vào được tính toán dựa trên mật độ tế bào trong nguồn ngày hôm đó, mối quan hệ sự phong phú của OTU trong nguồn ngày hôm đó và khối lượng bổ sung của nguồn nếu giá trị tuyệt đối độ phong phú được thêm vào lớn hơn số lượng tuyệt đối sự phong phú đã có sẵn trong bể vào ngày i-1, nguồn này được coi là nguồn đóng góp quan trọng của OTU này. Ngoài ra, nếu mức độ phong phú vào ngày i-1=0, OTU này được đánh dấu là nguồn giới thiệu mới. Vì độ phân giải lấy mẫu của nước nuôi là 1 mẫu mỗi ngày để giải trình tự gen 16S rRNA, cách tiếp cận này cung cấp một cái nhìn tổng quan về tác động của từng nguồn trong vòng 24 giờ sau khi bổ sung nguồn. Cần lưu ý rằng có thể có nhiều OTU hơn xâm nhập vào hệ vi sinh vật nước nuôi thông qua chất bổ sung của nguồn ban đầu này, nhưng chúng đã giảm dần sự phong phú trong vòng 24 giờ, và do đó, chúng không được phát hiện. Cần lưu ý rằng phân tích theo dõi nguồn nuôi cấy Artemia được thực hiện bằng cách sử dụng dữ liệu thành phần cộng đồng của nước nuôi Artemia và không hệ vi sinh vật liên quan đến Artemia.
Dự đoán quá trình tập hợp cộng đồng. Khuôn khổ được đề xuất bởi Stegen và cộng sự (2013) đã được sử dụng để xác định các quy trình tập hợp cộng đồng chiếm ưu thế. Mô hình này dựa trên tỷ lệ luân chuyển phát sinh gen và thành phần để ước tính định lượng ảnh hưởng của sự chuyển động, lựa chọn và phân tán đến sự tập hợp cộng đồng và được giải thích chi tiết trong Quy trình thử nghiệm thông tin hỗ trợ. Khung này được sử dụng để xác định các quá trình tập hợp cộng đồng chiếm ưu thế trong nước nuôi theo thời gian trong các bể riêng lẻ và để đánh giá các quá trình tập hợp chịu trách nhiệm đưa các đơn vị phân loại từ các nguồn vào. Để đánh giá quá trình kết hợp trong nước nuôi theo thời gian, các cộng đồng vào những ngày liên tiếp (tức là ngày i với ngày i+1) được so sánh đối với từng bể riêng biệt. Những dự đoán này sau đó được kết hợp để đưa ra sự phân bố của các quy trình khác nhau theo thời gian (Thông tin hỗ trợ Hình S9C) hoặc trong các bể riêng lẻ (Hình 6A).
Quá trình lắp ráp chịu trách nhiệm đưa các đơn vị phân loại từ hệ vi sinh vật ngoại vi vào được đánh giá thông qua việc so sánh hệ vi sinh vật trong mỗi nguồn với những hệ vi sinh vật có trong nước nuôi 1 ngày sau khi đưa nguồn vào. Ví dụ, sự tập hợp vi khuẩn từ môi trường nuôi cấy tảo vào ngày thứ 3 được đánh giá bằng cách xác định quá trình tập hợp từ quần thể vi khuẩn trong bể nuôi tảo vào ngày thứ 3 đến quần thể vi khuẩn trong nước ương vào ngày thứ 4 (tức là mẫu đầu tiên sau khi đưa vào), đối với từng bể riêng lẻ. Để đánh giá các quy trình cho từng nguồn (Hình 6B), các dự đoán được kết hợp trên mỗi nguồn.
3. Kết quả
5 bể nuôi ấu trùng Litopenaeus vannamei lặp lại và tất cả các nguồn dự kiến sẽ đóng góp vào việc hệ vi sinh vật nuôi trong nước, bao gồm thức ăn khô, Artemia, tảo và nước thay thế, được theo dõi trong 18 ngày (giai đoạn sống N5 đến PL10, Hình 1). Nước nuôi đã lấy mẫu ở độ phân giải 3 giờ cho phương pháp phân tích tế bào theo dòng chảy và giải trình tự gen 16S rRNA mỗi ngày 1 lần. Trong quá trình nuôi, bể 1 và 4 đạt tỷ lệ ấu trùng chết 100% lần lượt vào ngày thứ 13 và 10 (Thông tin hỗ trợ Hình S1). Chỉ có dữ liệu từ trước khi xảy ra trường hợp chết bao gồm các bể này.
3.1. Sự phong phú của vi khuẩn và tảo trong nước nuôi
Khi bắt đầu nuôi, sau khi bổ sung ấu trùng vào bể, nồng độ vi khuẩn trong nước là 4,21 ± 1,44 x 105 tế bào/ mL và mật độ tế bào tảo nằm dưới giới hạn phát hiện (tức là < 103 tế bào/ mL) . Trong những ngày tiếp theo, nồng độ vi khuẩn tăng đều được quan sát thấy ở tất cả các bể, đạt mật độ trung bình 2,33±0,71 x 107 tế bào/ mL vào ngày thứ 7 (Hình 2A). Từ ngày thứ 7 trở đi, mẫu nồng độ tế bào vi khuẩn bắt đầu khác nhau giữa các bể. Tất cả các bể đều có nồng độ tế bào vi khuẩn giảm, sau đó phục hồi và tăng thêm. Mức độ và thời gian của sự giảm này và sự phát triển tế bào tiếp theo là khác nhau giữa các bể và dẫn đến sự khác biệt về mật độ vi khuẩn lên tới đơn vị 1 log10 trên các bể (tức là 1,34-9,16 x 107 tế bào/ mL).
Tảo Chaetoceros calcitrans được sử dụng để nuôi ấu trùng trong 10 ngày đầu tiên. Trong giai đoạn này, mật độ tảo trong nước nuôi dao động trong khoảng 1,99 x 103 và 1,03 x 105 tế bào/ mL, với giá trị thấp nhất vào khoảng ngày thứ 3-4 và giá trị cao nhất vào khoảng ngày 7-9. Sau khi ngừng bổ sung tảo, mật độ tảo giảm nhanh chóng xuống dưới giới hạn phát hiện vào ngày thứ 12 (Thông tin hỗ trợ Hình S2).
3.2. Động lực cộng đồng tạm thời
Việc phân bổ PCOA về sự khác biệt Bray-Curtis của các cộng đồng vi khuẩn phù du cho thấy xu hướng tạm thời đối với các bể tạm thời (Hình 3A). Sự thay đổi đầu tiên trong thành phần cộng đồng đã được quan sát thấy từ ngày thứ 2 đến ngày thứ 3 (Hình 2B và 3A). Phân vùng đa dạng beta cho thấy sự thay đổi được quan sát gần như hoàn toàn (> 99,5%) được cho là do những thay đổi về mức độ phong phú tương đối của OTUS đã có sẵn trong hệ thống (tức là ‘biến thể phong phú’), và do đó, không gây ra sự xâm lấn lớn của các đơn vị phân loại mới (tức là doanh thu’, Thông tin hỗ trợ Hình S3). Trong giai đoạn này, vi khuẩn phát triển tích cực trong nước nuôi và mật độ vi khuẩn tăng trung bình gấp 2,2 lần (Hình 2A). Cùng với đó, điều này chỉ ra rằng sự thay đổi cộng đồng quan sát được là do quá trình phát triển đã dẫn đến sự phong phú của các thành viên cộng đồng cụ thể. OTUS có mức độ phong phú tương đối tăng mạnh thuộc về các chi Phaeodactylibacter (OTU1), Marivita (OTU2), Donghicola (OTU4) và Pseudoalteromonas (OTU13 và OTU27). Thành phần và động lực cộng đồng ban đầu trong bể 4 có phần khác biệt so với các bể khác (Kết quả thông tin hỗ trợ, Hình bổ sung S4, Hình 2B). Trong quá trình phát triển của vi khuẩn từ ngày thứ 2 đến ngày thứ 3, độ lệch của bể 4 so với các bể khác đã giảm đi, thể hiện qua sự khác biệt trung bình của Bray-Curtis giữa bể này và các bể khác (Hình 3B). Sự khác biệt trung bình của bể 5 so với các bể khác tăng lên, và điều này chủ yếu là do sự phát triển rõ rệt hơn của Marivita sp. trong bể này so với các bể khác (Hình 2B và 3B).

Hình 2. A. Động lực tạm thời của mật độ vi khuẩn trong nước nuôi. Đường màu đen biểu thị giá trị trung bình có điều kiện được làm mịn (LOESS) và các vùng được tô bóng biểu thị khoảng tin cậy 95% trên các đường làm mịn. B. Thành phần cộng đồng của năm bể lặp lại. Mỗi đoạn của một thanh tương ứng với một OTU. Tất cả các OTU thuộc 16 chi phong phú nhất đều có màu, các chi khác được dán nhãn ‘Khác’. Thành phần cộng đồng của bể 2 vào ngày thứ 6 bị thiếu do mẫu này không được lấy. [Hình màu có thể được xem tại wileyonlinelibrary.com]
Sự thay đổi thứ hai được thực hiện vào ngày 10-11, tương ứng với việc bổ sung tảo lần cuối làm thức ăn sống và lượng tảo giảm mạnh trong nước nuôi vào ngày thứ 11 (Thông tin hỗ trợ Hình S2). Sự phong phú tuyệt đối của 39 OTU tương quan đáng kể (tương quan Pearson, t-test, P < 0,001) tương quan với mật độ tảo trong nước nuôi trong toàn bộ quá trình canh tác (Bảng thông tin hỗ trợ S1). Điều này bao gồm một số OTUS chiếm ưu thế trong nửa đầu của quá trình nuôi và thuộc về các chi Phaeodactylibacter (OTU1, rp = 0,55), Balneola (OTU5, rp = 0,55), Owenweeksia (OTU19, rp = 0,35), Saprospiraceae chưa được phân loại (OTU30, rp = 0,36) và Rhodobacteraceae chưa được phân loại (OTU6, rp = 0,43). Cùng với độ phong phú của tảo giảm mạnh, độ phong phú tương đối của các OTUS này nhanh chóng giảm xuống, dẫn đến sự thay đổi cộng đồng được quan sát thấy. Phân vùng đa dạng beta đã xác nhận quan sát này bằng cách chỉ quy một phần nhỏ (0,01% -1,18%) trong tổng số khác biệt về doanh thu và quy phần lớn là do những thay đổi về mức độ phong phú tương đối của OTUS thường xuất hiện (Thông tin hỗ trợ Hình 3).
Theo thời gian, sự khác biệt giữa các bể lặp lại ngày càng tăng (Hình 3B). Cùng với sự thay đổi thành phần cộng đồng xảy ra vào khoảng ngày 11, sự gia tăng mạnh nhất về mức độ biến thiên giữa các bể tái tạo đã được quan sát thấy (tức là từ ngày 11 đến ngày 12, Hình 3B). Sau đó, sự biến thiên giữa các bể vẫn ở mức cao và các thành viên cộng đồng chiếm ưu thế khác nhau giữa các bể cho đến khi kết thúc quá trình nuôi. Sự phân chia đa dạng beta về sự khác biệt giữa các bể cho thấy rằng các bể chủ yếu bao gồm các đơn vị phân loại giống nhau, nhưng chúng khác nhau do mức độ phong phú tương đối khác nhau của các đơn vị phân loại này (tức là doanh thu trung bình 0,26%, Hình 3C).
3.3. Hệ vi sinh vật ngoại vi
Trong suốt quá trình nuôi, ấu trùng được cho ăn bằng các sản phẩm thức ăn sống (tảo và Artemia) và thức ăn khô khác nhau (Hình 1). Để có thể đánh giá ảnh hưởng của các hệ vi sinh vật ngoại vi trong hệ vi sinh vật nước nuôi, mật độ tế bào và thành phần cộng đồng của các nguồn này đã được nghiên cứu. Hệ vi sinh vật của các loại hệ vi sinh vật ngoại vi khác nhau (như tảo, Artemia, thức ăn khô và nước thay thế) khác với nước nuôi (không thể thực hiện PERMANOVA vì sự phân tán của nhóm khác nhau đáng kể) và khác biệt đáng kể với nhau. (r2 = 0,34, P = 0,001, PERMANOVA; Thông tin hỗ trợ Hình S5).
Từ ngày 1 (N5) đến ngày 10 (PL2), tảo Chaetoceros được nuôi trong bể phản ứng sinh học sục khí và sử dụng làm thức ăn sống. Một bể phản ứng sinh học duy nhất được sử dụng cho hai lần cho ăn mỗi ngày. Trong những ngày qua, mật độ vi khuẩn trong các bể phản ứng sinh học này thay đổi tới 1 log10 đơn vị (từ 1,30 x 106 đến 3,28 x 107 tế bào/ mL) và có sự thay đổi tối đa gấp 5 lần về mật độ vi khuẩn giữa hai lần cho ăn từ cùng một lò phản ứng sinh học (Hình 4A). Sự khác biệt trung bình của Bray-Curtis giữa các cộng đồng trong lò phản ứng sinh học là 0,78 ± 0,17, cho thấy sự thay đổi lớn theo từng đợt (Thông tin hỗ trợ Hình S6). Việc phân vùng sự khác biệt của Bray-Curtis chỉ ra rằng hầu hết các biến thể được giải thích là do sự khác biệt về mức độ phong phú tương đối của cùng một nhóm phân loại (<99, 5%, Bảng thông tin hỗ trợ S2). Do đó, bất chấp sự khác biệt về lô, 16 đơn vị phân loại lõi có thể được xác định (tức là các đơn vị phân loại được phát hiện trong 75% số mẫu, Bảng thông tin hỗ trợ S3).
Từ ngày thứ 5 đến ngày thứ 18, ấu trùng tôm được nuôi bằng Artemia, trong đó một mẻ bào nang mới nở sau mỗi 24 giờ và được bảo quản ở 4°C. Mật độ vi khuẩn ban đầu của các lô dao động từ 3,09 x 105 đến 3,89 x 106 tế bào/ mL (Hình 4C). Trong quá trình bảo quản, sự phát triển của vi khuẩn được quan sát hàng ngày với mật độ vi khuẩn tăng lên từ 1,2 đến 10 lần. Tương tự như tảo, thành phần hệ vi sinh vật khác nhau phần lớn giữa các lô khác nhau, được biểu thị bằng độ khác biệt trung bình của Bray-Curtis là 0,72 ± 0,17 và sự phân chia đa dạng beta cho thấy những điều này chủ yếu liên quan đến sự khác biệt về sự phong phú tương đối của các đơn vị phân loại hiện có (Thông tin hỗ trợ Hình S6 và Bảng 2). 27 đơn vị phân loại cốt lõi đã được xác định (Bảng thông tin hỗ trợ S4).
5 sản phẩm thức ăn khô được sử dụng làm thức ăn cho ấu trùng trong suốt quá trình nuôi. Sản phẩm thức ăn 1 chứa mật độ vi khuẩn là 3,66 x 109 tế bào/ g. Đối với các nguồn cấp dữ liệu khô khác, không thể xác định chính xác mật độ tế bào bằng phương pháp phân tích tế bào theo dòng chảy (xem Quy trình thử nghiệm thông tin hỗ trợ). Trình tự gen 16S rRNA đã cung cấp bằng chứng cho sự hiện diện của cộng đồng vi khuẩn trong các nguồn thức ăn này, vì các đơn vị phân loại được phát hiện khác biệt với các chất gây ô nhiễm tiềm ẩn trong bộ dụng cụ (Thông tin hỗ trợ Hình S7). Ngược lại với nước nuôi và các hệ vi sinh vật ngoại vi khác, hệ vi sinh vật trong thức ăn khô bị chi phối bởi các phân loại gram dương (Thông tin hỗ trợ Hình S6). Có sự khác biệt lớn giữa thành phần cộng đồng của các sản phẩm khác nhau, nguyên nhân chủ yếu là do sự khác biệt về mức độ phong phú tương đối của cùng một nhóm phân loại (Bảng thông tin hỗ trợ S2).
Việc thay nước được thực hiện cách ngày (30%-50% thể tích bể) bắt đầu từ ngày thứ 7. Mật độ tế bào trong nước thay thế dao động từ 1,64 x 104 đến 4,62 x 105 tế bào/ mL (Hình 4B). Thành phần cộng đồng giữa các lô nước khác nhau với mức chênh lệch trung bình của Bray-Curtis là 0,83 ± 0,14 (Bảng thông tin hỗ trợ S2). Đối với các nguồn khác, những khác biệt này có liên quan đến sự khác biệt về mức độ phong phú tương đối của cùng một đơn vị phân loại. Bất chấp sự khác biệt giữa nước thay thế vào những ngày khác nhau, vẫn có thể xác định được 16 đơn vị phân loại cốt lõi (Bảng thông tin hỗ trợ S5).
3.4. Theo dõi nguồn
Mỗi nguồn có lượng vi khuẩn dồi dào khác nhau và được thêm vào với số lượng và tần suất khác nhau và đưa các lượng vi sinh vật khác nhau vào nước nuôi (Thông tin hỗ trợ Hình S8). Trung bình, khi thêm tảo vào, lượng vi khuẩn là 1,22 x 101 tế bào/ mL/ ngày được thêm vào nước nuôi. Đối với Artemia, lượng này là 1,18 x 104 tế bào/ mL/ ngày, đối với thức ăn khô là 8,42 x 103 tế bào/ mL/ ngày và đối với thức ăn thay nước là 1,45 x 102 tế bào/ mL/ ngày. Cần lưu ý rằng đây là mức đánh giá thấp đối với thức ăn khô vì chỉ có thể xác định chính xác lượng vi khuẩn cho một sản phẩm thức ăn (xem Quy trình thử nghiệm thông tin hỗ trợ).
Để điều tra xem mức độ phân loại vi khuẩn được phát hiện trong nước nuôi có liên quan đến việc sử dụng các nguồn thức ăn khác nhau hay không, tải lượng OTU tuyệt đối trong nước nuôi được so sánh với tải lượng OTU được đưa vào thông qua thức ăn và nước thay thế (xem Quy trình thí nghiệm đối với các chi tiết trên giao thức). Đối với các giống Artemia, phân tích theo dõi nguồn được thực hiện bằng cách sử dụng hồ sơ thành phần cộng đồng của nước lưu trữ Artemia chứ không phải hệ vi sinh vật liên quan đến Artemia, vì hệ vi sinh vật này không được lấy mẫu. Phân tích này cho thấy rằng mỗi nguồn được điều tra đều có liên quan đến sự hiện diện của các đơn vị cụ thể trong nước nuôi. Tổng cộng, 57 lần du nhập đã được phát hiện và sự hiện diện của 42 trong số 498 OTU nước nuôi có thể là do việc bổ sung nguồn (Hình 5A). Trong số OTUS này, 26 con có nguồn gốc từ nuôi cấy tảo, 15 con từ Artemia, 6 con từ nước thay thế và 1 con từ các sản phẩm thức ăn khô. Một số OTUS được liên kết với nhiều nguồn, trong cùng một ngày (ví dụ: OTU21, Winogradskyella) hoặc vào các ngày khác nhau (ví dụ: OTU19, Owenweeksia sp.).
Đáng chú ý, OTUS được giới thiệu không nằm trong số các thành viên chiếm ưu thế trong hệ vi sinh vật của nguồn (tức là chỉ 7 trong số 42 OTU có tỷ lệ phong phú > 5% trong nguồn mà chúng xâm nhập, Hình 5B). Trong số 57 sự kiện, 49 sự kiện được phân loại là sự kiện mới được đưa vào, cho thấy hầu hết OTUS được đưa vào đều hoàn toàn không có trong hệ vi sinh vật trong bể hoặc chúng đã có mặt trước đó nhưng đã giảm xuống dưới giới hạn phát hiện.
Một số OTU được giới thiệu có thời gian hiện diện lâu sau khi được giới thiệu, chẳng hạn như OTU2 (Marivita sp.) vẫn tồn tại cho đến khi kết thúc quá trình canh tác sau khi được xâm nhập vào ngày 1, trong khi các OTU khác có thời gian hiện diện chỉ 1 hoặc 2 ngày (Hình 5C). Mức độ phong phú tương đối của OTUS có trong nước có thể lên tới 60% (Hình 5D). Sự thay đổi ban đầu do OTU đưa vào trong vòng 24 giờ sau khi bổ sung không liên quan đến độ phong phú tương đối tối đa hoặc thời gian hiện diện của OTU này trong nước nuôi. Ví dụ, OTU1 (Phaeodactylibacter sp.), ban đầu được đưa vào với log2 (thay đổi lần) tương đối nhỏ là 1,2, vẫn tồn tại trong nước nuôi trong 6-13 ngày tùy thuộc vào bể và đạt mức độ phong phú tương đối >60%. Điều này chỉ ra rằng ngay cả OTUS đã vào bể với số lượng tương đối thấp cũng có khả năng phát triển thành một trong những OTU phong phú nhất trong hệ thống. Tổng cộng có OTUS được thêm chiếm 37% cộng đồng nước nuôi trong toàn bộ quá trình canh tác (tức là 34% tảo, 2% Artemia, 0,05% lượng nước thay thế và 0,007% thức ăn khô).
3.5. Tập hợp cộng đồng trong nước nuôi
Khung được phát triển bởi Stegen và cộng sự (2013) đã được sử dụng để xác định các quá trình tập hợp cộng đồng chiếm ưu thế trong nước nuôi theo thời gian và để đánh giá các quá trình tập hợp chịu trách nhiệm cho việc du nhập các đơn vị phân loại từ các nguồn. Việc tập hợp cộng đồng trong các bể riêng lẻ được đánh giá thông qua so sánh hệ vi sinh vật trong những ngày liên tiếp cho từng bể riêng biệt (tức là ngày i với ngày i + 1). Đối với tất cả các bể, động lực chính của cộng đồng là các quá trình ngẫu nhiên (tức là 50% ‘chỉ tác động trôi dạt’, 36% ‘phân tán đồng đều’ và 4% ‘giới hạn phân tán kết hợp với trôi dạt’) và sự đóng góp của các quá trình chọn lọc bị hạn chế ( tức là 9% ‘lựa chọn đồng nhất’ và 1% ‘lựa chọn biến’) (Hình 6A, Thông tin hỗ trợ Hình S9).
Quá trình tập hợp chịu trách nhiệm đưa các đơn vị phân loại từ các nguồn vào được đánh giá thông qua việc so sánh hệ vi sinh vật trong mỗi nguồn với những hệ vi sinh vật có trong nước nuôi 1 ngày sau khi đưa nguồn vào. Trong trường hợp này, chỉ có sự hiện diện hay vắng mặt của các lực chọn lọc mới được đánh giá. Do sự ra đời của các đơn vị phân loại từ các nguồn bên ngoài, sự lựa chọn không đồng nhất có thể được hiểu là sự lựa chọn các đặc tính khác nhau so với các đặc tính trong nguồn, trong khi lựa chọn đồng nhất có thể được giải thích như lựa chọn các vi khuẩn tương tự trong nước nuôi như so với những gì có trong nguồn. Quá trình xử lý từ các nguồn khác nhau tùy thuộc vào loại nguồn (Hình 6B). Đối với tất cả các nguồn ngoại trừ nguồn thức ăn khô, việc tập hợp bị chi phối bởi sự trôi dạt (tức là không có lựa chọn có lợi cho vi khuẩn từ những nguồn này, cũng như không chọn lọc chống lại) với sự đóng góp hạn chế của sự đồng nhất lựa chọn (tức là 4% cho nước thay thế, 2% cho Artemia và 17% đối với tảo). Đối với thức ăn khô việc tập hợp các biến được điều chỉnh 61% có thể thay đổi.
Theo Jasmine Heyse, Ruben Props, Pantipa Kongnuan, Peter De Schryver, Geert Rombaut, Tom Defoirdt, Nico Boon
Nguồn: https://ami-journals.onlinelibrary.wiley.com/doi/epdf/10.1111/1462-2920.15310
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phiên Mã Của Litopenaeus vannamei Ở Ấu Trùng Zoea Và Trưởng Thành Bị Nhiễm Vibrio parahaemolyticus
- Ảnh Hưởng Của Nguồn Protein Đơn Bào Đến Tăng Trưởng Và Sức Khỏe Của Tôm Thẻ Chân Trắng
- Đối Mặt Với Nhu Cầu Nuôi Hải Sản Bền Vững Ngày Càng Tăng, Oman Cho Thử Nghiệm Nguồn Nước Nuôi Tôm Trên Sa Mạc

 English
English 中文 (中国)
中文 (中国)