Tóm tắt
Nuôi trồng thủy sản biển là ngành sản xuất thực phẩm phát triển nhanh nhất với sự đóng góp chủ yếu từ khối lượng cá chép và giá trị của tôm. Sự phát triển liên tục của nuôi trồng thủy sản đòi hỏi các công nghệ thay thế mới để đạt được sản xuất bền vững với chi phí kinh tế thấp. Các hệ thống dựa trên vi sinh vật như công nghệ biofloc (hệ thống không thay nước) và chất nền nhân tạo được tích hợp (dựa trên periphyton) trong các hệ thống nuôi thông thường là những phương pháp thực hành tốt nhất để sản xuất tôm khỏe mạnh. Các hệ thống dựa trên vi sinh vật là các phương pháp nuôi trồng thủy sản thân thiện với môi trường, có thể kích thích cả nhóm vi khuẩn dị dưỡng hoặc tự dưỡng bằng cách duy trì tỷ lệ carbon và nitơ (C:N) có thể chuyển đổi chất thải chứa nitơ thành sinh khối vi sinh vật hữu ích, có thể dùng làm nguồn thức ăn tự nhiên cho các sinh vật nuôi. Mặt khác, biofloc và Periphyton giúp cải thiện chất lượng nước bằng cách loại bỏ các chất nitơ độc hại khỏi các hệ thống này. Công nghệ này mang lại hiệu quả kinh tế, thân thiện với môi trường và được xã hội chấp nhận.
Giới thiệu
Nuôi trồng thủy sản là ngành sản xuất thực phẩm tăng trưởng nhanh nhất trên thế giới, nhưng cạnh tranh ngành công nghiệp ngày nay quan trọng nhất là tạo ra những con vật có chất lượng cao với chi phí khả thi về mặt kinh tế. Tuy nhiên, các hệ thống nuôi tôm thâm canh hiện nay đang thay nước nhiều và chất thải thức ăn đang gây ra những tác động bất lợi đến môi trường như phú dưỡng, sinh vật phù du không thể kiểm soát và các vấn đề khác (Martinez-Porchas và Martinez-Cordova 2012). Mặc dù nuôi tôm thành công nhưng ngành cần phát triển các công nghệ mới giúp nâng cao giá trị và tính bền vững môi trường (Kuhn và cộng sự, 2010).
Là một giải pháp thay thế cho hệ thống nuôi thâm canh hiện có, công nghệ biofloc (BFT) đã được phát triển như một hệ thống nuôi thâm canh để làm cho việc nuôi tôm hiệu quả hơn về mặt chi phí và tăng hiệu quả sử dụng chất dinh dưỡng, cung cấp bioflocs làm thức ăn bổ sung, giảm sử dụng nước và xả nước thải cũng như cải thiện an toàn sinh học (Wasielesky và cộng sự, 2006). Biofloc là hỗn hợp vi khuẩn không đồng nhất, vi tảo dạng sợi, động vật nguyên sinh, luân trùng, giun và các thành phần phi sinh học. Sự phát triển của vi khuẩn tăng lên khi nguồn carbon được bổ sung vào nước có sục khí mạnh với tỷ lệ C/N là 15:1 (Chamberiain và Hopkins, 1994; De Schryver và cộng sự, 2008). Các hạt biofloc chứa các vi khuẩn hữu ích như Bacillus sp., LactoBacillus sp. và Vibrio sp. (Anand và cộng sự, 2014, Kumar và cộng sự, 2015), các chất hợp chất có hoạt tính sinh học như carotenoid (Xu và Pan, 2013) và được biết đến với chế phẩm sinh học (Crab và cộng sự, 2010) và đặc tính kích thích miễn dịch (Anguilera-Rivera và cộng sự, 2014).
Hệ thống nuôi dựa trên vi sinh vật rất phù hợp cho tôm vì những thay đổi về mặt cơ thể sẽ cho phép chúng tận dụng quần thể vi sinh vật và đồng hóa protein của vi sinh vật, bằng cách tận dụng sinh khối vi sinh vật làm thức ăn tự nhiên. Wasilesky và cộng sự (2006) đã báo cáo rằng năng suất tự nhiên trong hệ thống BFT cung cấp nguồn thức ăn tự nhiên tại chỗ cho sinh vật nuôi và tăng cường sự tăng trưởng và tỷ lệ sống. Có tài liệu cho thấy L. vannamei chủ yếu ăn mảnh vụn và sinh vật đáy (Cordova và PenaMessina, 2005), tiêu thụ các khối vi sinh vật trong hệ thống biofloc và có thể phát triển tốt (Hargreaves, 2013). Nuôi loài này trong hệ thống dựa trên biofloc đã cho thấy cải thiện hoạt tính của enzyme tiêu hóa, hiệu suất tăng trưởng và tỷ lệ sống (McInthos, 2000; Tacon và cộng sự, 2002; Buford và cộng sự, 2004; Xu và Pan, 2012).
Tác dụng của hạt flocs vi sinh có thể tác động lên Vibrio sp. cả bên trong lẫn bên ngoài và một số ký sinh trùng bên ngoài tôm (Panigrahi và cộng sự, 2014). Việc bổ sung carbohydrate định kỳ vào nước được biết là có tác dụng chọn lọc sự huy động polyhydroxy alkanoates (PHA) của vi khuẩn dưới dạng bioflocs có thể tạo ra poly-ß hydroxy butyrate (PHB), có tác dụng kháng sinh và điều hòa miễn dịch (Sinha và cộng sự, 2008) và khi tôm tiêu thụ các flocs này, PHA sẽ phân hủy trong ruột và góp phần tạo ra đặc tính kháng khuẩn (Defoirdt và cộng sự, 2007).
Các vi sinh vật trong bioflocs và các chất chuyển hóa tế bào có thể tăng cường hệ thống miễn dịch bẩm sinh của tôm và bảo vệ tôm chống lại vi khuẩn (Smith và cộng sự, 2003; Vazquez và cộng sự, 2009). Panigrahi và cộng sự (2007) cho rằng biofloc có một số vật liệu di truyền liên quan đến miễn dịch như prophenoloxidase (PO), enzyme kích hoạt PO và serine proteinase1, do đó có tác dụng điều hòa miễn dịch ở tôm. Kim và cộng sự (2014) đã kết luận rằng tổng số lượng tế bào máu (THC) và hoạt tính PO cao ở L. vannamei nuôi trong hệ thống nuôi cấy dựa trên vi sinh vật cho thấy rõ mức độ biểu hiện cao hơn đáng kể của các gen điều chỉnh hệ thống kích thích PO như proPO1, proPO2 và PPAE1.
Việc sử dụng chất nền nhân tạo là một kỹ thuật khác để nâng cao năng suất tôm. Những chất nền này có thể tạo không gian cho sự phát triển của vi sinh vật chứa các nhóm vi sinh vật không đồng nhất có thể hoạt động như thức ăn tự nhiên cho sinh vật nuôi và duy trì chất lượng nước (Langis và cộng sự, 1988; Ramesh và cộng sự, 1999; Thompson và cộng sự, 2002). Một số chất nền tự nhiên được sử dụng rộng rãi là tre, rơm rạ, gỗ, bã mía (van Dam và cộng sự, 2002) và một số chất nền nhân tạo như màn chắn polyethylene và polypropylene, chai nhựa và một số sản phẩm thương mại đã được sử dụng như trong hệ thống nuôi cá (Azim và cộng sự, 2004) và tôm (Huchette và cộng sự, 2000; Bratvold và Browdy, 2001; Richard và cộng sự, 2009; Zhang, 2011). Các phương pháp nuôi cấy dựa trên chất nền còn được gọi là hệ thống nuôi cấy dựa trên Periphyton bao gồm các hỗn hợp không đồng nhất như tảo, vi khuẩn, nấm, động vật nguyên sinh, động vật phù du, mảnh vụn và các động vật không xương sống khác (Azim và Wahab, 2005). Nó có thể hấp thụ các chất dinh dưỡng như amoniac và nitrit từ nước và duy trì lượng oxy hòa tan (DO) và độ pH (Azim và cộng sự, 2002; Dodds, 2003; Bender và cộng sự, 2004; Schveitzer và cộng sự, 2013).
Mục đích chính của đánh giá này là ứng dụng hệ thống nuôi dựa trên vi sinh vật trong nuôi tôm để sản xuất bền vững. Các thông tin trên chủ yếu tập trung vào việc sử dụng hỗn hợp phức tạp của các vi sinh vật như vi khuẩn, vi tảo dạng sợi, động vật nguyên sinh, rotifer, giun và các thành phần phi sinh học làm thức ăn tự nhiên cho tôm. Nhiều nghiên cứu đa dạng đã được thực hiện trong lĩnh vực này với kết quả thành công và hữu ích trong nuôi tôm. Ngoài ra, bài đánh giá này còn cung cấp kiến thức cơ bản về hệ thống biofloc cho sinh viên, nhà nghiên cứu và người trong ngành.
Sự phù hợp của BFT đối với nuôi tôm
Các yếu tố cơ bản trong việc lựa chọn loài để nuôi trong hệ thống biofloc bao gồm khả năng chịu đựng chất rắn lơ lửng cao trong nước, khả năng thích nghi sinh lý có thể ăn sinh khối vi sinh vật và tiêu hóa (Milstein và cộng sự, 2001; Crab và cộng sự, 2012; Hargreaves, 2013). Trong tự nhiên, tôm thẻ chân trắng ăn nhiều loại thực vật phù du, mảnh vụn, thực vật vĩ mô, động vật thân mềm nhỏ, động vật giáp xác và động vật phù du (Senanan và cộng sự, 2009). Một nghiên cứu của Kent và cộng sự (2011) đã chứng minh khả năng của tôm thẻ chân trắng L. vannamei ăn vi tảo được nuôi trong các bình nuôi cấy tảo. Do đó, các loài giáp xác như tôm là những loài thích hợp cho hệ thống BFT vì chúng là loài ăn mảnh vụn và ăn cơ hội, ăn vi khuẩn, nấm và các vật liệu phân hủy khác (Milstein và cộng sự, 2001). Coyle và cộng sự (2010) và Perez-Fuentes và cộng sự (2013) Tôm thích thức ăn tự nhiên hơn thức ăn thương mại vì chúng ăn liên tục. Hargreaves (2013) chỉ ra rằng các sinh vật nuôi như tôm và cá rô phi có những biến đổi về hình thái cho phép chúng ăn và tiêu hóa thức ăn tự nhiên như biofloc. Khả năng của nhiều loài tôm khác nhau sử dụng biofloc, nhờ tác dụng có lợi đối với các chức năng sinh lý và tăng trưởng đã được ghi nhận rõ ràng (Bảng 1).
Bảng 1. Các nghiên cứu về tôm và các loài tôm càng thích hợp cho hệ thống nuôi biofloc

Thành phần dinh dưỡng của Biofloc
Bioflocs là nguồn dinh dưỡng tốt nhất, nhưng còn phụ thuộc vào loại hệ thống, môi trường (Ju và cộng sự, 2008a; Hargreaves, 2013). Về bản chất, các sinh vật được nuôi ăn biofloc và bắt đầu quá trình tái chế chất dinh dưỡng trong hệ thống nuôi trồng thủy sản. Giá trị dinh dưỡng của biofloc đối với sinh vật nuôi phụ thuộc vào nhiều yếu tố, chẳng hạn như việc lựa chọn thức ăn, khả năng tiêu thụ và tiêu hóa (Hargreaves, 2006). Nhiều nghiên cứu khác nhau đã được tiến hành về chất lượng dinh dưỡng của biofloc làm thức ăn cho tôm. Biofloc chứa đủ lượng protein thô, lipid thiết yếu, carbohydrate và tro cần thiết cho thức ăn thủy sản (Crab và cộng sự, 2010; Ballester và cộng sự, 2010). Ballester và cộng sự (2010) đã báo cáo bifloc chứa 30,4% protein thô. Điều này phù hợp với nhận định 25-50% của Hargreaves (2013). Tuy nhiên, Ekasari và cộng sự (2014) lại báo cáo 17,2-27,8% protein cho biofloc thu hoạch từ hệ thống nuôi tôm, với Crab và cộng sự, (2010). Trong mạng lưới thức ăn vi khuẩn, lipid thiết yếu và axit béo không bão hòa đa (PUFA) là hầu hết được giải phóng từ các nhóm động vật nguyên sinh có roi và có lông mao cũng như các loài tảo lam khác (Zhukova và Kharlamenko, 1999), mặc dù phần lớn vi khuẩn không đủ nguồn cung cấp PUFA (Meyers và Latscha, 1997). Crab và cộng sự (2010) đã báo cáo rằng axit palmitic, axit palmitoleic và axit linoleic là nhóm axit béo chính trong biofloc.
Trong biofloc, thành phần axit béo có thể thay đổi tùy theo nguồn carbon, loại nước được sử dụng (nước ngọt, nước biển) và phương pháp sản xuất được đề xuất bởi Emerenciano và cộng sự (2013). Họ cũng báo cáo sự hiện diện của các axit béo thiết yếu như axit linoleic, axit linolenic và axit arachidonic, v.v., trong biofloc. Ekasari và cộng sự (2014) tìm thấy 6-7,5% hàm lượng lipid trong biofloc và nằm trong phạm vi tối ưu 0,5-15% theo Hargreaves (2013). Những biến đổi chính về đặc tính dinh dưỡng của sinh khối vi sinh vật xảy ra do sự phát triển khác nhau của hạt floc (Rittmann và Mc Carty, 2001). Ví dụ, vi khuẩn không thể phát triển trên cơ chất axetat và glycerol nhưng chúng có thể giải phóng một lượng lớn exopolysacarit nhưng được sử dụng bởi các sinh vật nuôi cấy chủ yếu dành cho sự phát triển của tế bào, điều này có thể nâng cao tỷ lệ protein trong sinh khối vi sinh vật (Crab và cộng sự, 2010). Các nghiên cứu này cho thấy giá trị dinh dưỡng của biofloc phụ thuộc vào tỷ lệ Carbon:Nitơ và tính chất của chất nền, v.v. Do đó, yếu tố cơ bản cho sự phát triển của biofloc là lựa chọn nguồn carbohydrate. Thành phần gần đúng của sinh khối vi sinh vật trong các nghiên cứu khác nhau được thể hiện trong Bảng 2.
Bảng 2. Phân tích gần đúng các hạt Biofloc trong các nghiên cứu khác nhau

Cộng đồng vi sinh vật trong Biofloc
Việc phát triển biofloc trong hệ thống bên ngoài mang lại lợi nhuận rất lớn do các sinh vật quang tự dưỡng được tạo ra dưới ánh sáng vào ban ngày (Ray và cộng sự, 2009; Avnimelech, 2012; Baloi và cộng sự, 2013) và màu nước có thể thay đổi từ loại tảo xanh sang loại vi khuẩn màu nâu bằng cách tăng tỷ lệ cho ăn và được tính cho các nhóm vi sinh vật dưới dạng chỉ số màu (Hargreaves, 2013). Sự thay đổi màu sắc này là một trong những phương pháp quan trọng nhất để giảm amoniac đối với các nhóm vi sinh vật, những vi sinh vật này cũng có thể cần sục khí nhiều hơn (Hargreaves, 2013). Các vi khuẩn có lợi trong BFT đang cung cấp thức ăn tự nhiên và duy trì chất lượng nước (Avnimelech, 2012). Trong BFT, vi khuẩn nitrat hóa hóa tự dưỡng và vi khuẩn đồng hóa amoniac dị dưỡng là hai nhóm vi khuẩn quan trọng để duy trì chất lượng nước (Ebeling và cộng sự, 2006; Ray và cộng sự, 2010a), với nhu cầu oxy cao và mức độ kiềm thấp, dẫn đến nhu cầu oxy cao, và cần cung cấp thêm DO (Ray và cộng sự, 2010a).
Con đường của vi khuẩn nitrat hóa trong hệ thống nuôi đã được nghiên cứu rộng rãi (Tal và cộng sự, 2003; Michaud và cộng sự, 2006; Crab và cộng sự, 2007). Nguyên tắc chính là chuyển đổi tổng nitơ amoniac thành nitrit và nitrit được chuyển thành nitrat ít độc hơn đối với cá (Peng và Zhu, 2006; Ray và cộng sự, 2010b; Hargreaves, 2013) và đồng thời TAN bị loại bỏ có thể phát triển thành protein tế bào và cung cấp thức ăn tự nhiên cho động vật nuôi (Ebeling và cộng sự, 2006; Ray và cộng sự, 2010a). Hơn nữa, tốc độ tăng trưởng của vi khuẩn dị dưỡng cao gấp 10 lần so với vi khuẩn nitrat hóa khi được cung cấp đủ carbon hữu cơ, điều này có thể dẫn đến giảm mức TAN và tăng quần thể vi sinh vật cũng như chất lượng dinh dưỡng. Một số nghiên cứu đã được thực hiện về cấu trúc quần xã vi sinh vật và thành phần của biofloc trong nuôi tôm (Hargreaves, 2006; Crab và cộng sự, 2012; Hargreaves, 2013). Một số nghiên cứu đã được thực hiện về cấu trúc quần thể vi sinh vật và thành phần của bioflocs trong nuôi tôm (Ju và cộng sự, 2008a; Ballester và cộng sự, 2010; Anand và cộng sự, 2014; Ekasari và cộng sự, 2014; Kumar và cộng sự, 2015). Theo Ju và cộng sự (2008), sinh khối vi sinh vật từ bể nuôi L. vannamei có 24,6% thực vật phù du (chủ yếu là tảo cát như Thalassiosira, Chaetoceros và Navicula), 3% nhóm vi khuẩn (2/3 là gam âm và 1- một phần ba gam dương), một lượng nhỏ động vật nguyên sinh (98% trùng roi, 1,5% rotifer và 0,5% amip), 33,2% vật chất chết và tro còn lại (39,25%). Nó chỉ ra rằng sinh khối vi sinh vật có các nhóm sinh vật không đồng nhất. Biofloc từ các bể nuôi F. paulensis bao gồm các vi khuẩn dị dưỡng, vi khuẩn lam, tảo hai roi, trùng lông, trùng roi và luân trùng (Ballester và cộng sự, 2010).
Anand và cộng sự (2014) cho thấy các nhóm vi sinh vật chiếm ưu thế là Vibrio sps, LactoBacillus sps, Bacillus sps và nấm trong biflocs. Tuy nhiên, Vibrio sp. và Bacillus sp. chiếm ưu thế trên LactoBacillus sp. Các vi khuẩn probiotic như Bacillus sps. và LactoBacillus sp. trong đường tiêu hóa (GIT) của L. vannamei có thể dẫn đến tăng cường hoạt tính của enzyme tiêu hóa và phản ứng miễn dịch (Xu và Pan, 2013). Bacillus và LactoBacillus tiết enzyme tiêu hóa trong hệ thống bổ sung carbon cho thấy tốc độ tăng trưởng tốt hơn (Ringo và cộng sự, 2012; Anand và cộng sự, 2014). Sinh khối vi sinh vật trong BFT có thể làm tăng khả năng tiêu hóa và đồng hóa của tôm, mang lại tốc độ tăng trưởng và tỷ lệ sống tốt nhất (Anand và cộng sự, 2014). Trong một nghiên cứu khác của Ekasari và cộng sự (2014) cho thấy tổng số vi khuẩn sống (TBC) thấp hơn đáng kể (P < 0,05) trong nước của hệ thống bán thâm canh thông thường so với hệ thống biofloc. Kumar và cộng sự (2015) đã báo cáo rằng mật đường được bổ sung vào bể xử lý có lượng TBC và Vibrio cao nhất so với hệ thống không có biofloc.
Vai trò của vi sinh vật trong việc kích thích hoạt động của enzyme tiêu hóa
Sinh khối vi sinh vật trong BFT đóng vai trò chính trong việc kích thích hoạt tính của enzyme tiêu hóa ở tôm (Moss và cộng sự, 2001; Xu và cộng sự, 2012a) có thể làm tăng tốc độ tăng trưởng của tôm (Anand và cộng sự, 2014). Xu và Pan (2012) phát hiện hoạt tính của enzyme protease và amylase tăng ở tôm thẻ chân trắng L. vannamei được nuôi trong hệ thống BFT. Các nhóm vi khuẩn có lợi như Bacillus sps. trong biofloc giúp thay đổi tình trạng sinh lý và miễn dịch của vật nuôi bằng cách xâm nhập của vi khuẩn vào GIT (Zhao và cộng sự, 2012; Xu và Pan, 2013). Các nghiên cứu trên các dòng tương tự đã cho thấy mức độ hoạt tính của enzyme tiêu hóa tăng lên ở cá và tôm được nuôi bằng khẩu phần ăn bổ sung men vi sinh, vi tảo và Periphyton (Lara-Flores và cộng sự, 2003; Ziaei-Nejad và cộng sự, 2006; Anand và cộng sự, 2014). Ở tôm, các hạt floc vi sinh vật cho thấy tác động tích cực đối với hoạt tính của enzyme có thể đẩy nhanh quá trình tiêu hóa và sử dụng thức ăn theo đề xuất của Xu và Pan (2014). Việc cho tôm ăn các khối vi sinh vật ở mức 4% và 8% có thể làm tăng hiệu suất tăng trưởng và hoạt tính của enzyme tiêu hóa như amylase, cellulose và protease trong hệ thống BFT so với đối chứng được báo cáo bởi (Anand và cộng sự, 2014).
Vai trò của vi sinh vật trong việc duy trì chất lượng nước
Hệ thống flocs là một công nghệ khác giúp giữ chất lượng nước tốt hơn nhờ hoạt động tại chỗ của vi khuẩn sống trong nước, chủ yếu là nhóm vi khuẩn dị dưỡng (Avnimelech 1999 & 2012; Hargreaves, 2013). Việc bổ sung bột sắn vào hệ thống nuôi P. monodon có thể làm giảm tổng lượng nitơ amoni và nồng độ NO2-N được báo cáo bởi Hari và cộng sự (2004 & 2006). Việc bổ sung bột sắn vào hệ thống nuôi M. rosenbergii làm giảm đáng kể nồng độ TAN và NO2-N được báo cáo bởi Asaduzzaman và cộng sự (2008). Ray và cộng sự (2011) đã đo nhiệt độ nước, DO, pH và độ mặn 2 lần/ngày và TAN, nitrit và nitrat mỗi tuần một lần trong hệ thống nuôi L. vannamei với hai mức biofloc tức là mức biofloc thấp (T-LS) và hàm lượng biofloc cao (T-HS) cho thấy hàm lượng TAN, NO2 cao hơn và NO3 thấp hơn ở T-LS so với nghiệm thức THS. Raj Kumar và cộng sự (2015) đã nghiên cứu trong ba hệ thống biofloc khác nhau là mật đường, bột sắn và lúa mì về chất lượng nước, thành phần khối vi sinh vật và sự phát triển ở L. vannamei cho thấy mức độ loài nitơ trong hệ thống biofloc ít hơn đáng kể so với hệ thống đối chứng không có biofloc. Luis-Villaseñor và cộng sự (2015) đã đo nhiệt độ nước, DO, pH, độ mặn hai lần mỗi ngày và TAN, nitrite và nitrat ở các khoảng thời gian hàng tuần trong nuôi L. vannamei cho thấy nồng độ TAN, nitrite và nitrat trong hệ thống BFT thấp hơn đáng kể so với hệ thống đối chứng. Tuy nhiên, Effendy và cộng sự (2016) đã quan sát thấy giá trị NO2 và NO3 trong hệ thống bán biofloc cao hơn đáng kể (P < 0,01) so với hệ thống nuôi bán thâm canh của Fenneropenaeus indicus. Manan và cộng sự (2017) cũng đã tiến hành thử nghiệm quy trình xử lý sinh học trong công nghệ biofloc của P. monodon và kết luận rằng các vi sinh vật trong biofloc đóng vai trò là tác nhân xử lý sinh học tự nhiên đảm bảo chúng có thể duy trì chất lượng nước tối ưu cho tôm.
Vai trò của vi sinh vật trong việc thúc đẩy tăng trưởng ở tôm. Hiệu quả tăng trưởng hết sức quan trọng đối với người nuôi trồng thủy sản trên toàn thế giới. Lợi ích của biofloc đối với sự tăng trưởng và tỷ lệ sống của tôm đã được báo cáo bởi Hari và cộng sự (2004), Wisielesky và cộng sự (2006), De Schrvey và cộng sự (2008), Avnimelech và Kochba (2009), Krummenaeuer và cộng sự, (2011), Xu và Pan (2012), Kim và cộng sự (2014), Kumar và cộng sự (2015), Luis-Villasenor và cộng sự, (2015) và Effendy và cộng sự (2016). Tôm chủ yếu ăn mảnh vụn (Focken và cộng sự, 1998), ăn vi khuẩn, nấm và vật liệu phân hủy (Milstein và cộng sự, 2001; Serfling, 2006), do đó có khả năng sử dụng biofloc làm thức ăn. Biofloc có thể cải thiện tốc độ ăn vào, hấp thu, đồng hóa chất dinh dưỡng và có thể cung cấp nguồn dinh dưỡng tế bào ở tôm thẻ chân trắng (Tacon và cộng sự, 2002). Cho tôm hoặc cá ăn biofloc có rất nhiều lợi ích như cung cấp các chất dinh dưỡng khác nhau từ cộng đồng vi sinh vật, tăng cường sử dụng thức ăn và tăng trưởng, kích thích hoạt tính của enzyme tiêu hóa, giảm FCR và tăng cường hệ thống miễn dịch (Burford và cộng sự, 2004; Moss và cộng sự cộng sự, 2006; Wasielesky và cộng sự, 2006; Ballester và cộng sự, 2010; Jang và cộng sự, 2011; Emerciano và cộng sự, 2012; Xu và Pan, 2012; Perez-Fuentes và cộng sự, 2013).
Xu và Pan (2012) báo cáo tỷ lệ sống cao hơn và tăng trưởng tốt hơn của tôm thẻ chân trắng trong hệ thống BFT có bổ sung carbohydrate. Hargreaves (2013) báo cáo rằng 20-30% tăng trưởng của tôm trong hệ thống nuôi dựa trên biofloc thu được từ protein vi sinh vật trong nước. Tốc độ đồng hóa protein và lipid trong các nghiệm thức xử lý bằng biofloc cho thấy sự đóng góp tích cực của biofloc có nguồn gốc từ chất thải làm thức ăn tự nhiên cho các sinh vật nuôi có FCR thấp hơn trong hệ thống BFT (Megahed và cộng sự, 2010; Zhao và cộng sự, 2012; Xu và cộng sự, 2012; Gao và cộng sự, 2012). Xu và cộng sự (2012) đã báo cáo rằng bể thức ăn BFT – 30% và BFT 35% protein thô (CP) có mức tăng trọng và SGR cao hơn đáng kể ở tôm thẻ chân trắng L. vannamei khi so sánh với đối chứng (nước sạch và thức ăn 35% CP) và không có sự khác biệt đáng kể (P <0,05) giữa BFT25%, BFT-30% và BFT-35%. Anand và cộng sự (2014) đã đánh giá tác dụng của biofloc dưới hai nguồn carbohydrate (bột gạo-R và mật đường-M) và khẩu phần hai mức protein (32% và 40%) ở tôm giống P. monodon cho thấy tốt hơn (P < 0,01) ở các nghiệm thức (40 + R), (40 + M) và (32 + R) so với nhóm đối chứng (khẩu phần 32% và 40% protein không có biofloc). Kumar và cộng sự (2015) nhận thấy mức tăng trọng (P < 0,05) và tỷ lệ chuyển đổi protein cao hơn đáng kể ở tôm thẻ chân trắng L. vannamei được cho ăn khẩu phần ăn 35% protein trong hệ thống biofloc với bột ngô là nguồn carbohydrate so với tôm đối chứng không có biofloc. Effendy và cộng sự (2016) đã quan sát thấy tốc độ tăng trưởng tăng đáng kể (P<0,01) của Fenneropenaeus indicus được nuôi bằng thức ăn 35% protein trong hệ thống biofloc khi so sánh với hệ thống nước sạch.
Biofloc cho quản lý sức khỏe tôm
Sự hiện diện của sinh khối vi sinh vật trong hệ thống nuôi đã được báo cáo là giúp tăng cường sức khỏe của sinh vật nuôi, điều này có thể là do sự ức chế mầm bệnh được báo cáo bởi Bricknell và Dalmo (2005). Bioflocs là công nghệ mới để quản lý dịch bệnh có tác dụng vi sinh có lợi trái ngược với các nguyên liệu thông thường như kháng sinh, kháng nấm, bổ sung men vi sinh và prebiotic bên ngoài (Emerenciano và cộng sự, 2013). Hơn nữa, biofloc được báo cáo là chứa một lượng lớn các vi khuẩn và các hợp chất hoạt tính sinh học có tác dụng tích cực đối với sức khỏe của tôm (Xu và Pan, 2013).
Biofloc cũng có các loại đường amin như glucosamine, axit muramic, bromophenol, phytosterol và các sắc tố như carotenoid, chlorophylls và xanthophylls (Ju và cộng sự, 2008a) có thể nâng cao tình trạng miễn dịch của tôm bằng cách kích thích hệ thống miễn dịch (LinanCabello và cộng sự, 2002; Burford và cộng sự, 2004). Trong hệ thống BFT, việc bổ sung carbohydrate thường xuyên có thể tăng cường sự phát triển của các vi sinh vật tổng hợp polyhydroxyalkanoate (PHA) (Salehizadeh và Shojaosadati, 2001). Vi khuẩn và các hợp chất tổng hợp có thể hoạt động như tác nhân kiểm soát sinh học hiệu quả đồng thời cung cấp cho vật chủ sự cân bằng vi khuẩn có lợi trong ruột (Emerenciano và cộng sự, 2013).
Phản ứng miễn dịch của tôm trong hệ thống biofloc
Loài giáp xác có hệ thống miễn dịch không đặc hiệu với các thành phần thực bào và dịch thể, là cơ chế phòng vệ quan trọng nhất (Lee và Soderhall, 2001). Các chất kích thích miễn dịch phổ biến như peptide, lipopolysacarit, men vi sinh, vi tảo, carotenoid, vitamin và peptide (Devaraja và cộng sự, 1998; Ringo và cộng sự, 2012). Chúng có thể nâng cao khả năng miễn dịch ở tôm và nâng cao khả năng loại bỏ vi khuẩn gây bệnh (Flegel, 1997; Nonwachai và cộng sự, 2010). Ju và cộng sự (2008a, b) và Anguilera-Rivera và cộng sự (2014) cho rằng các khối vi sinh vật có thể mang lại lợi ích cho hệ thống miễn dịch của tôm nhờ sự hiện diện của carotenoids, retinoids, poly-βhydroxybutyrate và exoenzyme. Các vi sinh vật đã được sử dụng làm chất kích thích miễn dịch để tăng cường hệ thống miễn dịch và/hoặc tình trạng chống oxy hóa của tôm, sau đó làm tăng sức đề kháng của chúng đối với vi khuẩn gây bệnh (Ninawe và Selvin, 2009; Smith và cộng sự, 2003; Becerra-Dorame, 2012). Đã có báo cáo rằng một đợt bùng phát dịch bệnh Hội chứng hoại tử gan tụy cấp tính (AHPNS) với tỷ lệ chết lớn trong nuôi tôm có tỷ lệ mắc bệnh thấp hơn ở các hệ thống BFT (NACA, 2012), điều này cho thấy biofloc có thể có tác động tích cực đến phản ứng miễn dịch của tôm.
Ba loại tế bào máu khác nhau ở tôm: bạch cầu hạt, tế bào máu dạng hạt và bán hạt (SGH) đã được ghi nhận (Rodriguez và Le Moullac, 2000). Các tế bào máu thực hiện các hoạt động khác nhau như thực bào, bao bọc, hình thành nốt sần (Soderhall và Cerenius, 1992; Vargas-Albores và cộng sự, 1998) và sản xuất enzyme Propo (Lopez và cộng sự, 1996). Trong hệ thống phòng vệ của tôm, các tế bào hạt đóng vai trò quan trọng bởi phản ứng kháng khuẩn (Chisholm và Smith, 1995), tương tự, bạch cầu hạt hoạt động như một tế bào thực bào và tham gia vào quá trình sản xuất agglutinin và peptide kháng khuẩn (Rodriguez và Le Moullac, 2000).
Tầm quan trọng của tổng số lượng tế bào máu (THC) đối với khả năng kháng bệnh của tôm đã được ghi nhận (Rodriguez và Le Moullac, 2000; Ji và cộng sự, 2009; Xu và Pan, 2013). Rodriguez và Le Moullac (2000) đã báo cáo rằng giá trị THC thấp ở L. stylirostir trở nên rất nhạy cảm với Vibrio alginolyticus độc hại. Ở tôm He, THC có từ 20 – 40 x 106 tế bào/ mL hemolymp (Chang và cộng sự, 1999). Số lượng tế bào máu tăng lên đã được ghi nhận sau khi cho tôm ăn các chất bổ sung thức ăn như men vi sinh (Rengpipat và cộng sự, 2000), β-glucan (Lopez và cộng sự, 2003), khẩu phần ăn bổ sung tảo vĩ mô và β -carotene (Supamattaya và cộng sự, 2005). Các vi sinh vật biofloc được tôm ăn vào có thể giải phóng các chất trong đường tiêu hóa có khả năng kích thích khả năng miễn dịch bẩm sinh và giải phóng nhiều tế bào máu hơn vào vòng tuần hoàn (NACA, 2012).
Xu và Pan (2013) cao hơn đáng kể THC và hoạt động thực bào của tế bào máu ở tôm thẻ chân trắng nuôi trong môi trường nuôi cấy BFT so với đối chứng. Tôm thẻ chân trắng nuôi trong bể vi sinh có bổ sung hàm lượng protein từ 20% đến 35% cho thấy không có sự khác biệt về tổng số lượng tế bào máu và tình trạng miễn dịch giữa các bể xử lý cũng cho thấy không có tác dụng khi giảm hàm lượng protein trong bể biofloc (Xu và Pan, 2014). Ekasari và cộng sự (2014) không tìm thấy sự khác biệt đáng kể về THC trong nuôi tôm thẻ chân trắng trong bể biofloc khi sử dụng các nguồn carbon khác nhau. Tuy nhiên, THC của tôm chân trắng từ hệ thống biofloc có giá trị cao hơn so với đối chứng. Toledo và cộng sự (2014) cũng báo cáo không có sự khác biệt đáng kể về THC của tôm thẻ chân trắng L. vannamei được cho ăn khẩu phần ăn với 3 loại lipid khác nhau trong khẩu phần ăn được nuôi trong hệ thống biofloc dựa trên mật đường. Số lượng tế bào THC, bạch cầu hạt và hyaline cao hơn đáng kể đã được quan sát thấy trong hemolymp của tôm giống P. monodon được nuôi trong hệ thống biofloc dựa trên bột gạo so với đối chứng không có biofloc (kumar và cộng sự, 2015). Tôm con F. indicus được nuôi trong ao bifloc có THC cao hơn (P < 0,01) trong hemolymp so với tôm không có biofloc trước và sau thử nghiệm cảm nhiễm (Effendy và cộng sự, 2016).
Ở động vật giáp xác, các thành phần bạch huyết như protein, albumin, glucose, chất béo trung tính và cholesterol phản ánh chất lượng dinh dưỡng của tôm và nó cao ở tôm được nuôi bằng thức ăn tự nhiên (Gong và cộng sự, 2000) hoặc do tôm bị căng thẳng (Hall và Ham, 1998; LaraFlores và cộng sự, 2007). Trong protein huyết thanh của tôm có khoảng 90-95% haemocyanin (Depledge và Bjeregaard, 1989) và do đó việc giảm nó có thể ảnh hưởng đến các protein miễn dịch cụ thể của động vật đó (Perazzolo và cộng sự, 2002). Nồng độ protein tổng số trong huyết thanh ở tôm sú được báo cáo là giảm sau khi tiếp xúc với lượng nitơ nitrit cao hơn (Chen và Cheng, 1995).
Một nghiên cứu thực nghiệm của Anand (2012) cho thấy mức protein huyết thanh (P < 0,05) cao hơn đáng kể ở tôm giống P. monodon được nuôi bằng khẩu phần ăn kết hợp biofloc khi so sánh với thức ăn không có thành phần biofloc. Kumar và cộng sự (2015) đã báo cáo mức protein huyết thanh (P < 0,01) cao hơn đáng kể ở tôm giống P. monodon được nuôi trong hệ thống có flocs so với hệ thống thông thường. Trong hoạt động proPO, cả tế bào bán hạt và tế bào hạt đều hoạt động có vai trò nhận dạng và bảo vệ ở động vật giáp xác (Rodriguez và Le Moullac, 2000; Chiu và cộng sự, 2007). Phenoloxidase là một enzyme của động vật giáp xác có tác dụng làm hắc tố các tế bào lạ để làm bất hoạt và ngăn chặn sự nhân lên của chúng trong vật chủ. Phenoloxidase chủ yếu được sản xuất bởi thành tế bào của vi khuẩn như β-1,3-glucans và lipopolysaccharides (LPS) (Perazzolo và Barracco, 1997; Sritunyalucksana và Soderhall (2000); Cerenius và Soderhall, 2012). Tôm đang tiêu thụ biofloc như một loại thực phẩm tự nhiên trong hệ thống BFT (Crab và cộng sự, 2012; Ekasari và cộng sự, 2014) làm tăng hoạt tính THC và PO đã được xác nhận rõ ràng trong hệ thống biofloc L. vannamei bởi Kim và cộng sự, (2014) cho thấy mức độ cao hơn đáng kể của gen proPO1, proPO2 và PPAE1cos thể điều chỉnh hệ thống kích hoạt proPO. Hoạt tính PO cao hơn ở L. vannamei nuôi trong hệ thống biofloc cũng được quan sát thấy trong cả thử nghiệm trước và sau cảm nhiễm bằng cách tiêm virus hoại tử cơ (IMNV) so với tôm từ hệ thống đối chứng không biofloc (Ekasari và cộng sự, 2014). Kumar và cộng sự (2015) đã báo cáo hoạt tính phenoloxidase huyết thanh (P < 0,05) cao hơn ở tôm giống P. monodon được nuôi trong hệ thống BFT so với hệ thống đối chứng.
Ở động vật giáp xác, lysozyme là chất bảo vệ chính chống lại mầm bệnh (Vazquez và cộng sự, 2009). Lysozyme không xương sống (i-lyz) tấn công cả vi khuẩn Gram dương (Vocadlo và cộng sự, 2001) và vi khuẩn G-ve (PeregrinoUriarte và cộng sự, 2012). C-lyz (giống như lysozyme lòng trắng trứng gà) đã được xác định ở nhiều loài giáp xác khác nhau như L. vannamei (Mundo và cộng sự, 2003), P. Japonicas (Hikima và cộng sự, 2003), P. chinensis (Bu và cộng sự, 2008), P. monodon (Supungul và cộng sự, 2002; Tyagi và cộng sự, 2007), F. merguiensis (Mai và Hu 2009) và L. stylirostris (Lorgeril và cộng sự, 2005; Mai và Hu, 2009). Vega và cộng sự (2006) đã báo cáo hoạt động kháng khuẩn của c-lyz từ L. vannamei chống lại V. alginolyticus, V. parahemolyticus và V. cholerae. Chen và cộng sự (2015) đã báo cáo hoạt tính lysozyme giảm ở tôm thẻ chân trắng ngâm trong nước biển có chiết xuất Gracilaria tenuistipitata 600 ppm sau 72 giờ sau stress amoniac (5 ppm) nhưng trong nhóm đối chứng, hoạt tính lysozyme giảm đáng kể (P < 0,05) sau 24 giờ tiếp xúc với 5 ppm amoniac. Do đó, tôm thẻ chân trắng có bổ sung chiết xuất Gracilaria tenuistipitata cho thấy hoạt tính lysozyme giảm chậm và phục hồi nhanh so với giá trị thực tế, và cho thấy phản ứng miễn dịch tích cực của lysozyme chống lại stress amoniac.
Sản xuất và duy trì biofloc
Bioflocs được định nghĩa là các tập hợp (floc) của tảo, thực vật phù du, vi khuẩn tự do và bám dính, vật ăn của vi khuẩn như trùng lông, trùng roi, luân trùng, tuyến trùng và giáp xác chân chèo, vật chất sống và chết như phân và thức ăn thừa (Hargreaves, 2006; Crab và cộng sự, 2009; Ray và cộng sự, 2010b; Ballester và cộng sự, 2010; Hargeaves 2013), nấm men, vi khuẩn lam (Becerra-Dorame, 2012), colloids, polyme hữu cơ, cation và tế bào chết (De Schryver và cộng sự, 2008) và các hạt vô cơ (Burford và cộng sự, 2003). Các biofloc thông thường có dạng không đồng đều, có sự phân bố kích thước hạt đa dạng, mịn, dễ nén, có độ xốp cao và có thể thấm qua chất lỏng (Chu và Lee, 2004). Sự phát triển của biofloc trong bể nuôi mới đòi hỏi chất cấy như đất hoặc nước có hàm lượng vi sinh vật cao từ hệ thống sản xuất trước đó (Gaona và cộng sự, 2011). Avnimelech (1999) đã báo cáo việc sử dụng 20 g đất sét, 10 mg Ammonium Sulphate [(NH4)2SO4] và 200 mg glucose (nguồn carbohydrate) lắc trong 12 giờ với 1L nước máy để sản xuất bioflocs ban đầu. Tương tự, sử dụng 20 g đất đáy ao trong 1L nước có sục khí chứa 10 mg (NH4)2SO4 và 400 mg các nguồn carbon khác nhau như bột sắn, lúa mì, ngô và bã mía và được ủ trong 24 giờ để phát triển floc ban đầu.
Yếu tố chính cho sự hình thành các hạt floc vi sinh vật là khả năng của các tế bào vi sinh vật hình thành các tập hợp vi sinh vật và đặc tính cảm nhận đại biểu quorum sensing (De Schryver và cộng sự, 2008). Các yếu tố góp phần khác là tỷ lệ carbon:nitơ, loại nguồn carbon và nitơ vô cơ, sục khí, pH, nhiệt độ, v.v. Tỷ lệ C:N đóng vai trò quan trọng trong hệ thống BFT (Hargreaves, 2013), và là một yếu tố thiết yếu trong phát triển nitơ vô cơ thành tế bào vi sinh vật (Avnimelech, 1999; McIntosh, 2000; Hargreaves, 2013). Tỷ lệ chuyển đổi của vi khuẩn dị dưỡng nói chung là 40-60%, tỷ lệ carbon:nitơ trong thức ăn phải từ 10 trở lên là cần thiết cho sự phát triển của vi khuẩn dị dưỡng (Avnimelech, 1999). Bằng cách tăng tỷ lệ C:N, vi khuẩn dị dưỡng có thể hấp thụ amoniac từ nước và chuyển hóa thành sinh khối vi sinh vật, chứa protein (Hargreaves, 2013). Fontenot và cộng sự (2007) đã sử dụng bốn tỷ lệ C:N (5:1, 10:1, 20:1 và 30:1) trong nuôi tôm bằng cách cung cấp mật đường và kết luận rằng tỷ lệ C:N là 10:1 cho kết quả tốt hơn về khả năng loại bỏ nitơ vô cơ khỏi nước ở mức độ cao. Tuy nhiên, Luo và cộng sự (2014) đã báo cáo rằng tỷ lệ C:N phải > 10:1. Hargreaves (2013) báo cáo rằng tỷ lệ C:N 12-15:1 sẽ hỗ trợ vi khuẩn dị dưỡng. Hơn nữa đã có báo cáo tỷ lệ C:N tối ưu từ 15-20:1.
Trong trường hợp mức TAN cao, Avnimelech (2012) đề xuất sử dụng 20 ppm carbon hữu cơ để giảm mức TAN xuống 1 mg/l. Việc bổ sung carbon hữu cơ trong hệ thống biofloc rất gần với tỷ lệ cho ăn và hàm lượng protein hoặc hàm lượng nitơ trong khẩu phần (Hargreaves, 2013). Ông báo cáo rằng cứ mỗi kg thức ăn có 30-38% protein được thêm vào nước thì cần cung cấp 0,5-1 kg carbohydrate để duy trì tỷ lệ C:N cao.
Việc bổ sung nitơ vô cơ và carbohydrate là nguyên liệu chính để sản xuất số lượng lớn vi khuẩn dị dưỡng trong hệ thống BFT (Avnimelech, 1999; Ebeling và cộng sự, 2006). Vi khuẩn dị dưỡng sử dụng nitơ vô cơ được tạo ra từ thức ăn, chất bài tiết hoặc phân bón (Ammonium Sulphate). Carbohydrate hoạt động như một chất nền để xử lý BFT và phát triển các khối vi sinh vật (Avnimelech, 1999). Mặc dù vậy, việc lựa chọn nguồn carbon phụ thuộc vào chi phí, tính sẵn có, khả năng phân hủy sinh học và hiệu quả đồng hóa của vi khuẩn. Các loại nguồn carbon khác nhau được sử dụng cho các loài nuôi khác nhau trong hệ thống BFT được trình bày trong bảng 3.
Bảng 3. Các nguồn carbon khác nhau được thử nghiệm trong hệ thống BFT
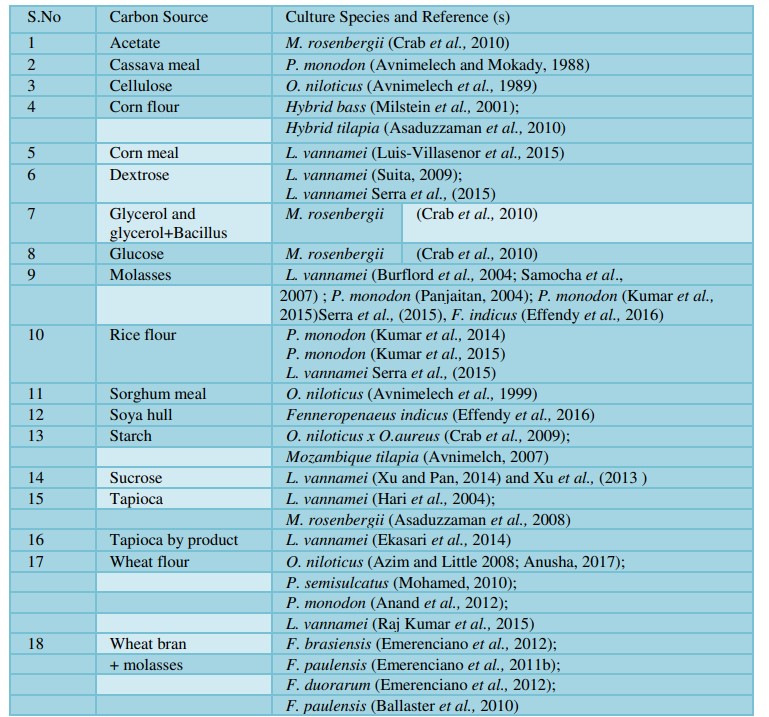
Việc bổ sung carbohydrate hữu cơ có liên quan đến tỷ lệ cho ăn và thường được thêm vào nước 1 hoặc 2 lần trong ngày sau khi cho ăn (Avnimelech, 1999; Azim và Little, 2008; Xu và cộng sự, 2012). Bột lúa mì được sử dụng làm carbon vì dễ tiếp cận và tạo ra các khối vi sinh vật có chất lượng tốt nhất (Azim và little, 2008; Ballester và cộng sự, 2010; Anand và cộng sự, 2014; Raj Kumar và cộng sự, 2015). Anand và cộng sự (2014) đã sử dụng 4,03 kg bột mì để tạo ra 1kg hạt floc. Trước đó, Kuhn và cộng sự (2009) đã báo cáo rằng có thể tạo ra 1 kg floc vi sinh vật từ 1,5 kg sucrose trong lò phản ứng sinh học.
Raj Kumar và cộng sự (2015) đã báo cáo rằng việc bổ sung bột mì có thể giúp phát triển các khối vi sinh vật và duy trì chất lượng nước cũng như tăng năng suất tôm trên các hệ thống biofloc sử dụng mật đường, bột sắn. Tương tự, Anusha (2017) đã quan sát thấy thành phần kết tụ tốt nhất trong bột mì được sản xuất biofloc khi so sánh với bột sắn, bột gạo và mật đường là nguồn carbon.
Sự phù hợp của công nghệ Biofloc dựa trên chất nền cho nuôi tôm
Chất nền nhân tạo là phương pháp mới được sử dụng trong quá trình tăng trưởng của động vật thủy sản để nâng cao hiệu quả trong hệ thống nuôi (Schveitzer và cộng sự, 2013). Chất nền nhân tạo như tấm polyetylen và polypropylen, chai nhựa, lưới và các vật liệu khác đã được sản xuất và sử dụng trong các điều kiện nuôi cấy khác nhau và báo cáo về các thí nghiệm này cho thấy những chất nền này có thể làm tăng đáng kể năng suất và tỷ lệ sống của tôm (Huchette và cộng sự, 2000; Bratvold và Browdy 2001; Richard và cộng sự, 2009; Zhang, 2011; Zhang và cộng sự, 2014). Vi tảo tự dưỡng và động vật phù du có trong ngoại vi của các phương pháp dựa trên chất nền cung cấp thức ăn tại chỗ dưới dạng các thành phần vi tảo, viz, tảo cát, trùng lông, trùng roi, giáp xác chân chèo và tuyến trùng để nuôi sinh vật (Arnold và cộng sự, 2005; Abreu và cộng sự, 2007; Fernandes da Silva và cộng sự, 2008; AudeloNaranjo và cộng sự, 2010). Theo Burford và cộng sự (2004), thực vật biểu sinh cung cấp cacbon và nitơ (39-53%) cho tôm vì chúng có thể dễ dàng được tôm sử dụng. Trong nuôi thâm canh, chất nền cung cấp thêm diện tích bề mặt cho tôm, có thể làm giảm sự cạnh tranh về không gian và ăn thịt đồng loại (Abdussamad và Thampy, 1994). Các động vật sống ở đáy như tôm bị giới hạn trong không gian hai chiều hơn là không gian ba chiều (Kumlu và cộng sự, 2001; Otoshi và cộng sự, 2006) và đã phản ánh rằng chất nền nhân tạo làm tăng không gian sống (Tidwell và cộng sự, 1999; Arnold và cộng sự, 2005; 2006; Zarain-Herzberg và cộng sự, 2006). Việc bổ sung chất nền thẳng đứng vào môi trường nuôi tôm giúp loại bỏ các chất rắn lơ lửng có thể làm giảm đáng kể lượng chất ô nhiễm hữu cơ (Langis và cộng sự, 1988; Hargreaves, 1998; Ramesh và cộng sự, 1999).
Giá trị dinh dưỡng của Periphyton
Periphyton được định nghĩa là một vật liệu phức tạp gắn trên chất nền ngâm bao gồm thực vật phù du, động vật phù du, sinh vật đáy và mảnh vụn (Weitzel, 1979; Azim và cộng sự, 2004). Vi tảo được sản xuất trên chất nền là nguồn cung cấp các hợp chất dinh dưỡng cao như axit béo, axit amin, vitamin và sắc tố (Thompson và cộng sự, 2002; Rajkumar và Kumaraguru-Vasagam, 2006; Khatoon, 2006). Động vật nguyên sinh và tuyến trùng là nguồn cung cấp axit béo chính. Tảo cát có thể cung cấp các axit béo thiết yếu và hàm lượng chất xơ thấp hơn nên tôm có thể dễ dàng tiêu hóa (Zhukova và Kharlamenko, 1999). Ví dụ, ấu trùng Penaeus cần 44% protein và sinh vật thức ăn tự nhiên đóng vai trò quan trọng trong tăng trưởng (Colvin và Brand, 1977). Việc sử dụng Periphyton giúp nâng cao chất lượng dinh dưỡng của tôm (Audelo-Naranjo và cộng sự, 2011) và nó cũng phụ thuộc vào loại chất nền và thời gian ngâm. Ledger và Hidrew (1998) ghi nhận 2-3% protein, 0,04-0,29% lipid và 29-33% carbohydrate trong Periphyton phát triển trên đá. Azim và cộng sự (2002) ghi nhận rằng nhiều protein từ tre (32%), tiếp theo là kanchi (30%) và thanh đay (13%). Keshavanath và cộng sự (2004) ghi nhận hàm lượng protein trong Periphyton trên tre là 19,27-35,56%. Becker (2007) báo cáo 35-63% protein, 10-57% lipid và 2-22% chất béo và một số loại tảo.
Chất lượng nước trong hệ thống chất nền
Periphyton trên giá thể ngâm đóng vai trò chính trong việc duy trì chất lượng nước trong ao nuôi. Tảo trên chất nền làm tăng quá trình nitrat hóa và giữ hàm lượng TAN và nitrit trong nước ở mức thấp (Ramesh và cộng sự, 1999; Thompson và cộng sự, 2002; Khatoon và cộng sự, 2009). Chất nền nhân tạo có thể làm giảm độ đục của nước và lượng sinh vật phù du trong nước (Asaduzzaman và cộng sự, 2008; 2009a). Drenner và cộng sự (1997) đã sử dụng cá và vi khuẩn để loại bỏ chất dinh dưỡng khỏi nước. Azim và cộng sự (2001) báo cáo rằng chất rắn lơ lửng trong nước bị giữ lại trên bề mặt, có thể khử amoniac và nitrat, tạo ra oxy, phân hủy chất hữu cơ và tăng cường quá trình nitrat hóa. Periphyton hiện diện trên chất nền ngoài khả năng đồng hóa amoniac và nitrit, còn có thể duy trì mức oxy hòa tan tối ưu, duy trì độ pH của nước (Azim và cộng sự, 2002; Dodds, 2003; Bender và cộng sự, 2004; Schveitzer và cộng sự, 2013). Arnold và cộng sự (2006) đã đánh giá các thông số chất lượng nước hàng tuần khi nuôi P. Monodon (PL15) trong 56 ngày ở hai mật độ thả giống (1000/m3 & 2000/m3) khi có giá thể nhân tạo và không có giá thể nhân tạo. Báo cáo hàng tuần cho thấy không có sự khác biệt đáng kể (P > 0,05) về nhiệt độ, oxy hòa tan và pH giữa tất cả các bể. Nồng độ trung bình được họ ghi lại đối với TAN, nitrit và nitrat có và không có chất nền nhân tạo là 0,39±0,17 ppm và 0,86±0,15 ppm; lần lượt là 0,62±0,09 ppm và 0,99±0,34 ppm và 1,44±0,09 ppm và 0,48±0,13 ppm. Zhang và cộng sự (2016) đã ghi nhận giá trị trung bình (P < 0,05) của nitrit và nitrat trong các hệ thống dựa trên chất nền thấp hơn đáng kể so với đối chứng trong nước nuôi L. vannamei. Tuy nhiên, không có sự khác biệt đáng kể (P < 0,05) về giá trị trung bình của TAN được quan sát giữa nhóm đối chứng và nhóm chất nền.
Tăng trưởng của tôm trong hệ thống SBT
Sản lượng sản xuất của tôm giống P. monodon cả về tốc độ tăng trưởng và tỷ lệ sống đều tăng lên đáng kể (P < 0,05) bằng cách giữ chất nền ngập nước (Arnold và cộng sự, 2006). Ballester và cộng sự (2007) đã báo cáo trọng lượng cuối cùng, tỷ lệ sống và sinh khối cao hơn (P < 0,05) ở tôm Farfantepenaeus paulensis được nuôi trong lồng có lưới lọc polyetylen làm chất nền so với lồng không có chất nền. Uddin và cộng sự (2007) báo cáo rằng O. niloticus (GIFT) trong nuôi ghép với tôm nước ngọt (Macrobrachium rosenbergii) cho thấy tốc độ tăng trưởng, tỷ lệ sống và năng suất của cả GIFT và tôm nước ngọt trong ao có nền tre cao hơn đáng kể so với ao đối chứng. Zhang và cộng sự (2010) đã báo cáo mức tăng trọng, tỷ lệ sống và năng suất ở L. vannamei tăng đáng kể (P < 0,05) khi tăng số lượng chất nền. Sự hiện diện của chất nền trong hệ thống nuôi đã giúp tôm chân trắng phát triển tốt hơn (Zhang, 2011). Tương tự, Zhang và cộng sự (2014) đã cho thấy tốc độ tăng trưởng và tỷ lệ sống của tôm thẻ chân trắng trong ao nuôi có chất nền (lưới in lụa) cao hơn đáng kể so với ao đối chứng không có chất nền nhân tạo trong điều kiện trong nhà vào mùa đông.
Phản ứng miễn dịch của tôm trong hệ thống SBT
Các nghiên cứu của Zhang và cộng sự (2010) đã quan sát thấy hoạt động của các thông số miễn dịch không đặc hiệu giảm đáng kể (P < 0,05) như phenoloxidase, hoạt tính kháng khuẩn, hoạt tính lysozyme, peroxidase và hemolysin của tôm thẻ chân trắng L. vannamei được nuôi trong bể PVC có lưới lọc bằng chất nền vải polypropylen tốt hơn nhóm đối chứng. Với số lượng chất nền ngày càng tăng, hoạt động của các thông số này giảm đi, cho thấy chất nền ngập nước có thể giảm thiểu tác động tiêu cực của mật độ thả giống nhiều hơn thông qua việc cung cấp đủ không gian sống cho tôm. Hàm lượng protein của L. vannamei trong cả bạch huyết và cơ, được nuôi cấy trong bể polyetylen hình trụ có dung tích 1000 lít với Aquamats cao hơn so với đối chứng, do tính sẵn có cao hơn (và tính đa dạng) của Periphyton (Audelo-Naranjo và cộng sự, 2012).
Sản xuất Periphyton trong hệ thống SBT
Việc sản xuất Periphyton trên các chất nền ngâm được điều khiển bởi các yếu tố khác nhau như khả năng tiếp cận các chất dinh dưỡng trong nước, nguồn ánh sáng sẵn có, độ sâu của nước, loại chất nền, v.v. (Hay, 1991; Konan-Brou và Guirus, 1994; Keshavanath và cộng sự, 2001). Bản chất và loại chất nền đóng vai trò chính trong sự phát triển của periphyton, chất khô không có tro, sắc tố và sự xâm nhập của tảo trên chất nền (Anderson và Underwood, 1994; Keshavanath và cộng sự, 2001; Azim và cộng sự, 2001; Danilov và Ekelund, 2001). Sinh khối periphyton cao [chất khô (DM) và chất khô không tro (AFDM)] được nhận thấy trên giá thể tre so với thanh đay, rơm rạ và bã mía theo báo cáo của (Keshavanath và cộng sự, 2001; Rai và cộng sự, 2008). Trong môi trường biển, DM và AFDM trung bình ghi được trên chất nền là 8,8 mg/cm2 và 4,5 mg/cm2 trên màn chống muỗi sau 30 ngày, tuy nhiên, 10 trong số 13 thí nghiệm ở nước ngọt ghi nhận dưới 4,5 mg/cm2 DM và thấp hơn 1 mg/cm2 AFDM (Azim và cộng sự, 2004; Richard và cộng sự, 2009).
Tóm lại, công nghệ Biofloc (BFT) và hệ thống nuôi dựa trên Periphyton là những hệ thống nuôi thay thế cho các hệ thống thâm canh hiện có để làm cho việc nuôi tôm ít hiệu quả hơn về mặt chi phí và hiệu quả kinh tế, bền vững với môi trường. Những hệ thống này là hệ thống không thay nước, vì vậy chúng có thể giảm lượng nước sử dụng và xả nước thải, đồng thời cải thiện an toàn sinh học. Bioflocs và màng sinh học (periphyton) có hỗn hợp phức tạp của các chất như vi khuẩn, vi tảo dạng sợi, động vật nguyên sinh, luân trùng, giun và các thành phần phi sinh học đều được tôm sử dụng làm thức ăn tự nhiên. Các hệ thống này có thể đóng vai trò quan trọng trong nuôi trồng thủy sản bền vững thông qua chất lượng nước tốt và giảm nhu cầu thức ăn, tăng cường phản ứng miễn dịch của tôm và năng suất cao hơn để đạt được nhiều lợi nhuận hơn trong nuôi tôm.
Theo Chethurajupalli Lavanya, Tambireddy Neeraja, Suresh Kummari và Meshram Supradhnya Namdeo
Nguồn: https://www.academia.edu/58517197/Microbial_Based_Culture_Systems_For_Sustainable_Shrimp_Production
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Các Lựa Chọn Thay Thế Kháng Sinh Để Kiểm Soát Bệnh Do Vi Khuẩn Trong Nuôi Trồng Thủy Sản
- Phương Án Đưa Ra Các Giải Pháp Quản Lý Nước Thải Trong Nuôi Tôm Dựa Vào Thiên Nhiên
- Tôm Sạch Mầm Bệnh: Tiến Bộ Của Ngành Nuôi Tôm

 English
English 中文 (中国)
中文 (中国)