Vi khuẩn nitrat hóa có thể tồn tại và bắt đầu lại quá trình nitrat hóa trong màng sinh học được duy trì trong các điều kiện khác nhau

Các tác giả đã đánh giá tác động của các chiến lược quản lý khác nhau đối với quần thể vi khuẩn nitrat hóa trong chất nền nhân tạo của hệ thống nuôi tôm thẻ chân trắng sử dụng công nghệ biofloc. Kết quả cho thấy vi khuẩn nitrat hóa có thể tồn tại và bắt đầu lại quá trình nitrat hóa trong màng sinh học được duy trì ở các điều kiện khác nhau, và quần thể vi sinh vật nitrat hóa có thể tồn tại trong chất nền nhân tạo sau một khoảng thời gian mà không cần có tôm, sục khí hoặc nước, đồng thời có thể hỗ trợ năng suất tôm thẻ chân trắng.
Công nghệ Biofloc (BFT) được biết đến với việc tăng năng suất trong nuôi tôm biển ở mật độ cao, ngoài ra còn thúc đẩy cải thiện kiểm soát môi trường thông qua việc giảm (hoặc không) thay nước. Sự tích tụ các hợp chất nitơ trong hệ thống có liên quan đến việc tôm hấp thụ và sử dụng thức ăn, sự bài tiết của tôm và sự phân hủy chất hữu cơ (ví dụ, thức ăn thừa và phân).
Mức độ không mong muốn của các hợp chất độc hại này, đặc biệt là amoniac và nitrit, có thể gây ra stress và thay đổi sinh lý ở các sinh vật nuôi, ảnh hưởng đến sự tăng trưởng và tỷ lệ sống, và có thể làm giảm năng suất. Trong trường hợp này, sự hiện diện của vi khuẩn nitrat hóa trong hệ thống BFT đóng một vai trò quan trọng trong việc kiểm soát amoniac và nitrit, đồng thời oxy hóa các hợp chất độc hại thành các hợp chất ít độc hại hơn đối với tôm (ví dụ như oxy hóa nitrit thành nitrat).
Việc sử dụng chất nền nhân tạo trong hệ thống BFT là một phương pháp được áp dụng để tăng diện tích bề mặt có sẵn cho sự bám dính của vi khuẩn nitrat hóa để màng sinh học có thể phát triển trong suốt chu kỳ nuôi, duy trì chất lượng nước và đóng góp như một nguồn thức ăn bổ sung cho sinh vật nuôi. Với tầm quan trọng của việc sử dụng chất nền nhân tạo để duy trì chất lượng nước trong hệ thống nuôi thâm canh, việc tái sử dụng chất nền trong các chu kỳ liên tiếp là điều cần thiết.
Điều quan trọng cần nhấn mạnh là loại vi khuẩn hiếu khí này thuộc loại “vi khuẩn bám dính” phụ thuộc vào chất nền để phát triển; khi đã xâm chiếm, vi khuẩn nitrat hóa sẽ hoạt động để duy trì chất lượng nước trong hệ thống BFT. Trong một nghiên cứu trước đây, Morais và cộng sự đã quan sát thấy rằng chất nền nhân tạo cần thiết cho sự bám dính và phát triển của vi khuẩn oxy hóa amoniac (AOB) và vi khuẩn oxy hóa nitrit (NOB). Kết quả là, chiến lược tái sử dụng (nước hoặc chất nền) đã thành công trong các hệ thống nuôi siêu thâm canh liên tiếp. Việc tái sử dụng chất cấy vi khuẩn với nước giàu bioflocs là một phương pháp phổ biến được thực hiện với sự thành công tương đối trong các hệ thống BFT.
Tuy nhiên, không có sự thống nhất về cách duy trì chất nền khi các chu kì nuôi khác nhau được kéo dài và việc lựa chọn phương pháp quản lý hiệu quả có thể đem lại năng suất cuối cùng tốt hơn. Do đó, điều quan trọng là phải xác định chiến lược quản lý tốt nhất để áp dụng giữa các chu kỳ nuôi, duy trì quần thể vi khuẩn nitrat hóa hình thành trong màng sinh học.
Do đó, mục đích của nghiên cứu này là đánh giá tác động của màng sinh học với các chiến lược quản lý khác nhau đối với quần thể vi khuẩn nitrat hóa, quần thể vi sinh vật, hiệu quả quá trình nitrat hóa và tốc độ tăng trưởng của tôm thẻ chân trắng (Litopenaeus vannamei) trong hệ thống biofloc.
Thiết lập nghiên cứu
Thí nghiệm được thực hiện trong bể PE với thể tích hiệu dụng là 200 L trong 60 ngày, và nó được chia thành giai đoạn I và giai đoạn II, mỗi giai đoạn kéo dài 30 ngày. Một chất nền nhân tạo không lơ lửng, thương mại (Needlona®) đã được sử dụng với tỷ lệ 200% diện tích bể, để cho phép màng sinh học phát triển. Nghiên cứu được thực hiện mà không cần thay nước.
Các chất nền trước đây đã được sử dụng trong hệ thống sản xuất tôm thẻ L. vannamei dựa trên BFT và sau đó được phân chia ngẫu nhiên vào các thí nghiệm. Trong nghiên cứu này, 4 nghiệm thức được thực hiện với bốn lần lặp lại, mỗi nghiệm thức áp dụng phương pháp quản lý khác nhau. Mẫu nước (20 ml) và màng sinh học (5 cm) được thu thập 1 lần/tuần và cố định trong 4% formalin để phân tích vi sinh vật.
Giai đoạn I
Trong giai đoạn I, các nghiệm thức được thiết lập như sau:
T1 – BFT: đối chứng – màng sinh học + nước + tôm + sục khí
T2: màng sinh học + nước + sục khí
T3: màng sinh học + nước
T4: chỉ màng sinh học (Hình 1).
Các bể thí nghiệm cho giai đoạn I (chỉ nghiệm thức T1 – đối chứng) được thả tôm thẻ chân trắng với mật độ 500 con/m2, trọng lượng trung bình là 8 g. Tôm được cho ăn 2 lần/ngày, sử dụng thức ăn thương mại chứa 35% protein thô (Guabi®).
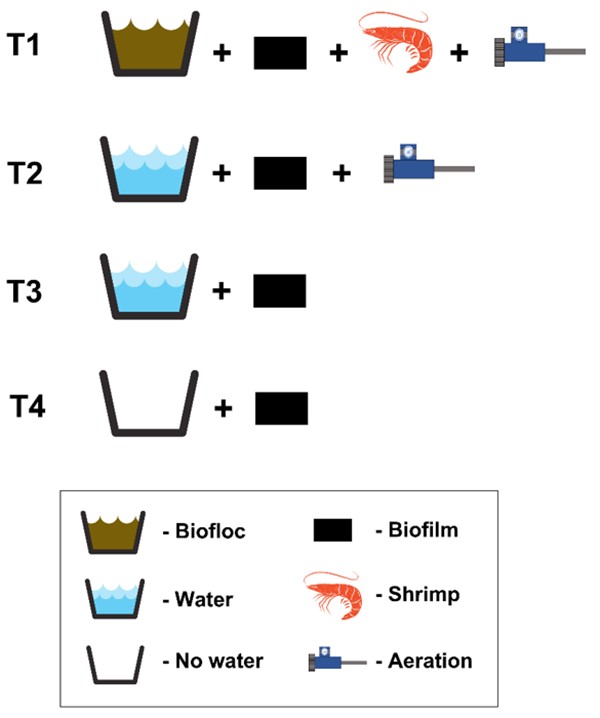
Hình 1: Sơ đồ thiết kế thí nghiệm giai đoạn I.
Giai đoạn II
Trong giai đoạn II, giai đoạn ương (30 ngày) được thực hiện để đánh giá hiệu quả của tái sử dụng màng sinh học từ các biện pháp quản lý khác nhau trong giai đoạn I. Các bể thí nghiệm chứa chất nền nhân tạo được bổ sung nước biển đã lọc, khử clo và bắt đầu chu kỳ ương.
Để thúc đẩy sự phát triển của biofloc, tỷ lệ carbon-nitơ (C: N) đã được điều chỉnh thành 15: 1 với việc bổ sung mật đường khi tổng nồng độ nitơ amoniac (TAN) đạt 1 mg/L. Trong giai đoạn II này, các bể được thả tôm post thẻ L. vannamei với mật độ 1.750 con/m3, trọng lượng trung bình ban đầu là 0,095 ± 0,051 g. Tôm được cho ăn 3 lần/ngày bằng thức ăn thương mại chứa 40% protein thô (Guabi®).
Trong cả hai giai đoạn của nghiên cứu, các thông số chất lượng nước (nhiệt độ, oxy và pH), các hợp chất nitơ độc hại (amoniac, nitrit và nitrat) và photphat đã được theo dõi.

Hình 2: Các bể thí nghiệm (a), quản lý chất nền nhân tạo (b), lắp đặt chất nền nhân tạo (c), nước sạch (d), hệ thống BFT (e) và thu hoạch (f).
Kết quả và thảo luận
Giai đoạn I
Dữ liệu về nồng độ của các hợp chất nitơ độc hại xác định trong giai đoạn I được trình bày trong Bảng 1. Kết quả cho thấy nồng độ amoniac, nitrit và photphat tương tự nhau giữa các nghiệm thức. Tuy nhiên, nitrat cao hơn ở nghiệm thức T1 (đối chứng), và sự khác biệt lớn này được cho là do trong nghiệm thức này, màng “trưởng thành” được sử dụng với vi khuẩn nitrat hóa (AOB và NOB) được cố định và trong giai đoạn cuối cùng của quá trình nitrat hóa.
Bảng 1: Các giá trị được xác định đối với các hợp chất chứa nitơ trong Giai đoạn I với việc tái sử dụng các chất nền được duy trì trong các điều kiện khác nhau.
|
Các thông số |
Nghiệm thức | |||
| T1 | T2 | T3 |
T4* |
|
|
TAN (mg/L) |
0.19 ± 0.08 | 0.12 ± 0.12 | 0.2 ± 0.18 |
– |
| Nitrit (mg/L) | 0.10 ± 0.06 | 0.09 ± 0.11 | 0.08 ± 0.10 |
– |
| Nitrate (mg/L) | 126.33 ± 45.62 | 9.03 ± 3.47 | 5.25 ± 3.00 |
– |
| Phosphate (mg/L) | 4.17 ± 1.49 | 2.00 ± 1.50 | 1.23 ± 0.64 |
– |
Trong giai đoạn I, các thông số chất lượng nước chính nằm trong phạm vi được khuyến cáo đối với tôm thẻ L. vannamei, ngay cả những nghiệm thức không có tôm. Về vi sinh vật trong nước, chúng tôi quan sát thấy sự giảm rõ rệt ở các nghiệm thức không có tôm và sục khí, ngoại trừ nghiệm thức đối chứng. Ở nghiệm thức T2, chúng tôi không quan sát thấy sự xuất hiện của giun tròn; và ở nghiệm thức T3, chúng tôi không quan sát thấy luân trùng. Sự vắng mặt và giảm mật độ của một số nhóm vi sinh vật có thể được giải thích bởi các điều kiện bất lợi của chất nền được sử dụng trong giai đoạn này. Hình 3 cho thấy sự phong phú tương đối của vi sinh vật trong giai đoạn I sau 30 ngày.
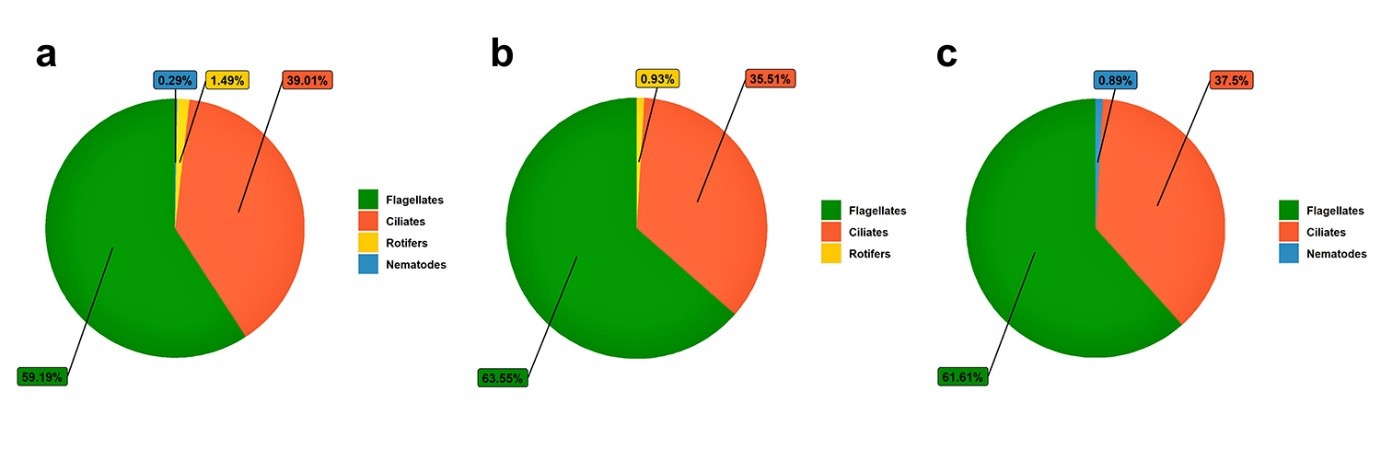
Hình 3: Số lượng tương đối (%) trùng roi, trùng lông, luân trùng và giun tròn hiện diện ở giai đoạn I trong quá trình nuôi tôm thẻ L. vannamei ở các nghiệm thức T1 (a), T2 (b), và T3 (c).
Giai đoạn II
Có sự tương đồng về nồng độ amoniac giữa các nghiệm thức, ngoại trừ nghiệm thức T1 (đối chứng; Hình 4a). Ở nghiệm thức T2, T3 và T4 có sự gia tăng nồng độ amoniac trong những ngày đầu tiên của thử nghiệm, nhưng nó giảm ở ngày nuôi thứ 7 (Hình 4a). Những kết quả này cho thấy hiệu quả của vi khuẩn oxy hóa amoniac sau khi các biện pháp quản lý khác nhau được áp dụng đối với chất nền. Nồng độ nitrit (Hình 4b), photphat và nitrat trong giai đoạn II giữa các nghiệm thức là tương tự nhau.
Ở nghiệm thức T2 và T3, nồng độ nitrit được kiểm soát từ ngày thứ 10 của thử nghiệm. Trong nghiệm thức T4, nghiệm thức chứa chất nền nhưng không chứa nước, việc kiểm soát nitrit bắt đầu từ ngày 14 của thử nghiệm và mức độ ổn định được nhận thấy từ ngày 18 của quá trình nuôi (Hình 4b). Các thông số chất lượng nước khác vẫn nằm trong phạm vi được khuyến nghị đối với tôm thẻ L. vannamei. Điều quan trọng cần lưu ý là nghiên cứu được thực hiện mà không cần thay nước.
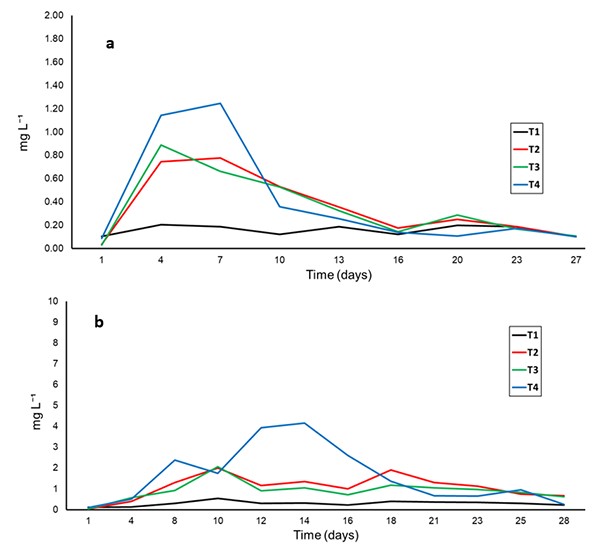
Hình 4: Tổng nồng độ nitơ amoniac (a) và nitrit (b) ở giai đoạn II trong quá trình nuôi tôm thẻ L. vannamei với việc sử dụng chất nền nhân tạo theo các chiến lược tái sử dụng khác nhau.
Trong giai đoạn II, sự phong phú của vi sinh vật tăng lên ở các nghiệm thức không có tôm và sục khí trong giai đoạn I. Trong giai đoạn này, chúng tôi quan sát thấy sự hiện diện của luân trùng và giun tròn ở các nghiệm thức T2, T3 và T4, điều này không quan sát thấy ở giai đoạn I. Mặc dù việc quản lý được thực hiện, các quần thể vi sinh vật vẫn hiện diện trong nước. Điều này có thể là do sự hình thành của một môi trường giàu chất dinh dưỡng để tái tạo lại quần thể vi khuẩn, và do đó, có sự phát triển của vòng vi khuẩn trong hệ thống. Hình 5 cho thấy sự phong phú tương đối của các vi sinh vật đơn bào trong giai đoạn II của thí nghiệm.
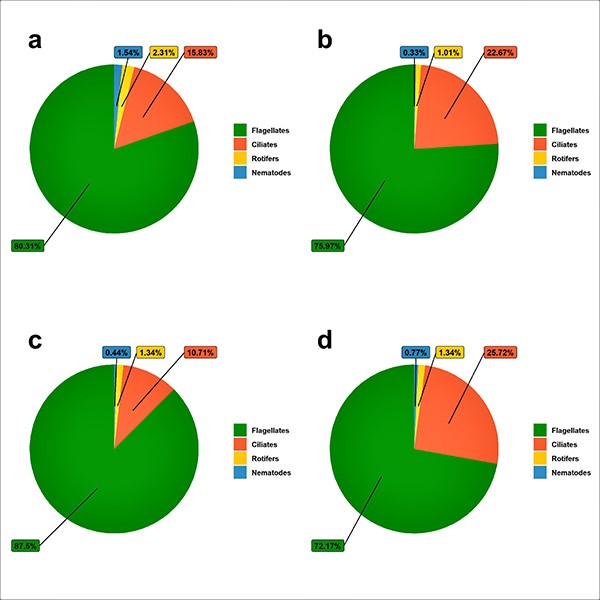
Hình 5: Sự phong phú tương đối (%) vi sinh vật đơn bào có trong giai đoạn II trong quá trình nuôi tôm thẻ L. vannamei với việc sử dụng chất nền nhân tạo theo các chiến lược tái sử dụng khác nhau ở các nghiệm thức T1 (a), T2 (b), T3 (c) và T4 (d).
Về tốc độ tăng trưởng của tôm, các nghiệm thức cho thấy kết quả tương tự nhau (Hình 6). Những kết quả này cho thấy rằng các cách quản lý chất nền khác nhau không ảnh hưởng đến sự tăng trưởng và tỷ lệ sống của tôm trong các trại ương thâm canh sử dụng hệ thống biofloc, vì chúng tôi không tìm thấy sự khác biệt đáng kể nào.
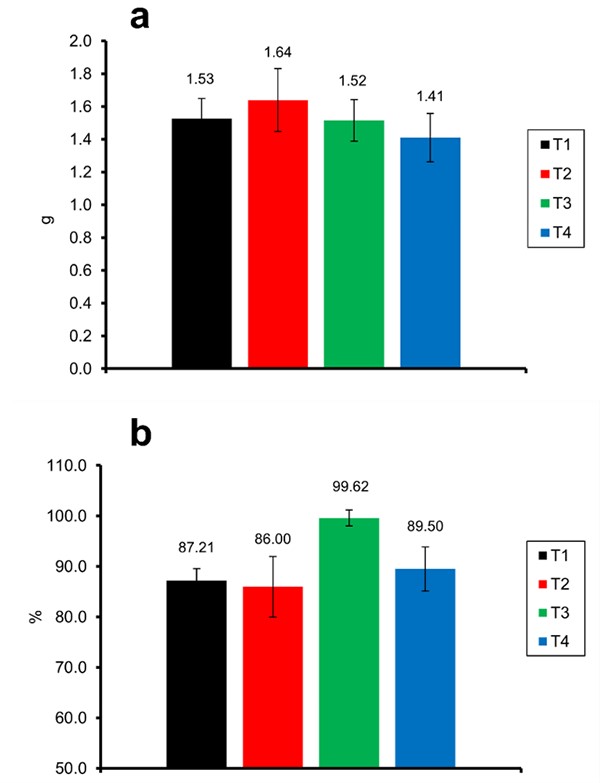
Hình 6: Trọng lượng cuối cùng (a) và tỷ lệ sống (b) của tôm thẻ L. vannamei được nuôi trong hệ thống biofloc trong quá trình nuôi tôm thẻ L. vannamei với việc sử dụng chất nền nhân tạo theo các chiến lược tái sử dụng khác nhau.
Kết luận
Các phân tích vi khuẩn của chúng tôi đang được tiến hành (ngay cả những mẫu chỉ tiếp xúc với không khí trong 30 ngày), nhưng dựa trên những phát hiện ban đầu trong nghiên cứu của chúng tôi, chúng tôi có thể kết luận rằng vi khuẩn nitrat hóa có thể tồn tại và bắt đầu lại quá trình nitrat hóa trong màng sinh học ở các điều kiện khác nhau.
Các chiến lược quản lý khác nhau mà chúng tôi đã sử dụng cho thấy có thể duy trì một quần thể vi sinh vật hiện diện trong chất nền nhân tạo, sau một thời gian ngay cả khi không có tôm, sục khí và thậm chí cả nước. Hơn nữa, các chiến lược khác nhau mà chúng tôi sử dụng trong nghiên cứu không ảnh hưởng tiêu cực đến sự tăng trưởng của tôm.
Theo Thạc sĩ Bianca de Oliveira Ramiro, Tiến sĩ Wilson Wasielesky Jr., Thạc sĩ Otávio Augusto Lacerda Ferreira Pimentel, Kỹ sư Natalia Pereira da Silva, Kỹ sư Genes Fernando Gonçalves Junior, Tiến sĩ Lucélia do Valle Borges, Tiến sĩ Dariano Krummenauer
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Mối Liên Hệ Giữa Nhiễm Enterocytozoon hepatopenaei, Chậm Tăng Trưởng Và Hệ Vi Sinh Vật Đường Ruột Ở Tôm Thẻ Chân Trắng Ở Những Kích Thước Khác Nhau
- Bổ Sung Nucleotide Vào Khẩu Phần Ăn Của Tôm Thẻ Chân Trắng Nuôi Trong Ao Thâm Canh Ngoài Trời
- Ánh Sáng Đèn LED Có Thể Ảnh Hưởng Đến Sự Tăng Trưởng Của Tôm Và Chất Lượng Nước Trong Hệ Thống Biofloc

 English
English