TÓM TẮT
Ngày càng có nhiều bằng chứng cho thấy mối liên hệ chặt chẽ giữa sự lây nhiễm mầm bệnh, các chỉ số sinh lý và hệ vi sinh vật đường ruột. Để kiểm tra ảnh hưởng của nhiễm Enterocytozoon hepatopenaei (EHP) lên sự chậm tăng trưởng và hệ vi sinh vật đường ruột, tôm thẻ chân trắng Thái Bình Dương (P. vannamei) nhiễm EHP với những kích thước khác nhau đã được sử dụng.
Tôm với các nhóm cỡ lớn, trung bình và nhỏ thuộc cùng một lô post và được nuôi trong một ao với cùng một chế độ ăn và điều kiện môi trường. Số lượng bản sao EHP cho thấy rằng càng nhiều bản sao EHP thì kích thước cá thể tôm càng nhỏ. Dữ liệu điện di trên gel biến tính (DGGE) cho thấy số lượng khuẩn đường ruột của tôm cỡ nhỏ tương tự như tôm cỡ trung bình, hơn là tôm cỡ lớn. Nó ngụ ý rằng hệ vi sinh vật đường ruột bị ảnh hưởng bởi mức độ nhiễm EHP. Nó cũng cho thấy rằng kích cỡ tôm khác nhau là do nhiễm EHP liên tiếp. Trong số các nhóm có kích thước khác nhau, mức độ Vibrio ở nhóm nhỏ là cao nhất, cho thấy việc nhiễm EHP có thể tăng tính nhạy cảm đối với sự xâm nhập của mầm bệnh. Phát hiện của chúng tôi cung cấp bằng chứng về các mẫu vi khuẩn đường ruột bị thay đổi do nhiễm EHP, càng có nhiều bản sao EHP thì kích thước tôm càng nhỏ hơn; và các cá thể có kích thước khác nhau do các giai đoạn nhiễm EHP liền kề.
1/ Giới thiệu
Tôm thẻ chân trắng được giới thiệu lần đầu tiên vào năm 1988, được nuôi rộng rãi từ miền nam đến miền bắc Trung Quốc (Miao và Yuan, 2007). Theo thống kê từ Aqua Culture Asia Pacific, sản lượng tôm thẻ chân trắng ở Trung Quốc là khoảng 1,4 triệu tấn trong năm 2013. Tuy nhiên, sản lượng đã giảm xuống còn khoảng 0,7 triệu tấn từ năm 2014 đến năm 2016 (số liệu chưa được công bố). Sự thất thoát này chủ yếu là do các bệnh truyền nhiễm, chẳng hạn như virus hội chứng đốm trắng (WSSV), Enterocytozoon hepatopenaei (EHP), và hội chứng hoại tử gan tụy cấp tính (AHPND), virus hoại tử cơ tạo máu và cơ quan biểu mô (IHHNV), virus hội chứng Taura (TSV), Virus đầu vàng (YHV) (Flegel, 2012; Lo và cộng sự, 1996). Trong số các mầm bệnh này, EHP là mầm bệnh mới xuất hiện nhưng đã gây ra thiệt hại lớn cho nuôi tôm Thẻ chân trắng. Mầm bệnh này thường không được chú ý vì EHP hiếm khi gây ra tỷ lệ chết cao như AHPND (Tang và cộng sự., 2016).
EHP lần đầu tiên được mô tả trên P. monodon cho thấy sự chậm phát triển trong các ao nuôi thương phẩm ở Thái Lan vào năm 2009 (Tourtip và cộng sự, 2009) lây nhiễm cho các loài tôm bao gồm P. vannamei, P. monodon và Penaeus japonicus, gây chậm phát triển nghiêm trọng (Chayaburakul và cộng sự, 2004; Tourtip và cộng sự, 2009). Kể từ đó, EHP đã được báo cáo ở các quốc gia khác bao gồm Việt Nam, Ấn Độ, Trung Quốc, Indonesia, Malaysia và Venezuela (Rajendran và cộng sự., 2016; Tang và cộng sự., 2016; Shen và cộng sự., 2017). Gần đây, tỷ lệ nhiễm EHP cao đã trở thành mối đe dọa chính đối với ngành nuôi tôm ở châu Á (Shen và cộng sự., 2019; Behera và cộng sự.,2019).
Mặc dù nhiễm EHP khiến Thẻ chân trắng chậm phát triển đáng kể, nhưng ít người biết về mối liên hệ giữa chu kì nhiễm EHP với kích thước chiều dài cơ thể trong chu kỳ sinh sản. Trước đây, sau một vài báo cáo về bệnh lý học (Rajendran và cộng sự, 2016; Tang và cộng sự, 2016), các báo cáo chủ yếu tập trung vào việc phát triển phương pháp thử nghiệm (Tourtip và cộng sự, 2009; Tangprasittipap và cộng sự, 2013; Sathish Kumar và cộng sự, 2018; Liu và cộng sự, 2017; Ma và cộng sự, 2021). Hiện tại, chúng tôi cũng đã tiến hành các nghiên cứu về dịch tễ học EHP từ năm 2016 tại Giang Tô của Trung Quốc (Shen và cộng sự, 2017, 2019) và sinh lý học (Qiao và cộng sự, 2018), phương pháp thử nghiệm (Ma và cộng sự, 2021).
Tuy nhiên, ít người biết về quá trình lây nhiễm EHP và những thay đổi của hệ vi sinh vật đường ruột. Trong nghiên cứu này, chúng tôi đã quan sát bào tử EHP trong mô gan tụy, kiểm tra các bản sao của EHP bằng PCR thời gian thực, phân tích hệ vi sinh vật trong ruột với DGGE ở ba nhóm tôm có kích thước, để làm sáng tỏ một số câu hỏi như sau. Liệu những cá thể có kích thước lớn có khả năng chống lại sự lây nhiễm EHP hoặc chúng có bị lây nhiễm EHP trong những giai đoạn khác nhau không? Làm thế nào và điều gì đã giúp hệ vi sinh vật đường ruột phản ứng lại với mầm bệnh EHP?
2/ Chất liệu và phương pháp
2.1 Thu thập mẫu
Tổng số 60 mẫu tôm nuôi trong 70 ngày đã được thu thập từ một ao nhà kính với các cá thể có kích thước khác nhau đáng kể từ một trang trại nuôi tôm ở thành phố Nam Đông, tỉnh Giang Tô, Trung Quốc vào ngày 7 tháng 5 năm 2019.
Các cá thể tôm được chọn ngẫu nhiên và chia thành ba nhóm có kích thước: Cỡ lớn (BS, chiều dài cơ thể = 12,5 ± 2,6 cm, n = 6), trung bình (MS, chiều dài cơ thể = 6,5 ± 1,6 cm, n = 6), nhỏ (SS, chiều dài cơ thể = 2,5 ± 0,7 cm, n = 6) để phân tích. Các mẫu được đo kích thước và đông lạnh ở -80 ℃ để kiểm tra phát hiện mầm bệnh.
Mẫu nước được thu thập bằng các chai thuốc thử 50 mL đã khử trùng. Phân được thu thập từ các khay thức ăn ở ba vị trí khác nhau dọc theo ao. Các chất cặn dư thừa được thu gom bằng xẻng. Nước, phân và chất cặn dư thừa đều được thu với ba lần lặp lại.
2.2 Phân lập axit nucleic
Gan tụy và ruột được mổ xẻ và làm đồng nhất trong dung dịch đệm ly giải (50 mM Tris-HCl, 50 mM EDTA, 1% SDS, 100 mM NaCl, pH 8,0) tương ứng chứa 20 mg L-1 proteinase K. DNA được phân lập và tinh sạch bằng cách sử dụng phương pháp phenol-cloroform. Đối với PCR, tất cả các mẫu DNA được điều chỉnh đến nồng độ 100 ng µ L-1 bằng nước cất. DNA của phân và Over-sed được phân lập bằng UltraClean MegaPrep Soil DNA Kit (Mo Bio Laboratories, Inc.) theo quy trình của nhà sản xuất. Các mẫu nước được lọc bằng bộ lọc 0,22 µ m và quá trình tách chiết DNA được thực hiện theo bộ kit Phân lập DNA trong nước UltraClean (Phòng thí nghiệm Mo Bio, Inc.). Tất cả DNA được lưu trữ ở -20◦C trước khi sử dụng.
2.3 PCR và phân tích PCR thời gian thực
Các mẫu DNA tinh khiết của tất cả các mẫu được kiểm tra sự hiện diện của các mầm bệnh tôm khác nhau, bao gồm WSSV, EHP, AHPND, IHHNV, TSV, YHV. Tổng số RNA phân lập từ mô mang và mô gan tụy được sử dụng để tổng hợp cDNA bằng cách sử dụng SMARTScribe Reverse Tran-scriptase (Clontech) và mồi oligo-dT. Sau đó, cDNA được sử dụng làm khuôn mẫu để phát hiện TSV và YHV. Các loại mồi được sử dụng cho các PCR khác nhau được cung cấp trong Bảng 1. Số lượng bản sao của mầm bệnh EHP trên tôm được thực hiện bằng cách sử dụng PCR thời gian thực với đầu dò Taqman (Liu và cộng sự, 2017). Chuẩn plasmid có chứa gen EHP SSU rDNA được pha loãng trong dung dịch 10-fold-series đến thang 8 mức độ. Ba điểm tương đồng được sử dụng làm mẫu của các xét nghiệm Taqman qPCR. Số lượng bản sao EHP/ng DNA của HP bằng số lượng bản sao chia cho mẫu của HP.
2.4 Phân tích PCR-DGGE
Bộ gen DNA được sử dụng làm khuôn để khuếch đại vùng V3-V4 của gen 16 S rRNA được bảo tồn của vi khuẩn bằng cách sử dụng bộ mồi phổ dụng 338 F với kẹp GC và 519 R (Rungrassamee và cộng sự., 2016). Các điều kiện khuếch đại như sau: 94 ℃ trong 5 phút, sau đó là 35 chu kỳ 94 ℃ trong 1 phút, 55 ℃ trong 1 phút và 72 ℃ trong 1,5 phút, và kết thúc ở 72 ℃ 10 phút sau đó làm mát ở 4 ℃. DGGE đã được áp dụng cho các bộ khuếch đại PCR sử dụng thiết bị Hệ thống Dcode (Phòng thí nghiệm Bio-Rad, Inc.).
2.5 Phân tích các mẫu DGGE
DGGE được nhuộm bằng SYBR Green (Invitrogen), làm khô qua đêm ở 55◦C và được số hóa bằng máy đo mật độ GS 800 đã hiệu chuẩn (Bio-Rad). Gel DGGE được phân tích bằng phần mềm BIORAD Quantity One 4.3.0. Dấu vân tay DGGE được tự động cho điểm bằng cách có hoặc không có các dải đồng di chuyển, không phụ thuộc vào cường độ. Đối với phân tích cụm, PCR-DGGE của một bộ mồi đã được thực hiện theo phương pháp trùng lặp. Sự tương đồng theo từng cặp được tính toán dựa trên hệ số tương quan Xúc xắc. Các biểu đồ được tạo ra bằng cách sử dụng thuật toán của phương pháp nhóm cặp không trọng số với trung bình số học (UPGMA). Cây phát sinh loài được xây dựng bằng phương pháp Maximum Parsimony.
2.6 Khôi phục các dải từ gel DGGE và giải trình tự
Các chuỗi nhị phân được tạo cho các làn DGGE riêng lẻ bằng cách xác định số lượng và vị trí của các dải so với tổng số vị trí của dải được phát hiện. Các dải ưu thế để phân tích trình tự được chiết xuất dạng gel DGGE bằng dao mổ vô trùng. Các lát băng được đặt trong các ống polypropylene 1,5 mL đã khử trùng với dung dịch đệm 100 µ L TE. Các ống này được đặt ở 4 ℃ qua đêm, DNA mẫu cho PCR được khuếch tán vào nước. Khoảng 5 µ L DNA khuôn mẫu được nối vào vectơ PMD-19T (TaKaRa, Nhật Bản) và sau đó tiếp tục được biến đổi thành các tế bào khả biến của Escherichia coli DH5α (TaKaRa, Nhật Bản). Các dòng clone dương tính đã được gửi đến Công ty Công nghệ Sinh học Sangon Thượng Hải để phân tích trình tự.
2.7 Phân tích thống kê
Kết quả được phân tích bằng phương pháp Phân tích một chiều (ANOVA) với độ tin cậy là 95%. Thử nghiệm Turkey đã được áp dụng bằng SPSS 20.0, nếu chúng có ý nghĩa.
3/ Kết quả
3.1 Kích thước tôm và phân tích PCR
18 cá thể tôm được chia thành ba nhóm, được đặt tên là BS, MS, SS, cho thấy sự khác biệt có ý nghĩa theo kích thước cơ thể (P <0,05) (Bảng 2). Kết quả phân tích PCR cho thấy tất cả các cá thể tôm, phân và chất lắng cặn đều dương tính với EHP, trong khi tất cả đều âm tính với các mầm bệnh khác (Bảng 2).
3.2 Phân tích PCR thời gian thực
Số lượng bản sao gen EHP của SS là cao nhất, gấp 3442 lần của BS, 77 lần của MS. Số lượng bản sao gen EHP trong phân là khoảng 105.144 bản sao / ng HpDNA, gấp 15 lần so với chất cặn dư thừa và 115 lần so với nước (Hình 1).
Hình 1. Số lượng bản sao EHP trong tế bào biểu mô gan tụy của các nhóm tôm có kích thước khác nhau, Phân, cặn dư thừa và nước. a, b, c Các phạm vi được phân tích với một chỉ số trên khác có ý nghĩa khác nhau (dựa trên trung bình ± độ lệch chuẩn) theo ANOVA một chiều (p <0,05).
3.3 Các dạng dải
Các vùng biến đổi V3 và V4 của rRNA 16S từ các cá thể tôm khác nhau, phân, cặn dư thừa, nước được khuếch đại từ bộ gen DNA tinh khiết được phân tách trong các cấu hình DGGE (Hình 2). Các cấu hình DGGE của nhóm tôm được nhóm lại một cách rõ ràng với nhau, sau đó nhóm nước, cặn dư và phân (Hình 3). Các cấu hình vi khuẩn trong nhóm tôm cho thấy sự khác biệt cao hơn về kiểu hình vi khuẩn với phạm vi tương đồng 43–71%, trong khi cấu hình DGGE của nhóm môi trường cho thấy ít biến đổi hơn với phạm vi tương đồng 51–84%. Trong nhóm tôm, đầu tiên nhóm SS và MS nhóm lại, sau đó nhóm với nhóm BS.
Tổng cộng có 22 dải đại diện đã được cắt và giải trình tự để xác nhận các loài vi khuẩn (Bảng 3). Các dải được giải trình tự có liên quan đến Phylum Proteobacteria, Bacteroidetes, Firmicutes, Cyanobacteria. Đáng chú ý, Band 10 chiếm ưu thế trong tất cả các nhóm, với trình tự liên kết với họ Vibrio với họ hàng gần nhất của Photobacterium damselae. Băng 12, với trình tự được liên kết với họ Vibrio, chiếm ưu thế trong các nhóm BS, MS, SS, nhóm phân.
3.4 Phân Cụm DGGE
Cụm cấu hình dải DGGE dựa trên ma trận khoảng cách Pearson nói chung cho thấy rằng hai nhóm riêng biệt đã được tách biệt (Hình 3). BS, MS và SS được phân nhóm tương ứng với đặc tính của mẫu, trong khi nước, cặn bã và phân được nhóm lại trong nhóm còn lại. Đáng chú ý, mặc dù BS, MS và SS được nhóm thành một cụm, MS và SS được nhóm với nhau trước; sau đó BS được nhóm lại vào chúng. Ngoài ra, phân và cặn dư được nhóm lại trước; sau đó nước được nhóm vào chúng.
4/ Thảo luận
EHP được báo cáo lần đầu tiên ở Thái Lan vào năm 2004 (Chayaburakul và cộng sự, 2004), và chính thức được mô tả vào năm 2009 dựa trên dữ liệu mô học, siêu cấu trúc và phát sinh loài (Tourtip và cộng sự, 2009). Sau đó, EHP đã được chấp nhận rộng rãi như là tác nhân gây chậm phát triển của Thẻ chân trắng.
Trong nghiên cứu này, các nhóm tôm BS, MS và SS được thu thập trong cùng một ao nhà kính, được thả giống từ một lô post đã được nuôi trong 70 ngày, cho thấy kích thước cơ thể khác nhau đáng kể (P <0,05). Thông qua xét nghiệm mầm bệnh chính, kết quả cho thấy tất cả các nhóm khác nhau đều chỉ dương tính với EHP (Bảng 2), cho thấy EHP là tác nhân gây bệnh gây chậm phát triển, phù hợp với phát hiện trước đó (Ha và cộng sự, 2010; Kesavan và cộng sự, 2017). Định lượng EHP ở SS cao hơn đáng kể so với MS (P <0,05) và MS cao hơn đáng kể so với BS (P <0,05), cho thấy rằng nhiễm EHP càng nhiều thì tăng trưởng càng bị ảnh hưởng nghiêm trọng hơn.
Một số nghiên cứu trước đây đã chứng minh bản sao EHP của gan tụy có mối tương quan nghịch với chỉ số khối cơ thể của tôm (Liu, 2017). Ngoài ra, có một bằng chứng cho thấy EHP lây lan theo chiều ngang vì các mức độ nhiễm EHP sẽ khác nhau khi các con tôm có kích thước khác nhau.
Tất cả các cá thể tôm có kích thước khác nhau được thu thập từ một ao có nghĩa là chúng có các yếu tố môi trường, thời kỳ phát triển và chế độ ăn giống nhau. Chúng tôi nhận thấy rằng các cá thể tôm ở ba kích thước khác nhau đều bị nhiễm EHP trong một lô post, cho thấy rằng sự nhiễm EHP không phụ thuộc vào di truyền của tôm.
Theo hiểu biết của chúng tôi, không có nghiên cứu nào cho thấy các cá thể tôm lớn có khả năng chống lại sự sinh sôi của EHP. Các nghiên cứu trước đây cho thấy hệ vi sinh vật đường ruột sẽ bị thay đổi bởi một số yếu tố, chẳng hạn như chế độ ăn uống, giai đoạn tăng trưởng và tình trạng sinh lý (Rungrassamee và cộng sự., 2016; Run-grassamee và cộng sự., 2013). Trong nghiên cứu này, hệ vi sinh vật đường ruột chỉ có thể bị ảnh hưởng bởi tình trạng sinh lý do nhiễm EHP và nó cho thấy rằng SS giống với nhóm MS hơn là BS, cho thấy rằng tình trạng sinh lý của SS gần với MS hơn của BS. Các nghiên cứu về bệnh lý đặc trưng của đường ruột của tôm thẻ khỏe mạnh, dưới khỏe mạnh và bị bệnh cho thấy mức độ nghiêm trọng của bệnh tương quan với mức độ loạn khuẩn, và sự khởi phát của bệnh có thể được mô hình hóa dựa trên thành phần của hệ vi sinh vật đường ruột (Xiong và cộng sự. , 2017).
Mặc dù các cá thể tôm hiếm khi bị chết do nhiễm EHP (Sritunyalucksana và cộng sự, 2014), nhưng các tế bào biểu mô gan tụy lại bị tổn thương do nhiễm EHP (Tourtip và cộng sự, 2009). Do đó, các thông số sinh hóa đã bị thay đổi (Santhoshkumar và cộng sự, 2016), sau đó hệ vi sinh vật đường ruột bị thay đổi. Ngoài ra, các bào tử EHP được xác nhận có thể lây truyền theo chiều dọc giữa các cá thể tôm với nhau qua nước (Salachan và cộng sự, 2016). Điều này cho thấy từng cá thể tôm đã bị nhiễm bệnh. Theo đó, chúng ta có thể giả định rằng các bản sao nhiễm EHP khác nhau là kết quả của các giai đoạn nhiễm EHP khác nhau, dẫn đến các trường hợp vi sinh vật khác nhau, cuối cùng dẫn đến các cá thể có kích thước khác nhau.
Mặc dù một số nghiên cứu đã báo cáo về thành phần và cộng đồng vi khuẩn đường ruột trong L. vannamei, bao gồm cả sự thay đổi cấu trúc của cộng đồng vi khuẩn bị nhiễm AHPND / EMS (Rungrassamee và cộng sự., 2016; Cornejo-Granados và cộng sự., 2017), có rất ít báo cáo về sự thay đổi của hệ vi sinh vật đường ruột sau khi nhiễm EHP. Trong nghiên cứu này, chúng tôi phát hiện ra rằng dải 5,10, 11 và 12 đều có liên quan đến vi khuẩn Gammaproteobacteria “thống trị” các cộng đồng vi khuẩn trong ruột tôm, điều này phù hợp với các nghiên cứu trước đây (Run-grassamee và cộng sự., 2016). Lớp Gammaproteobacteria, chủ yếu bao gồm Vibrio và Photobacterium spp., đã được báo cáo chiếm hơn 70% trình tự phân lập trong ruột tôm (Run-grassamee và cộng sự., 2013). Nhóm 12 liên kết với Vibrio từ nhóm SS trở nên sáng hơn từ các nhóm BS, MS đến SS có nghĩa là sự phong phú tương đối của Vibrios trở nên cao hơn khi lây nhiễm các bản sao cao hơn của EHP. Đặc biệt, nhóm 12 thuộc giống Vibrio cho thấy mức độ cao nhất trong ruột SS. Ngày càng có nhiều bằng chứng cho thấy sự thay đổi thành phần vi khuẩn của hệ vi sinh vật đường ruột có thể dẫn đến tính nhạy cảm cao hơn đối với sự xâm nhập của mầm bệnh (Quigley, 2013). Hơn nữa, sự phong phú tương đối của dải 12 trong nhóm Phân tương đối cao hơn so với nhóm Nước và cặn dư, cho thấy rằng các chi Vibrio đang chiếm ưu thế trong đường ruột của tôm với sự lây nhiễm EHP và Vibrio từ ruột tôm truyền sang.
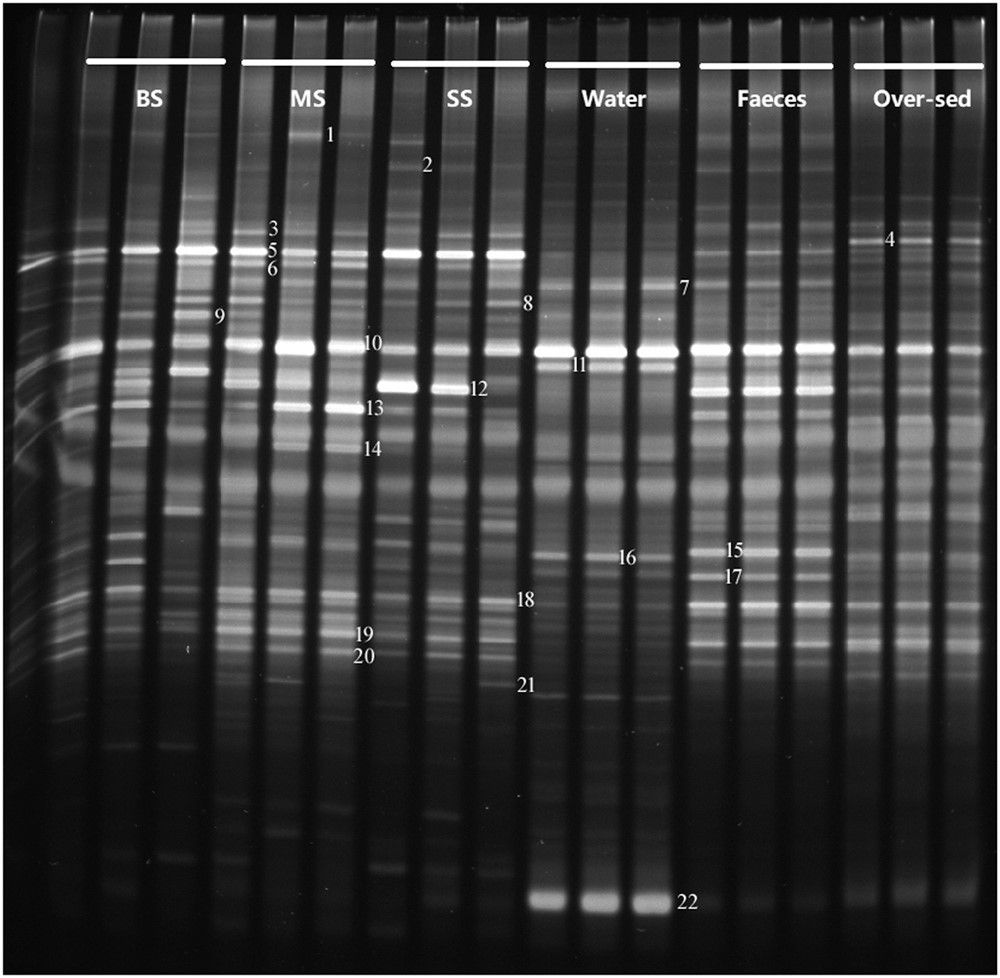
Hình 2. Hồ sơ DGGE của BS, MS, SS, Nước, Phân và cặn dư.
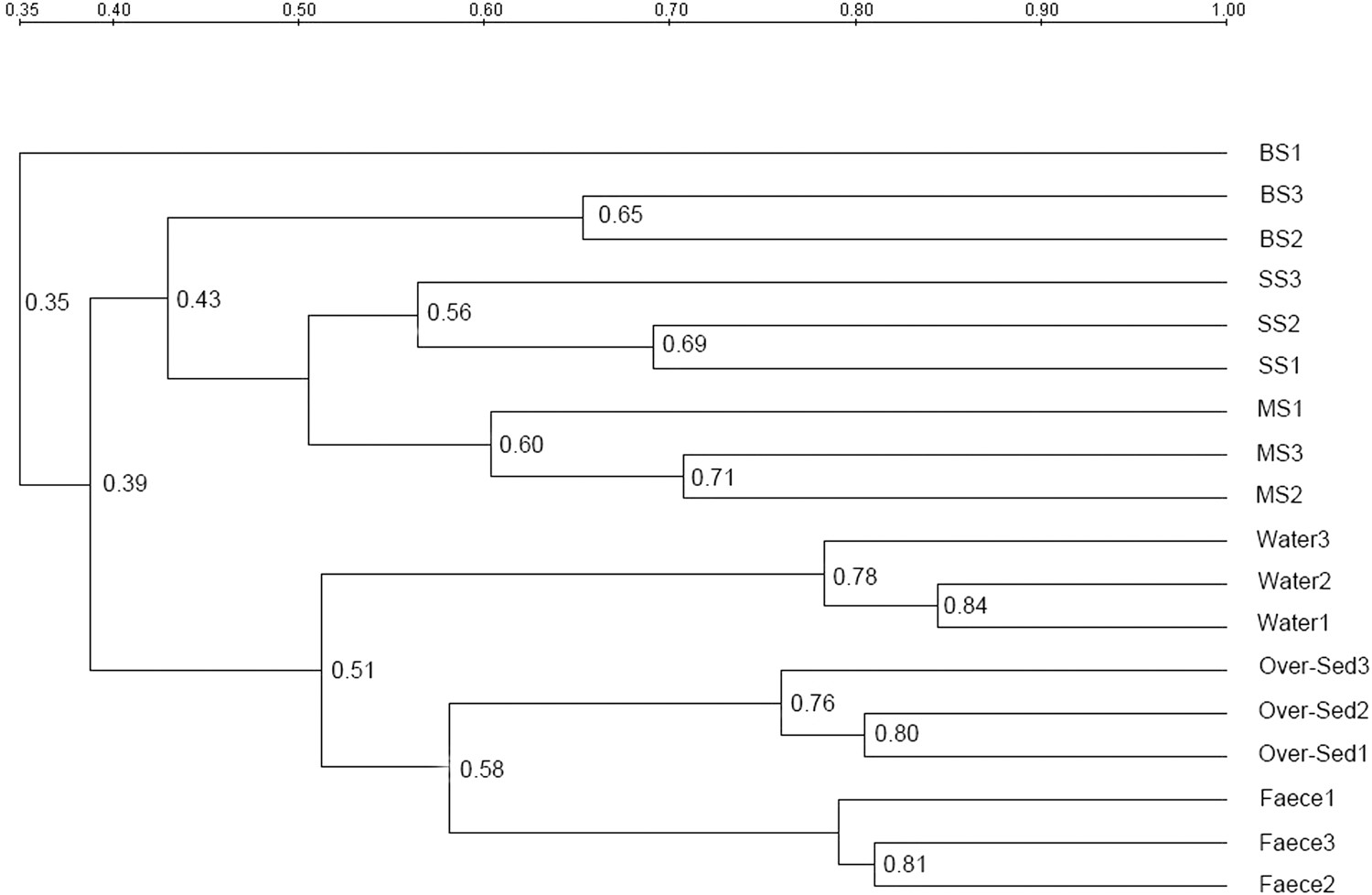
Hình 3. Phân tích phân cụm các cấu hình DGGE của BS, MS, SS, Nước, Phân và cặn dư. Các dải 1–22, các dải DGGE đại diện, được phục hồi từ gel DGGE và giải trình tự.
Nhóm tác giả: Hui Shena, b, c, Xianping Fan a, Yi Qiao a, Ge Jiang a, Xihe Wan a, Jie Cheng a, Haolan Li c,Yabin Dou b, Hui Li a, Libao Wang a, Wenjun Shi a, Yali Qin a, Jing Shen a
Biên dịch: Trầm Minh Nhựt – Công ty TNHH PTTS Bình Minh.
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Bổ Sung Nucleotide Vào Khẩu Phần Ăn Của Tôm Thẻ Chân Trắng Nuôi Trong Ao Thâm Canh Ngoài Trời
- Tiềm Năng Sản Xuất PUFAs Có Giá Trị Cao Từ Vi Tảo
- Chất Thải Trong Chế Biến Tôm Sú Có Thể Được Chuyển Thành Bột Có Giá Trị Gia Tăng

 English
English