Tóm tắt
Nghiên cứu này đánh giá tác động của chiết xuất tỏi đối với tăng trưởng và các thông số hemolymp ở tôm thẻ chân trắng Litopenaeus vannamei trong 56 ngày. Tôm thẻ chân trắng (trọng lượng trung bình 18,21±0,29 g) được nuôi trong 4 bể polyethylene 300 lít với 4 nghiệm thức, mỗi nghiệm thức có 4 lần lặp lại và mỗi nghiệm thức lặp lại thử nghiệm 5 con tôm. Một khẩu phần ăn cơ bản được bổ sung 0 (đối chứng), 40, 80 và 100 ppm chiết xuất tỏi đã được cung cấp cho tôm. Chỉ tiêu sinh trắc học của tôm đo lường vào cuối thí nghiệm và hemolymp được thu thập bằng ống tiêm 2ml. Chiết xuất tỏi tăng lượng ăn vào hàng ngày, hiệu quả chuyển đổi thức ăn, tỷ lệ hiệu quả sử dụng protein và tỷ lệ lột xác (P < 0,05), nhưng không có sự thay đổi đáng kể về tốc độ tăng trọng, tốc độ tăng trưởng cụ thể, hệ số thể trạng và chỉ số gan (P> 0,05). Nhóm tôm được xử lý có hàm lượng protein cơ thể tăng, hàm lượng chất béo và tro giảm so với nhóm đối chứng (P < 0,05). Tổng số lượng tế bào máu không thay đổi, nhưng số lượng tế bào máu khác biệt và tổng protein huyết tương thay đổi ở tôm được xử lý so với tôm đối chứng (P < 0,05). Dựa trên kết quả thu được từ nghiên cứu này, chiết xuất tỏi có tiềm năng sử dụng làm thức ăn bổ sung để thúc đẩy tăng trưởng và cải thiện sức khỏe của tôm thẻ chân trắng.
Giới thiệu
Việc sử dụng chất kích thích miễn dịch trong nuôi tôm ngày càng phổ biến do tính an toàn và hiệu quả trong việc thay thế cho thuốc kháng sinh và hóa trị liệu tôm có hệ thống miễn dịch bẩm sinh, bao gồm tế bào và dịch thể, đóng vai trò quan trọng trong việc chống lại bệnh tật. Tế bào máu đóng vai trò chủ đạo trong việc chống lại bệnh tật thông qua các cơ chế như thực bào, tạo hắc tố, đóng gói, gây độc tế bào và đông máu. Các yếu tố bảo vệ dịch thể như protein đông máu, agglutinin, enzyme thủy phân và peptide kháng khuẩn được giải phóng khi ly giải tế bào máu (Chisholm và Smith, 1995; Muta và Iwanaga 1996; Destoumieux và cộng sự, 2000).
Khẩu phần ăn có chứa chất kích thích miễn dịch được sử dụng trong nuôi trồng thủy sản nhằm tăng khả năng chống lại stress và bệnh tật của cá nuôi và động vật không xương sống bằng cách cảnh báo hệ thống miễn dịch (Rendon và Balcazar, 2003; Donate và cộng sự, 2010).
Nuôi trồng thủy sản đại diện cho một trong những nhà cung cấp thực phẩm chính trên thế giới. Trong nuôi tôm, tôm thẻ chân trắng (Litopenaeus vannamei) là loài tôm penaeid chính hiện đang được nuôi ở Trung và Nam Mỹ (Burge và cộng sự, 2007; Chang-Che và Jiann-Chu, 2008). Tuy nhiên, trong hai thập kỷ qua, nghề nuôi tôm thương mại trên toàn thế giới đã phải hứng chịu những đợt bùng phát dịch bệnh chủ yếu do vi khuẩn và vi rút Vibrio gây ra do môi trường ao nuôi bị suy thoái (Lo và cộng sự, 2003).
Tôm thẻ chân trắng Litopenaeus vannamei, phân bố tự nhiên dọc theo bờ biển Thái Bình Dương ở Trung và Nam Mỹ đã trở thành loài nuôi quan trọng nhất trên toàn thế giới do phát triển thành công các kỹ thuật điều khiển đàn bố mẹ, sinh sản và sản xuất giống (Tayag và cộng sự, 2010).
Tỏi (Allium sativum) là một loại cây trồng lâu đời được sử dụng trong nhiều thế kỷ như một gia vị, thuốc và thực phẩm chức năng. Nó được biết đến với khả năng tăng cường sức khỏe thể chất và tinh thần. Tác dụng của tỏi đã được nghiên cứu trên nhiều dạng chiết xuất khác nhau, bao gồm dung dịch nước, ethanol và bột khô. Các nghiên cứu cho thấy tỏi chứa nhiều hợp chất organosulfur có lợi cho sức khỏe, chẳng hạn như allicin, ajoene, S-allylcysteine, diallyl disulfide, Smethylcysteine sulfoxide và S-allylcysteine. Trong nuôi trồng thủy sản, tỏi cũng được sử dụng như một chất kích thích tăng trưởng cho cá. Ví dụ, tỏi đã được chứng minh là có hiệu quả trong việc cải thiện tăng trọng cơ thể, lượng thức ăn tiêu thụ và hiệu quả sử dụng thức ăn ở cá rô phi sông Nile. Ngoài ra, tỏi còn có vai trò tiềm năng trong việc phòng ngừa và điều trị bệnh ở cá. Tỏi có thể được sử dụng để kiểm soát mầm bệnh, đặc biệt là vi khuẩn và nấm, giúp tăng cường sức khỏe cho cá. Nhiều nghiên cứu đã được thực hiện để đánh giá hiệu quả của tỏi trong nuôi trồng thủy sản. Một số kết quả nghiên cứu đáng chú ý bao gồm: Tôm kuruma Marsupenaeus japonicus được kích thích bằng chiết xuất tỏi (allicin) cho thấy sự biểu hiện gen miễn dịch bẩm sinh tăng cao. Ấu trùng Penaeus monodon được cho ăn thức ăn có bổ sung chiết xuất tỏi có tỷ lệ sống, tốc độ tăng trưởng và huyết học tốt hơn. Tôm thẻ chân trắng được cho ăn khẩu phần có 6% bột tỏi đạt mức tăng trọng cao nhất. Tôm được cho ăn Artemia được làm giàu với 200mg chiết xuất tỏi trên mỗi kg thức ăn cho thấy tốc độ tăng trưởng, tỷ lệ sống và chiều dài tốt nhất.
Mục đích của nghiên cứu này là đánh giá ảnh hưởng của chiết xuất tỏi trong khẩu phần ăn như một chất phụ gia thức ăn đối với hiệu suất tăng trưởng, sử dụng thức ăn, các thông số sinh hóa của cơ thể và một số chỉ số huyết học ở tôm thẻ chân trắng Litopenaeus vannamei.
Chuẩn bị nghiên cứu
Chuẩn bị dịch chiết tỏi và khẩu phần thí nghiệm
Tỏi tươi được mua từ chợ địa phương ở Hamadan (Iran). Tỏi tươi bóc vỏ được cắt thành từng miếng nhỏ, sấy khô, nghiền mịn rồi ngâm trong cồn etylic 95% ủ ở nhiệt độ phòng và sau ba ngày, lọc qua giấy lọc Whatman (42 micron) và lặp lại 3 lần để đảm bảo chiết xuất toàn bộ. Gộp các dịch chiết, cô đặc và loại bỏ dung môi bằng thiết bị bay hơi quay ở 75°C dưới áp suất giảm. Dịch chiết tỏi được giữ trong tủ lạnh ở 4°C trước khi sử dụng. Khẩu phần thí nghiệm được chuẩn bị bằng cách kết hợp bột viên tôm thương phẩm (công ty 21-beiza, Iran) với chiết xuất thực vật và 2% gelatin để tạo ra 4 khẩu phần: (1) khẩu phần thương mại làm nhóm đối chứng, (2) 40 mg/kg thức ăn, (3) 80 mg/kg thực phẩm, (4) 100 mg/kg thực phẩm. Sau khi sấy khô, các viên được bảo quản trong túi nhựa ở nhiệt độ 4°C cho đến khi sử dụng. Thành phần thức ăn cơ bản sử dụng cho tôm thẻ chân trắng Litopenaeus vannamei trong nghiên cứu này bao gồm 33% protein thô, 8% lipid thô, 4% carbohydrate thô, 14% tro và 10% độ ẩm.
Nuôi tôm
90 con tôm thẻ chân trắng (Litopenaeus vannamei Boone) khỏe mạnh được thu thập từ một trang trại thương mại ở Bushehr, miền Nam Iran. Tôm được thích nghi trong 15 ngày với điều kiện phòng thí nghiệm và được nuôi trong bể nhựa gia cố bằng sợi thủy tinh (FRP) và được cho ăn theo khẩu phần ăn thương mại. Điều kiện môi trường (nhiệt độ, pH, độ mặn, oxy hòa tan) được theo dõi và duy trì ổn định. Có 4 nghiệm thức với 4 lần lặp lại. Mỗi lần lặp lại bao gồm 5 con tôm có trọng lượng trung bình 18,21±0,29 g trong bể FRP tròn 300 lít với 200 lít nước ở độ mặn 29,42± 0,64 ppt. Sục khí được cung cấp bởi một viên đá khí duy nhất để duy trì lượng oxy hòa tan ở mức 7,72 ± 0,18 mg/L. Tôm được cho ăn 3 lần/ngày vào lúc 08h, 11h và 18h. Vỏ, phân và tôm chết được loại bỏ hàng ngày và thay 30% nước mỗi ngày (Javadzadeh và cộng sự, 2012). Trong thời gian thí nghiệm, nhiệt độ nước được duy trì ở mức 25,19 ± 0,087 °C và pH 8,02 ± 0,051.
Thông số tăng trưởng và dinh dưỡng
Khi kết thúc thử nghiệm cho ăn, tổng trọng lượng và chiều dài của tôm được đo và gan tụy được thu thập. Tỷ lệ tăng trọng tương đối (WG%) = 100× (Wt – W0)/ W0 ×100; Tốc độ lột xác (MR, %/ngày)= (Nm / Ns) / T, Tốc độ tăng trưởng riêng (SGR) = ln Wt-ln W0 ÷ T × 100, lượng thức ăn ăn vào (FId)= 100 × F/ (T× (Wt+ W0)/2), hiệu suất chuyển hóa thức ăn (FCEd)= 100× (Wt- W0)/F , Tỷ lệ hiệu quả protein (PER)= (Wt- W0)/P, chỉ số gan (HIS) = Khối lượng gan/con cá trọng lượng cơ thể, Hệ số điều kiện (CF%)= (Wt× 100)/ (L)3 và tỷ lệ cho ăn hàng ngày (DFR, %) = lượng ăn vào/((W0+Wt)/2 ngày thí nghiệm)×100 đã được tính toán trong đó Wt và W0 lần lượt là trọng lượng cơ thể ướt cuối cùng và ban đầu của tôm; Nm, tần số lột xác; Ns, số lượng tôm trong một bể tương ứng; T, thời gian thí nghiệm kéo dài; F, tổng lượng thực phẩm tiêu thụ tính theo trọng lượng khô; P, tổng lượng Protein tiêu thụ tính theo trọng lượng khô; L, tổng chiều dài của mỗi con tôm (Wang và cộng sự, 2004).
Các thông số huyết học (Tổng số lượng tế bào máu (THC) và số lượng tế bào máu khác biệt (DHC))
0.5 ml hemolymp được thu thập từ lượt bơi thứ hai bằng cách sử dụng kim tiêm dưới da cỡ 21 và ống tiêm 2 ml. Mỗi ống tiêm được đổ đầy trước 0,3 ml chất chống đông máu (10 mM Tris–HCl, 250 mM sucrose, 100 mM natri citrat, pH 7,6). Chất chống đông máu được thêm vào để tạo ra tỷ lệ thể tích cân bằng giữa lượng hemolymp và chất chống đông máu. 50 ml hemolymp chống đông đã được cố định với một thể tích tương đương của formalin đệm trung tính (10%) trong 30 phút để đo tổng số lượng tế bào máu (THC) và số lượng tế bào máu khác biệt (DHC). Lượng hemolymp chống đông còn lại được ly tâm ở tốc độ 300×g trong 10 phút ở 4°C để tách tế bào máu ra khỏi huyết tương. Protein tổng số trong huyết tương được đo bằng phương pháp trắc quang bằng cách sử dụng bộ chẩn đoán giao dịch (Thomas, 1998).
Tổng số tế bào máu được đếm bằng máy đo huyết sắc tố (Boeco, Đức) và kính hiển vi ánh sáng ở độ phân giải 100 ×. Hemolymp cố định được phết lên lam kính và nhuộm bằng dung dịch Giemsa (10%) trong 10 phút. Các tế bào máu biệt hóa bao gồm tế bào Hyaline, tế bào bán hạt và tế bào hạt được đặc trưng theo Tsing và cộng sự (1989) và 100 tế bào từ mỗi phết tế bào được đếm dưới kính hiển vi ánh sáng.
Phân tích thành phần sinh hóa cơ thể
Các khẩu phần thử nghiệm đã được lấy mẫu trước và sau khi chiết xuất tỏi để phân tích protein thô, chất béo và tro. Vào cuối cuộc thử nghiệm, tôm trong mỗi bể được lấy mẫu ngẫu nhiên và sản lượng thịt (%) được đánh giá sau khi lột vỏ và bỏ đầu. Thịt được đồng nhất để phân tích độ ẩm, protein thô và tro thô. Thành phần hóa học được xác định theo các quy trình sau (AOAC, 1984): protein thô (Nx6,25) bằng phương pháp Kjeldahl (Thiết bị chưng cất Kjeltec 2100, Foss Tecator, Hoganas, Thụy Điển), chất béo thô sử dụng phương pháp chiết ether, độ ẩm bằng cách sấy khô ở nhiệt độ 105°C trong 24 giờ, tro sử dụng lò nung ở 550°C trong 4 giờ.
Phân tích thống kê
Kết quả được phân tích bằng phần mềm SPSS (phiên bản 16.0). Dữ liệu được chuẩn hóa bằng KolmogorovSmirnov Test. Các thử nghiệm đa phạm vi của ANOVA và Tukey đã được sử dụng một cách để xác định tầm quan trọng của sự khác biệt giữa các nhóm. Tất cả các kết quả được biểu thị bằng phương tiện ± sai số chuẩn (M ± SE) và sự khác biệt đáng kể được biểu thị ở mức ý nghĩa P<0,05.
Kết quả
Tham số tăng trưởng
Vào cuối thử nghiệm cho ăn 56 ngày, tỷ lệ lột xác cao ở tôm được cho ăn với khẩu phần ăn 80 và 100 mg/kg chiết xuất tỏi và thấp nhất ở tôm được cho ăn theo khẩu phần ăn 40 mg/kg và nhóm được cho ăn theo khẩu phần ăn không bổ sung chiết xuất tỏi (p < 0,05) (Bảng 1).
Không có sự gia tăng đáng kể về tỷ lệ tăng cân, SGR, HIS và CF trong số các nghiệm thức nhưng kết quả được trình bày trong Bảng 1 cho thấy xu hướng tăng tỷ lệ tăng cân và SGR ở nhóm bổ sung chiết xuất tỏi 80 mg/kg. Ngoài ra, tôm được cho ăn bằng 100 mg/kg chiết xuất tỏi có HIS cao hơn tôm được nuôi bằng các nồng độ chiết xuất tỏi khác và tôm được cho ăn bằng 40 mg/kg chiết xuất tỏi có CF cao hơn tôm được nuôi bằng các nồng độ khác.
Bảng 1: Các thông số tăng trưởng và tỷ lệ cho ăn của tôm thẻ chân trắng được nuôi bằng các khẩu phần ăn thử nghiệm khác nhau có bổ sung chiết xuất tỏi ở các mức độ khác nhau.
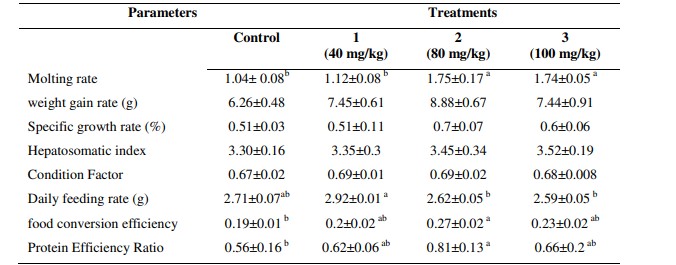
* Các chữ cái khác nhau thể hiện sự khác biệt có ý nghĩa giữa các nghiệm thức (p<0,05). Tất cả dữ liệu được trình bày dưới dạng Giá trị trung bình ± SE.
Thông số cho ăn
Vào cuối thử nghiệm cho ăn 56 ngày, DFI cao ở tôm được cho ăn 40 mg/kg chiết xuất tỏi và tỷ lệ thấp nhất ở tôm được cho ăn theo khẩu phần ăn bổ sung 100 mg/kg chiết xuất tỏi (p < 0,05). Hiệu suất chuyển đổi thức ăn ở nhóm 80 mg/kg chiết xuất tỏi cao hơn đáng kể so với tôm được cho ăn ở các nồng độ khác. PER tuân theo mô hình tương tự như hiệu suất chuyển đổi nguồn thức ăn (Bảng 1).
Các thông số liên quan đến huyết học
Hình 1 minh họa THC và DHC của tôm được cho ăn khẩu phần ăn có chiết xuất tỏi và khẩu phần ăn đối chứng trong 56 ngày. Không có sự khác biệt đáng kể về THC giữa các nhóm tôm. Giá trị THC của tôm ở các nhóm ăn khẩu phần ăn đối chứng, 40 mg/kg, 80 mg/kg và 100 mg/kg chiết xuất tỏi lần lượt là: (8,75 ± 1,96) ×103, (8957,7±1,36) ×103, (13431,1±2,68) ×103 và (15005,7± 4,01) ×103 tế bào/ml (Hình 1A). Ngoài ra, tế bào dạng hạt bị ảnh hưởng nhiều nhất bởi chiết xuất tỏi. Nhóm tôm được cho ăn 100 mg/kg chiết xuất tỏi có số lượng tế bào dạng hạt cao nhất vào ngày thứ 56 (Hình 1B). Nhóm tôm được cho ăn 80 mg/kg chiết xuất tỏi có số lượng tế bào hyaline thấp hơn đáng kể so với nhóm ăn 40 mg/kg chiết xuất tỏi và nhóm đối chứng. Nhóm tôm được cho ăn 80 mg/kg chiết xuất tỏi có số lượng tế bào bán hạt thấp hơn đáng kể so với các nhóm tôm khác. Nhóm tôm được cho ăn 100 mg/kg chiết xuất tỏi có tổng lượng protein huyết tương cao hơn các nhóm tôm khác.
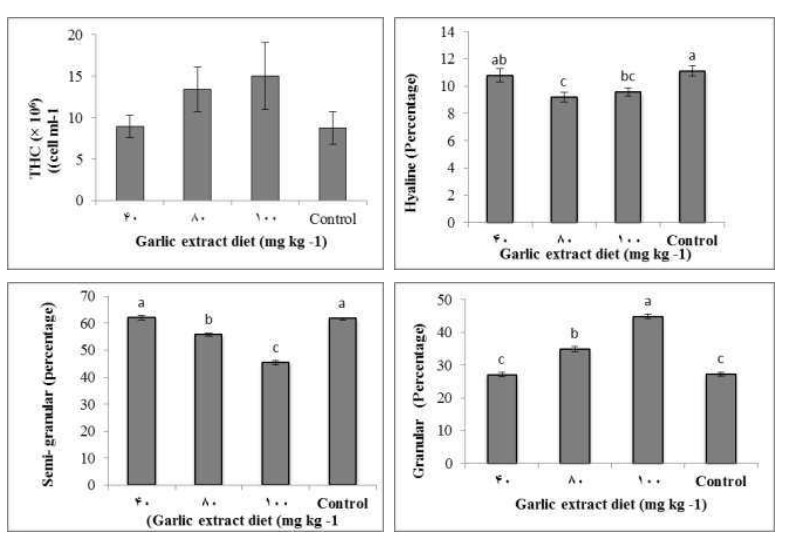
Hình 1: Tổng số lượng tế bào máu (A), tế bào Hyaline (B), Tế bào bán hạt (C) và tế bào hạt (D) của tôm thẻ chân trắng Litopenaeus vannamei, được cho ăn bằng khẩu phần ăn không có chiết xuất tỏi làm đối chứng và khẩu phần ăn với các khẩu phần ăn khác nhau nồng độ chiết xuất tỏi 40, 80 và 100 (mg/ kg khẩu phần ăn) trong 56 ngày. Dữ liệu (trung bình ±SE) với các chữ cái khác nhau có sự khác biệt đáng kể (p < 0,05) giữa các nghiệm thức.
Phân tích thành phần cơ thể
Kết quả phân tích thành phần cơ thể bao gồm protein tổng số, chất béo, tro và độ ẩm từ các mẫu mô cơ được trình bày trong Bảng 2.
Bảng 2: Thành phần sinh hóa cơ thể của tôm thẻ chân trắng được nuôi bằng các khẩu phần ăn thử nghiệm khác nhau có bổ sung chiết xuất tỏi ở các mức độ khác nhau
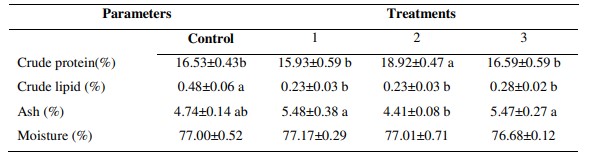
* Các chữ cái khác nhau thể hiện sự khác biệt có ý nghĩa giữa các nghiệm thức (p< 0,05). Tất cả dữ liệu được trình bày dưới dạng Giá trị trung bình ± SE.
Hàm lượng protein cao nhất (18,92 ± 0,47%) được ghi nhận ở nhóm tôm được cho ăn 80 mg/kg chiết xuất tỏi, cao hơn đáng kể so với các nhóm tôm khác. Hàm lượng lipid trong mô cơ của tôm được cho ăn 40, 80 và 100 mg/kg chiết xuất tỏi thấp hơn đáng kể so với nhóm tôm không bổ sung chiết xuất tỏi (p < 0,05). Ngoài ra, hàm lượng tro trong mô cơ của tôm được cho ăn 40, 80 và 100 mg/kg chiết xuất tỏi cao hơn đáng kể so với nhóm tôm không bổ sung chiết xuất tỏi (p < 0,05).
Thảo luận
Tỏi (Allium sativum) được biết đến với nhiều tác dụng tích cực trong nuôi ấu trùng cá và tôm, bao gồm chống căng thẳng, thúc đẩy tăng trưởng, kích thích sự thèm ăn, kích thích miễn dịch và đặc tính kháng khuẩn trong nuôi ấu trùng cá và tôm. Nghiên cứu này nhằm đánh giá ảnh hưởng của chiết xuất tỏi đối với việc thúc đẩy tăng trưởng, kích thích sự thèm ăn, kích thích miễn dịch và các thành phần sinh hóa trong cơ thể tôm thẻ chân trắng Litopenaeus vannamei. Kết quả cho thấy xu hướng tăng tỷ lệ tăng cân và SGR, nhưng không đáng kể. Có thể là do allicin trong tỏi thúc đẩy hệ vi khuẩn đường ruột, cải thiện tiêu hóa và tăng cường sử dụng năng lượng. Xu hướng tăng HIS, có thể do chiết xuất tỏi kích thích gan sản xuất enzyme tiêu hóa và dự trữ năng lượng. Nhìn chung, đường cong tăng trưởng của tôm cũng tương tự như các loài giáp xác khác, tức là theo kiểu bậc thang với tốc độ tăng trưởng rất nhanh trong mỗi quá trình lột xác. Chiết xuất tỏi có thể làm tăng chất lượng thức ăn, giúp tôm tăng trưởng nhanh hơn. Trong nghiên cứu này, MF cao hơn dẫn đến tôm tăng trưởng nhanh hơn; trong khi đối với tôm tăng trưởng kém thì MF tương đối thấp. Vì vậy, có một mối tương quan rõ ràng giữa sự tăng trưởng và lột xác. Có vẻ như chiết xuất tỏi ở mức 80 ppm có thể làm tăng chất lượng của khẩu phần ăn cơ bản.
Tỷ lệ hiệu quả sử dụng thức ăn (FER) và PER là Hai chỉ số quan trọng để đánh giá chất lượng protein và cân bằng axit amin trong khẩu phần ăn của tôm. Chất lượng thức ăn, mật độ thả và chất lượng nước ảnh hưởng đến năng suất nuôi tôm. Wanapat và cộng sự (2008) nhận thấy khả năng tiêu hóa, hấp thu và lưu giữ Nitơ ở nhóm bổ sung bột tỏi cao hơn đáng kể so với nhóm đối chứng. Phát hiện hiện tại của chúng tôi cũng phù hợp với những kết quả này rằng tôm được cho ăn khẩu phần ăn chiết xuất tỏi có mức sử dụng Nitơ (PER, %) cao hơn nhóm đối chứng.
Tỏi có thể ảnh hưởng đến quá trình chuyển hóa protein thông qua kích thích tiết hormone (noradrenaline và adrenaline), tăng cường quá trình đồng hóa protein. Nghiên cứu của Oh et al. (2001) cho thấy tỏi thúc đẩy quá trình đồng hóa protein ở chuột. Tỏi đã ức chế hoạt động gan của các enzyme tạo mỡ và cholesterogen như enzyme malic, enzyme tổng hợp axit béo, glucose-6 phosphate dehydrogenase, dẫn đến giảm nồng độ lipid trong cơ thể (Yeh và Liu, 2001). Các thành phần khoáng thiết yếu cho nhiều chức năng quan trọng trong cơ thể. Chất lượng thức ăn ảnh hưởng đến sự tăng trưởng, tỷ lệ sống và thành phần khoáng trong cơ thể tôm. Hàm lượng tro cao trong thân thịt có thể do khả năng tiếp cận thức ăn và hấp thụ khoáng chất của tôm.
Hệ thống miễn dịch bẩm sinh đóng vai trò quan trọng trong việc bảo vệ tôm khỏi mầm bệnh và các yếu tố bên ngoài. Tế bào máu đóng vai trò quan trọng trong phản ứng miễn dịch và được phân thành ba loại: tế bào hyaline (HC), tế bào bán hạt và tế bào hạt (GC). HC có liên quan đến quá trình thực bào, trong khi các tế bào bán hạt và GC có liên quan đến việc đóng gói và giải phóng hệ thống prophenoloxidase (proPO) (Jiravanichpaisal và cộng sự, 2006). Trong nghiên cứu này, chiết xuất tỏi có xu hướng tăng số lượng tế bào hyaline (HC), nhưng không đáng kể. Số lượng tế bào máu tăng có thể do sự tăng sinh của tế bào máu trong quá trình tạo máu.
Phản ứng miễn dịch là phản ứng sinh lý duy trì cân bằng nội môi. Chiết xuất tỏi có thể ảnh hưởng đến quá trình cầm máu của tôm và làm giảm tế bào hyaline và bán hạt. Ngoài ra, sự gia tăng tế bào hạt và giảm tế bào bán hạt có thể liên quan đến tác dụng của chiết xuất tỏi (Soltani, 2008). Các tế bào dạng hạt chứa các peptide kháng khuẩn được coi là lớp bảo vệ đầu tiên của vật chủ trong hệ thống miễn dịch bẩm sinh (Soltani, 2008).
Trong nuôi trồng thủy sản, chất kích thích miễn dịch có thể kích thích hệ thống miễn dịch bẩm sinh bằng cách kích hoạt hoặc tăng hoạt động của bạch cầu hạt và đại thực bào và tăng số lượng thực bào (Sakai, 1999; Yin và cộng sự, 2006, 2009). Tăng cường tổng hợp protein để tạo ra nhiều phân tử tham gia vào hệ thống miễn dịch bẩm sinh như lysozyme, phosphatase kiềm và nitơ monoxide. Protein huyết thanh là phản ánh chính xác tình trạng của cơ thể và những thay đổi xảy ra trong cơ thể dưới tác động của các yếu tố bên trong và bên ngoài. Tôm được cho ăn khẩu phần ăn có chứa chiết xuất tỏi có tổng lượng protein trong huyết thanh cao hơn. Kết quả này phù hợp với nghiên cứu của Hussein et al. (2001) về mức protein tổng số trong huyết thanh tăng ở chuột bạch tạng đực sau khi dùng dầu tỏi. Lý do tăng protein huyết thanh có thể là do sự gia tăng mức độ globulin miễn dịch và tổng nồng độ globulin. Nồng độ protein huyết thanh cao có thể do cải thiện chức năng gan và các cơ quan khác trong quá trình tổng hợp protein huyết tương.
Kết luận
Dựa trên kết quả thu được từ nghiên cứu này, chiết xuất tỏi có thể được sử dụng làm thức ăn bổ sung trong nuôi tôm, nhưng việc sử dụng chiết xuất này nên được thực hiện sau khi kiểm tra bổ sung với các mức chiết xuất khác và ở các giai đoạn khác nhau trong vòng đời của tôm.
Theo Samadi, Leila; Zanguee, Nasim; Mousavi, Seyed Mohammad; Zakeri, Mohammad
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Đánh Giá Tác Dụng Của Các Loại Probiotic Bacillus Trong Nuôi Nuôi Thủy Sản
- Ảnh Hưởng Của Việc Thay Thế Một Phần Bột Cá Bằng Sản Phẩm Từ Đậu Nành Và Bột Gà Đối Với Tôm Sú
- Công Nghệ Mới Biofloc Và Bệnh Tôm Trong Nuôi Trồng Thủy Sản Siêu Thâm Canh

 English
English 中文 (中国)
中文 (中国)