Tóm tắt
Vi khuẩn sinh học Halomonas aquamarina và tảo Shewanella có thể cải thiện hiệu suất nuôi tôm thẻ chân trắng trong hệ thống không thay nước. Nghiên cứu được thực hiện theo hai bước liên tiếp: (1) kiểm tra khả năng gây bệnh của cả probiotic trong nuôi tôm thẻ chân trắng và (2) kiểm tra tác dụng của probiotic đối với chất lượng nước và kiểm soát hội chứng vibriosis. Ngay từ bước đầu tiên, việc sử dụng men vi sinh không có tác dụng gây bệnh cho tôm PL vì tỷ lệ sống là 84-98% đã được ghi nhận. Từ bước hai, việc áp dụng cả hai loại vi khuẩn probiotic đã có thể ức chế sự phát triển quần thể V. harveyi trong đó tỷ lệ sống sót cao nhất đạt được là 93,94% khi bổ sung H. aquamarina. Các thông số chất lượng nước trong hệ thống có bổ sung vi khuẩn sinh học không khác biệt đáng kể so với hệ thống không bổ sung vi khuẩn sinh học. Xét về các thông số sinh học khác, việc sử dụng các chế phẩm sinh học này đã ảnh hưởng đáng kể đến việc tăng trọng của tôm. Các vi khuẩn sinh học này có thể cạnh tranh với vi khuẩn gây bệnh và sản xuất các chất kháng khuẩn, giúp bảo vệ tôm khỏi bệnh tật. Vi khuẩn sinh học Halomonas aquamarina và tảo Shewanella là một giải pháp tiềm năng để cải thiện hiệu suất nuôi tôm thẻ chân trắng trong hệ thống không thay nước.
Giới thiệu
Nuôi trồng thủy sản là một ngành có tốc độ tăng trưởng nhanh chóng và đóng vai trò quan trọng trong phát triển kinh tế. Tuy nhiên, ngành này vẫn còn nhiều thách thức, đặc biệt là trong việc quản lý chất lượng nước và dịch bệnh. Nuôi trồng thủy sản là một ngành có tốc độ tăng trưởng nhanh chóng, đáp ứng nhu cầu thực phẩm từ nghề cá. Indonesia là một trong những nước sản xuất nuôi trồng thủy sản lớn nhất, với tốc độ tăng trưởng hàng năm là 10,26%. Tôm thẻ chân trắng là một trong những mặt hàng nuôi trồng thủy sản chính ở Indonesia, đóng góp đáng kể vào tổng sản lượng nuôi trồng thủy sản của nước này. Tuy nhiên, ngành nuôi trồng thủy sản ở Indonesia vẫn còn nhiều bất lợi, đặc biệt là năng suất nuôi thấp trong giai đoạn ương giống, do áp dụng hệ thống nuôi mẻ chưa chú trọng đến chất lượng nước và quản lý dịch bệnh. Để phát triển bền vững, ngành nuôi trồng thủy sản cần giải quyết các thách thức về quản lý chất lượng nước và dịch bệnh.
Hội chứng vibriosis là một trong những bệnh nhiễm trùng chính trong nuôi tôm thẻ chân trắng. Các phương pháp hiện có để giải quyết hội chứng vibriosis có những hạn chế nhất định. Chế phẩm sinh học là một giải pháp tiềm năng để giải quyết hội chứng vibriosis. Nghiên cứu này đã sử dụng hai loại chế phẩm sinh học bản địa là Halomonas aquamarina và tảo Shewanella. Kết quả nghiên cứu cho thấy việc áp dụng hai chế phẩm sinh học này đã cải thiện đáng kể chất lượng nước, tỷ lệ sống và tăng trưởng của tôm thẻ chân trắng.
Nguyên liệu và phương pháp
Chuẩn bị nghiên cứu
Hai loại vi khuẩn probiotic này được phân lập và chọn lọc từ trại giống Situbondo, Đông Java. Số lượng tế bào tối ưu của H. aquamarina là 106 CFU/mL và 105 CFU/mL đối với S. algae. Số lượng tế bào tối ưu của V. harveyi gây nhiễm trùng tôm là 104 CFU/mL.
Thử nghiệm khả năng gây bệnh của men vi sinh đối với tôm thẻ chân trắng PL-4: H. aquamarina và S. algae đã được thử nghiệm về khả năng gây bệnh đối với nuôi tôm thẻ chân trắng PL-4. Thử nghiệm khả năng gây bệnh sử dụng bốn ly hóa chất (2L), mỗi ly chứa 1,5 lít nước biển. Vì 0,1% v.v của mỗi vi khuẩn đã được sử dụng [(K) không bổ sung vi khuẩn; (P8) bổ sung H. aquamarina; (P9) bổ sung S. algae; và (V) bổ sung V. harveyi] vào mật độ quang tế bào lần lượt là 106 CFU/mL, 105 CFU/mL và 104 CFU/mL đối với H. aquamarina, S. algae và V. harveyi. Tuổi của ba vi khuẩn cấy này là 24 giờ. Trong thử nghiệm này, 50 con tôm thẻ chân trắng PL-4 đã được thêm vào mỗi nhóm thử nghiệm. Thử nghiệm khả năng gây bệnh được thực hiện trong 12 ngày. Số lượng tôm thẻ chân trắng còn lại ở mỗi nhóm thử nghiệm được tính toán vào cuối thời gian nuôi để biết tỷ lệ sống.
Ứng dụng vi khuẩn probiotic trong nuôi tôm thẻ chân trắng PL-4
Bố trí thí nghiệm: 10L nước biển đã khử trùng có độ mặn 30 ppt được thả vào mỗi bể, đáy được phủ đá bicarbonate đã khử trùng để đệm. Đường sục khí được ổn định sau đó nối với bơm sục khí (Hình 1) và mỗi bể có tốc độ sục khí là 200 mL/ phút.
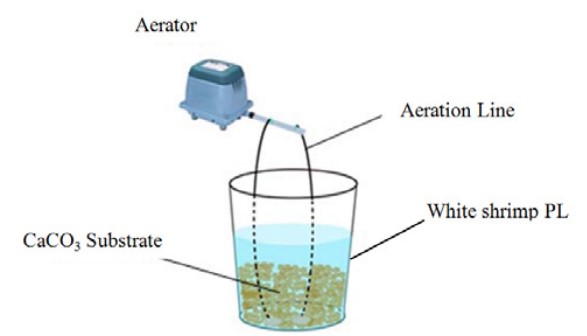
Hình 1: Hệ thống bố trí ứng dụng H. aquamarina và S. algae để chống lại V. harveyi trong nuôi L. vannamei.
Vi khuẩn probiotic được kích hoạt trong 24 giờ và được thêm vào môi trường nuôi cấy dựa trên nhóm xử lý (Bảng 1) ở mức 0,1% v.v đối với nồng độ và mật độ quang học 106 CFU/mL đối với H. aquamarina, 105 CFU/mL đối với H. aquamarina. S. algae. Vi khuẩn V. harveyi (0,1% v.v) đã được thêm vào môi trường nuôi cấy sau 24 giờ kể từ khi bổ sung men vi sinh. Sau đó, PL-4 được đưa vào nuôi với mật độ 330 cá thể/bể. Thí nghiệm được tiến hành trong 12 ngày ở nhiệt độ 26 ± 2°C, mỗi nghiệm thức lặp lại 3 lần. Trong thí nghiệm này, không xả nước bằng cách thêm đá CaCO3 vào mỗi bể đáy làm chất nền nuôi cấy. Môi trường nuôi được nuôi bằng vi tảo (Chaetoceros sp.) và ấu trùng Artemia sp. đã khử trùng. Lượng thức ăn được điều chỉnh phù hợp với mật độ thả tôm thẻ chân trắng PL. Vi tảo được cho ăn thủ công 2 lần/ngày vào lúc 09h00 và 03h00 chiều và Artemia sp. được cho ăn 3 lần/ ngày vào lúc 08 giờ sáng, 12 giờ trưa và 08 giờ tối.
Bảng 1: Các nghiệm thức vi khuẩn probiotic gây bệnh Vibrio harveyi trong nuôi tôm thẻ chân trắng.
Quan sát bao gồm tỷ lệ sống của tôm thẻ chân trắng vào cuối thời gian nuôi, chiều dài và trọng lượng của tôm thẻ chân trắng khi bắt đầu và kết thúc nuôi, đo các thông số chất lượng nước (nhiệt độ, độ mặn, DO, pH, amoniac, nitrit và nitrat), đếm cộng đồng vi khuẩn, nhận dạng vi khuẩn và biến động quần thể vi khuẩn trong quá trình nuôi cấy.
Thông số chất lượng nước: Một số thông số chất lượng nước, tức là nhiệt độ, độ mặn, độ pH và oxy hòa tan (DO) được đo hàng ngày, trong khi nồng độ amoniac, nitrit và nitrat được đo 2 ngày/ lần.
Các thông số kỹ thuật nuôi tôm thẻ chân trắng: Tỷ lệ sống của tôm thẻ chân trắng L. vannamei được tính toán vào cuối thời kỳ nuôi bằng cách đếm số lượng tôm còn lại so với số lượng ban đầu. Tỷ lệ sống của PL được tiến hành bằng cách sử dụng phương trình sau:
SR=Nt/No×100%
Trong đó:
SR=Tỷ lệ sống sót
No=Số tôm ban đầu
Nt=Số tôm cuối cùng
Trọng lượng cơ thể và chiều dài trung bình của tôm post được ghi nhận ở 20% quần thể trong mỗi nghiệm thức vào cuối thời kỳ nuôi.
Lấy mẫu vi khuẩn: Phân tích vi sinh được thực hiện bằng cách lấy mẫu 10 mL nước từ mỗi bể nuôi và lấy mẫu tôm để phân tích ruột vi khuẩn. Số lượng vi khuẩn được tính là kết quả của số lượng khuẩn lạc đếm được trên đĩa Petri nhân với hệ số pha loãng.
Định danh vi khuẩn: Định danh vi khuẩn được thực hiện bằng cách kiểm tra hình thái khuẩn lạc, xét nghiệm Gram và 17 xét nghiệm hoạt tính sinh hóa để tìm ra sự đa dạng của vi khuẩn trong nước trong thời gian nuôi.
Phân tích thống kê: Tất cả dữ liệu được xử lý thống kê bằng cách sử dụng ANOVA một chiều. Sự khác biệt đáng kể giữa các phương tiện (p<0,05) đã được kiểm tra bằng phép thử đa phạm vi của Duncan.
Kết quả và thảo luận
Thử nghiệm khả năng gây bệnh của vi khuẩn probiotic đối với tôm thẻ chân trắng
Thử nghiệm khả năng gây bệnh được thực hiện để kiểm tra xem H. aquamarina và S. algae có ảnh hưởng tiêu cực đến quá trình nuôi tôm thẻ chân trắng PL hay không. Kết quả cho thấy tỷ lệ sống của tôm thẻ chân trắng ở cả hai nhóm bổ sung probiotic đều cao hơn so với nhóm đối chứng không bổ sung vi khuẩn. Tỷ lệ sống của tôm thẻ chân trắng trong nhóm bổ sung H. aquamarina cao hơn so với nhóm bổ sung S. algae. Kết quả này cho thấy cả hai chế phẩm sinh học đều có thể được sử dụng làm chất bổ sung thức ăn để cải thiện sức khỏe của tôm thẻ chân trắng PL-4.
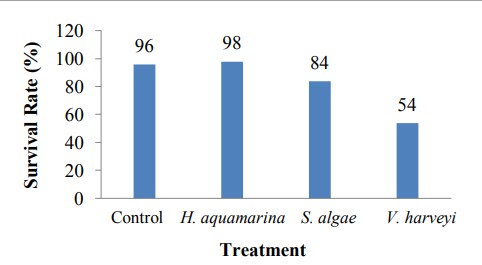
Hình 2: Tỷ lệ sống của tôm thẻ chân trắng PL thu được từ xét nghiệm mầm bệnh.
Ứng dụng vi khuẩn probiotic trong nuôi tôm thẻ chân trắng PL-4
Thông số chất lượng nước: Chất lượng nước là yếu tố quan trọng trong nuôi tôm thẻ chân trắng, cần được quan sát thường xuyên để đảm bảo tôm khỏe mạnh và phát triển tốt. Kết quả đo các thông số chất lượng nước bao gồm nhiệt độ, độ mặn, DO, pH và hàm lượng amoniac, nitrit, nitrat được trình bày ở Bảng 2.
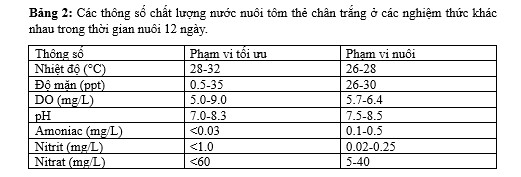
Nhiệt độ: Nhiệt độ và độ mặn là hai yếu tố quan trọng ảnh hưởng đến sinh trưởng và phát triển của tôm thẻ chân trắng. Sự gia tăng nhiệt độ kích hoạt quá trình trao đổi chất tăng lên với tốc độ tối đa. Tôm thẻ chân trắng có khả năng chịu nhiệt độ rộng, nhiệt độ tối ưu cho sinh trưởng và phát triển là 28-32°C. Nhiệt độ nước dưới 15°C và trên 35°C có thể gây chết cho tôm.
Độ mặn: Tôm thẻ chân trắng là sinh vật eurihaline, có khả năng thích ứng với độ mặn dao động. Tôm thẻ chân trắng có khả năng điều hòa thẩm thấu tốt ngay cả khi sống ở độ mặn thấp. Khả năng này phát triển dần dần kể từ tôm post.
Oxy hòa tan (DO): Oxy hòa tan (DO) và pH là hai yếu tố quan trọng ảnh hưởng đến sinh trưởng và phát triển của tôm thẻ chân trắng. Tôm thẻ chân trắng cần oxy để hô hấp và sinh trưởng. Hàm lượng DO thích hợp cho tôm thẻ chân trắng là 5-9 mg/L. Giảm DO sẽ dẫn đến giảm tốc độ chuyển hóa thức ăn, tốc độ tăng trưởng và tốc độ chuyển hóa thức ăn. DO dưới 1,5 mg/L trong thời gian dài có thể khiến tôm chết.
Mức độ axit (pH): Độ pH là log âm của nồng độ ion hydro trong nước. Độ pH bị ảnh hưởng bởi quá trình hô hấp, có thể làm giảm độ pH. CO2 trong nước hòa tan tạo thành H2CO3. Độ pH thích hợp cho tôm thẻ chân trắng là 7-9. Độ pH dưới 6,5 hoặc trên 10 sẽ gây nguy hiểm cho mang tôm và ảnh hưởng đến tốc độ tăng trưởng của tôm. Việc bổ sung đá CaCO3 vào đáy bể nuôi cấy có tác dụng như chất nền nuôi cấy có thể giúp ổn định độ pH.
Amoniac: Amoniac là chất thải nitơ có thể gây độc cho tôm thẻ chân trắng. Nồng độ amoniac trong nước nuôi tôm thẻ chân trắng thường vượt quá 0,1 mg/L, nhưng không ảnh hưởng đáng kể đến tôm nếu độ pH của nước vẫn ở mức tối ưu. Amoniac trong nước có hai dạng: amoniac liên kết và amoniac ion hóa. Amoniac ion hóa là dạng gây độc cho tôm. Để đảm bảo tôm thẻ chân trắng phát triển tốt, cần kiểm soát nồng độ amoniac trong nước nuôi dưới 0,3 mg/L.
Nitrit: Nitrit là chất độc hại cho tôm ở mức độ nhất định, nồng độ nitrit an toàn cho tôm là dưới 1,36 mg/L. Trong nghiên cứu này, nồng độ nitrit trong nước nuôi tôm thẻ chân trắng dao động từ 0,02 đến 0,25 mg/L, nằm dưới nồng độ tối đa cho phép.
Nitrate: Trên thực tế hợp chất nitrat không độc hại trong nuôi tôm, nồng độ an toàn cho tôm là dưới 60 mg/L. Trong nghiên cứu này, nồng độ nitrat dao động từ 5 đến 40 mg/L, nằm dưới nồng độ tối đa cho phép. Nồng độ nitrat tăng dần theo thời gian nuôi, có thể do quá trình nitrat hóa.
Tỷ lệ sống và tăng trưởng tôm thẻ chân trắng PL
Tỷ lệ sống của ấu trùng tôm thẻ chân trắng cũng được xác định qua ảnh hưởng của việc bổ sung H. aquamarina và S. algae vào môi trường nuôi tôm thẻ chân trắng nhiễm V. harveyi. Hình 3 cho thấy tỷ lệ sống của tôm thẻ chân trắng PL trong tác dụng đối kháng của vi khuẩn probiotic đối với V. harveyi. Tỷ lệ sống cao nhất là bổ sung H. aquamarina vào môi trường nuôi cấy (KP8), tiếp theo là bổ sung S. algae (KP9), H. aquamarina–S. algae (KC), S. algae–V. harveyi (P9), H. aquamarina–S. algae–V. harveyi (PC), H. aquamarina–V. harveyi (P8) và điều khiển (K). Tỷ lệ sống thấp nhất đạt được khi bổ sung V. harveyi (KV).
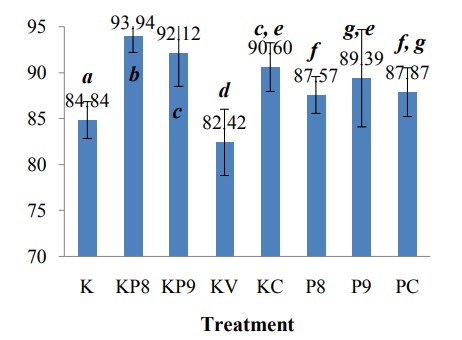
Hình 3: Tỷ lệ sống của tôm thẻ chân trắng ở cuối thời kỳ nuôi bằng chế phẩm sinh học đối với thử nghiệm V. harveyi.
Bổ sung chế phẩm sinh học Halomonas aquamarina (P8) và Shewanella algae (P9) vào thức ăn của tôm thẻ chân trắng PL có tác dụng cải thiện tỷ lệ sống của tôm, giúp tôm chống lại nhiễm trùng của vi khuẩn V. harveyi. Tỷ lệ sống của tôm thẻ chân trắng ở nhóm bổ sung chế phẩm sinh học cao hơn đáng kể so với nhóm không bổ sung. Trong đó, tỷ lệ sống của nhóm bổ sung P9 cao nhất, cao hơn đáng kể so với nhóm bổ sung P8. Việc bổ sung chế phẩm sinh học không ảnh hưởng đáng kể đến sự tăng trưởng của tôm thẻ chân trắng.

Hình 4: Tăng trưởng trọng lượng PL tôm thẻ chân trắng cuối thời kỳ nuôi

Hình 5: Tăng trưởng chiều dài tôm thẻ chân trắng vào cuối thời kỳ nuôi.
Hình 5 thể hiện số liệu về chiều dài cơ thể tôm thẻ chân trắng PL. Mức tăng chiều dài cơ thể cao nhất mà KC thu được, tiếp theo là P8, KP9, P9, KP8, KV, PC và cuối cùng là K. Dựa trên phân tích thống kê, không có sự khác biệt đáng kể nào về chiều dài cơ thể ở tất cả các nhóm (p > 0,05). Nó chỉ ra rằng việc bổ sung men vi sinh không mang lại bất kỳ ảnh hưởng nào đến chiều dài cơ thể. Tuy nhiên, có một số khác biệt đáng kể về mức tăng trọng lượng cơ thể ở một số nhóm điều trị. KV khác biệt đáng kể với các nhóm khác ở trọng lượng cơ thể thấp nhất. Và việc bổ sung men vi sinh (KP8 và KP9) có sự khác biệt đáng kể so với các nhóm khác.
Nhận dạng vi khuẩn: Vi khuẩn tìm thấy cả trong nước và mẫu ruột tôm được xác định thông qua phương pháp xét nghiệm sinh hóa (Bảng 3). Nhìn chung, H. aquamarina và S. algae được tìm thấy ở tất cả các nhóm nuôi cấy. Điều đó cho thấy 2 chế phẩm sinh học này là vi khuẩn bản địa trong nuôi tôm thẻ chân trắng.
Quần thể H. aquamarina, S. algae và V. harveyi trong quá trình nuôi cấy
Quần thể vi khuẩn trong nước nuôi: Quần thể vi khuẩn được kiểm tra từ 1 mL mẫu nước nuôi L. vannamei cho thấy có nhiều loài vi khuẩn khác nhau được tìm thấy trong mỗi phương pháp xử lý như trong Hình 6. Probiotic H. aquamarina và S. algae, cũng như mầm bệnh, V. harveyi có thể được tìm thấy ở tất cả các nghiệm thức với số lượng tế bào ở mức độ khác nhau. Tình trạng này có nghĩa là tất cả vi khuẩn thực ra cũng là vi khuẩn bản địa vốn sinh sống ở nước biển hoặc môi trường nuôi cấy biển.
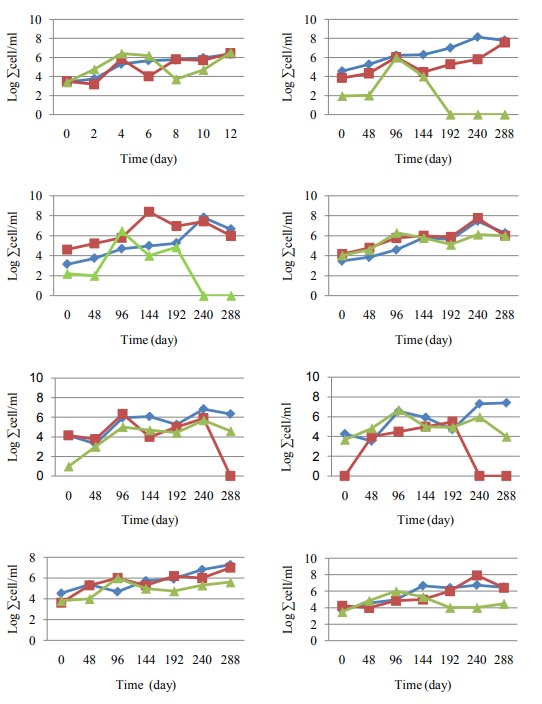

Trong môi trường nuôi tôm thẻ chân trắng, cả hai loại men vi sinh H. aquamarina và S. algae đều có khả năng ức chế sự phát triển của vi khuẩn V. harveyi. Nhóm bổ sung men vi sinh H. aquamarina (KP8) có tỷ lệ sống cao nhất và không tìm thấy V. harveyi trong môi trường nuôi cấy. Nhóm bổ sung men vi sinh S. algae (KP9) cũng có tỷ lệ sống cao và V. harveyi được tìm thấy nhưng với số lượng thấp. Kết quả này cho thấy cả hai loại men vi sinh đều có tiềm năng ứng dụng trong nuôi trồng thủy sản để cải thiện tỷ lệ sống và sức khỏe của tôm thẻ chân trắng.
Ở nhóm xử lý KV, Việc bổ sung vi khuẩn gây bệnh V. harveyi vào môi trường nuôi tôm thẻ chân trắng làm giảm tỷ lệ sống của tôm.
Ở nhóm xử lý KC, Tỷ lệ sống của tôm thẻ chân trắng cao nhất khi bổ sung men vi sinh H. aquamarina hoặc S. algae, nhưng thấp hơn khi bổ sung cả hai loại men vi sinh này cùng lúc. Điều này phù hợp với tỷ lệ sống của tôm thẻ chân trắng, cho thấy tỷ lệ sống thấp hơn so với việc áp dụng chế phẩm sinh học nuôi đơn lẻ (KP8 và KP9).
Trong nhóm xử lý P8, H. aquamarina và V. harveyi được thêm vào môi trường nuôi cấy. Việc bổ sung cả hai loại men vi sinh cùng lúc có thể làm giảm hiệu quả ức chế vi khuẩn gây bệnh của men vi sinh, do sự cạnh tranh giữa các vi khuẩn này về dinh dưỡng và không gian.
Trong nhóm xử lý P9, Việc bổ sung vi khuẩn gây bệnh V. harveyi vào môi trường nuôi tôm thẻ chân trắng có thể làm giảm tỷ lệ sống của tôm, ngay cả khi cả hai loại men vi sinh đều tồn tại trong môi trường nuôi.
Trong nhóm xử lý bằng PC, H. aquamarina, S. algae và V. harveyi đã được thêm vào môi trường nuôi cấy. Trong biểu đồ, cho thấy mỗi vi khuẩn dao động trong thời gian nuôi cấy. Số lượng V. harveyi giảm vào cuối quá trình nuôi cấy do hoạt động ức chế men vi sinh.
Quần thể vi khuẩn trong ruột L. vannamei: Vi khuẩn tìm thấy trong các mẫu ruột của L. vannamei hầu hết giống với vi khuẩn tìm thấy trong nước nuôi (Hình 7), ngoại trừ một loài khác được cho là hệ vi sinh vật bình thường của L. vannamei, Micrococcus sp. Kết quả của nghiệm thức K chứng minh rằng cả hai chế phẩm sinh học, H. aquamarina và S. algae, và V. harveyi đều được nuôi tôm tiêu thụ. Micrococcus sp. được tìm thấy trong hệ thống này. Thể hiện sự phát triển năng động của từng hệ thống, H. aquamarina vẫn tăng theo ngày.
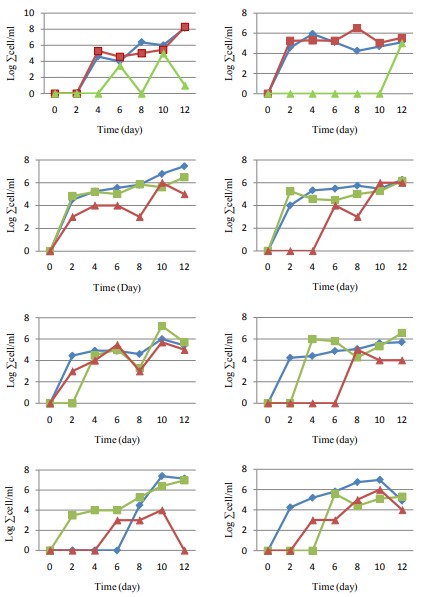

Ở nghiệm thức KP8, cả hai loại probiotic đều được tìm thấy từ ngày thứ 2, mỗi loài đều biến động và có xu hướng giảm dần. Điều đó cho thấy rằng việc chỉ thêm S. algae vào môi trường nuôi cấy không phải là một phương pháp phòng ngừa hiệu quả chống lại mầm bệnh.
Ở nghiệm thức KV, khuẩn lạc của mầm bệnh này được tìm thấy với số lượng lớn kể từ ngày thứ 6, đạt mức cao nhất vào ngày lấy mẫu cuối cùng. Các trại nuôi tôm đã bị vi khuẩn V. harveyi tấn công dẫn đến tỷ lệ sống sót thấp.
Tốc độ tăng trưởng của cả H. aquamarina và S. algae trong nghiệm thức KC cho thấy hoạt động đối kháng của cả hai nhóm nuôi. V. harveyi được tìm thấy từ ngày 0 đến ngày 12, nghĩa là nếu có bất kỳ tác dụng ức chế nào trong ruột tôm thì nó không thể hoạt động hiệu quả để ức chế mầm bệnh này phát triển liên tục. Micrococcus sp cũng có thể phát triển tốt trong môi trường nuôi cấy. Tương tự như nghiệm thức 8, số lượng tế bào H. aquamarina ngày càng chiếm ưu thế.
Nghiệm thức P8 và P9 cho thấy khả năng của V. harveyi đối với ruột của tôm thẻ chân trắng L. vannamei vào giữa thời kỳ nuôi cấy, khoảng ngày thứ 6 và 8. Điều kiện này cho thấy cơ chế ức chế do H. aquamarina thực hiện trong việc tiết ra bacteriosin, được coi là hiệu quả hơn so với nghiệm thức P8 và P9. S. algae hoạt động tốt hơn trong nước hơn là bên trong ruột tôm.
Men vi sinh H. aquamarina và S. algae có khả năng ức chế sự phát triển của vi khuẩn gây bệnh V. harveyi trong nuôi tôm thẻ chân trắng. Cụ thể, H. aquamarina có thể ức chế V. harveyi bằng cách tiết ra kháng sinh aminophenoxazinones, phân tử siderophore aquachelin, exoenzyme và hợp chất hữu cơ. S. algae có thể ức chế V. harveyi bằng cách tiết ra bacteriocin, tạo ra màng sinh học và hợp chất lợn (pyomelanin). Bổ sung men vi sinh H. aquamarina và S. algae là một biện pháp hiệu quả để phòng ngừa bệnh tôm thẻ chân trắng.
Kết luận
Trong thời gian nuôi, các thông số chất lượng nước bao gồm nhiệt độ, độ mặn, độ pH, nồng độ oxy hòa tan (DO), nồng độ amoniac, nitrit và nitrat hầu hết có xu hướng ổn định và không có sự khác biệt đáng kể theo ngày. Tỷ lệ sống sót thấp nhất được đưa ra bởi nghiệm thức 4 chỉ bổ sung phân lập V. harveyi. Mặc dù cả hai loại men vi sinh đều có hoạt tính ức chế thách thức V. harveyi, H. aquamarina chiếm ưu thế và được cho là có hiệu quả hơn S. algae. Do đó, nuôi cấy H. aquamarine đơn lẻ có thể mang lại kết quả tốt hơn để duy trì nuôi tôm post L. vannamei thay vì nuôi cấy hỗn hợp, vì tốc độ tăng trưởng của cả hai loại men vi sinh không cho thấy hoạt động cộng sinh hoặc hiệp lực.
Theo Gede Suantika, Pingkan Aditiawati, Dea Indriani Astuti và Zarah Fazri Khotimah
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Sản Xuất Tôm Thẻ Chân Trắng Ở Trung Quốc
- Ảnh Hưởng Của Tăng Thân Nhiệt Đến Phản Ứng Miễn Dịch Của Tôm Thẻ Chân Trắng Bị Nhiễm IMNV
- Tiêu Thụ Giun Nhiều Tơ Làm Tăng Sinh Tổng Hợp Prostaglandin Ở Tôm Sú Cái Penaeus monodon

 English
English