3.5. Thông số miễn dịch hemolymp
Kết quả miễn dịch hemolymp của P. monodon được trình bày trong Bảng 7. AKP tăng đáng kể (p<0,05) trong các nghiệm thức bổ sung Ast, trong khi không có ý nghĩa nào khác (p>0,05) được phát hiện trong các nghiệm thức bằng D–F. AST cho thấy xu hướng giảm liên tục với sự gia tăng mức độ Ast trong khẩu phần ăn. Mức bổ sung Ast trong khẩu phần ăn 61,5 mg/kg (nghiệm thức D) cho thấy giá trị cao hơn đáng kể so với đối chứng. Ngược lại, Ast trong khẩu phần ăn giảm đáng kể (p <0,05) làm giảm hoạt tính ALT trong hemolymp của tôm.

3.6. Kiểm tra khả năng chống stress
Các giá trị LT50 đối với thử nghiệm khả năng chống chịu căng thẳng do nhiễm Vibrio parahaemolyticus được thể hiện trong Hình 2. Các giá trị LT50 tăng đáng kể (p<0,05) khi bổ sung Ast trong khẩu phần ăn. Hiệu suất tốt nhất được đưa ra bởi nghiệm thức F, trong khi không quan sát thấy sự khác biệt đáng kể (p>0,05) so với nghiệm thức E.
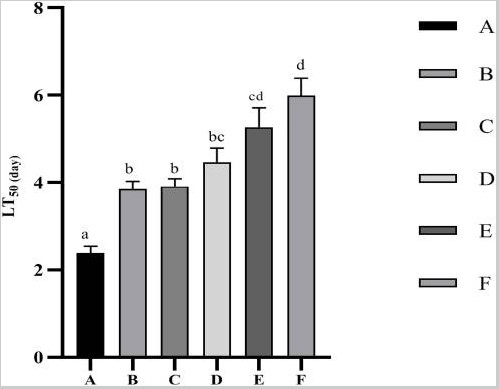
Hình 2. Thời gian đến tỷ lệ chết 50% (LT50) của tôm sú P. monodon sau khi nhiễm Vibrio parahaemolyticus. Dữ liệu được biểu thị dưới dạng trung bình ± SEM từ các nhóm ba lần. Các chữ cái khác nhau cho thấy sự khác biệt đáng kể (p <0,05) giữa các thanh khác nhau.
3.7. So sánh hệ vi sinh vật đường ruột
Số liệu thống kê đa dạng alpha và OTU của hệ vi sinh vật đường ruột ở tôm sú P. monodon được thể hiện trong Hình 3. Mức độ Good’s coverage (Hình 3A) cho mỗi nghiệm thức đạt tới 99%. Các kết quả của Shannon và Chao 1 có thể phản ánh thông tin về sự đa dạng và phong phú của vi khuẩn trong các mẫu ruột (Hình 3B, C). 2 thông số này không có sự khác biệt đáng kể (p>0,05) giữa các nghiệm thức. Mặc dù OTU (Hình 3D) giảm khi tăng mức Ast trong khẩu phần ăn, nhưng không có sự khác biệt đáng kể (p>0,05) được phát hiện giữa tất cả các nghiệm thức.
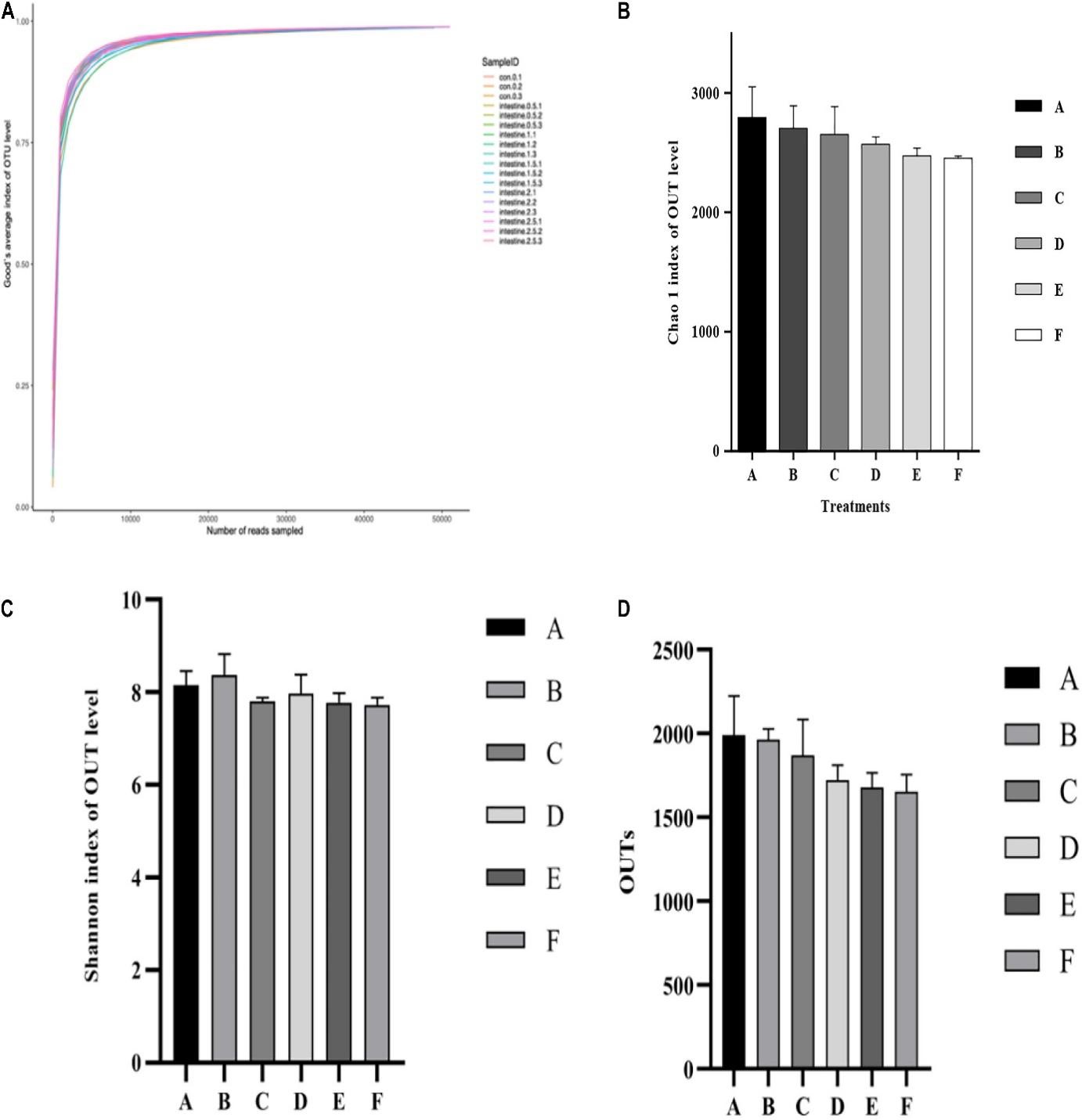
Hình 3. Phân tích so sánh đa dạng alpha với cộng đồng vi sinh vật trong ruột tôm được cho ăn với các mức astaxanthin khác nhau trong 56 ngày. (A) Đường cong Good’s coverage; (B) Chỉ số phong phú Chao 1; (C) Chỉ số đa dạng của Shannon; (D) Chỉ số so sánh độ phong phú của OTU đối với các mẫu đường ruột A, B, C, D, E và F. Dữ liệu được biểu thị dưới dạng trung bình ± SEM từ các nhóm ba lần. Các chữ cái khác nhau cho thấy sự khác biệt đáng kể (p <0,05) giữa các thanh khác nhau. OTU, đơn vị phân loại hoạt động.
Thành phần cộng đồng vi sinh vật và sự phong phú của tất cả các mẫu đường ruột ở cấp độ ngành được trình bày trong Hình 4. Các thành viên cộng đồng vi khuẩn chiếm ưu thế nhất ở cấp độ ngành, Firmicutes, Bacteroidetes, Proteobacteria và Actinobacteria lần lượt chiếm 45.23, 31.66, 15.82 và 4.87% trong tổng số cộng đồng vi khuẩn (Hình 4A) . Không có sự khác biệt đáng kể nào được ghi nhận về tải lượng tương đối của Firmicutes (p=0,67), Bacteroidetes (p=0,27), Proteobacteria (p=0,41) và Actinobacteria (p=0,61) trong số tất cả các nghiệm thức (Hình 4B).
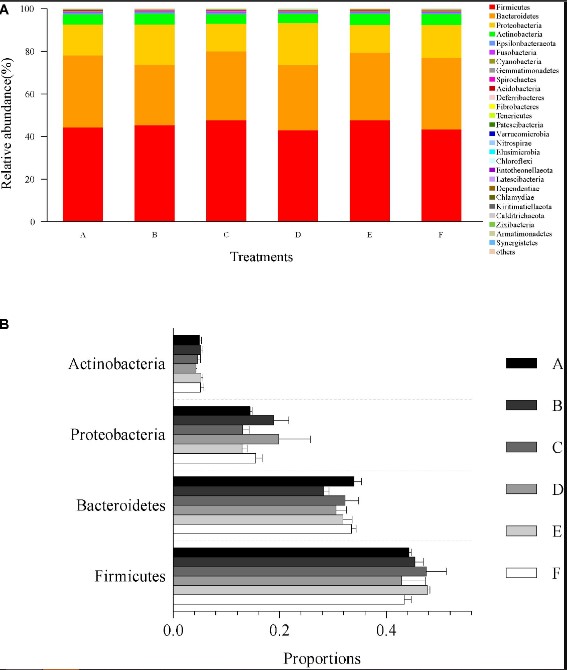
Hình 4. Tải lượng tương đối của ngành ưu thế và so sánh với sự phong phú của vi khuẩn trong ruột ở cấp độ ngành. (A) tải lượng tương đối của ngành chiếm ưu thế (top 30) từ tất cả các dữ liệu giải trình tự có thể phân loại. Các loại ngành chưa được phân loại với số lượng tương đối thấp hơn 1% được chỉ định là “những loại khác”. (B) So sánh sự phong phú với 4 thành viên cộng đồng vi khuẩn chiếm ưu thế ở cấp độ ngành, bao gồm Firmicutes, Bacteroidetes, Proteobacteria và Actinobacteria. Dữ liệu được biểu thị dưới dạng trung bình ± SEM từ các nhóm ba lần.
Thành phần cộng đồng vi sinh vật và sự phong phú của tất cả các mẫu đường ruột ở cấp độ chi được trình bày trong Hình 5. 15 chi hàng đầu trong trình tự có thể phân loại là Clostridium, Ruminococcus, Bacteroides, Bifidobacterium, Escherichia–Shigella, Klebsiella, Sutterella, Prevotella, Prevotella, Eubacterium, Lachnospiraceae, Rikenellaceae, Blautia, Haemophilus và Lactobacillus (Hình 5A). Kết quả phân tích thử nghiệm ANOVA không cho thấy bất kỳ sự khác biệt đáng kể nào (p>0,05) về mức độ tải lượng tương đối của các giống này (Hình 5B) giữa tất cả các nghiệm thức.
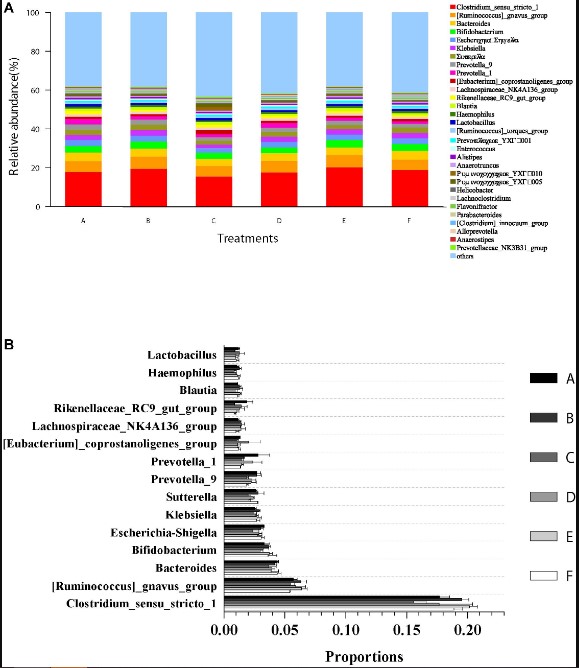
Hình 5. Mức độ tải lượng tương đối của các chi chiếm ưu thế và so sánh với mức độ phong phú của vi khuẩn trong ruột ở cấp độ chi. (A) tải lượng tương đối của các chi trội (top 30) từ tất cả các dữ liệu giải trình tự có thể phân loại. Các chi chưa được phân loại với số lượng tương đối thấp hơn 1% được chỉ định là “các chi khác”. (B) So sánh mức độ phong phú với 15 chi có nhiều nhất trong ruột tôm trong tất cả các nghiệm thức. Dữ liệu được biểu thị dưới dạng trung bình ± SEM từ các nhóm ba lần.
Thành phần cộng đồng vi sinh vật và sự phong phú của tất cả các mẫu đường ruột ở cấp độ chi được trình bày trong Hình 5. 15 chi hàng đầu trong trình tự có thể phân loại là Clostridium, Ruminococcus, Bacteroides, Bifidobacterium, Escherichia–Shigella, Klebsiella, Sutterella, Prevotella, Prevotella, Eubacterium, Lachnospiraceae, Rikenellaceae, Blautia, Haemophilus và Lactobacillus (Hình 5A). Kết quả phân tích thử nghiệm ANOVA không cho thấy bất kỳ sự khác biệt đáng kể nào (p>0,05) về mức độ tải lượng tương đối của các giống này (Hình 5B) giữa tất cả các nghiệm thức.
4. Thảo luận
4.1. Hiệu suất sinh học
Carotenoid chủ yếu được sử dụng làm nguồn sắc tố trong nuôi trồng thủy sản để cải thiện chất lượng sản phẩm (Shahidi và Brown, 1998). Bên cạnh vai trò quan trọng này, carotenoids cũng đóng một vai trò thiết yếu trong việc tăng cường sử dụng chất dinh dưỡng và cuối cùng là cải thiện sự tăng trưởng và tỷ lệ sống của động vật thủy sinh (Niu và cộng sự, 2012; Zhang và cộng sự, 2013). Trong ngành nuôi trồng thủy sản, chi phí thức ăn chiếm khoảng 50–60% tổng chi phí hoạt động tùy thuộc vào quy mô sản xuất và phương pháp nuôi (Lim và cộng sự, 2017). Do đó, vai trò có lợi của Ast như một chất phụ gia dinh dưỡng quan trọng cho sự tăng trưởng và tỷ lệ sống là cần thiết để giảm thiểu biến động chi phí sản xuất do giá cao gây ra (Niu và cộng sự, 2009; Wang và cộng sự, 2018a). Hiện tại, sản xuất Ast thương mại chủ yếu là Ast tổng hợp vì chi phí sản xuất tương đối thấp hơn so với các lựa chọn thay thế khác (Saini và Keum, 2018). Trong những năm qua, ngày càng có nhiều báo cáo cho thấy mối tương quan tích cực giữa việc bổ sung Ast tổng hợp trong khẩu phần ăn với hiệu suất tăng trưởng và tỷ lệ sống, hoặc một trong hai mối tương quan đó ở các loài động vật thủy sinh khác nhau (Wade và cộng sự, 2017; Wang và cộng sự, 2019). Một vài nghiên cứu đã được thực hiện để đánh giá Ast từ P. rhodozyma về hiệu suất tăng trưởng do hạn chế năng lực sản xuất của nó. Gần đây, nhu cầu ngày càng tăng của người tiêu dùng đối với sản xuất công nghệ sinh học làm cho sắc tố tổng hợp ít được ưa chuộng hơn và Ast thu được từ các nguồn sinh học có tiềm năng thu được lợi ích lâu dài trên thị trường toàn cầu. Hơn nữa, dạng Ast (đồng phân quang học 3R, 3′R) trong P. rhodozyma được cho là có khả dụng sinh học cao hơn (Bjerkeng và cộng sự, 2007). Các nghiên cứu trước đây đã chứng minh tác dụng có lợi của Ast tổng hợp và tảo trong khẩu phần ăn ở nhiều loài tôm với bằng chứng cho thấy việc bổ sung Ast có thể thúc đẩy tăng trọng và cải thiện tỷ lệ sống ở tôm sú P. monodon (Niu và cộng sự, 2012), Litopenaeus vannamei (Flores và cộng sự, 2007; Niu và cộng sự, 2009), Macrobrachium rosenbergii (Kumar và cộng sự, 2009), Paralithodes camtschaticus (Daly và cộng sự, 2013), và Marsupenaeus japonicus (Wang và cộng sự, 2018b). Nghiên cứu này đã chứng minh tác động tích cực của việc bổ sung Ast lên men đối với năng suất sinh trưởng và tỷ lệ sống ở tôm sú P. monodon. Kết hợp lại, những dữ liệu này cho thấy một cách nhất quán rằng Ast trong khẩu phần ăn như một yếu tố dinh dưỡng rất quan trọng trong việc kích thích sự tăng trưởng và tỷ lệ sống của động vật thủy sinh. Tuy nhiên, một số tranh cãi đã được tìm thấy trong các nghiên cứu về L. vannamei (Ju và cộng sự, 2011), M. japonicus (Yamada và cộng sự, 1990; Chien và Jeng, 1992), và Eriocheir sinensis (Long và cộng sự, 2017; Jiang và cộng sự, 2020), đã chứng minh rằng tốc độ tăng trưởng và tỷ lệ sống của con non là tương tự nhau bất kể có bổ sung Ast trong khẩu phần ăn hay không. Những kết luận không thống nhất này có thể được giải thích là do nhu cầu caroten khác nhau giữa các loài động vật thủy sinh, điều kiện nuôi (trong nhà hay không, lượng caroten ngoại sinh có ăn vào hay không, thời gian nuôi, nhiệt độ và mật độ), thành phần thức ăn (hàm lượng caroten cơ bản trong khẩu phần ăn), và tình trạng sức khoẻ của động vật.
Tương tự như vậy, việc bổ sung Ast trong khẩu phần ăn từ 25 đến 100 mg/ kg đã được chứng minh là làm tăng đáng kể tốc độ tăng trọng của tôm sú P. monodon nhưng không ảnh hưởng đến tỷ lệ sống (Wade và cộng sự, 2015). Trong một nghiên cứu khác, tôm thẻ chân trắng L. vannamei tăng trưởng đáng kể khi tăng lượng Ast ở mức 125 và 150 mg/ kg so với những con được cho ăn với lượng Ast tương đối thấp hơn (khẩu phần 25, 50, 75 và 100 mg/ kg), nhưng tỷ lệ sống không bị ảnh hưởng (Zhang và cộng sự, 2013). Mối tương quan đáng kể đã được quan sát thấy giữa nồng độ caroten mô và tỷ lệ sống sót (Chien và Jeng, 1992). Wade và cộng sự (2017) gợi ý rằng tỷ lệ sống sẽ không bị ảnh hưởng khi hàm lượng caroten trong cơ thể ở trên một mức nhất định, nếu không sẽ bị tổn hại dưới mức đó nếu không bổ sung caroten. Do đó, khi mức độ caroten trong mô ban đầu đủ cao trong quá trình thử nghiệm cho ăn, việc bổ sung thêm caroten cho phép cải thiện tốc độ tăng trưởng hơn là cải thiện tỷ lệ sống (Niu và cộng sự, 2014). Các thông số tăng trưởng, bao gồm trọng lượng cơ thể cuối cùng (FBW), tăng trọng cơ thể (BWG) và tốc độ tăng trưởng cụ thể (SGR), chủ yếu phản ánh khả năng giữ lại hoặc tích lũy các chất dinh dưỡng từ thức ăn vào cơ thể nhưng không đánh đồng chính xác tình trạng sức khỏe của động vật thủy sinh (Du và Turchini, 2021). Hơn nữa, tác động tích cực đến tỷ lệ sống của Ast trong khẩu phần ăn dường như có liên quan chặt chẽ với khả năng chống oxy hóa được đề xuất, điều hòa phản ứng miễn dịch và đặc tính giảm căng thẳng (Niu và cộng sự, 2012; Wade và cộng sự, 2017). Do đó, phản ứng miễn dịch không đặc hiệu và khả năng kháng bệnh đối với tải lượng của V. parahaemolyticus đã được bổ sung trong nghiên cứu này để đạt được đánh giá đáng tin cậy hơn về sự tăng trưởng khỏe mạnh của tôm con được nuôi bằng Ast từ P. rhodozyma.
4.2. Thành phần cơ thể và tổng hàm lượng Carotenoid của tôm
Kết quả thành phần toàn bộ cơ thể phù hợp với những phát hiện của Niu và cộng sự (2009) và Zhang và cộng sự (2013) trong đó việc bổ sung caroten dường như không ảnh hưởng đến thành phần toàn bộ cơ thể tôm.
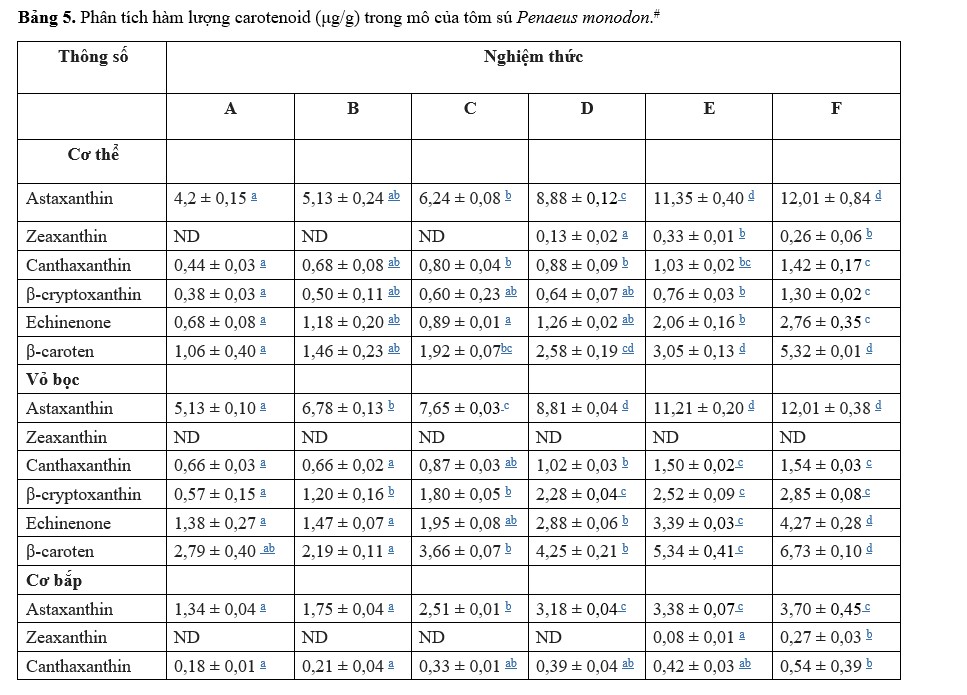
Động vật thủy sinh, bao gồm cả động vật giáp xác, không thể tổng hợp carotenoids de novo, phải nhận được carotenoids thông qua khẩu phần ăn (Matsuno, 2001). Nhiều nghiên cứu đã chứng minh rằng carotenoid trong khẩu phần ăn có thể làm tăng sự tích luỹ của carotenoid trong các mô (Ju và cộng sự, 2011; Wang và cộng sự, 2018b). Trong nghiên cứu này, hàm lượng caroten tổng số trong các mô khác nhau (Hình 1) tăng đáng kể khi tăng mức bổ sung Ast, cho thấy xu hướng tương tự về tăng trưởng, khả năng chống oxy hóa và hiệu suất đáp ứng miễn dịch. Hiện tượng này có nghĩa là động vật giáp xác thường tích lũy carotenoid trong các mô, bao gồm gan tụy, vỏ, cơ và buồng trứng, sẽ được chuyển hóa khi nguồn cung cấp thức ăn thấp để tối ưu hóa tình trạng sức khỏe trong quá trình phát triển hoặc để đáp ứng với hoàn cảnh môi trường (Wade và cộng sự, 2017; Babin và cộng sự, 2019).
Chức năng được thiết lập tốt nhất là khẩu phần ăn của tôm có bổ sung Ast sẽ đạt được màu đỏ mong muốn do nồng độ Ast trong vỏ tăng lên (Shahidi và Brown, 1998). Jiang và cộng sự (2020) đã báo cáo rằng hàm lượng Ast trong vỏ có tương quan với giá trị màu đỏ (a∗) của động vật giáp xác khi chế biến, phản ánh nồng độ Ast trong các mô. Nghiên cứu này đã phát hiện nồng độ Ast trong vỏ tăng lên với mức Ast trong khẩu phần ăn tăng lên như mong đợi. Hơn nữa, Ast trong khẩu phần ăn ảnh hưởng đáng kể đến mức độ zeaxanthin, canthaxanthin và-carotene trong các mô. Yamada và cộng sự (1990) tuyên bố rằng động vật giáp xác decapod có khả năng chuyển đổi trao đổi chất caroten trong các cơ quan nội tạng của chúng. Sự tích tụ của các carotenoid cụ thể cũng cho thấy chức năng cụ thể tương ứng của chúng trong các mô khác nhau. Hơn nữa, sự hiện diện gia tăng của Ast trong cơ tôm (Bảng 5) có thể mang lại nhiều lợi ích cho sức khỏe con người do hoạt tính chống oxy hóa mạnh chẳng hạn như chống viêm, chống lão hóa, tăng cường hệ thống miễn dịch, chống ung thư và chống nắng (Lim và cộng sự, 2017).
4.3. Khả năng chống oxy hóa và đáp ứng miễn dịch không đặc hiệu
Các hoạt động nuôi tôm mật độ cao thường phải chịu nhiều tác nhân gây căng thẳng về thể chất và môi trường xung quanh bao gồm phân loại, vận chuyển, đông đúc, thiếu oxy, biến động nhiệt độ và tải lượng nitơ amoniac cao, cuối cùng dẫn đến rối loạn chức năng sinh lý cơ thể và ức chế miễn dịch dễ bị mầm bệnh xâm nhập (Liu và cộng sự, 2016). Động vật không xương sống thiếu hệ thống miễn dịch thích ứng, chủ yếu dựa vào các phản ứng miễn dịch bẩm sinh như là tuyến phòng thủ đầu tiên chống lại những kẻ xâm lược (Yan và cộng sự, 2020). AKP là một phosphatase quan trọng điều chỉnh quá trình phosphoryl hóa và khử phospho liên quan đến sự phát triển của động vật, vận chuyển chất dinh dưỡng và lưu trữ mầm bệnh trong lysosome (Zhu và cộng sự, 2021). Trong nghiên cứu này, các hoạt tính AKP trong hemolymp tăng lên đáng kể cùng với sự gia tăng nồng độ Ast trong khẩu phần ăn, cho thấy tác động tích cực của Ast trong khẩu phần ăn đối với khả năng miễn dịch của P. monodon. Phát hiện này phù hợp với các nghiên cứu trước đây về Eriocheir sinensis (Jiang và cộng sự, 2020). Những thay đổi về nồng độ men ALT và AST trong hemolymp luôn cho thấy trạng thái sinh lý của tế bào gan tụy (Ettefaghdoost và Haghighi, 2021). Nói chung, được giữ ở mức thấp, chúng tăng lên đáng kể trong hemolymp khi gan tụy bị tổn thương nghiêm trọng. Có sự tương đồng trong các nghiên cứu đã đề cập (Niu và cộng sự, 2012) với nghiên cứu này về việc giảm đáng kể các hoạt tính của ALT và AST trong các nghiệm thức bổ sung Ast (Bảng 7). Hơn nữa, một nghiên cứu về Oncorhynchus mykiss cho thấy ALT và AST huyết thanh giảm khi được nuôi bằng P. rhodozyma (Nakano và cộng sự, 1999). Các kết quả tổng hợp cho thấy vai trò quan trọng của Ast đối với việc cải thiện tình trạng của các tế bào gan tụy ở tôm sú P. monodon.
Gan tụy của động vật giáp xác là một cơ quan quan trọng và đa chức năng bao gồm chuyển hóa, giải độc và bài tiết (Vogt, 2019). Các enzyme chống oxy hóa của gan tụy được sử dụng làm chỉ dấu sinh học để hiển thị ảnh hưởng của Ast trong khẩu phần ăn đối với tình trạng chống oxy hóa của tôm sú P. monodon. Hệ thống miễn dịch và chống oxy hóa ở động vật giáp xác là hai cơ chế sinh lý quan trọng điều chỉnh chức năng miễn dịch, đảm bảo chức năng tế bào tối ưu và mang lại sự cải thiện sinh lý (Zhu và cộng sự, 2021). SOD là một enzym chống oxy hóa chính hoạt động như một chất dọn dẹp các gốc superoxide do stress oxy hóa (Chien và cộng sự, 2003). CAT được phân bố rộng rãi trong một số mô để tiêu thụ peroxit như một chất thu gom H2O2 nội bào (Hugo, 1984). Nói chung, hoạt tính của SOD và CAT sẽ được điều chỉnh để dập tắt các loại oxy phản ứng (ROS) được tạo ra trong thời gian căng thẳng (Duan và cộng sự, 2015). Các nghiên cứu về Macrobrachium nipponense (Ettefaghdoost và Haghighi, 2021), P. monodon (Niu và cộng sự, 2014), và E. sinensis (Jiang và cộng sự, 2020) cho thấy có sự giảm đáng kể của hai enzym này trong các nghiệm thức có chứa Ast so với nghiệm thức đối chứng, điều này phù hợp với nghiên cứu này. T-AOC đại diện cho một chỉ số toàn diện về tình trạng chống oxy hóa của một cá thể (Zhang và cộng sự, 2013). MDA là sản phẩm chính của quá trình peroxy hóa lipid và có thể phá hủy cấu trúc và chức năng của tế bào. Thử nghiệm hoạt tính của enzyme này cho thấy quá trình peroxy hóa lipid (Esterbauer và Cheeseman, 1990). Trong nghiên cứu này, Ast trong khẩu phần ăn làm tăng đáng kể T-AOC và giảm MDA trong gan tụy, hỗ trợ kết quả trên SOD và CAT, cho thấy mức độ căng thẳng oxy hóa thấp hơn khi bổ sung Ast trong khẩu phần ăn của tôm. Hiệu suất tích cực đối với các thông số chống oxy hóa của Ast có thể là do khả năng cực cao của nó trong việc loại bỏ các gốc oxy tự do và ngăn chặn quá trình peroxy hóa PUFA trong các mô (Wade và cộng sự, 2017).
4.4. Tính mẫn cảm của tôm với Vibrio parahaemolyticus
Trong thời kỳ bùng nổ nuôi trồng thủy sản P. monodon, nhiều đợt bùng phát dịch bệnh do vibriosis gây ra do suy thoái môi trường đã dẫn đến những tác động kinh tế đáng kể trên toàn thế giới (Duan và cộng sự, 2015). Một số nghiên cứu đã báo cáo rằng V. parahaemolyticus có thể gây hoại tử gan tụy cấp tính (AHPND) bằng cách giảm khả năng miễn dịch và tổn thương gan tụy của tôm (Zhu và cộng sự, 2021). Men Ast trong khẩu phần ăn làm tăng đáng kể khả năng kháng V. parahaemolyticus theo kết quả LT50 trong nghiên cứu này, điều này có thể góp phần vào tác dụng kháng khuẩn cho thấy rằng Ast trong khẩu phần ăn có thể ức chế nhiễm trùng V. Parahaemolyticus. Tuy nhiên, V. parahaemolyticus là mầm bệnh có điều kiện: khả năng gây bệnh được kích hoạt bởi các yếu tố gây căng thẳng về thể chất làm phá vỡ sự cân bằng giữa động vật thủy sinh và môi trường xung quanh (Pang và cộng sự, 2019). Do đó, tình trạng miễn dịch được cải thiện bằng cách tạo ra AST, ALT, AKP và SOD trong tôm bằng cách bổ sung Ast trong khẩu phần ăn cũng là một trong những lý do chính để bảo vệ chống lại nhiễm trùng gây bệnh trong nghiên cứu này.
4.5. Phân tích hệ vi sinh vật đường ruột
Phân tích hệ vi sinh vật đường ruột của động vật thủy sản nuôi cho thấy mối quan hệ với sức khỏe của tôm (Zhu và cộng sự, 2021). Vi khuẩn đường ruột và các chất chuyển hóa của vi khuẩn ảnh hưởng trực tiếp đến khả năng hấp thụ dinh dưỡng và khả năng miễn dịch của vật chủ (Ayiku và cộng sự, 2020). Nghiên cứu này là nghiên cứu đầu tiên thảo luận về ảnh hưởng của việc bổ sung Ast trong khẩu phần ăn đối với cộng đồng vi sinh vật trong ruột của tôm sú P. monodon. Không quan sát thấy sự khác biệt đáng kể về sự phong phú và đa dạng của vi khuẩn đường ruột giữa tất cả các nghiệm thức. Theo nghiên cứu về L. vannamei (Ayiku và cộng sự, 2020; Wang và cộng sự, 2021), Firmicutes, Bacteroidetes, Proteobacteria, và Actinobacteria đã hình thành các ngành chiếm ưu thế trong ruột tôm. Những vi khuẩn này đóng vai trò quan trọng trong quá trình trao đổi chất sinh lý của vật chủ (Sun và cộng sự, 2020). Mặc dù tải lượng tương đối của 4 ngành quan trọng này có thể bị ảnh hưởng bởi môi trường nuôi và thành phần dinh dưỡng cơ bản của khẩu phần ăn, nhưng thành phần của vi khuẩn đường ruột ở các cấp độ của ngành khá giống nhau giữa các nghiên cứu khác nhau. Các chi chiếm ưu thế trong nghiên cứu này khác với kết quả thu được ở các sinh vật khác: ví dụ, Wang và cộng sự (2021) tiết lộ rằng Candidatus Bacilloplasma, Vibrio, Lactobacillus, Spongiimonas, và Flavirhabdus là chi chiếm ưu thế trong ruột của L. vannamei. Trong ruột của tôm sú P. monodon, Chaiyapechara và cộng sự (2012) đã tìm thấy các chi vi khuẩn chiếm ưu thế là Vibrio, Photobacterium, Aeromonas hoặc Propionigenium, kết luận rằng vi khuẩn đường ruột ở các cấp độ chi thay đổi đáng kể và khác biệt với môi trường nuôi dưỡng. Không có sự khác biệt đáng kể đã được phát hiện trên các chi và ngành chiếm ưu thế trong số tất cả các nghiệm thức này. Các kết quả tổng hợp chỉ ra rằng việc bổ sung Ast trong khẩu phần ăn không ảnh hưởng đáng kể đến sự đa dạng vi khuẩn, cộng đồng vi khuẩn chiếm ưu thế hoặc sự tương đồng của cộng đồng vi khuẩn trong ruột của tôm sú P. monodon.
5. Kết luận
Bổ sung Ast trong khẩu phần ăn từ P. rhodozyma có thể mang lại năng suất tăng trưởng mong muốn, tình trạng chống oxy hóa, phản ứng miễn dịch không đặc hiệu, khả năng kháng bệnh và hàm lượng caroten trong P. monodon. Hơn nữa, năng suất Ast của P. rhodozyma đầy triển vọng là nguồn tự nhiên có thể cung cấp một giải pháp thay thế cho Ast tổng hợp trong ngành nuôi tôm sú Penaeus monodon.
Theo Weilong Wang, Mengting Liu, Samia Fawzy, Yucai Xue, Meiqin Wu, Xuxiong Huang, Gafeng Yi, Qian Lin
Nguồn: https://pubmed.ncbi.nlm.nih.gov/34803988/
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Cập Nhật Các Chiến Lược Điều Trị Bệnh Vi Bào Tử Microsporidosis Gây Ra Bởi EHP Ở Gan Tụy Tại Buổi Tư Vấn Của NACA
- Nucleotides: Thành Phần Chức Năng Trong Thức Ăn Cho Tôm
- Nuôi Trồng Thủy Sản Trên Ruộng Lúa Có Thể Giúp Đáp Ứng Nhu Cầu An Ninh Lương Thực Toàn Cầu

 English
English