Tóm tắt
Tính bền vững của nghề nuôi tôm trong ao nước lợ đang gây tranh cãi vì sản lượng thấp và nạn phá rừng ngập mặn. Sản lượng thấp phần lớn là do khâu chuẩn bị ao chưa tốt. Cây ngập mặn thường được trồng trên bờ ao để làm rào chắn bảo vệ. Nghiên cứu này xem xét tác động của 3 loại phân hữu cơ lỏng từ rau, trái cây và hỗn hợp rau – trái cây trong các bể chứa. Các bể này đã được lót bằng lá Avicennia marina để nguyên hoặc cắt nhỏ nhằm mô phỏng điều kiện ao nuôi địa phương. Thiết kế chia thành 28 bể vuông, mỗi bể được thả 100 con tôm sú 15 ngày tuổi (Penaeus monodon). 4 bể được sử dụng làm đối chứng và 24 bể được chỉ định cho các nghiệm thức, 12 bể nguyên vẹn và 12 bể lá cắt nhỏ. Trong số các bể xử lý, 4 bể chứa phân hữu cơ lỏng từ rau, 4 bể chứa trái cây và 4 bể chứa hỗn hợp rau -trái cây. Tôm được cân tại các thời điểm bắt đầu, giữa và kết thúc thử nghiệm 50 ngày. Chúng được cho ăn ở mức 5% tổng trọng lượng ước tính; tỉ lệ sống được tính vào cuối thử nghiệm. Tỷ lệ sống của nghiệm thức và đối chứng (65–76%) không khác biệt đáng kể. Tôm trong nước có phân hữu cơ rau tăng trưởng nhanh hơn đáng kể (2,7%/ ngày) so với cả hai nghiệm thức bằng trái cây (2,5%/ ngày), trong khi tất cả các nghiệm thức đều có tốc độ tăng trưởng nhanh hơn đáng kể so với đối chứng (2,0%/ ngày). Tốc độ tăng trưởng thấp hơn của tôm được cho bón phân ủ từ trái cây. Điều này có thể là do tảo hai roi có thể ảnh hưởng tiêu cực đến tôm. Tôm trong bể có lá xắt nhỏ tăng trưởng tốt hơn một chút so với tôm trong bể có lá nguyên vẹn.
1. Giới thiệu
Những người nuôi tôm truyền thống ở Indonesia đã hạn chế bớt các yếu tố đầu vào, như thức ăn, nhưng hầu hết họ không thực hành các biện pháp nuôi trồng thủy sản có trách nhiệm, chẳng hạn như xử lý đáy ao thường xuyên. Hầu hết chỉ dựa vào một cửa cống duy nhất để nước lợ chảy vào ao và bắt động vật. Những thực hành này, cùng với việc thiếu đào tạo kỹ thuật và tư vấn chuyên môn không đầy đủ, đã dẫn đến thu hoạch thấp, không ổn định và thu nhập thấp. Thực trạng này diễn ra đối với người nuôi tôm nhiều hơn đối với người nuôi cá măng.
Để nâng cao kiến thức, và cuối cùng là năng suất và thu nhập, các trường học ven biển do dự án Xây dựng với Thiên nhiên quản lý đã giảng dạy và đào tạo nông dân trong một chu kỳ vụ mùa về nuôi cá có trách nhiệm và đầu vào bên ngoài thấp cho phương pháp nuôi trồng thủy sản bền vững (LEISA), đây là phương pháp đầu tiên được sử dụng trong nông nghiệp (Reijntjes và cộng sự, 1992). LEISA tối ưu hóa các nguồn tài nguyên địa phương hiện có bằng cách kết hợp các thành phần khác nhau, tối đa hóa khả năng tái chế và giảm thiệt hại về môi trường bằng cách giảm thiểu đầu vào bên ngoài, đồng thời duy trì sản xuất bền vững và đầy đủ trong dài hạn. LEISA đã được Brown và Fadillah giới thiệu thành công cho những người nuôi cá măng thông qua các trường học thực địa ven biển ở Sulawesi (2013), và gần đây là cho những người nuôi tôm ở huyện Demak của Trung Java thông qua Xây dựng với Thiên nhiên. Để làm phân hữu cơ lỏng, người nuôi tôm và cá măng học cách lên men chất thải rau và trái cây từ các hộ gia đình và chợ. Sau đó, họ sử dụng phân lỏng này để xử lý đáy ao và duy trì chất lượng nước của ao trong suốt thời gian nuôi. Các tác động khác nhau của việc sử dụng trái cây hoặc rau quả vẫn chưa được biết, nhưng cộng đồng vi sinh vật phát triển trong quá trình ủ phân kỵ khí hoặc hiếu khí phụ thuộc một phần vào loại và lượng tương đối của nguyên liệu đầu vào (Franke-Whittle và cộng sự, 2014) .
Vì dư lượng của cả rau và trái cây đều hạn chế và thức ăn đắt tiền, nhưng lá rừng ngập mặn lại dồi dào, chúng tôi đã thử nghiệm tác dụng của việc thêm lá Avicennia marina (Forssk, Vierh.) vào nước. Chương trình duy trì rừng ngập mặn của chính phủ Indonesia yêu cầu nông dân trồng cây ngập mặn trên các bờ ao dưới hình thức nuôi trồng thủy sản kết hợp với bùn (Primavera 2000). Cây mắm ổi Avicennia marina là loài tiên phong có kích thước trung bình với rễ khí sinh (Chanda và cộng sự, 2016) và có khả năng chịu mặn và bồi lắng cao. Lá của nó có chiều dài từ 4 đến 11 cm, có lớp biểu bì mỏng hơn, nồng độ nitơ ban đầu cao hơn, tỷ lệ C:N thấp hơn, hàm lượng tanin thấp hơn và tốc độ phân hủy nhanh hơn các loài khác (Robertson1988; Camilleri 1989; Steinke và cộng sự 1990; Primavera 1993). Hơn nữa, lá A. marina có tác dụng điều chỉnh độ pH của ao nuôi tôm và có thể dùng như một loại phân bón tiềm năng cho ao nuôi (Primavera 2000). Ở vùng ven biển Java, nông dân sử dụng lá và hạt A. marina làm thức ăn gia súc và thực phẩm, đồng thời họ đánh giá cao loài này vì đặc tính chữa bệnh. Ikhwanuddin và cộng sự (2014) phát hiện ra rằng dịch nhựa của cây Terminalia catappa (một loài sống trong rừng ngập mặn) đã cho tỷ lệ tăng trưởng của tôm post Penaeus monodon cao hơn so với nguyên lá. Rejeki và cộng sự (2019) cũng kiểm chứng điều này đối với dịch và lá xắt nhỏ của cây đước đôi Rhizophora apiculata và A. marina. R. apiculata được phát hiện là có tác động tiêu cực (Chanda và cộng sự, 2016; Primavera 1993), mặc dù đây là loài được trồng nhiều nhất trong nuôi trồng thủy sản ở Indonesia.
Nghiên cứu này so sánh tác động của phân hữu cơ dạng lỏng gồm rau, trái cây hoặc hỗn hợp cả hai và xem xét tác động của việc bổ sung A. marina nguyên lá hoặc cắt nhỏ đối với sự tăng trưởng và tỷ lệ sống của tôm sú P. monodon chưa trưởng thành (giai đoạn juvenile). Các vi sinh vật có trong phân ủ lỏng được kỳ vọng sẽ đẩy nhanh quá trình phân hủy của lá A. marina. Việc sử dụng lá nguyên và lá cắt nhỏ giả định rằng lá cắt nhỏ sẽ phân hủy nhanh hơn và chất dinh dưỡng sẽ được sử dụng bởi nấm và vi khuẩn, từ đó sẽ được sử dụng bởi mảnh vụn giàu nitơ mà tôm có thể ăn được.
2. Vật liệu và phương pháp
2.1. Thiết kế nghiên cứu
Một thiết kế chia nhóm nhỏ đa yếu tố với hai yếu tố trong các nhóm chính và ba yếu tố trong các nhóm phụ đã được sử dụng. Nhân tố chính (A) có 2 nghiệm thức: A1, toàn bộ lá A. marina; và A2, lá A. marina cắt nhỏ, cả hai đều được định lượng 100 g/bể, hoặc 0,125 g/ L.
Lá Avicennia marina được thu hái từ các cây ngập mặn quanh khu vực nghiên cứu rồi cho vào túi làm bằng lưới nylon có mắt lưới 3mm để phơi khô trong bóng râm ở nhiệt độ phòng trong 3 ngày trước khi cho vào bể thí nghiệm.
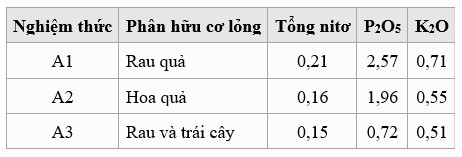
Yếu tố nhóm phụ, phân hữu cơ lỏng (B), bao gồm 3 nghiệm thức: B1, phế phẩm thực vật lên men (10 kg hỗn hợp bắp cải, rau xanh, mù tạt, cải xoăn và cà rốt); B2, phế phẩm trái cây lên men (10 kg hỗn hợp đu đủ, thanh long, dưa lưới); và B3, phế phẩm hỗn hợp rau củ (5 kg) và trái cây (5 kg) lên men.
Các chất nền cho B3 đến từ cùng một nguồn như B1 và B2, và tỷ lệ giữa các chất nền riêng lẻ là bằng nhau. Việc lựa chọn chất nền cho phân hữu cơ lỏng dựa trên sự sẵn có của địa phương với chi phí bằng không; nông dân có thể thu gom chúng từ rác thải ở chợ hoặc rác thải sinh hoạt. Quá trình lên men kéo dài 10 ngày trong một thùng kín có ngâm các thành phần sau trong nước: 10 kg chất nền băm nhỏ, 1 L mật đường, 4 hạt (khoảng 5 g) men dùng để lên men sắn và 1 kg men cám gạo. Các nghiệm thức A1B1, A1B2, A1B3, A2B1, A2B2 và A2B3, mỗi nghiệm thức có 4 lần lặp lại trong 50 ngày. Các bể đối chứng chỉ nhận được thức ăn công nghiệp, không có phân lỏng hoặc lá rừng ngập mặn.
Các bể bạt nhựa hình vuông có khung tre được đặt trong nhà chứa bán trong nhà được lợp bằng tấm lợp sợi thủy tinh trong suốt. 28 bể thí nghiệm được thả với 100 con tôm sú P. monodon 15 ngày tuổi, tôm post thu được từ Trung tâm Nghiên cứu và Phát triển Nước lợ ở Jepara. Mỗi bể chứa 800 L nước lợ (độ mặn 21 g/ L) và một lớp nền (pH 6,5) bằng đất thịt pha sét ± 5 cm từ đáy ao gần nhà ga. Cung cấp một lớp chất nền dưới đáy mỗi bể mô phỏng các điều kiện môi trường thúc đẩy sự phát triển của tôm con trong ao nước lợ. Nước được sục khí liên tục và nước từ cùng một nguồn được thêm vào khi cần thiết để giữ thể tích ở mức ban đầu. Một tuần trước khi thí nghiệm bắt đầu, 20 mL phân ủ lỏng và lá khô được bổ sung theo các nghiệm thức. Hàng tuần, trong suốt thời gian nghiên cứu, 5 mL phân hữu cơ dạng lỏng được thêm vào các nghiệm thức tương ứng bằng cách pha loãng 5 mL trong 500 mL nước lợ và phân phối đều trên 8 bể.
Tôm post được cho ăn bằng thức ăn viên công nghiệp với tỷ lệ 5% tổng trọng lượng cơ thể, ước tính ở giai đoạn đầu và giai đoạn giữa. Để khuyến khích tôm sử dụng thức ăn tự nhiên được cung cấp và sản xuất trong bể, tỷ lệ cho ăn này bằng 2/3 tỷ lệ tối ưu đối với tôm sú con (Niu và cộng sự, 2016). Thức ăn viên chứa 41% protein, 5% chất béo, 2% chất xơ, 13% tro và 11% độ ẩm được bổ sung 2 lần/ ngày.
2.2. Thu thập và tính toán dữ liệu
2.2.1. Năng suất sinh trưởng và tỷ lệ sống
Trọng lượng được đo 3 lần để tính toán tốc độ tăng trưởng và điều chỉnh việc cho ăn. Trọng lượng cơ thể ban đầu được xác định cho toàn bộ quần thể (3000 tôm post) bằng cách lấy mẫu ngẫu nhiên 350 cá thể trong nhóm 10 con để giảm thiểu biến động do gió. Giữa giai đoạn thử nghiệm, 25 con tôm từ mỗi bể được cân. Trọng lượng cơ thể cuối cùng được xác định bằng cách cân tất cả các cá thể còn sống và chia chúng cho tổng số cá thể. Tổng sinh khối tôm của các bể được biểu thị trên mỗi bể 1 m2. Cân được thực hiện bằng cân điện tử A&D HL-100 với độ chính xác 0,01 g.
Tốc độ tăng trưởng cụ thể (SGR, tính bằng %/ ngày) được tính bằng công thức của Busacker và cộng sự (1990):
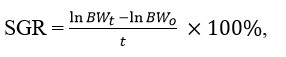
Trong đó: BWt là trọng lượng cơ thể cuối cùng (g); BWo là trọng lượng cơ thể ban đầu (g); và t là thời lượng của thí nghiệm (ngày).
Để tính tỷ lệ sống sót (SR), chúng tôi đếm số lượng sống sót trên mỗi bể và áp dụng công thức của Busacker và cộng sự (1990):
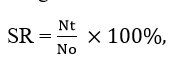
Trong đó: Nt là số lượng tôm được thu thập tại thời điểm lấy mẫu t và No là số lượng tôm được thả ban đầu.
2.2.2. Thông số chất lượng nước
Giá trị amoniac, nitrat và phốt phát trong nước được đo hai lần mỗi tuần tại Phòng thí nghiệm Kỹ thuật Môi trường của Đại học Diponegoro (UNDIP). Mẫu nước 500 mL được tổng hợp tại chỗ, sau đó thêm H2SO4 đậm đặc để giảm độ pH xuống 2. Sau đó, mẫu được vận chuyển trong hộp cách nhiệt. Phương pháp amoni salicylat được sử dụng để phân tích amoniac, diazot hóa nitrat để phân tích nitrat và phương pháp axit ascorbic phốt phát để phân tích phốt phát, sau đó là đo quang phổ ở các bước sóng khác nhau. Nhiệt độ, độ pH, độ mặn và oxy hòa tan (DO) được đo tại chỗ bằng máy kiểm tra chất lượng nước.
Sự phong phú của sinh vật phù du được đo ngoài hiện trường bằng cách lọc nước bằng lưới sinh vật phù du có mắt lưới 25 µm, sau đó bảo quản trong chai đựng mẫu 350 mL với dung dịch formalin 4%. Mẫu được vận chuyển đến Phòng thí nghiệm Khoa học Hàng hải FPIK tại UNDIP trong hộp cách nhiệt. Các mẫu nước được lấy để đo mức độ phong phú của sinh vật phù du được phân tích vào đầu, giữa và cuối nghiên cứu.
Loại và tổng lượng vi khuẩn trong phân trộn lỏng được đếm trong một mẫu được lấy ngay trước khi ứng dụng. Mẫu 500 mL được vận chuyển trong hộp cách nhiệt có đá đến phòng thí nghiệm. Vi khuẩn được tính là tổng số đĩa, dựa trên quy trình của USDA (2015). Vi khuẩn được xác định sau khi nuôi cấy trên đĩa thạch bằng phương pháp phết đĩa (Cowan 2003).
2.3. Phân tích dữ liệu
Dữ liệu tạo ra trong nghiên cứu này được phân tích bằng phần mềm SigmaPlot® 12 để tính toán giá trị trung bình và độ lệch chuẩn. Tính quy phạm của dữ liệu đã được kiểm tra bằng phép thử Shapiro–Wilk. Dữ liệu tăng trưởng và SR được phân tích bằng cách sử dụng phân tích phương sai chia ô hai chiều (ANOVA). Trong phân tích sau, chúng tôi đã sử dụng dữ liệu của đối chứng hai lần, như là một phần của cả hai nhóm xử lý rừng ngập mặn, vì số lượng bể có sẵn bị hạn chế. Trong các trường hợp có tương tác và tác động đáng kể của yếu tố B, chúng tôi đã phân tích dữ liệu sâu hơn bằng các bài kiểm tra đa biến post hoc Dunn và Tukey.
Chỉ số đa dạng sinh vật phù du được tính toán bằng phương trình Shannon và Wiener và chỉ số thống trị theo phương trình Margalef. Các kết quả được trình bày một cách mô tả.
3. Kết quả
Tác động của việc sao chép và tương tác giữa các yếu tố là không đáng kể trong ANOVA sơ đồ phân chia đa yếu tố của SR (Bảng 1) hoặc của SGR (Bảng 2 và 3). Do đó, chúng tôi đã sử dụng kết quả ANOVA cho các yếu tố chính.
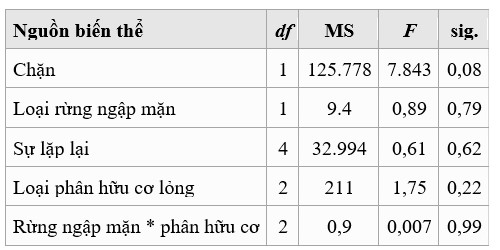
Bảng 1. ANOVA ô chia đa yếu tố về tác động của lá rừng ngập mặn và loại phân hữu cơ đối với tôm sú P. monodon SR
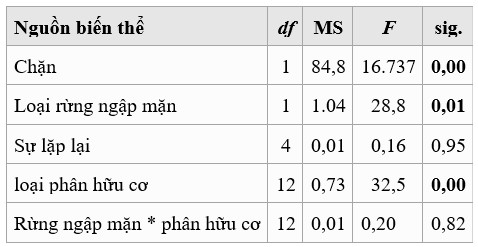
Bảng 2. ANOVA chia nhóm đa yếu tố về ảnh hưởng của lá rừng ngập mặn và loại phân hữu cơ đối với tôm sú SGR
Bảng 3. Phạm vi các thông số chất lượng nước và phạm vi khuyến nghị cho tôm sú (tính bằng mg/ L, trừ khi được đề cập)
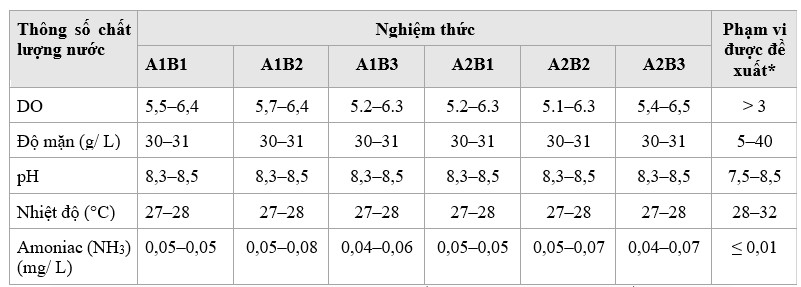
*Quy định của Bộ trưởng Bộ Hàng hải và Nghề cá Cộng hòa Indonesia số 75/Permen-KP/2016. Hướng dẫn chung cho Penaeus monodon và Litopenaeus vannamei
3.1. Tỷ lệ sống của tôm sú giống
SR trung bình dao động trong khoảng từ 65 đến 76% (Hình 1). SR cao nhất đạt được với phân trộn lỏng của rau hoặc trái cây; SR cho phân hữu cơ hỗn hợp gần giống như đối chứng. Tuy nhiên, cả việc xử lý lá rừng ngập mặn hay xử lý phân hữu cơ lỏng đều không có ảnh hưởng đáng kể đến SR (Bảng 1).
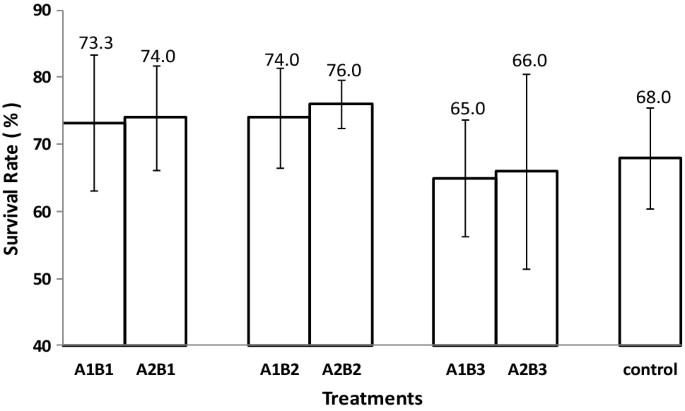
Hình 1. Biểu đồ tỷ lệ sống trung bình, với độ lệch chuẩn, của tôm sú cho mỗi nghiệm thức
3.2. Tốc độ tăng trưởng đặc trưng và sinh khối của tôm post monodon
Phân lỏng (p < 0,001) cải thiện đáng kể sự tăng trưởng của tôm so với đối chứng; việc cắt nhỏ lá A. marina có ảnh hưởng đáng kể (p < 0,01) trong quá trình xử lý phân hữu cơ (Bảng 2). SGR của lá rừng ngập mặn được cắt nhỏ cao hơn khoảng 0,4% điểm so với của nghiệm thức có cả lá (Hình 2). Việc thêm phân hữu cơ đã cải thiện SGR từ 0,2 đến 1,2% điểm/ ngày so với đối chứng. Do tác dụng tích lũy của lá rừng ngập mặn cắt nhỏ và phân hữu cơ lỏng làm từ rau, SGR của tôm sú đạt 2,7% ± 0,2%/ ngày, trong khi ở phân hữu cơ có trái cây là 2,2% ± 0,1%/ ngày, và của đối chứng là 1,5% ± 0,1%/ ngày (Hình 2).
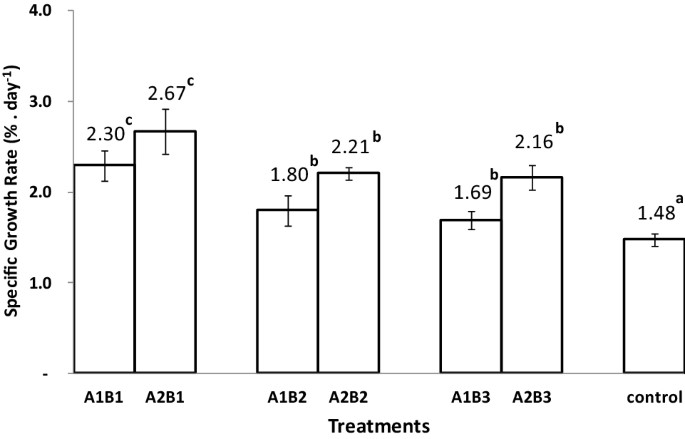
Hình 2. Biểu đồ tốc độ tăng trưởng riêng trung bình của tôm sú P. monodon, với độ lệch chuẩn, đối với từng nghiệm thức
Phân lỏng (p < 0,001) cải thiện đáng kể sinh khối của tôm so với đối chứng; trong các nghiệm thức phân hữu cơ, lá A. marina được cắt nhỏ có tác dụng đáng kể (p <0,01) so với toàn bộ lá. Mỗi bể, sinh khối cuối cùng của tôm là cao nhất, 275 ± 72 g, trong nghiệm thức phân hữu cơ và lá cây; trung gian cho trái cây ủ với lá, 181 ± 18 g; và thấp nhất đối với đối chứng, 71 ± 8,6 g (Hình 3). Sinh khối của các bể có lá A. marina cắt nhỏ cao hơn khoảng 40% so với các bể có cả lá.
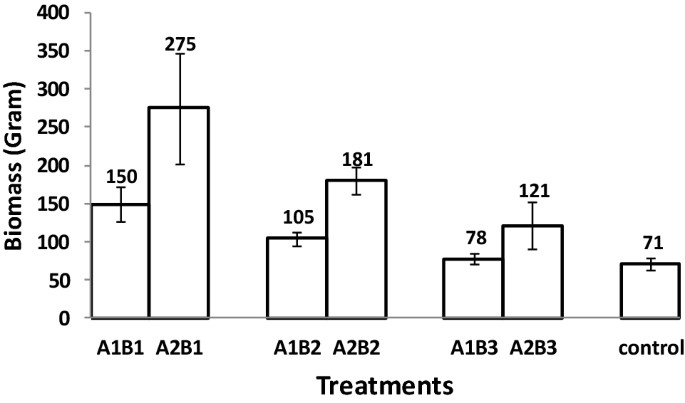
Hình 3. Biểu đồ sinh khối của tôm sú P. monodon, với độ lệch chuẩn cho mỗi nghiệm thức
3.3. Chất lượng nước, phân lỏng, sinh vật phù du và vi khuẩn
Trong quá trình nghiên cứu, mức độ DO, độ mặn, pH và nhiệt độ không khác biệt đáng kể trrong nghiệm thức (Bảng 3). Mặc dù nhiệt độ ở giới hạn dưới và độ pH gần với giới hạn trên, nhưng các thông số chất lượng nước và vật lý này, cũng như DO, vẫn nằm trong phạm vi được khuyến nghị cho nuôi tôm. Nồng độ amoniac khá cao so với tiêu chuẩn và dao động nhiều hơn nhưng không khác biệt đáng kể giữa các nghiệm thức. Tình trạng của tôm ở tất cả các nghiệm thức đều bình thường vì hàm lượng duy trì dưới mức gây độc (0,08 mg/ L).
Tần suất lấy mẫu không đủ để so sánh thống kê về tác động của các nghiệm thức đối với sự thay đổi chất dinh dưỡng. Tuy nhiên, nồng độ trung bình của PO4 và NO3 trong bể tăng lên trong quá trình thí nghiệm lần lượt từ 0,07 ± 0,0 đến 0,12 ± 0,1 mg/ L và từ 0,05 ± 0,02 đến 0,07 ± 0,03 mg/ L (Hình 4). Cả hai thông số đều có cùng xu hướng giảm nhẹ trong 2 tuần đầu tiên và tăng dần trong các tuần tiếp theo. Đối với PO4, mức tăng là mạnh nhất đối với phân hữu cơ hỗn hợp và trung gian đối với phân hữu cơ rau, trong khi không thấy ảnh hưởng nào đối với phân hoa quả. Đối với NO3, sự gia tăng tương đối chỉ được quan sát thấy đối với phân hữu cơ hoa quả.
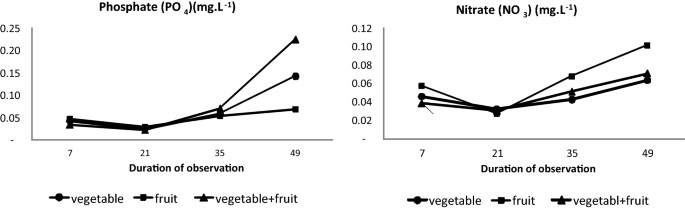
Hình 4. Hàm lượng PO4 và NO3 trong nước bể cho ba loại phân hữu cơ tại 4 thời điểm
Phân hữu cơ dạng lỏng với rau chứa hàm lượng nitơ tổng số, P2O5, và K2O cao nhất so với các nghiệm thức khác (Bảng 4). Hàm lượng P2O5 thấp trong phân hỗn hợp tương phản với hàm lượng PO4 cao trong nước bể. Đối với hàm lượng N trong phân hữu cơ và nước trong bể, các nghiệm thức trái cây và rau củ đã thay đổi thứ hạng.
Bảng 4. Hàm lượng (mg/ L) của N, P và K trong ba loại phân hữu cơ lỏng
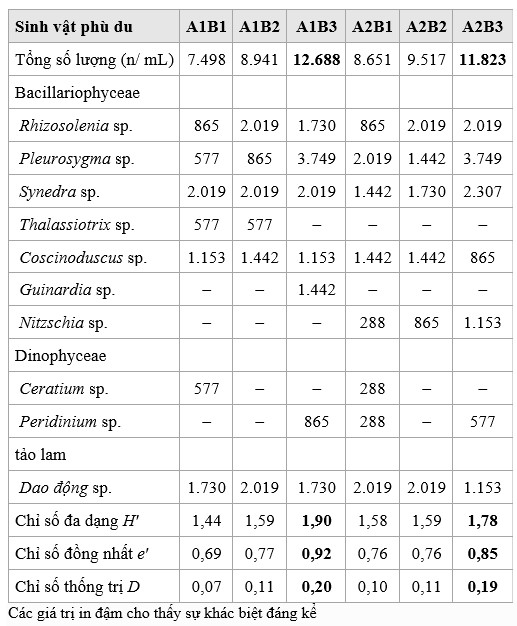
Tất cả các nghiệm thức đều có sinh vật phù du từ ba chi: Bacillariophyceae, Dinophyceae và Cyanophyceae (Bảng 5). Tính đa dạng thấp đối với cả ba loài (H ′ < 2,3), không có loài nào chiếm ưu thế (D < 0,5) và tính đồng nhất cao (e′ > 0,5). Tuy nhiên, Thalassiotrix và Guinardia sp. chỉ được tìm thấy ở nghiệm thức còn nguyên lá rừng ngập mặn, trong khi Nitzschia sp. chỉ được tìm thấy trong nghiệm thức lá rừng ngập mặn. Sự hiện diện của Ceratium sp. là điển hình cho phân hữu cơ rau. Các nghiệm thức bao gồm cả rau và trái cây có xu hướng có giá trị cao nhất về tính đa dạng, ưu thế và tính đồng nhất.
Bảng 5. Số lượng loài sinh vật phù du trong nước của 6 nghiệm thức và các chỉ số về tính đa dạng, tính đồng nhất và ưu thế của sinh vật phù du
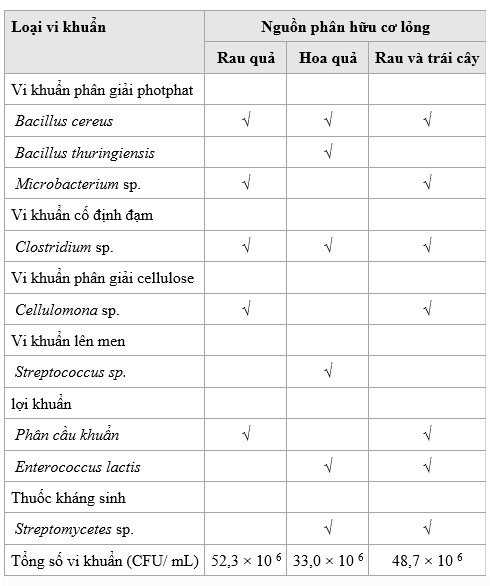
Tổng số vi khuẩn là cao nhất đối với phân hữu cơ dạng lỏng từ rau củ, thấp nhất đối với phân trộn từ trái cây và trung bình đối với hỗn hợp rau củ quả (Bảng 6). Bacillus cereus và Clostridium sp. đã được tìm thấy trong cả ba, trong khi Streptococcus sp. và Bacillus thuringiensis chỉ được tìm thấy trong phân hoa quả. Hai thứ sau không được tìm thấy trong phân ủ hỗn hợp. Chỉ có bốn trong số sáu loài được tìm thấy trong phân trộn trái cây cũng được tìm thấy trong phân trộn hỗn hợp, trong khi tất cả vi khuẩn được tìm thấy trong phân trộn rau củ được tìm thấy trong phân trộn lỏng. Vi khuẩn có đặc tính hòa tan P, cố định N, phân hủy cellulose, lên men, lợi khuẩn hoặc kháng sinh; nhưng vi khuẩn hòa tan P, Microbacteriu sp., chiếm ưu thế trong hỗn hợp không có B. thuringiensis từ phân hoa quả.
Bảng 6. Tổng số lượng và loại vi khuẩn được tìm thấy trong phân trộn lỏng
4. Thảo luận
Nghiên cứu hiện tại cho thấy phân trộn lỏng và lá rừng ngập mặn đã cải thiện đáng kể SGR của tôm sú con P. monodon mà không ảnh hưởng đến SR. Cắt nhỏ lá rừng ngập mặn càng nâng cao SGR này. Phân lỏng của rau tạo ra SGR cao hơn đáng kể so với phân lỏng của trái cây hoặc của hỗn hợp trái cây và rau.
4.1. Tỷ lệ sống của tôm sú PL
SR ở các nghiệm thức dao động trong khoảng từ 65 đến 76% và không khác biệt so với SR ở các nghiệm thức đối chứng (68%), chúng cũng không bị ảnh hưởng đáng kể bởi các nghiệm thức. Các SR này nằm trong cùng phạm vi với các SR được tìm thấy bởi Ikhwanuddin và cộng sự, (2014) đối với nước rò rỉ từ lá T. catappa, của Nga và cộng sự (2006) đối với dịch nhựa từ lá R. apiculata, và bởi Rejeki và cộng sự (2019) đối với dịch nhựa và lá cắt nhỏ của cả R. apiculata và A. marina.
Mặc dù không có ý nghĩa, nhưng SR trong nghiệm thức trộn hỗn hợp rau củ quả thấp hơn so với các nghiệm thức khác cũng như đối chứng. SR thấp hơn trong các nghiệm thức có chứa cả rau và trái cây có thể là do sự nở hoa gây hại của tảo 2 roi Peridinium sp. (Keawtawee và cộng sự 2012). Một số tác giả (Hallegraeff 1993; Alonso và Osuna 2003; Songsangjinda và cộng sự, 2006) đã báo cáo rằng tảo hai roi làm giảm đáng kể sản lượng của các trang trại nuôi tôm sú, và Yan và cộng sự, (2002) ước tính rằng cá chết ở Vịnh Daya, Quảng Đông, Trung Quốc, là do Peridinium quinquecorne trong số các loài khác gây ra. Phân hữu cơ rau không chứa Peridinium sp., nhưng Ceratium sp., được phân loại lại thành Tripos sp. (Gómez 2013) và không được coi là độc hại (Ayada và cộng sự, 2018).
4.2. Ảnh hưởng của lá rừng ngập mặn và lá cắt nhỏ
Cắt nhỏ lá A. marina đã cải thiện đáng kể SGR của tôm khoảng 0,4 điểm so với cắt cả lá, cả hai đều được định lượng ở mức 0,125 g/ L. Kết quả này phù hợp với kết quả của Ikhwanuddin và cộng sự (2014) đã tìm thấy tốc độ tăng trưởng của tôm post P. monodon trong nghiệm thức dịch nhựa cao hơn so với nghiệm thức T. catappa còn nguyên lá. Rejeki và cộng sự (2019) đã quan sát thấy tốc độ tăng trưởng của tôm vượt trội khi xử lý lá băm nhỏ và dịch từ lá so với cả lá của R. apiculata và A. marina, tất cả đều được định lượng ở mức 0,125 g/ L. Những phát hiện này cho thấy rằng việc chặt hoặc nghiền nát lá rừng ngập mặn làm cho các chất dinh dưỡng từ lớp rác này dễ dàng hơn để chuyển đổi bởi vi khuẩn và nấm và sau đó ở dạng mảnh vụn giàu nitơ, khiến nước rò rỉ có giá trị dinh dưỡng cao hơn.
Quy trình của chúng tôi không bao gồm chỉ xử lý bằng lá rừng ngập mặn; do đó, nghiên cứu của chúng tôi không thể xác nhận liệu việc bổ sung toàn bộ lá có tác động tích cực hay không. Tuy nhiên, Nga và cộng sự (2006) phát hiện ra rằng một lượng vừa phải (2,5–5 g/L) lá R. apiculata hỗ trợ tích cực cho sự tăng trưởng của tôm.
4.3. Sự khác biệt về tác dụng của ba loại phân hữu cơ
Mặc dù phân hữu cơ dạng lỏng do trại sản xuất trong nghiên cứu này chứa ít chất dinh dưỡng hơn so với các sản phẩm thay thế thương mại, nhưng cả ba loại phân trộn đều có liên quan đến sự tăng trưởng của tôm sú P. monodon. Tiêu chuẩn của Quy định của Bộ trưởng Nông nghiệp Indonesia (2013) có lẽ là yêu cầu tiêu chuẩn đối với phân trộn lỏng thương mại. Tăng trưởng tốt nhất thu được từ phân trộn lỏng với rau (2,3 và 2,7%/ ngày), tiếp theo là phân hữu cơ với trái cây và phân hỗn hợp (1,7–2,2%/ ngày), trong đó tăng trưởng cao hơn ít nhất 0,2%/ ngày so với đối chứng.
Phân hữu cơ lỏng được làm từ chất thải của rau và trái cây bằng quá trình lên men kỵ khí. Men dùng để lên men sắn và được bổ sung để bắt đầu quá trình lên men bao gồm sự kết hợp của Amylomyces rouxii, Rhizopus oryzae, Endomycopsis burtonii, Mucor sp., Candida utilis, Saccharomycopsis fibuligera, Saccharomyces cerevisiae, và ba loại vi khuẩn axit lactic: Pediococcus pentosaceus, Lactobacillus plantarum, và Lactobacillus fermentum (Gandjar 2003). Mặc dù men có thể có cùng liều lượng, 5 g mỗi phân lỏng, nhưng sự đa dạng và phong phú của vi khuẩn trong quá trình ủ phân khác nhau dựa trên vật liệu ủ phân, chất bổ sung dinh dưỡng (Chandna và cộng sự 2013) và thời gian ủ phân (Franke-Whittle và cộng sự 2014). Nghiên cứu hiện tại đã xác nhận biến thể này: Cellulomonas sp. được tìm thấy trong rau và phân trộn, trong khi Streptomycetes sp. được tìm thấy trong cả trái cây và phân hỗn hợp, và Streptococcus sp. và B. thuringiensis chỉ được tìm thấy trong phân hoa quả.
Tổng số vi khuẩn của phân hữu cơ được làm từ chất thải thực vật cao hơn (52 × 106) so với phân hữu cơ làm từ trái cây (22 × 106); số lượng này là trung gian cho phân hữu cơ từ chất thải hỗn hợp rau và trái cây (49 × 106). Tất cả các loại vi sinh vật phát triển đều có đặc điểm tích cực. Enterococcus faecium có đặc tính sinh học vì khả năng điều chỉnh hệ thống miễn dịch của vật chủ và do đó cải thiện phản ứng chống lại mầm bệnh (Khalkhali và Mojgani 2017). Streptomycetes sp. tiết ra các enzyme gây độc cho sâu bệnh (de Lima Procópio và cộng sự 2012). Streptomyceae là những sinh vật chuyển tiếp giữa vi khuẩn và nấm giúp biến đổi axit amin và các chất tương tự do vi khuẩn quang hợp tạo ra thành chất kháng sinh để kiểm soát mầm bệnh.
Trong số ba loại phân hữu cơ lỏng, phân hữu cơ rau chứa hàm lượng N, P và K cao nhất. Hàm lượng P cao có thể được giải thích là do sự hiện diện của hai loại vi khuẩn hòa tan P (B. cereus và Microbacterium sp.) trong phân hữu cơ lỏng có rau, trong khi phân hoa quả chứa B. cereus và B. thuringiensis. Widawati và Suliasih (2006) tuyên bố rằng Bacillus sp. là vi khuẩn hòa tan P có khả năng hòa tan các nguyên tố P liên kết với các nguyên tố khác (ví dụ: Fe, Al, Ca và Mg), trong khi chủng Microbacterium hòa tan P vô cơ thành P hữu cơ (Zhu và cộng sự, 2011; Rivas và cộng sự, 2004); cả hai đều làm cho P vô cơ khả dụng hơn. Hàm lượng P cao hơn trong phân trộn lỏng với rau cung cấp nhiều chất dinh dưỡng hơn vì sự đa dạng hơn của vi khuẩn hòa tan P trong nghiệm thức này. Vi khuẩn cố định N, chẳng hạn như Clostridium sp., hấp thụ N từ đất, nước và không khí để phân hủy chất hữu cơ, làm cho N này có sẵn dưới dạng nitrat để cây sử dụng. Cả ba loại phân hữu cơ đều có Clostridium sp., nhưng tổng số vi khuẩn trong phân hữu cơ rau cao hơn trong phân hữu cơ trái cây và chúng ta có thể giả định rằng điều này đã góp phần vào hàm lượng P và N cao hơn.
Thực vật phù du là thành phần dinh dưỡng chính của tôm he con trong các lạch ngập mặn thủy triều ở bán đảo Malaysia, bên cạnh vi tảo đáy (Newell và cộng sự, 1995), và ở Philippines, bên cạnh vi tảo biểu sinh (Primavera 1993). Hena và Hishamuddin (2012) phát hiện ra rằng ruột trước của tôm post P. monodon chứa chủ yếu là mảnh vụn (dưới dạng mảnh vụn không xác định), tiếp theo là thực vật phù du (chủ yếu là tảo cát) và giáp xác chân chèo. Phần lớn các sinh vật phù du được tìm thấy trong ba loại phân hữu cơ là Bacillariophyceae (tảo cát). Chúng ta có thể giả định rằng tốc độ tăng trưởng vượt trội của tôm trên phân hữu cơ lỏng làm từ thực vật là gián tiếp do lượng N và P sẵn có cao hơn, cả hai đều giúp tăng cường lượng sinh vật phù du.
5. Kết luận
Phân lỏng làm từ rau giúp tốc độ tăng trưởng của P. monodon con tốt nhất. Tỷ lệ sống của tôm là như nhau (65–76%) đối với tất cả các nghiệm thức và đối chứng. Tuy nhiên, tốc độ tăng trưởng của tôm thấp hơn một chút với phân hữu cơ lỏng từ trái cây và phân hữu cơ hỗn hợp, mặc dù tôm tăng trưởng tốt hơn so với đối chứng. Tốc độ tăng trưởng cụ thể thấp hơn với phân hoa quả (2,0 so với 2,5) có thể là kết quả của sự hiện diện của tảo hai roi trong hỗn hợp. Cắt nhỏ hoặc nghiền nát lá A. marina làm tăng tốc độ hấp thụ chất dinh dưỡng từ lá. Thêm 0,125 g/ L lá rừng ngập mặn đã cắt nhỏ hoặc toàn bộ vào nước trong bể đã cải thiện tốc độ tăng trưởng của tôm.
Theo Restiana Wisnu Ariyati, Sri Rejeki, Lestari L. Widowati, Tita Elfitasari & Roel H. Bosma
Nguồn: https://link.springer.com/article/10.1007/s40071-019-00239-x
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Nucleotides: Thành Phần Chức Năng Trong Thức Ăn Cho Tôm
- Phương Pháp Mới Có Giá Trị Trong Việc Phát Hiện Virus Hội Chứng Đốm Trắng
- Nấm Men Biến Đổi Gen – Nguồn Astaxanthin Đầy Hứa Hẹn Cho Thức Ăn Tôm

 English
English 中文 (中国)
中文 (中国)