Tóm tắt
Chẩn đoán hồi cứu tập hợp vi khuẩn (n=31) có nguồn gốc từ 5 trang trại bị ảnh hưởng bởi hội chứng tôm chết sớm (EMS) ở Đông Nam Á vào năm 2016 cho thấy 9/31 phân lập từ hai trang trại có kết quả xét nghiệm dương tính với V. parahaemolyticus gây bệnh hoại tử gan tụy cấp tính (VPAHPND). Phân tích phân tử của 22 phân lập còn lại cho thấy 21 phân lập thuộc về các loài Vibrio bao gồm VPnon-AHPPND, V. vulnificus, V. cholerae, V. owensii và V. alginolyticus. Một phân lập từ một trang trại AHPND đã được xác định sơ bộ là Aeromonas schubertii dựa trên 99,43% nhận dạng nucleotide của 16S rRNA với chủng tham chiếu ATCC 43700 (X60416). Các bệnh do vi khuẩn Vibrio gây ra đã được nghiên cứu kỹ lưỡng ở tôm, nhưng khả năng gây bệnh của các loài không phải Vibrio thường bị bỏ qua. Vì mô tả về A. schubertii có trong các trang trại nuôi tôm là rất hiếm, nghiên cứu này do đó tập trung vào việc xác định loài và tiềm năng gây bệnh của nó đối với tôm dựa trên sự kết hợp của nhiều phương pháp tiếp cận như phân tích trình tự đa địa điểm (MLSA), thử nghiệm cảm nhiễm, mô bệnh học và lai tạo tại chỗ (ISH). Dựa trên MLSA của 2464 bp có nguồn gốc từ 16S rRNA (1346 bp), gyrB (568 bp) và rpoB (550 bp), phân lập này đã được xác nhận là A. schubertii. Thử thách ngâm bằng cách sử dụng ba lần pha loãng nối tiếp 10 lần liên tiếp (2 × 104 đến 2 × 106 CFU/mL) cho thấy A. schubertii gây bệnh cho tôm và tỷ lệ chết tích lũy phụ thuộc vào liều lượng (45–70%). Tôm bị bệnh có biểu hiện toàn thân màu đỏ và tổn thương mô bệnh học, đặc biệt là các ống gan tụy bị vỡ và bao bọc điển hình. ISH sử dụng đầu dò đặc hiệu với A. schubertii đã xác nhận sự định vị của vi khuẩn trong gan tụy của tôm bị nhiễm bệnh. Tóm lại, nghiên cứu này đã báo cáo một loài gây bệnh mới, không phải Vibrio, A. schubertii đã phục hồi từ một trang trại bị ảnh hưởng bởi AHPND, gây ra tỷ lệ chết lên đến 70% trong thử thách ngâm. Vì A. schubertii còn khá mới đối với tôm nên có thể tiềm ẩn rủi ro đối với các vùng nuôi tôm có độ mặn thấp, do đó cần phải giám sát tích cực mầm bệnh này.
1. Giới thiệu
Tôm thẻ chân trắng (Penaeus vannamei) là một loài nuôi trồng thủy sản quan trọng để xuất khẩu ở nhiều nước ở châu Á. Sản lượng tôm toàn cầu tăng đáng kể trước khi ngành này bị ảnh hưởng nặng nề bởi một căn bệnh mới xuất hiện, chủ yếu được gọi là hội chứng tôm chết sớm (EMS), sau đó được gọi là bệnh hoại tử gan tụy cấp tính (AHPND). Kiến thức khoa học về tác nhân gây bệnh, V. parahaemolyticus chứa một plasmid độc lực (pVA) mã hóa độc tố nhị phân PirVp A và B (VPAHPND) và cơ chế gây chết ở tôm sau đó đã được phát hiện. EMS/AHPND ảnh hưởng chủ yếu đến tôm con trong vòng 35 ngày sau khi thả và dẫn đến tỷ lệ chết nghiêm trọng lên đến 100%. Một nghiên cứu đoàn hệ trước đây trên 196 ao nuôi tôm Thái Lan cho thấy EMS bao gồm sự phức tạp của nhiều mầm bệnh góp phần như các loài Vibrio gây ra AHPND, virus hội chứng đốm trắng (WSSV), vi bào tử trùng Enterocytozoon hepatopenaei (EHP) cũng như các loài vi khuẩn không xác định khác. Do đó, trong các ao nuôi tôm bị ảnh hưởng bởi EMS, không chỉ có tác nhân gây bệnh AHPND mà còn có các vi sinh vật gây bệnh khác.
Bệnh do Vibrio gây ra trên tôm đã được nghiên cứu kỹ lưỡng bao gồm VPAHPND, VPnon-AHPND, V. harveyi, V. vulnificus, V. alginolyticus, V. cholerae và V. owensii. Chỉ có một vài báo cáo về khả năng gây bệnh của các loài không phải Vibrio đối với tôm he, tức là Photobacterium damselae subsp. damselae, Streptococcus spp., Spiroplasma penaei, Aeromonas hydrophila, và A. schubertii. Không có trường hợp nào có liên quan đến tôm bị ảnh hưởng bởi EMS/AHPND. Trong những nỗ lực liên tục để phát hiện các mầm bệnh khác liên quan đến EMS, gần đây nhất, một loài vi khuẩn mới Shewanella khirikhana được phân lập từ một ao bị ảnh hưởng bởi EMS ở Thái Lan đã được báo cáo là một mầm bệnh tôm mới, gây ra tỷ lệ chết 100% ở mức 72 hpi ở tất cả các liều thử nghiệm ngâm từ 104 đến 106 CFU/mL. Tôm bị bệnh cho thấy tổn thương mô bệnh học đặc biệt của các tế bào chất có không bào của dây thần kinh bụng và cơ quan bạch huyết. Trong nghiên cứu hiện tại, chúng tôi đã báo cáo một loài không phải Vibrio bất thường, A. schubertii, được phân lập từ một trang trại nuôi tôm EMS/AHPND có khả năng gây bệnh và tỷ lệ chết ở tôm có tổn thương bệnh lý nghiêm trọng ở gan tụy.
2. Vật liệu và phương pháp
2.1. Phân lập vi khuẩn
Năm 2016, trong đợt bùng phát nghiêm trọng của EMS/AHPND ở Đông Nam Á, một phòng thí nghiệm ẩn danh tại địa phương đã thu thập mẫu tôm từ 5 trang trại bị ảnh hưởng để điều tra sơ bộ. Theo phòng thí nghiệm địa phương, các mẫu tôm được lấy từ cả trang trại bán thâm canh và thâm canh nơi độ mặn tương đối thấp, 10–15 ppt. Phân lập vi khuẩn được thực hiện từ gan tụy và dạ dày của tôm bị ảnh hưởng (khoảng 5 con mỗi trang trại) bằng cách sử dụng thạch muối mật thiosulfate citrate sucrose (TCBS) hoặc đĩa môi trường CHROMagar™ Vibrio. Sau đó, 16 khuẩn lạc màu xanh lá cây và 15 màu vàng đã được chọn và chỉ được bảo quản trong môi trường đậu nành tryptic có chứa 15% glycerol ở -80ºC do hạn chế của các cơ sở chẩn đoán có thể tiếp cận tại thời điểm xảy ra sự kiện. Do đó, những phân lập này đã được xác định hồi cứu trong nghiên cứu này.
2.2. Chiết xuất DNA vi khuẩn
31 chủng vi khuẩn thuần chủng (16 khuẩn lạc màu xanh lá cây và 15 khuẩn lạc màu vàng) đã được chiết xuất DNA bằng cách đun sôi như đã mô tả trước đây. Tóm lại, điều này đã được thực hiện bằng cách cấy một khuẩn lạc của mỗi chủng phân lập trong 3 mL nước dùng đậu nành tryptic (TSB) bổ sung với 1,5% NaCl và ủ với lắc qua đêm ở 30ºC. Viên tế bào vi khuẩn sau đó được thu thập bằng cách ly tâm ở 5000 g trong 10 phút, rửa một lần bằng nước cất vô trùng và tạo huyền phù lại bằng 200 μL nước cất vô trùng. Quá trình ly giải tế bào được thực hiện bằng cách làm nóng ở 95ºC trong 10 phút. Sau khi ủ trên đá trong 10 phút và ly tâm nhanh, phần nổi phía trên chứa DNA của vi khuẩn được thu thập và chất lượng và số lượng DNA được đo bằng phương pháp đo quang phổ ở OD260 và OD280.
2.3. Phân tích PCR đặc hiệu (phương pháp AP4 lồng nhau, duplex pirAB, V. parahaemolyticus ldh và V. harveyi toxR)
Để sàng lọc các chủng vi khuẩn chứa gen độc tố PirABVp, DNA từ 31 chủng vi khuẩn đã được phân tích bằng phương pháp AP4 lồng nhau và PCR song song cộng với PirABVp. Song song, các xét nghiệm PCR đặc hiệu với V. parahaemolyticus và V. harveyi đã được sử dụng lần lượt cho 16 chủng màu xanh lá cây và 15 chủng màu vàng. Các mồi tương ứng nhắm vào đoạn gen hemolysin phụ thuộc lecithin (ldh) của V. parahaemolyticus (450 bp) và trình tự điều hòa phiên mã xuyên màng (toxR) của V. harveyi (382 bp). DNA bộ gen chiết xuất từ phân lập VPAHPND XN89 và V. harveyi Y6 đã được sử dụng làm đối chứng dương tính trong các thử nghiệm tương ứng. Nước cất không có mẫu DNA đã được sử dụng để làm đối chứng âm tính.
2.4. Xác định các vi khuẩn chưa biết còn lại bằng cách giải trình tự 16S rRNA
Các vi khuẩn chưa biết còn lại (1 phân lập màu xanh lá cây và 15 phân lập màu vàng) âm tính trong các thử nghiệm PCR cụ thể ở trên đã được tiếp tục xác định loài bằng 16S rRNA. Việc khuếch đại 16S rRNA được tiến hành bằng cách sử dụng mồi phổ biến Uni-Bact-F/R được mô tả bởi Weisburg và cộng sự, (Bảng 1). Các sản phẩm amplicon có kích thước khoảng 1,5 kb đã được tinh chế gel (Favorgen Gel / PCR Purification Mini Kit) và được gửi để giải trình tự DNA hai chiều tại Macrogen (Hàn Quốc) bằng cách sử dụng mồi khuếch đại của chúng. Chương trình ver.5.6.7 geneious và các ứng dụng web NCBI đã được sử dụng để phân tích trình tự. Nhận dạng trình tự nucleotide của các chuỗi thu được được xác định bởi BLASTn (https://blast.ncbi.nlm.nih.gov ) và một cây phát sinh loài với Neighbor joining được xây dựng bởi chương trình MEGA7 cùng với các chuỗi 16S rRNA của các chủng tham chiếu từ GenBank với 1000 bản sao bootstrap.
Bảng 1 Mồi được sử dụng trong nghiên cứu này
2.5. Phân tích trình tự đa điểm (MLSA) của Aeromonas schubertii
Để xác nhận các loài vi khuẩn thuộc một phân lập đặc biệt được phục hồi từ một trang trại nuôi tôm EMS được xác định là A. schubertii dựa trên 16S rRNA (xem bên dưới), phân tích trình tự đa điểm (MLSA) bằng cách sử dụng ba đoạn gen; 16S rRNA, gyrB (DNA gyrase, tiểu đơn vị B) và rpoB (RNA polymerase, chuỗi beta) đã được thực hiện. Trình tự mồi được liệt kê trong Bảng 1. Quy trình PCR để khuếch đại hai gen sau đã được theo dõi theo các bài báo đã xuất bản trước đó. Kết quả trình tự DNA từ các amplicon cụ thể của các đoạn gen 16S rRNA, gyrB và rpoB đã được nối và sử dụng cho cây phát sinh loài dựa trên MLSA bằng chương trình MEGA7 với 1000 bản sao bootstrap. Trình tự tương ứng của các loài có liên quan chặt chẽ đã được lấy từ GenBank và được nối theo cách tương tự để MLSA và cấu trúc cây.
2.6. Khả năng gây bệnh của schubertii trong thử thách ngâm
Tôm thẻ chân trắng khỏe mạnh (Penaeus vannamei) có trọng lượng cơ thể ~ 1 g được nuôi trong bể thủy tinh sợi 20 L có chứa nước biển nhân tạo (15 ppt). Phân lập vi khuẩn của A. schubertii 2322 được nuôi cấy trên TSA+1,5% NaCl qua đêm ở 30ºC. Sau đó, một khuẩn lạc thuần chủng duy nhất được cấy trong 5 mL TSB + 1,5% NaCl và phát triển qua đêm ở 30ºC với 250 vòng/phút . Nuôi cấy vi khuẩn (1%) được chuyển vào TSB+1,5% NaCl, ủ ở 30ºC với độ lắc liên tục cho đến khi OD600 đạt 1,0 (tương đương ~2 × 108 CFU/mL như được xác minh bằng số lượng đĩa). Thí nghiệm bao gồm bốn nhóm được thực hiện lặp lại với 10 con tôm mỗi bể. Trong ba nhóm xử lý, nuôi cấy vi khuẩn 200 mL, 20 mL và 2 mL được tạo viên và hòa tan lại trong 20 mL dung dịch muối (0,85%) trước khi thêm vào bể 20 L để đạt mật độ vi khuẩn cuối cùng lần lượt là 2×106, 2×105 và 2×104 CFU/mL. Nhóm đối chứng âm tính nhận được dung dịch muối không có vi khuẩn. Tôm thử nghiệm được duy trì ở mức 28–29ºC mà không thay nước. Tỷ lệ chết của tôm và các dấu hiệu lâm sàng được ghi nhận trong 96 giờ. Tiến hành tái phân lập vi khuẩn với đại diện của tôm sắp chết (n=6) bằng cách sử dụng môi trường TSA được bổ sung 1,5% NaCl.
2.7. Kiểm tra mô học và lai tạo tại chỗ (ISH)
Tôm sắp chết đại diện từ nhóm bị nhiễm bệnh và tôm khỏe mạnh từ nhóm đối chứng đã được bảo quản trong dung dịch cố định của Davidson để nghiên cứu những thay đổi mô bệnh học. Các mẫu đã được xử lý cho mô học tiêu chuẩn, nhuộm màu bằng hematoxylin và eosin (H&E). Các tổn thương mô bệnh học đã được quan sát dưới kính hiển vi quang học được trang bị máy ảnh kỹ thuật số. Các mẫu đại diện cho thấy những thay đổi bệnh lý bất thường cũng được chọn để xác nhận nhiễm khuẩn bằng xét nghiệm ISH. Các mẫu tôm từ bể đối chứng cũng được đưa vào. Gen hemolysin chịu nhiệt (GenBank gia nhập số. CP013067, thẻ locus WL1483_1062), một gen duy nhất của A. schubertii đã được chọn làm mục tiêu cho đầu dò cụ thể. Một cặp mồi cụ thể (Bảng 1) nhắm mục tiêu một đoạn 460 bp (Hình. S1) được thiết kế trong nghiên cứu này để chuẩn bị đầu dò ghi nhãn PCR digoxygenin (DIG). Quá trình PCR bao gồm 35 chu kỳ; biến tính ở 94ºC trong 20 giây, ủ ở 55ºC trong 20 giây và mở rộng ở 72ºC trong 20 giây. Thanh lọc đầu dò được thực hiện bằng Favogen Gel / PCR Purification Mini Kit. Một đầu dò có nhãn DIG 282 bp có nguồn gốc từ bộ gen IMNV (virus hoại tử cơ truyền nhiễm) đã được sử dụng làm đầu dò không liên quan cho xét nghiệm ISH. Các slide điều khiển âm tính mà không có đầu dò cũng được bao gồm. Phương pháp ISH tiêu chuẩn được thực hiện như được mô tả trước đây bằng cách sử dụng đầu dò 250 ng trên mỗi slide.
2.8. PCR đặc hiệu để sàng lọc nhanh schubertii
Vì A. schubertii tương đối mới đối với tôm, để tạo điều kiện sàng lọc và lựa chọn nhanh chóng các khuẩn lạc nghi ngờ từ phân lập ban đầu, chúng tôi đã tối ưu hóa điều kiện PCR bằng cách sử dụng mồi nhắm vào gen hemolysin chịu nhiệt như đã đề cập ở trên. Hỗn hợp phản ứng PCR (25 μL) bao gồm 2 μL mẫu DNA (100 ng /μL), 0,2 μL taq DNA polymerase (5 đơn vị / μL, Invitrogen™), 2,5 μL dung dịch đệm PCR 10X, 0,5 μL của 10 mM dNTP, 0,5 μL của 50 mM MgCl2, 0,5 μL của 10 μM mỗi mồi TH-F/R và nước. Dựa trên kết quả của PCR gradient, nhiệt độ ủ ở mức 55ºC đã được chọn để khuếch đại PCR. Các điều kiện cuối cùng bao gồm biến tính ở 94ºC trong 5 phút và 30 chu kỳ biến tính ở 94ºC trong 20 giây, ủ ở 55ºC trong 20 giây và mở rộng ở 72ºC trong 20 giây. Sau đó, tính đặc hiệu của quy trình PCR đã được thiết lập đã được đánh giá bằng cách sử dụng DNA bộ gen chiết xuất từ 4 loài Aeromonas có liên quan chặt chẽ (A. caviae, A. dhakensis, A. jandaei và A. hydrophila) và 6 loài Vibrio phân lập được phục hồi sau các đợt bùng phát EMS trong nghiên cứu này bao gồm VPAHPND, VPnon-AHPND, V. vulnificus, V. alginolyticus, V. owensii và V. cholerae. DNA chiết xuất từ A. schubertii trong nghiên cứu này được sử dụng làm đối chứng dương tính trong khi nước không có mẫu được sử dụng làm đối chứng âm tính. Lưu ý rằng 4 loài Aeromonas là từ bộ sưu tập Centex Shrimp.
3. Kết quả
3.1. Chẩn đoán hồi cứu cho thấy hai trong số năm trang trại EMS có kết quả xét nghiệm dương tính với VPAHPND
Dựa trên các thử nghiệm PCR cụ thể, 15/16 chủng phân lập hình thành khuẩn lạc màu xanh lá cây đã được chỉ định cho 9 VPAHPND và 6 VPnon-AHPND (Bảng 2). 9 phân lập VPAHPND được tìm thấy từ 2/5 trang trại EMS (Bảng 2). Tất cả 15 khuẩn lạc hình thành khuẩn lạc màu vàng đều có kết quả xét nghiệm âm tính với V. harveyi bằng PCR đặc hiệu toxR (hình không minh họa).
Bảng 2 Chi tiết về 31 phân lập vi khuẩn từ 5 trang trại bị ảnh hưởng bởi EMS
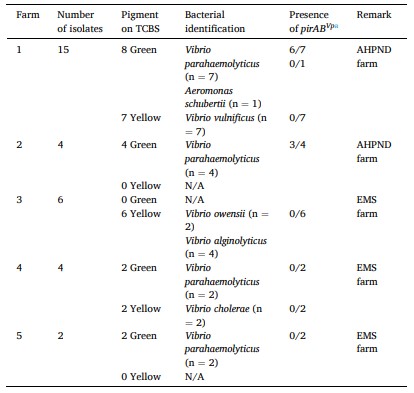
a Cả hai phương pháp AP4 lồng nhau và pirA/B hai mặt đều cho thấy kết quả phát hiện nhất quán.
3.2. Aeromonas schubertii, một loại vi khuẩn mới được phục hồi từ một trang trại AHPND
Trong nghiên cứu này, 16 chủng phân lập chưa xác định (1 màu xanh lá cây và 15 màu vàng) đã được xác định loài bằng cách phân tích trình tự 16S rRNA. Dựa trên BLASTn, tất cả các loài vi khuẩn đã được xác định ở cấp độ loài với tỷ lệ nhân dạng >99,63% cho chủng tham chiếu tương ứng (Bảng 2). Một phân lập màu xanh lá cây (sau này được gọi là A. schubertii 2322) được phân loại chính thức là Aeromonas schubertii trong khi 15 khuẩn lạc màu vàng được phân loại là Vibrio cholerae (2), V. owensii (2), V. vulnificus (7) và V. alginolyticus (4) (Bảng 2).
Do A. schubertii hiếm khi liên quan đến tôm bị bệnh và trước đây chưa được báo cáo ở các trang trại bị ảnh hưởng bởi AHPND, nên nghiên cứu này tập trung chủ yếu vào việc xác định và điều tra khả năng gây bệnh của A. schubertii 2322 đối với sức khỏe của tôm (bên dưới). Xác định thêm đã xác nhận loài A. schubertii 2322 dựa trên MLSA là 2464 bp có nguồn gốc từ các chuỗi nối của 16S rRNA (1346 bp) gyrB (568 bp) và rpoB (550 bp) và cây phát sinh loài với trình tự tương ứng của các chủng tham chiếu được lấy từ cơ sở dữ liệu GenBank (Hình 1).
 3.3. A. schubertii gây chết tôm thẻ chân trắng trong cảm nhiễm bằng cách ngâm
3.3. A. schubertii gây chết tôm thẻ chân trắng trong cảm nhiễm bằng cách ngâm
Tỷ lệ chết tích lũy ở ba nhóm cảm nhiễm, tiếp xúc với 2 × 106, 2 × 105 hoặc 2 × 104 CFU / mL của A. schubertii 2322 theo con đường ngâm, lần lượt là 70, 60 và 45% (Hình 2). Tuy nhiên, không có sự khác biệt đáng kể giữa các nhóm tiếp xúc với vi khuẩn, rất có thể là do kích thước mẫu nhỏ được sử dụng. Không có tỷ lệ chết nào được quan sát thấy trong nhóm đối chứng nhận được 0,85% NaCl thay vì vi khuẩn trong và sau 96 giờ sau khi nhiễm bệnh (hpi) (Hình 2). Con tôm bị nhiễm bệnh có biểu hiện lờ đờ và tập trung dưới đáy bể. Tôm sắp chết có thân màu đỏ rõ ràng và gan tụy nhợt nhạt trước khi chết (Hình 3). Nhiều khuẩn lạc xác định chính xác, một hình thái điển hình của sự phát triển của A. schubertii trên TSA được bổ sung 1,5% NaCl, đã được phân lập lại thành công từ tôm sắp chết đại diện. Về mặt mô học, tôm không bị nhiễm bệnh từ nhóm đối chứng cho thấy cấu trúc gan tụy bình thường với sự hiện diện của nhiều tế bào B trong ống (Hình 4A) trong khi tôm sắp chết tiếp xúc với A. schubertii 2322 trong vòng 48 giờ đầu tiên cho thấy các tế bào biểu mô bị tổn thương từ trung bình đến nặng của ống gan tụy nơi tế bào B và R bị giảm đáng kể (Hình 4B) hoặc gần như biến mất hoàn toàn (Hình 4C và D). Tôm chết sau đó (72–96 giờ) cho thấy cả ống gan tụy bị vỡ và thoái hóa hình ống với lớp vỏ mãn tính bao quanh bởi các tế bào máu lớn (mũi tên) (Hình 4E và F). Xét nghiệm ISH sử dụng đầu dò đặc hiệu A. schubertii đã định vị các tín hiệu phản ứng dương tính trong ống gan tụy của tôm bị nhiễm bệnh trong khi không quan sát thấy tín hiệu dương tính trong cùng các mẫu được thử nghiệm bằng đầu dò không liên quan (đầu dò IMNV), không có đầu dò hoặc mẫu tôm không bị nhiễm bệnh từ nhóm đối chứng (Hình 5). Lưu ý rằng mảnh 460 bp được khuếch đại của A. schubertii 2322 (Hình. S1) có tỷ lệ đồng nhất trình tự nucleotide từ 99,35–100% với trình tự A. schubertii trong khi nó thể hiện ≤78,10% đối với trình tự của các loài Aeromonas khác trong cơ sở dữ liệu GenBank.

Hình 2. Tỷ lệ chết tích lũy của tôm thẻ chân trắng sau khi được thử nghiệm với ba liều A. schubertii 2322 theo đường ngâm. Mỗi lần điều trị (n = 10) được thực hiện trùng lặp và theo dõi 96 h sau nhiễm trùng (hpi). Nhóm đối chứng nhận được 0,85% NaCl thay vì vi khuẩn. Chỉ các thanh phía trên được hiển thị.
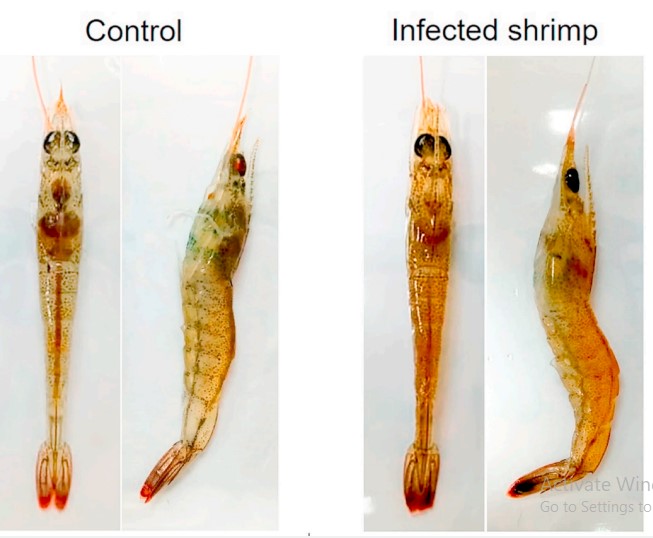
Hình 3. Dấu hiệu tổng thể so sánh của tôm có vẻ khỏe mạnh từ nhóm đối chứng (trái) và tôm bị nhiễm bệnh bằng thực nghiệm với A. schubertii 2322 (phải). Tôm bị nhiễm bệnh cho thấy cơ thể màu đỏ và gan tụy nhợt nhạt.

Hình 4. Ảnh chụp hiển vi nhuộm H&E của phần gan tụy từ tôm khỏe mạnh trong nhóm đối chứng (mẫu đại diện ở 96 hpi) (A) và tôm sắp chết đại diện (B đến F) từ A. schubertii 2322 nhóm bị nhiễm bệnh. Tôm chết sau 24 giờ cho thấy các vùng hỗn hợp của ống gan tụy (B) bình thường và vỡ trong khi tôm chết từ 48–72 giờ cho thấy mức độ nghiêm trọng của ống gan tụy bị vỡ (C–D) tăng lên. Hoại tử nghiêm trọng của ống và bao bọc (mũi tên) đã được quan sát thấy ở tôm chết ở 72 giờ (E). Trộn các ống gan tụy bị vỡ và bao bọc (mũi tên) được quan sát thấy ở tôm chết ở tốc độ 96 giờ (F). Hộp đen cho thấy độ phóng đại cao của sự bao bọc được bao quanh bởi các tế bào máu lớn. C, các tế bào biểu mô bị vỡ của ống gan tụy, N, bình thường, thanh, 100 μm.
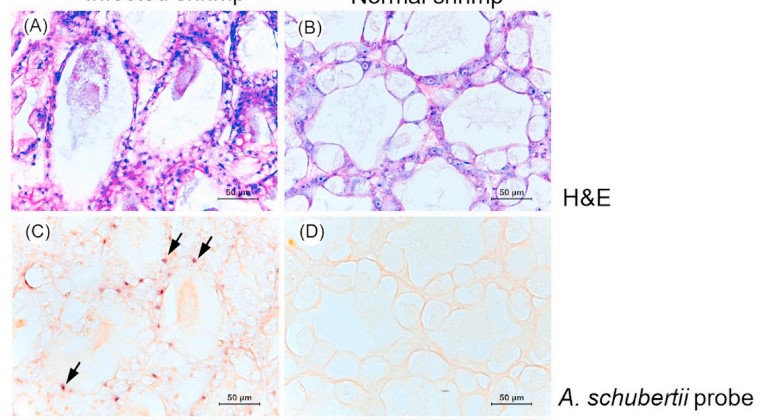
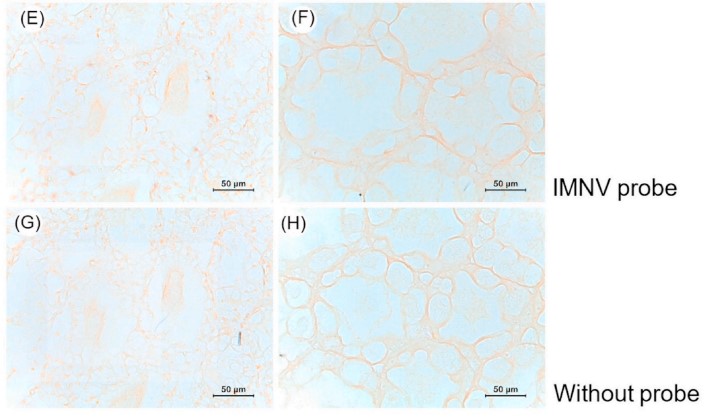
Hình 5. Ảnh chụp hiển vi của xét nghiệm lai tạo tại chỗ cho đại diện A. schubertii 2322 bị nhiễm bệnh và kiểm soát tôm. Phần nhuộm màu A-B, H&E, C-D; các phần mô liên tiếp được xét nghiệm bằng đầu dò đặc hiệu với A. schubertii; E-F, các phần được ủ bằng đầu dò không liên quan (đầu dò IMNV) và G-H, kiểm soát âm mà không cần đầu dò. Mũi tên chỉ ra phản ứng ISH tích cực. thanh, 50 μm.
3.4. PCR đặc hiệu để sàng lọc ban đầu A. schubertii
Quy trình PCR ban đầu khi thử nghiệm với các phân lập vi khuẩn đã được thử nghiệm đã tạo ra amplicon dự kiến là 460 bp chỉ từ A. schubertii trong khi không có sản phẩm nào được phát hiện ở 4 loài Aeromonas được thử nghiệm khác và 6 loài Vibrio đã được thử nghiệm (Hình 6). Điều này chỉ ra rằng bộ mồi có thể được sử dụng để sàng lọc PCR nhanh chóng cho A. schubertii trong số các phân lập vi khuẩn khác.
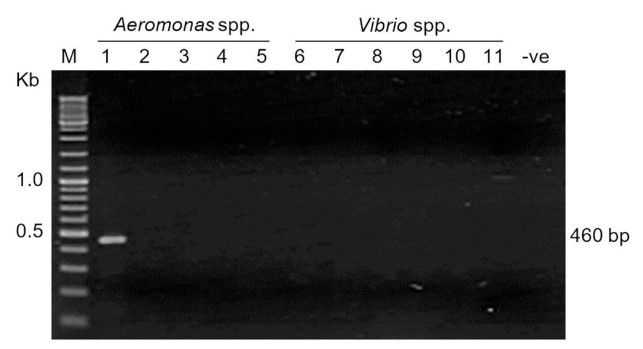
Hình 6. Xét nghiệm độ đặc hiệu của phát hiện PCR đặc hiệu với A. schubertii. DNA từ các loài Aeromonas và Vibrio khác nhau đã được thử nghiệm. Làn 1, A. schubertii 2322; làn 2–5, A. caviae, A. dhakensis, A. jandaei và A. hydrophila; làn 6–11, VPAHPND, VPnon-AHPND, V. vulnificus, V. alginolyticus, V. owensii và V. cholerae; làn M: Dấu hiệu DNA (2- thang DNA nhật ký; Phòng thí nghiệm sinh học New England). -ve: không có kiểm soát mẫu. Amplicon dự kiến (460 bp) chỉ được phát hiện từ DNA của A. schubertii.
4. Thảo luận
4.1. Aeromonas schubertii tương đối mới đối với tôm thẻ chân trắng
Aeromonas là vi khuẩn Gram âm, hình que thường được phân loại là sinh vật nước ngọt. nhưng được tìm thấy ở khắp mọi nơi từ hệ sinh thái nước ngọt đến biển. Một số loài trong chi này như A. hydrophila, A. veronii, A. caviae, A. jandaei, A. dhakensis và A. schubertii là những tác nhân gây bệnh quan trọng của cá nuôi nước ngọt. A. schubertii được biết đến như một mầm bệnh cá mới nổi gây ra u hạt nội tạng ở cá lóc nuôi nước ngọt và cá rô phi sông Nile hoang dã nước lợ ở Trung Quốc.
Người ta biết liệu các loài Aeromonas có gây bệnh cho tôm nuôi ở nước ngọt và nước lợ như đã báo cáo ở cá hay không. Yano và cộng sự đã báo cáo sự phân lập của một số Aeromonas spp., bao gồm A. schubertii từ tôm biển nuôi trong các ao có độ mặn thấp nội địa ở Thái Lan. Tuy nhiên, khả năng gây bệnh của chúng đối với tôm vẫn chưa được nghiên cứu. Gần đây, A. hydrophila đã được báo cáo là một tác nhân gây bệnh teo gan tụy với tỷ lệ chết 50–100% ở tôm thẻ chân trắng P. vannamei nuôi nước ngọt ở Trung Quốc. Cho đến nay chỉ có một báo cáo về nhiễm A. schubertii ở tôm. A. schubertii HS1 đã được chứng minh là nguyên nhân gây ra “bệnh thân đỏ” của tôm thẻ chân trắng nuôi nước ngọt ở Trung Quốc. Sau một thử nghiệm ngâm, liều tương đối cao (5 × 106 CFU/mL) của A. schubertii HS1 đã giết chết 96% tôm và tôm bị nhiễm bệnh thử nghiệm có dấu hiệu toàn thân màu đỏ như quan sát thấy khi nhiễm tự nhiên. Không có thay đổi mô bệnh học nào do nhiễm A. schubertii gây ra đã được mô tả trong nghiên cứu nói trên và không có nghiên cứu tiếp theo nào được báo cáo sau lần bắt đầu đầu tiên. Trong nghiên cứu hiện tại, một liều 2 × 106 CFU/mL A. schubertii 2322 đã gây ra tỷ lệ chết tích lũy 75% ở tôm thẻ chân trắng và dấu hiệu thân màu đỏ từ tôm sắp chết trong thử nghiệm cảm nhiễm cũng được quan sát thấy. Mặc dù nguồn gốc của hai phân lập A. schubertii là khác nhau; một từ ao nuôi cấy nước ngọt trải qua bệnh thân đỏ và một từ một trang trại nuôi nước lợ bị nhiễm AHPND (nghiên cứu này); nó có thể gợi ý rằng A. schubertii là một loại vi khuẩn gây bệnh mới được báo cáo gây chết tôm thẻ chân trắng.
Sự phân lập vi khuẩn ban đầu sử dụng môi trường chọn lọc TCBS và CHROMagar™ Vibrio có thể góp phần vào tỷ lệ phục hồi thấp của A. schubertii trong nghiên cứu này (1/31 phân lập). Tuy nhiên, điều đó có thể không có nghĩa là tỷ lệ nhiễm của vi khuẩn này thấp. Do đó, cần xem xét theo dõi tỷ lệ nhiễm A. schubertii trên tôm nuôi, đặc biệt là đối với các vùng nuôi tôm có độ mặn thấp. Cũng có ý kiến cho rằng việc sử dụng các môi trường chung như thạch đậu nành tryptic, thạch dinh dưỡng hoặc thạch truyền não và tim để phân lập ban đầu có thể làm tăng cơ hội phục hồi vi khuẩn này.
4.2. Tổn thương của tôm nhiễm schubertii giống với tổn thương VPAHPND không điển hình
Các đặc điểm mô bệnh học của các tế bào biểu mô bị vỡ trong ống gan tụy do A. schubertii gây ra như đã được báo cáo trước đây từ tôm nhiễm Vibrio. Ví dụ, các chủng Vibrio như vậy là một phân lập non-VPAHPND 2HP gây bệnh từ Thái Lan đã giết chết 75% tôm trong một thử nghiệm ngâm, một chủng đột biến (XN87) của VPAHPND chứa ΔpirAVp pirBVp + từ Việt Nam không tạo ra độc tố PirVp nhưng vẫn giết chết 50% tôm và hai phân lập V. parahaemolyticus không điển hình (36 và 43) từ Nam Mỹ mang pirABVp chiều dài đầy đủ mà không sản xuất độc tố PirVp nhưng vẫn giết chết 100% tôm. Do đó, các tế bào biểu mô bị vỡ của ống gan tụy là một loại đặc điểm mô bệnh học chết người gây ra bởi một số chủng V. parahaemolyticus và A. schubertii. Trong trường hợp của A. schubertii, đặc điểm mô bệnh học này được quan sát thường xuyên hơn ở tôm chết trong 2 ngày đầu tiên trong khi những con chết sau đó (ngày 3-4) cho thấy phản ứng mãn tính bổ sung của việc bao bọc với sự xâm nhập của các tế bào máu lớn. Điều này cho thấy rằng các tế bào biểu mô bị vỡ của ống gan tụy có khả năng do nhiễm trùng cấp tính dẫn đến chết do rối loạn chức năng của gan tụy bị tổn thương.
4.3. Phát hiện sớm schubertii từ vi khuẩn được phân lập từ các trang trại nuôi tôm
Vì A. schubertii được cho là một mầm bệnh mới của tôm, nên có khả năng rất ít cuộc điều tra trước đây tập trung vào vi khuẩn này như một tác nhân gây bệnh cho tôm. Sàng lọc PCR nhanh được báo cáo trong nghiên cứu này có thể hữu ích cho việc phát hiện ban đầu các phân lập giả định A. schubertii trong số các bộ sưu tập vi khuẩn được phân lập từ các trang trại nuôi tôm. Để xác nhận thêm, những vi khuẩn được thử nghiệm dương tính đó phải được giải trình tự 16S rRNA hoặc MLSA (sử dụng kết hợp 16S rRNA và hai gen giữ nhà gyrB và rpoD).
Tóm lại, nghiên cứu này đã báo cáo một A. schubertii gây bệnh mới, được phân lập từ một ao nuôi tôm bị ảnh hưởng bởi AHPND nuôi ở độ mặn tương đối thấp. Phân lập này gây chết tôm và gây tổn thương gan tụy nghiêm trọng. PCR đặc hiệu sau đó đã được phát triển để hỗ trợ sàng lọc nhanh mầm bệnh này. Cần theo dõi liên tục vì vi khuẩn gây bệnh này có thể gây nguy cơ tiềm ẩn cho các khu vực nuôi tôm có độ mặn thấp.
Theo Pattiya Sangpo, Siripong Thitamadee, Ha Thanh Dong, Saengchan Senapin.
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
Nguồn: https://www.sciencedirect.com/science/article/abs/pii/S0882401020308676
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Bổ Sung Chiết Xuất Cà Tím Lông (Solanum ferox) Và Gừng Đắng (Zingiber zerumbet) Làm Tác Nhân Sinh Học Thực Vật Trên Tôm Thẻ Chân Trắng (Litopenaeus vannamei)
- Ảnh Hưởng Của 3 Loại Phân Hữu Cơ Lỏng Kết Hợp Với Lá Mắm Ổi Avicennia marina Đến Sinh Trưởng Và Tỷ Lệ Sống Của Tôm Sú (Penaeus monodon)
- Nuôi Tôm Siêu Thâm Canh: Phân Tích Và Những Thách Thức Trong Tương Lai

 English
English 中文 (中国)
中文 (中国)