Tóm tắt
Quorum sensing là quá trình giao tiếp giữa tế bào với tế bào của vi khuẩn với các phân tử tín hiệu nhỏ như lactone acyl-homoserine để điều chỉnh độc lực của nhiều vi khuẩn gây bệnh. Do đó, phương pháp can thiệp vào quorum sensing hiện đang được nghiên cứu như một chiến lược kiểm soát sinh học mới để chống lại các bệnh nhiễm trùng do vi khuẩn. Trong nghiên cứu này, tác động của 19 chủng vi tảo đối với kiểu hình của ba chủng vi khuẩn bởi tín hiệu lactone acyl-homoserine báo cáo đã được nghiên cứu. Hai chủng vi tảo nước ngọt ức chế sản xuất violacein của chủng báo cáo Quorum sensing Chromobacterium violaceum CV026. Các thử nghiệm tiếp theo sử dụng Escherichia coli JB523 cho thấy chiết xuất vi tảo ức chế hoặc kích thích Quorum sensing, tùy thuộc vào chủng tảo. 1 loại tảo nước ngọt và 5 loại tảo biển cho thấy hoạt động ức chế Quorum sensing, trong khi 2 loại tảo kích thích biểu hiện gen bởi tín hiệu Quorum sensing. Các chủng vi tảo cho thấy hoạt động ức chế trong các xét nghiệm trước đó cũng ức chế sự phát quang sinh học bởi tính hiệu lactone acylhomoserine ở tác nhân gây bệnh Vibrio harveyi trong nuôi trồng thủy sản. Sự phát triển của tất cả các chủng báo cáo được phát hiện là không bị ảnh hưởng bởi các mẫu vi tảo. Chủng vi tảo có triển vọng nhất được phát hiện là Chlorella saccharophila CCAP211/48, vì chiết xuất của nó ức chế biểu hiện gen bởi tín hiệu Quorum sensing ở cả ba chủng báo cáo.
1. Giới thiệu
Vi khuẩn và vi tảo cùng tồn tại trong hệ sinh thái thủy sinh mặc dù chúng rất khác biệt về mặt tiến hóa, các nghiên cứu đã chỉ ra rằng có một số tương tác xảy ra giữa chúng. Một loại tương tác là thông qua việc can thiệp vào Quorum sensing (QS) — giao tiếp giữa tế bào với tế bào của vi khuẩn thông qua việc sản xuất, giải phóng và phát hiện các phân tử tín hiệu nhỏ (Fuqua và cộng sự, 2001; Jayaraman và Wood, 2008; Waters và Bassler, 2005). Các loại phân tử tín hiệu khác nhau được tạo ra bởi vi khuẩn, với acyl homoserine lactone (AHL) là tín hiệu QS được nghiên cứu nhiều nhất cho đến nay (Boyer và Wisniewski-Dyé, 2009). Sử dụng hệ thống giao tiếp giữa tế bào với tế bào này, vi khuẩn điều chỉnh biểu hiện gen quan trọng cho sự sống, sự phát triển, và khả năng gây bệnh (De Kievit và Iglewski, 2000; Williams và cộng sự, 2000). Khả năng can thiệp vào QS tạo nên một chiến lược kiểm soát sinh học mới vì có mối liên hệ giữa QS và quá trình sinh bệnh của nhiều tác nhân gây bệnh vi khuẩn quan trọng (Donabedian, 2003; Finch và cộng sự, 1998).
Sự can thiệp QS đã được chứng minh là xảy ra giữa tảo và màng sinh học (biofilm) vi khuẩn (được Joint và cộng sự, 2007; Rivas và cộng sự, 2010 đánh giá). Ngoài ra, tảo biển cũng được phát hiện có khả năng phá vỡ QS (được Dobretsov và cộng sự, 2009 và Natrah và cộng sự, 2011 đánh giá). Tảo biển Delisea pulchra đã được nghiên cứu rộng rãi về khả năng ức chế quá trình xâm chiếm của vi khuẩn thông qua việc giải phóng furanone halogen (Dworjanyn và Steinberg, 1999; Givskov và cộng sự, 1996; Rasmussen và Givskov, 2006). Ba chất đối kháng AHL mới cũng đã được phát hiện từ tảo đỏ Ahnfeltiopsis flabelliformis (Kim và cộng sự, 2007). Các hỗn hợp hợp chất được phân lập từ tảo này ức chế tín hiệu Quorum sensing bởi AHL theo cách phụ thuộc vào liều lượng (Liu và cộng sự, 2008). Trong khi đó, hoạt động can thiệp QS nhỏ đã được phát hiện trong tảo thuộc họ Caulerpaceae, Rhodomelaceae và Galaxauraceae (Skindersoe và cộng sự, 2008). Gần đây, việc sản xuất các chất chuyển hóa ức chế QS cũng đã được báo cáo ở các vi khuẩn biển khác nhau (Dobretsov và cộng sự, 2010; Kanagasabhapathy và cộng sự, 2009; Teasdale và cộng sự, 2010). Trái ngược với tảo lớn và vi khuẩn biển, có ít thông tin về tác dụng của các chất chuyển hóa thứ cấp do vi tảo tạo ra đối với QS của vi khuẩn. Chlamydomonas reinhardtii là loại vi tảo duy nhất được báo cáo cho đến nay là sản xuất ra các hợp chất can thiệp QS (Rajamani và cộng sự, 2008; Teplitski và cộng sự, 2004).
Vì Quorum sensing đã được chứng minh là có thể điều chỉnh độc lực của nhiều tác nhân gây bệnh trong nuôi trồng thủy sản (Natrah và cộng sự, 2011), nên sự can thiệp Quorum sensing của vi tảo có thể mang lại những cơ hội để phòng ngừa bệnh do vi khuẩn trong nuôi trồng thủy sản. Do đó, nghiên cứu này đã đánh giá tác động của các chủng vi tảo khác nhau thường được sử dụng trong nuôi trồng thủy sản đối với biểu hiện gen do tín hiệu QS điều chỉnh. Khả năng can thiệp vào tín hiệu QS AHL đã được nghiên cứu bằng cách sử dụng các chủng vi khuẩn báo cáo khác nhau, bao gồm cả tác nhân gây bệnh Vibrio harveyi trong nuôi trồng thủy sản.
2. Vật liệu và phương pháp
2.1. Thuốc thử
N-Hexanoyl-L-homoserine lactone (HHL) và N-(3-oxohexanoyl)-Lhomoserine lactone (OHHL) được mua từ Sigma-Aldrich (Bornem, Bỉ). Tất cả thuốc thử được pha loãng bằng nước cất hoặc ethanol và pha loãng thêm bằng môi trường tảo. Tất cả các dung dịch gốc được giữ ở nhiệt độ −20°C. Các dung dịch chứa AHL được đệm ở pH 6,5 bằng cách thêm axit 3-(N-morpholino)-propanesulfonic) (MOPS, Sigma).
2.2. Điều kiện sinh trưởng của vi tảo
Các chủng vi tảo axenic được lấy từ Bộ sưu tập nuôi cấy tảo và động vật nguyên sinh (CCAP, Phòng thí nghiệm biển Dunstaffnage, Scotland), Bộ sưu tập nuôi cấy của Đại học tảo Göttingen (SAG, Đức), Trung tâm quốc gia Provasoli-Guillard về nuôi cấy thực vật phù du biển (CCMP, Hoa Kỳ). Phaeodactylum tricornutum PT18.6 là quà tặng của Tiến sĩ W. Vyverman (Khoa Sinh học hệ thống thực vật, Đại học Ghent). Tất cả các chủng được sử dụng trong nghiên cứu này đều được liệt kê trong Bảng 1.
Vi tảo nước ngọt được nuôi trong Bold’s basal medium (BBM) và các chủng biển trong Guillard’s F2 medium. Tất cả các loại tảo đều được nuôi cấy bằng chai Schott 250 ml vô trùng, được cung cấp sục khí lọc 0,22 μm. Tất cả các thông số nuôi cấy tảo đều được giữ không đổi (pH 7, ánh sáng liên tục 100 μmol photon/ m2/ s, nhiệt độ 24°C và độ mặn 30 g/ l đối với spp biển). Mật độ nuôi cấy được đo bằng máy đếm tế bào máu Bürker và máy quang phổ (Thermo Spectronic) ở OD550 nm. Tảo từ ba nền nuôi cấy độc lập được thu hoạch ở pha mũ muộn và pha tĩnh muộn bằng máy ly tâm (5000 vòng/phút trong 5 phút). Dịch nổi của các nền nuôi cấy tảo được thu thập và bảo quản ở -20°C trong các thùng chứa vô trùng. Các thử nghiệm Axenity được thực hiện bằng cách cấy dịch nổi trên thạch biển, thạch luria bertani (thử nghiệm nhiễm khuẩn) và thạch khoai tây dextrose (thử nghiệm nhiễm nấm). Các mẫu cũng được kiểm tra thường quy bằng kính hiển vi ở độ phóng đại 1000 lần với ngâm dầu, ngay trước khi thu hoạch.
Bảng 1 Danh sách các chủng tảo được sử dụng trong nghiên cứu này.
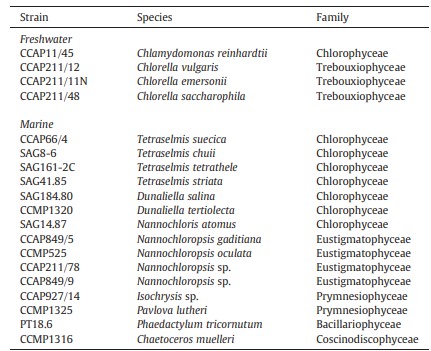
CCAP, Bộ sưu tập nuôi cấy tảo và động vật nguyên sinh Phòng thí nghiệm biển Dunstaffnage (Scotland, Vương quốc Anh); SAG, Bộ sưu tập nuôi cấy tảo của Đại học Göttingen (Đức); CCMP, Trung tâm quốc gia Provasoli-Guillard về nuôi cấy thực vật phù du biển (Hoa Kỳ).
2.3. Chuẩn bị chiết xuất từ dịch nổi của tảo
Các chiết xuất cho hoạt động can thiệp QS được chuẩn bị theo Teplitski và cộng sự (2004) với các sửa đổi. 10mL dịch nổi của tảo không có tế bào được trộn với etyl axetat với thể tích bằng nhau. Các mẫu được lắc kỹ và được ly tâm ở tốc độ 3000 vòng/phút trong 10 phút. Các phân đoạn etyl axetat được thu thập và bước chiết xuất được lặp lại hai lần. Sau đó, các mẫu được cô quay dưới áp suất giảm ở nhiệt độ nước 30°C và được hòa tan lại trong 100 μl acetonitril 100% và pha loãng với 300 μl nước cất. Tất cả các mẫu được giữ ở nhiệt độ −20°C trong các chai đựng mẫu thủy tinh cho đến lần sử dụng tiếp theo.
2.4. Phát hiện hoạt động can thiệp vào Quorum sensing
2.4.1. Xét nghiệm đĩa thạch violacein Chromobacterium violaceum CV026
C. violaceum CV026 là một đột biến mini-Tn5 của chủng hoang dã ATCC 31532 bị thiếu CviI (AHL synthase) và tạo ra sắc tố màu tím violacein khi có AHL ngoại sinh (McClean và cộng sự, 1997). Chất báo cáo nhạy cảm nhất với HHL. 20mL thạch Luria-Bertani (2 g/L MOPS) (pH 6,5) được trộn với HHL để tạo ra nồng độ cuối cùng là 10 μg/L. Sau đó, thạch đông lại được phủ 100 μl C. violaceum CV026 (nuôi bằng kanamycin ở nồng độ 20 mg/L). 10 μl chiết xuất pha loãng bốn lần với nước cất được chấm trên các đĩa. Chiết xuất từ môi trường nuôi cấy tảo tươi được sử dụng làm đối chứng âm tính. Các đĩa được ủ trong 24 giờ ở 27°C và sự ức chế sản xuất violacein do QS điều chỉnh được kiểm tra vào ngày hôm sau. Sự kích thích sản xuất violacein được thử nghiệm tương tự, không thêm HHL vào các đĩa.
2.4.2. Xét nghiệm vi đĩa protein huỳnh quang xanh (GFP) Escherichia coli JB523
E. coli JB523 là một chủng báo cáo có độ nhạy cao và chứa plasmid pJBA130 mã hóa protein huỳnh quang xanh ổn định (GFP) trong phản ứng của AHL ngoại sinh (Andersen và cộng sự, 2001). Chủng này nhạy cảm nhất với OHHL. Chủng JB523 được nuôi qua đêm ở môi trường LB đệm 28°C bổ sung 20 mg/L tetracycline cho đến khi mật độ quang đạt khoảng 1 ở 550 nm. Sau đó, vi khuẩn được pha loãng đến OD600 là 0,1 và được trộn với các tiêu chuẩn OHHL hoặc chiết xuất tảo (pha loãng sáu lần với nước cất). Chiết xuất từ môi trường phát triển tảo tươi được sử dụng làm đối chứng âm tính. Đĩa được ủ ở 28°C trong 16 giờ. Sau đó, sản xuất GFP do QS điều chỉnh được đánh giá bằng các phép đo huỳnh quang (kích thích 475 nm và phát xạ 515 nm) bằng cách sử dụng đầu đọc đa năng Tecan. Huỳnh quang được chuẩn hóa theo mật độ tế bào của chủng báo cáo (OD550). Tỷ lệ phần trăm ức chế sản xuất GFP do QS điều chỉnh được tính toán so với môi trường kiểm soát tương ứng.
2.4.3. Xét nghiệm phát quang sinh học được điều chỉnh bởi AHL của V. harveyi
Độ phát quang do QS điều chỉnh ở V. harveyi được đo theo Henke và Bassler (2004) với một số sửa đổi nhỏ. V. harveyi JMH612 LÀ một đột biến kép thụ thể tín hiệu của chủng BB120, chỉ tạo ra độ phát quang để đáp ứng với HAI-1 (Henke và Bassler, 2004), được sử dụng làm chất báo cáo. Chất báo cáo được nuôi qua đêm trong môi trường nuôi cấy tảo biển (Difco) ở 28°C với chế độ lắc (100 vòng/phút) cho đến khi OD550 = 1. Sau đó, dịch được pha loãng với môi trường nuôi cấy tảo biển tươi (1:1000) và nuôi cấy lại trong sáu giờ nữa cho đến khi độ phát quang đạt cực đại. Sau đó, chất báo cáo được trộn với chiết xuất tảo pha loãng 10 lần (1:1) và cấy ba lần vào các đĩa vi mô màu đen. Độ phát quang được đọc sau mỗi 30 phút trong 2 giờ. Chiết xuất từ môi trường tảo tươi được sử dụng làm đối chứng âm tính. Sự tăng trưởng được đo bằng cách chuyển từng mẫu sang một tấm vi mô trong suốt, tại đó mẫu được đọc ở bước sóng 550 nm bằng máy đọc đa năng Tecan. Độ phát quang được chuẩn hóa theo mật độ tế bào của chủng báo cáo và phần trăm ức chế độ phát quang do QS điều chỉnh được tính toán so với môi trường kiểm soát tương ứng. Chúng tôi cũng đã thử nghiệm tác dụng của các chất chiết xuất đối với sự phát quang sinh học do AI-2 và CAI-1 điều chỉnh bằng cách sử dụng các đột biến kép thụ thể JMH597 và JAF375 (Defoirdt và cộng sự, 2008).
2.5. Phân tích thống kê
Dữ liệu thu thập được từ ba bộ tảo độc lập (n = 3). Sự khác biệt đáng kể giữa môi trường kiểm soát và các mẫu riêng lẻ được phân tích bằng kiểm định Student’s t-test mẫu độc lập. Dữ liệu không phân phối chuẩn được chuyển đổi để đáp ứng điều kiện đồng nhất về phương sai. Dữ liệu không đáp ứng kiểm định tham số được phân tích bằng kiểm định Mann–Whitney. Phân tích thống kê được thực hiện bằng Gói thống kê cho Khoa học xã hội (SPSS), phiên bản 13.0.
3. Kết quả
Chủng báo cáo C. violaceum CV026 cho thấy sản xuất violacein rõ ràng trên các đĩa thạch chứa 10 μg/L HHL. Sự ức chế rõ ràng của sản xuất violacein đã được quan sát thấy trên các đĩa mà chiết xuất của tảo nước ngọt C. saccharophila CCAP211/48 và C. vulgaris CCAP211/12 được chấm (Bảng 2). Hơn nữa, các vùng ức chế mờ đục, cho thấy sự phát triển của chủng báo cáo không bị ảnh hưởng. Do đó, việc thiếu sắc tố màu tím không phải do hoạt động kìm khuẩn của các chiết xuất đối với chủng báo cáo. Xét nghiệm đã được sửa đổi một chút để xem liệu tảo có tạo ra bất kỳ chất chuyển hóa nào có thể kích thích sản xuất violacein do tín hiệu QS trong CV026 hay không. Trong xét nghiệm này, mỗi chiết xuất tảo được chấm vào CV026 sau đó nuôi trên các đĩa mà không bổ sung HHL. Không có mẫu nào cho thấy kích thích sản xuất violacein (dữ liệu không được hiển thị). Việc không sản xuất violacein cho thấy tảo không sản xuất chất chủ vận hoặc nồng độ quá thấp để có thể phát hiện trong xét nghiệm.
Bảng 2 Ức chế sản xuất violacein do tín hiệu Quorum sensing ở Chromobacterium violaceum CV026 khi có mặt N-hexanoylhomoserine lactone bằng chiết xuất từ các nền nuôi cấy pha mũ và pha tĩnh của các loại vi tảo khác nhau.
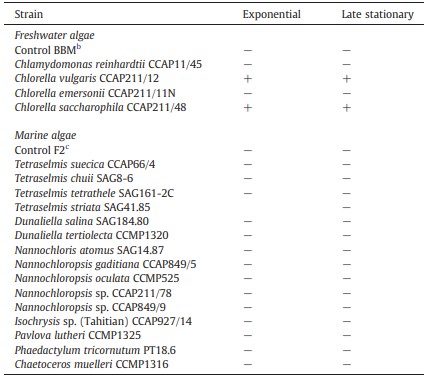
a + biểu thị sự ức chế; − biểu thị không có sự ức chế.
b Môi trường tảo nước ngọt Bold’s Basal.
c Môi trường tảo biển F2.
Sự ức chế sản xuất GFP do tín hiệu AHL ở E. coli JB523 đã được quan sát thấy ở 1 loài tảo nước ngọt và 5 loài tảo biển, trong khi 1 loài tảo nước ngọt và 1 loài tảo biển kích thích sản xuất GFP (Bảng 3). Sản xuất GFP do tín hiệu QS đã giảm đáng kể trong chiết xuất của C. saccharophila CCAP211/48 từ giai đoạn tăng trưởng theo cấp số nhân muộn. Trong khi đó, 1 loài tảo nước ngọt khác là C. reinhardtii CCAP11/45 đã kích thích sản xuất GFP do tín hiệu QS ở giai đoạn tăng trưởng theo cấp số nhân muộn. Không có sự khác biệt nào về hoạt động GFP được quan sát thấy đối với cả hai loài trong các chiết xuất được lấy ở giai đoạn ổn định muộn. 5 loài tảo biển là Nannochloropsis CCAP849/9, Isochrysis sp. CCAP927/14, Tetraselmis suecica CCAP66/4, T. striata SAG41.85 và T. tetrathele SAG161-2C cũng ức chế đáng kể quá trình sản xuất GFP do tín hiệu QS (Bảng 3). Điều quan trọng là không có chiết xuất tảo nào ức chế sự phát triển của các chủng báo cáo. Trên thực tế, tất cả các chiết xuất Tetraselmis đều được phát hiện kích thích sự phát triển của chủng báo cáo JB523 (dữ liệu không được hiển thị).
Bảng 3 Sản xuất tín hiệu Quorum sensing GFP bởi Escherichia coli JB523 khi có 1 μg/L N-(3-oxohexanoyl)-L-homoserine lactone,và có hoặc không có chiết xuất vi tảo được thu thập ở pha mũ hoặc pha tĩnh. Sản xuất GFP được xác định bằng cách đo huỳnh quang cụ thể. Chiết xuất từ môi trường tảo tươi được sử dụng làm đối chứng; huỳnh quang cụ thể quan sát được đối với chiết xuất môi trường được đặt ở mức 100% và các giá trị khác được chuẩn hóa theo đó.
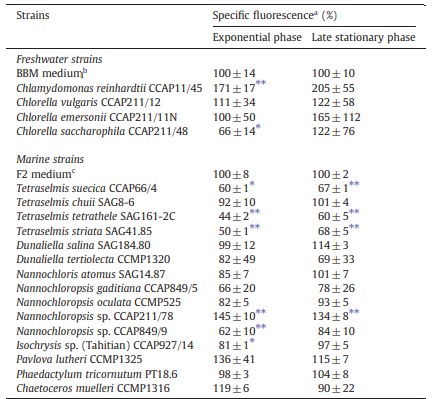
a Huỳnh quang GFP được hiệu chỉnh theo mật độ tế bào của chất báo cáo (Huỳnh quang/OD550nm). Kết quả được thể hiện dưới dạng trung bình ± độ lệch chuẩn thu được đối với chiết xuất của ba nền nuôi cấy tảo độc lập.
b Môi trường tảo nước ngọt Bold’s Basal.
c Môi trường tảo biển F2. fluo, huỳnh quang; abs, độ hấp thụ.
⁎ Khác biệt đáng kể so với môi trường đối chứng ở p<0,05.
⁎⁎ Khác biệt đáng kể so với môi trường đối chứng ở p < 0,01.
Để nghiên cứu sự can thiệp với AHL của Vibrio harevyi (Harveyi Autoinducer 1; HAI-1), chúng tôi đã sử dụng đột biến kép thụ thể AI-2 và CAI-1 JMH612, trong đó phát quang sinh học do tín hiệu Quorum sensing AHL. Vi tảo thể hiện hoạt động ức chế ở một trong những chất báo cáo trước đó đã được chọn cho xét nghiệm này. Chlorella saccharophila CCAP211/48 liên tục ức chế (p<0,05) sự phát quang do tín hiệu AHL ở V. harveyi trong hai giờ ủ (Bảng 4). Một số chủng vi tảo khác cũng cho thấy hoạt động ức chế. Tuy nhiên, trong những trường hợp này, sự ức chế không đáng kể hoặc chỉ giới hạn ở giai đoạn đầu của quá trình ủ. Không có loài tảo nào ảnh hưởng đến sự phát quang ở các đột biến kép thụ thể JMH597 và JAF375, trong đó sự phát quang sinh học được điều chỉnh bởi các phân tử tín hiệu AI-2 và CAI-1. Điều này cho thấy sự ức chế phát quang sinh học ở chủng báo cáo AHL JMH612 là do sự can thiệp vào tín hiệu AHL chứ không phải do sự can thiệp vào quá trình sinh hóa phát quang sinh học.
Bảng 4 Sự phát quang sinh học được điều chỉnh bằng Quorum sensing của Vibrio harveyi JMH612 (cảm biến HAI-1+, cảm biến AI-2–, cảm biến CAI-1–), có và không có chiết xuất tảo. Chiết xuất từ môi trường tảo tươi được sử dụng làm đối chứng; mức độ phát quang sinh học được quan sát thấy đối với chiết xuất môi trường được đặt ở mức 100% và các giá trị khác được chuẩn hóa theo đó.
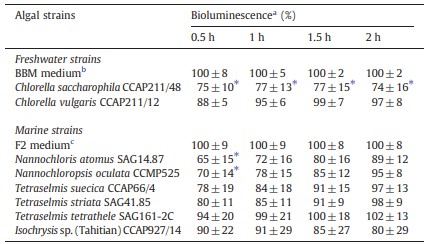
a Kết quả được thể hiện dưới dạng trung bình ± độ lệch chuẩn thu được từ chiết xuất của ba nền nuôi cấy tảo độc lập.
b Môi trường tảo nước ngọt Bold’s Basal.
c Môi trường tảo biển F2.
⁎ Khác biệt đáng kể so với môi trường đối chứng (p < 0,05).
4. Thảo luận
Trong nghiên cứu này, chúng tôi đã thực hiện sàng lọc đầu tiên về sự can thiệp của Quorum sensing bằng vi tảo, tập trung vào các loài thường được sử dụng trong nuôi trồng thủy sản. Khả năng can thiệp vào QS AHL đã được nghiên cứu bằng cách sử dụng các chủng vi khuẩn báo cáo khác nhau, bao gồm cả tác nhân gây bệnh nuôi trồng thủy sản V. harveyi. Một sàng lọc sơ bộ cho thấy 2 trong số 19 loại tảo, C. saccharophila CCAP211/48 và C. vulgaris CCAP211/12, đã ức chế sản xuất sắc tố do tín hiệu AHL ở chủng báo cáo C. violaceum CV026. Một chủng báo cáo thứ hai là E. coli JB523 đã được sử dụng để đo đinh lượng các hiệu ứng can thiệp của QS. S ản xuất GFP do tín hiệu QS điều chỉnh đã giảm đáng kể trong chiết xuất của tảo biển Nannochloropsis CCAP849/9, Isochrysis sp. CCAP927/14, T. suecica CCAP66/4, T. striata SAG41.85 và T. tetrathele SAG161-2 C và tảo nước ngọt C. saccharophila CCAP211/48. Trong khi đó, một loài tảo nước ngọt khác là C. reinhardtii CCAP11/45 kích thích sản xuất GFP do tín hiệu QS. Trái ngược với kết quả của chúng tôi, Teplitski và cộng sự (2004) phát hiện ra rằng các phân đoạn khác nhau của dịch lọc nuôi cấy chủng C. reinhardtii 2137 được lấy ở pha mũ kích thích các chất báo cáo dựa trên LasR và CepR nhưng không kích thích chất báo cáo dựa trên LuxR. Điều này cho thấy rằng hoạt động can thiệp QS có thể đặc hiệu theo chủng hơn là đặc hiệu theo loài và các chủng C. reinhardtii khác nhau có thể tạo ra các chất chuyển hóa can thiệp QS khác nhau. Trước đây, sản xuất các chất chuyển hóa thứ cấp của vi tảo là phụ thuộc vào chủng chứ không phải loài. Ví dụ, sản xuất saxitoxin của vi tảo ‘thủy triều đỏ’ Alexandrium spp. chỉ giới hạn ở một số chủng nhất định (Shimizu, 1996). Thật không may, chúng tôi không thể nghiên cứu tác động của chủng C.reinhardtii 2137 trong thiết lập thử nghiệm của mình vì nó phát triển rất kém trong môi trường được sử dụng trong nghiên cứu của chúng tôi.
Vi tảo cho thấy hoạt động ức chế ở một trong những chất báo cáo trước đó đã được nghiên cứu về khả năng ức chế phát quang sinh học do AHL điều chỉnh ở mầm bệnh nuôi trồng thủy sản V. harveyi. C. saccharophila CCAP211/48 liên tục ức chế phát quang do tín hiệu AHL ở V. harveyi trong hai giờ ủ. Một số vi tảo khác cũng cho thấy hoạt động ức chế. Tuy nhiên, đối với các chủng này, sự ức chế không đáng kể hoặc chỉ giới hạn ở giai đoạn đầu của quá trình ủ. Hoạt động ức chế C. saccharophila CCAP211/48 ổn định trong xét nghiệm V. harveyi chỉ ra rằng tảo này có thể tạo ra một hoặc nhiều chất chuyển hóa có hoạt tính đối kháng. Các hợp chất đối kháng QS đã được báo cáo trước đây ở tảo lớn, chẳng hạn như D. pulchra và A. flabelliformis. Các hợp chất do các tảo lớn này tạo ra được xác định là furanone halogen hóa (Manefield và cộng sự, 2002) và hỗn hợp betonicine, floridoside và axit isethionic (Liu và cộng sự, 2008). Ngược lại, không có chất chuyển hóa đối kháng QS nào được báo cáo trước đây ở vi tảo. Hoạt tính ức chế QS giảm theo thời gian trong xét nghiệm V. harveyi của các vi tảo khác (chẳng hạn như Nannochloris atomus SAG14.87 và Nannochloropsis oculata CCMP525) cho thấy sự ức chế QS ở các chủng này là do sản xuất các hợp chất phản ứng. Thật vậy, phản ứng giữa các phân tử tín hiệu và các hợp chất phản ứng sẽ làm bất hoạt cả các tín hiệu và các hợp chất phản ứng. Do đó, trong trường hợp như vậy, mức độ của các hợp chất phản ứng giảm dần theo thời gian, trong khi chủng báo cáo V. harveyi liên tục tạo ra các phân tử tín hiệu trong quá trình thử nghiệm (Henke và Bassler, 2004). Đây không phải là trường hợp của chủng báo cáo JB523 (Andersen và cộng sự, 2001), điều này có thể giải thích sự khác biệt giữa thử nghiệm JB523 và thử nghiệm V. harveyi. Tảo lớn đã được chứng minh trước đây là tạo ra các hợp chất phản ứng không ổn định gây trở ngại cho QS. Ví dụ, Laminaria digitata tạo ra các hợp chất halogen bị oxy hóa có thể làm bất hoạt các phân tử AHL (Borchardt và cộng sự, 2001).
Tóm lại, chúng tôi thấy rằng các loại vi tảo khác nhau can thiệp vào quá trình Quorum sensing AHL ở vi khuẩn Gram âm. Vì quá trình Quorum sensing điều chỉnh độc lực của các tác nhân gây bệnh nuôi trồng thủy sản khác nhau, nên các loại vi tảo có khả năng can thiệp vào quá trình Quorum sensing có thể là tác nhân kiểm soát sinh học thú vị để sử dụng trong nuôi trồng thủy sản. Chủng thú vị nhất trong nghiên cứu của chúng tôi có vẻ là C. saccharophila CCAP211/48, vì nó ức chế biểu hiện gen được điều chỉnh bởi quá trình Quorum sensing ở cả ba chủng báo cáo (sử dụng cả AHL không thay thế, thay thế oxo và thay thế hydroxyl), bao gồm cả tác nhân gây bệnh nuôi trồng thủy sản V. harveyi.
Theo F.M.I. Natrah, Mireille Mardel Kenmegne, Wiyoto Wiyoto, Patrick Sorgeloos, Peter Bossier, Tom Defoirdt
Nguồn: https://www.wellesu.com/10.1016/j.aquaculture.2011.04.038
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phần 1: Hiệu suất của ấu trùng tôm sú gia hóa (Penaeus monodon) và cua bùn (Scylla paramamosain) trong ao nuôi tôm lúa quảng canh
- Phần 2: Hiệu suất của ấu trùng tôm sú gia hóa (Penaeus monodon) và cua bùn (Scylla paramamosain) trong ao nuôi tôm lúa quảng canh
- Ảnh hưởng của chiết xuất vi tảo đến phản ứng miễn dịch và sức đề kháng ở tôm thẻ chân trắng

 English
English 中文 (中国)
中文 (中国)