Tóm tắt
Vannamei là mặt hàng nuôi trồng thủy sản chủ lực ở Indonesia. Tuy nhiên, mục tiêu sản lượng 450.000 tấn chỉ đạt 91,5% do dịch bệnh bùng phát. Việc sử dụng chế phẩm sinh học thay thế kháng sinh được xem là giải pháp hiệu quả. Hiệu quả của việc áp dụng chế phẩm sinh học để kiểm soát vi sinh vật gây bệnh bị ảnh hưởng nhiều bởi loại vi khuẩn được sử dụng. Nghiên cứu này được thực hiện để so sánh hiệu quả của hai loại chế phẩm sinh học (A và B) với thành phần vi khuẩn khác nhau đối với năng suất tôm thẻ chân trắng. Nghiên cứu sử dụng ao rộng 2.200 m2 được che chắn bằng bạt LDPE. Mật độ thả giống là 250 con/m2. Tôm thẻ chân trắng được cho ăn thức ăn nhân tạo chứa protein từ 30-40%, chất béo 5%, chất xơ 4% và hàm lượng nước 11% trong quá trình nuôi. Để chuẩn bị và duy trì việc quản lý nước, chế phẩm sinh học A và B đã được áp dụng. Kết quả cho thấy việc sử dụng men vi sinh loại B đạt năng suất tốt hơn loại A.
Giới thiệu
Tôm thẻ chân trắng (Litopenaeus vannamei) là mặt hàng kinh tế thiết yếu vì tốc độ tăng trưởng nhanh, tỷ lệ sống cao, sức đề kháng tốt và được nuôi rộng rãi trên toàn thế giới (Santanumurti et al., 2019). Tại Indonesia, tôm thẻ chân trắng đóng góp 40% sản lượng thủy sản (Hadie & Hadie, 2017).
Các hoạt động nuôi tôm thâm canh và siêu thâm canh sử dụng mật độ và thức ăn cao làm tăng dư lượng thức ăn và phân tôm, làm giảm chất lượng nước, chẳng hạn như tăng chất hữu cơ và các sinh vật amoniac gây bệnh. Chất lượng môi trường khiến tôm bị căng thẳng và dễ mắc bệnh. Một loại bệnh thường tấn công tôm là Vibriosis, do vi khuẩn thuộc chi Vibrio gây ra. Tôm thẻ chân trắng bị bệnh này tấn công có thể gây tỷ lệ chết lên tới 100% (Satyantini et al., 2019).
Việc sử dụng chế phẩm sinh học như một ứng dụng giúp cải thiện tình trạng sức khỏe tôm thẻ chân trắng là lựa chọn tốt hơn so với việc sử dụng kháng sinh để điều trị. Ngoài ra, kháng sinh có thể có tác dụng kháng thuốc trên tôm thẻ chân trắng (Rume và cộng sự, 2012). Men vi sinh bảo vệ tôm chân trắng bằng cách tạo ra các hợp chất hóa học có tác dụng diệt khuẩn và kìm khuẩn chống lại các quần thể vi khuẩn khác.
Việc sử dụng chế phẩm sinh học để kiểm soát vi sinh vật gây bệnh chịu ảnh hưởng của vi khuẩn được sử dụng. Môi trường ảnh hưởng đến đời sống của vi khuẩn. Các quần thể vi khuẩn trong môi trường đòi hỏi dinh dưỡng và khả năng chịu đựng các thông số lý hóa khác nhau (Rume và cộng sự, 2012). Vi khuẩn men vi sinh thu được từ môi trường nuôi trồng thủy sản được kỳ vọng sẽ có những ưu điểm nhất định so với vi khuẩn men vi sinh phân lập từ các nguồn khác. Vi khuẩn men vi sinh thu được từ môi trường nuôi trồng thủy sản được đánh giá cao hơn do khả năng thích nghi và hoạt động hiệu quả trong môi trường ao nuôi (Muliani et al., 2008).
Trước đây PT Logigo Jaya Raya chưa áp dụng chế phẩm sinh học. Năng suất trung bình mỗi ao thấp (SR 46,5±2,5%, ABW 14±0,7g và sinh khối 3,486±98 kg). Sau một chu kỳ sử dụng Men vi sinh A, giá trị SR, ABW và sinh khối tăng lên. Nghiên cứu này so sánh chế phẩm sinh học A và B (được các nhà cung cấp khuyến nghị) và ảnh hưởng của chúng đến năng suất tôm thẻ chân trắng được nuôi tại PT. Loligo Jaya Raya, Sidoarjo.
Chuẩn bị nghiên cứu
Nghiên cứu này được thực hiện từ tháng 9 đến tháng 12 năm 2020 tại ao PT Loligo, Sidoarjo, Đông Java (tại ao 1,2,3,4). Các ao có diện tích 2.200 m2 (44x50x2 m3) được sử dụng được bảo vệ bằng bạt LDPE. Các nghiệm thức được thử nghiệm là sử dụng men vi sinh A và B (với các thành phần vi khuẩn và phương pháp sử dụng khác nhau) trên năng suất tôm thẻ chân trắng và được thực hiện theo tiêu chuẩn DOC 90.
Chuẩn bị ao nuôi
Các giai đoạn chuẩn bị ao là phơi khô ao, bón vôi, sửa lớp lót bạt và xây dựng ao. Chuẩn bị ao bao gồm làm sạch bụi bẩn và sinh vật phù du lắng xuống hoặc lọa bỏ rêu và sửa độ dốc về phía cống trung tâm. Dùng dolomite (CaMg (CO3)2) và vôi sống (CaO) với liều lượng 2 kg/ m2 và để yên trong 3 ngày.
Xử lý nước
Nước được bơm từ bể chứa về bể xử lý cho đến khi mực nước đạt 50 cm. Sau đó, việc xử lý được thực hiện với liều 60 mg/L chlorine và sau đó thêm nước đến mức 110 cm. Sau hai ngày, hàm lượng clo đã được kiểm tra. Sau khi nước trung tính, CaCO3 được thêm vào ở mức 50 mg/L. Ngày hôm sau bổ sung liên tục 1 mg/L men vi sinh A và B trong 3 ngày vào buổi sáng (lúc 07h00).
Mật độ thả
Tôm thẻ chân trắng được thả ở giai đoạn PL 11 được chứng nhận SPF (Specific Pathogen Free). Tôm được thả vào buổi sáng và được thích nghi với môi trường trước đó trong 30 phút. Mật độ thả là 250 con/ m2 (550.000 con/ ao).
Quản lý nguồn thức ăn
30 ngày đầu tiên cho ăn thức ăn viên dựa trên chương trình cho ăn mù, tại DOC 31 và đến DOC 90 dựa trên chương trình anco trong đó lưới lấy mẫu đã bắt được tôm. Thức ăn được sử dụng là thức ăn nhân tạo với ba loại: vụn mịn, vụn và viên. Thức ăn vụn mịn được sử dụng vào đầu giai đoạn nuôi cho đến DOC 30. Sau đó, DOC 29 được thay thế bằng thức ăn vụn. Để thích ứng, thức ăn được trộn trước, với thành phần thức ăn nghiền mịn và vụn ở DOC 29 (75% : 25%), DOC 30 (50% : 50%) và DOC 31 (25% : 75%) và DOC 32 (100% vỡ vụn). Sau DOC 30, bắt đầu lấy mẫu để theo dõi tốc độ tăng trưởng của tôm. Dựa vào kết quả lấy mẫu, ước tính sinh khối tôm trong các ao nuôi để có thể tính toán nhu cầu thức ăn tiếp theo thông qua giá trị xác định FR của chương trình cho ăn. Sau khi thu hoạch, tính toán FCR (tỷ lệ chuyển đổi thức ăn) để đánh giá hiệu quả của thức ăn và chế phẩm sinh học.
Quản lý nước
Việc hút nước và thay nước nhằm mục đích loại bỏ thức ăn thừa và tôm hoặc sinh vật phù du lắng xuống đáy ao. Nước ao thải được thay thế bằng nước đã được khử trùng trong ao chứa. Hai loại vi khuẩn men vi sinh khác nhau, đó là men vi sinh A và men vi sinh B, đã cải thiện chất lượng nước. Ở ao 1 và 2, men vi sinh A được sử dụng, trong khi ở ao 3 và 4 là men vi sinh B. Việc sàng lọc men vi sinh A được thực hiện để xác định các loại vi khuẩn có trong đó để so sánh hiệu quả của nó với vi khuẩn có trong men vi sinh B. Men vi sinh A là một sản phẩm men vi sinh dạng lỏng có thể được tạt trực tiếp xuống nước. Men vi sinh B ở dạng lỏng và phải được lên men trước nhằm tăng số lượng vi khuẩn. Quy trình lên men men vi sinh B là cứ 1 lít men vi sinh B thêm vào 1 kg viên D0 và 1 kg mật đường. Sau khi hòa trộn các thành phần, thêm nước biển tới 100 lít và sục khí trong 24 giờ.
Men vi sinh A và B được áp dụng lúc 07:00 sáng. Men vi sinh A và B được áp dụng cứ sau 5 ngày. Nhưng tại DOC 75, chế phẩm sinh học được cung cấp hai ngày một lần với liều 2 mg/L cho đến thời điểm thu hoạch. Có thể thấy so sánh thành phần của men vi sinh A và B trong Bảng 1. Chất lượng nước được đo thường xuyên vào buổi sáng và buổi tối, bao gồm pH, độ mặn, nhiệt độ, DO, amoniac và nitrit.
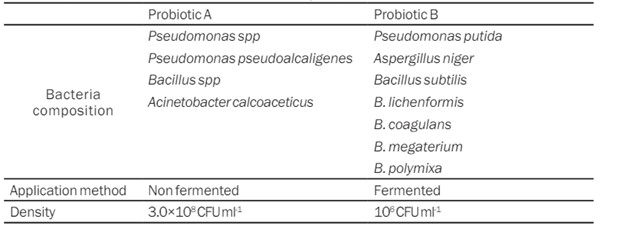
Bảng 1. Thành phần vi khuẩn, phương pháp ứng dụng và mật độ chế phẩm sinh học
Đo lường tăng trưởng
Sự tăng trưởng được thực hiện bằng cách lấy mẫu tại DOC 35 và sau đó cứ 7 ngày/ lần cho đến khi thu hoạch để xác định sự tăng trưởng và tình trạng của tôm. Lấy mẫu bằng lưới, tiến hành 10 ngày một lần vào buổi sáng. Dữ liệu được tính toán bao gồm ABW (Trọng lượng cơ thể trung bình), số lượng cá thể, sinh khối.
Thu hoạch và sau thu hoạch
Việc thu hoạch được thực hiện tại DOC 91 bằng lưới căng (như lưới kéo) và kéo hai bên để tôm gom về phía góc ao. Tôm được nâng lên bằng giỏ thu hoạch. Sau đó, tôm thẻ chân trắng được phân loại theo kích cỡ.
Kết quả và thảo luận
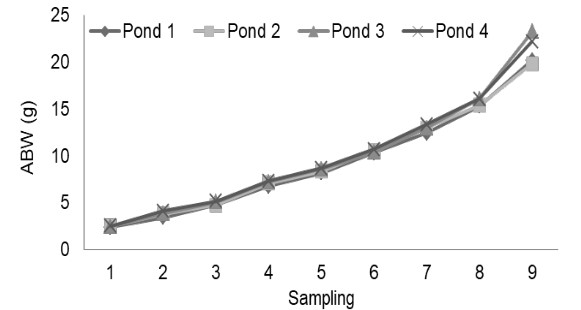
Việc lấy mẫu tôm để xác định giá trị Trọng lượng cơ thể trung bình (ABW) được thực hiện tại DOC 35, 42, 49, 56, 63, 70, 77 và 84. Trong khi tại DOC 91, các mẫu được đếm khi thu hoạch. Sau 7 lần lấy mẫu, giá trị ABW ở ao 1,2,3 và 4 gần bằng hoặc không có giá trị khác nhau. Ở đợt lấy mẫu thứ 8, tốc độ tăng trưởng của tôm chân trắng bắt đầu có sự khác biệt. Tại DOC 91, ABW ở ao 3 và 4 cao hơn ao 1 và 2. Chất hữu cơ sẽ tăng theo ngày nuôi tôm, chất hữu cơ này đến từ thức ăn còn lại và phần còn lại của quá trình trao đổi chất của sinh vật phù du. Khả năng sử dụng vi khuẩn thông qua chế phẩm sinh học đóng vai trò quan trọng trong việc xử lý chất hữu cơ trong ao nuôi. Khi lượng chất hữu cơ vượt quá khả năng xử lý của vi khuẩn, chất lượng nước sẽ xấu đi (Effendi, 2003).
Bảng 3 cho thấy giá trị amoniac và nitrit ở ao 1 và 2 cao hơn ở ao 3 và 4. Bảng 1 cho thấy thành phần vi khuẩn có trong hai chế phẩm sinh học A và B được thử nghiệm. Cả hai đều có số lượng Bacillus gần như nhau. Bacillus sp. là vi khuẩn chiếm ưu thế nhất trong cả hai sản phẩm men vi sinh. Điều này dựa trên một số đặc tính có lợi của Bacillus sp., cụ thể là khả năng sống và phát triển trong nhiều điều kiện môi trường, sản xuất enzyme với số lượng lớn, chống lại mầm bệnh bằng cách ức chế sự phát triển của chúng và có tính cạnh tranh. Bacillus sp. cũng có thành tế bào dày để sống lâu hơn, có khả năng chống mất nước và chịu được nhiệt độ lên tới 60°C (Decamp & David, 2005). B. subtilis sản sinh ra enzyme bacitracin. B. lichenformis, B. coagulans, B. megaterium, B. polimyxa sản xuất enzyme polymyxin. Soeka và cộng sự (2011) tuyên bố rằng Bacillus lichenformis có thể sản xuất một số enzyme ngoại bào: amylase, aminopeptidase, protease kim loại, lactam end-N-acetylglucosaminidase và lipase. Những vi khuẩn này cũng có khả năng chống lại môi trường kiềm.
Trong nuôi trồng thủy sản, hai yếu tố phải được xem xét để tạo nên quần thể vi sinh vật ổn định: yếu tố ngẫu nhiên và yếu tố quyết định (Rahayu, 2011). Yếu tố quyết định liên quan đến liều lượng và phản ứng do vi sinh vật gây ra, chẳng hạn như ảnh hưởng của nó đến chất lượng nước. Đồng thời, yếu tố ngẫu nhiên là cơ hội để vi sinh vật xâm nhập vào đúng thời điểm và môi trường sống. Men vi sinh A có mật độ 3,0×106 CFU/mL, trong khi Men vi sinh B có mật độ ít nhất là 106 CFU/mL. Trong vòng đời của chúng, vi khuẩn sinh sản vô tính bằng cách phân chia. Công việc của vi khuẩn mới được thể hiện ở sự khác biệt về thứ hạng của các đơn vị log. Mặc dù men vi sinh A và men vi sinh B có cùng cấp bậc log đơn vị, nhưng việc áp dụng men vi sinh B được lên men trước tiên, do đó, cấp bậc log đơn vị mật độ khuẩn lạc vi khuẩn tăng lên và men vi sinh B có mật độ cao hơn men vi sinh A. Men vi sinh A trong giai đoạn duy trì được sử dụng trong ba ngày và duy trì mỗi tuần một lần theo khuyến nghị sử dụng sản phẩm. Men vi sinh B trong giai đoạn chuẩn bị đầu tiên được sử dụng trong 13 ngày và sử dụng hàng ngày trong quá trình duy trì (ngẫu nhiên). Hai yếu tố này có nhiều khả năng ảnh hưởng nhất đến tác dụng có ảnh hưởng của men vi sinh ngoài các loài vi khuẩn ảnh hưởng đến chúng. Giá trị hiệu quả thức ăn cao cho thấy tôm phản ứng tốt hơn với thức ăn, do đó nó được biểu thị bằng sự tăng trưởng của tôm (Anwar et al., 2016).
Sự gia tăng ABW của tôm còn bị ảnh hưởng bởi CaMg(CO3)2 và CaO được áp dụng trong quá trình chuẩn bị và nuôi tôm. Dolomite và vôi sống không ảnh hưởng trực tiếp đến sự phát triển của tôm nhưng có thể đáp ứng nhu cầu canxi và khoáng chất khi lột xác và làm cứng vỏ khi lột xác. Quá trình phục hồi tôm lột xác càng nhanh thì tôm càng tăng trưởng vì sau khi lột xác, tôm sẽ thèm ăn để đáp ứng sự thèm ăn đã giảm trước khi lột xác (Yunus et al., 2020).
Bảng 2 cho thấy sự khác biệt về giá trị tỷ lệ sống ở các ao 1, 2, 3 và 4. Hệ số chuyển đổi thức ăn là một trong những thông số có thể đo lường hiệu quả của việc sử dụng thức ăn chăn nuôi tôm: FCR càng thấp thì việc sử dụng thức ăn càng hiệu quả. cho ăn. Ngược lại, FCR càng cao thì việc sử dụng thức ăn để tăng trọng lượng tôm nuôi càng lãng phí (Zainuddin và cộng sự, 2019).
Bảng 2. Năng suất ao nuôi với các giá trị chênh lệch.
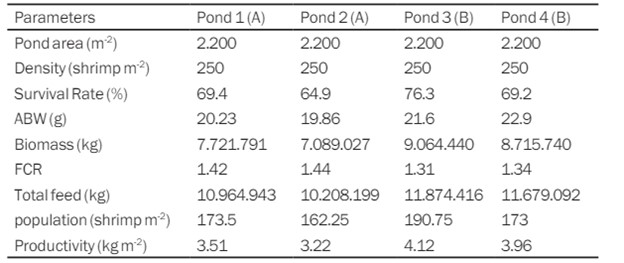
Sự hiện diện của vi sinh vật trong đường tiêu hóa của tôm thẻ chân trắng cho phép nó giúp tiêu hóa thức ăn đi vào cơ thể (Zainuddin và cộng sự, 2019). Novitasari (2017) cho rằng việc trộn thức ăn với vi khuẩn Bacillus sp. có thể làm tăng sự phát triển của tôm thẻ chân trắng. Bổ sung Bacillus sp. vào thức ăn với số lượng phù hợp có thể giảm FCR.
Việc bổ sung men vi sinh có thể làm giảm quần thể Vibrio sp. Nghiên cứu này cũng cho thấy kết quả tương tự. Soundarapandian et al. (2010) và Yudiati và cộng sự (2010) đã báo cáo rằng vi khuẩn men vi sinh có nguồn gốc từ nuôi tôm trong nước có tiềm năng và có thể ngăn chặn sự phát triển của vi khuẩn gây bệnh, bao gồm cả Vibrio sp. Vi khuẩn phân hủy amoniac Nitrosomonas eutrophic và Nitrobacter winogradsky và vi khuẩn phân hủy chất hữu cơ Paracoccus pantotrophus và Bacillus sp. được sử dụng đồng thời để tăng tỷ lệ sống thêm 6-7% nhưng không làm tăng tốc độ tăng trưởng của tôm thẻ chân trắng (L. vannamei). Cung cấp men vi sinh cũng có thể làm giảm tổng số lượng Vibrio và tổng số vi khuẩn.
Vi khuẩn Pseudomonas putida được sử dụng không mang lại tác dụng nhất quán và đáng kể đối với BOT, NO2-N, PO4-P và NH4-N, nhưng lại có tác dụng đáng kể đối với H2S vào cuối nghiên cứu về tăng tỷ lệ sống của tôm. Vi khuẩn men vi sinh có thể phát triển và ngăn chặn sự phát triển của Vibrio sp. cả trong đường tiêu hóa và môi trường nuôi tôm. Hơn nữa, đã có tuyên bố rằng việc sử dụng chế phẩm sinh học Bacillus và Pseudomonas với mật độ 108 tế bào/mL cho kết quả tốt nhất trong việc giảm tổng lượng Vibrio và tỷ lệ sống của tôm thẻ chân trắng so với chế phẩm sinh học Bacillus và Pseudomonas với mật độ 106 tế bào /mL (Satyantini và cộng sự, 2019).
Độ mặn trong ao bị ảnh hưởng bởi độ mặn của nguồn nước và độ bốc hơi. Độ mặn đóng vai trò trong quá trình điều hòa áp suất thẩm thấu và quá trình lột xác của tôm. Ở các ao 1,2,3 và 4, giá trị độ mặn là như nhau. Giá trị độ mặn thu được vẫn nằm trong mức phù hợp cho tôm phát triển (Arsad và cộng sự, 2017).
Giá trị pH trong quá trình bảo trì vẫn ở mức tối ưu từ 7,6 đến 8,2. Giá trị pH không nên dao động cao vì sẽ khiến tôm bị căng thẳng, giảm cảm giác thèm ăn và ảnh hưởng đến khả năng miễn dịch của tôm (Multazam & Hasanuddin, 2017). Giá trị pH nước thấp sẽ khiến tôm chết, trong khi độ pH nước cao có thể khiến tôm tăng trưởng chậm (Salam và cộng sự, 2019).
Mối quan hệ giữa oxy hòa tan và tôm là liên tục và ảnh hưởng lẫn nhau. Mức oxy hòa tan trong ao 1,2,3 và 4 đều ở mức tối ưu. Nồng độ oxy hòa tan dao động hàng ngày và theo mùa, ảnh hưởng đến hoạt động quang hợp và hô hấp của hệ sinh vật thủy sinh. Sự ổn định của giá trị oxy hòa tan trong nước cũng ảnh hưởng đến sự phát triển của tôm ở mật độ cao, cả từ nhu cầu của tôm và các vi sinh vật sống trong tôm. Các vi sinh vật được đề cập là vi khuẩn men vi sinh và sinh vật phù du (Effendi, 2003).
Nhiệt độ ở ao 1,2,3 và 4 ở mức tối ưu. Nhiệt độ tối ưu cho tôm dao động từ 26-34°C (Suwarsih và cộng sự, 2016). Nhiệt độ nước cao khiến oxy trong nước bốc hơi khiến ấu trùng tôm bị thiếu oxy. Nhiệt độ nước thấp sẽ khiến tôm thèm ăn (Adipu, 2019). Nếu nhiệt độ nước dưới 24°C, nên kiểm tra mức độ thèm ăn bằng cách sử dụng bộ điều khiển anco.
Nhiệt độ nước tăng thêm 10°C sẽ làm tăng mức tiêu thụ oxy của sinh vật dưới nước lên gấp 2-3 lần. Nhiệt độ tăng cũng sẽ kéo theo giá trị oxy hòa tan giảm khiến nó không thể đáp ứng nhu cầu oxy trong nước. Việc sục khí bằng bánh guồng được thực hiện liên tục để không xảy ra dao động nhiệt độ cao hơn (Effendi, 2003).
Men vi sinh được lên men trước sẽ làm tăng số lượng vi khuẩn riêng lẻ có trong đó để hoạt động của vi khuẩn sẽ hiệu quả hơn. Mật độ vi khuẩn trong men vi sinh B thấp hơn nhưng quá trình lên men được thực hiện có thể làm tăng sản lượng vi khuẩn. Bảng 3 cho thấy ao 3 và 4 sử dụng men vi sinh B có hàm lượng amoniac thấp hơn so với ao 1 và 2 sử dụng men vi sinh A. Điều này cho thấy vi khuẩn trong men vi sinh B phân hủy chất hữu cơ và ức chế hàm lượng amoniac.
Bảng 3. Kết quả đo chất lượng nước trong quá trình nuôi tôm thẻ chân trắng.
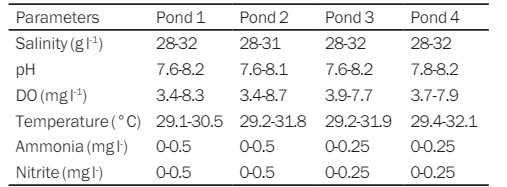
Mặc dù men vi sinh B có xếp hạng đơn vị log thấp hơn men vi sinh A, nhưng nó được tiến hành lên men. Thứ hạng đơn vị log của mật độ khuẩn lạc vi khuẩn tăng lên và men vi sinh B có mật độ vi khuẩn cao hơn men vi sinh A. Ở giai đoạn chuẩn bị môi trường, men vi sinh A và men vi sinh B được cung cấp một mg/L mỗi ngày và liên tục trong ba ngày. Trong quá trình duy trì, thời gian được cung cấp năm lần với liều 1 mg/L (theo khuyến cáo sử dụng của sản phẩm). Nhưng tại DOC 75, chế phẩm sinh học được cung cấp hai ngày một lần với số lượng 2 mg/L cho đến thời điểm thu hoạch.
Kết Luận
Hàm lượng nhiều vi khuẩn men vi sinh gián tiếp mang lại năng suất cao hơn. Thành phần vi khuẩn sẽ chuyển hóa chất hữu cơ và chuyển hóa thành các hợp chất dễ tiêu hóa. Men vi sinh B cũng có tác dụng tốt hơn đối với chất lượng nước.
Hàm lượng vi khuẩn bên trong nhiều hơn, chẳng hạn như men vi sinh B, mang lại chất lượng không khí-nước tốt hơn cho tỷ lệ sống của tôm thẻ chân trắng và giá trị FCR, dẫn đến năng suất cao hơn. Quá trình lên men men vi sinh sẽ làm tăng mật độ vi khuẩn bên trong giúp sử dụng hiệu quả hơn.
Theo Maria Gorety Eny Kristiany, Guntur Prabowo, Suharyadi Suharyadi1 & Erni Marlina
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Bổ sung một phần nước biển để cải thiện hiệu suất tôm thẻ chân trắng Litopenaeus vannamei trong các hệ thống biofloc có độ mặn thấp
- Phần 2: Ảnh hưởng của việc bổ sung nucleotide trong khẩu phần đến năng suất, lợi nhuận và khả năng kháng bệnh của tôm thẻ chân trắng Litopenaeus vannamei được nuôi ở Indonesia trong điều kiện ao thâm canh ngoài trời
- Ảnh Hưởng Của Oxy Hòa Tan Siêu Bão Hòa Đến Sự Biểu Hiện Gen Liên Quan Đến Tăng Trưởng, Tỷ Lệ Sống Và Miễn Dịch Của Tôm Thẻ Chân Trắng (Litopenaeus vannamei)

 English
English 中文 (中国)
中文 (中国)