5/ Quá trình hình thành biofilm
Vi khuẩn hình thành biofilm để phản ứng với các căng thẳng từ môi trường như bức xạ UV, mất nước, thiếu dinh dưỡng, pH biến động, nhiệt độ khắc nghiệt, nồng độ muối cao, áp suất và các chất kháng khuẩn cao. Trong tài liệu này, điều kiện dẫn đến sự hình thành biofilm rất phức tạp (O’Toole và cộng sự, 2000; Hall- Stoodley và cộng sự, 2004; Lopez và cộng sự, 2010; Galie và cộng sự, 2018). Người ta tin rằng sự hình thành biofilm bắt đầu với sự liên kết thuận nghịch của vi khuẩn lên bề mặt, sau đó là sự liên kết chặt chẽ, thường được hỗ trợ bởi sự bám dính và tương tác của vi khuẩn trong phạm vi ngắn. Sự liên kết thuận nghịch của chúng được tiến triển thông qua việc tạo ra EPS. Sau đó, chúng phát triển thành một cấu trúc có tổ chức được đặt trong EPS. Cuối cùng, các tế bào vi khuẩn có thể thoát ra khỏi biofilm trưởng thành và phân tán vào môi trường để xâm nhập vào các vùng mới (Berne và cộng sự, 2015; Hoffman và cộng sự, 2015; Limoli và cộng sự, 2015; Toyofuku và cộng sự, 2016). Các giai đoạn hình thành biofilm này được minh họa trong Hình 1. Năm giai đoạn chính dẫn đến sự phát triển của dạng sống phiêu sinh tự do thành sống thành cộng đồng “biofilm” ít vận động được thảo luận dưới đây.
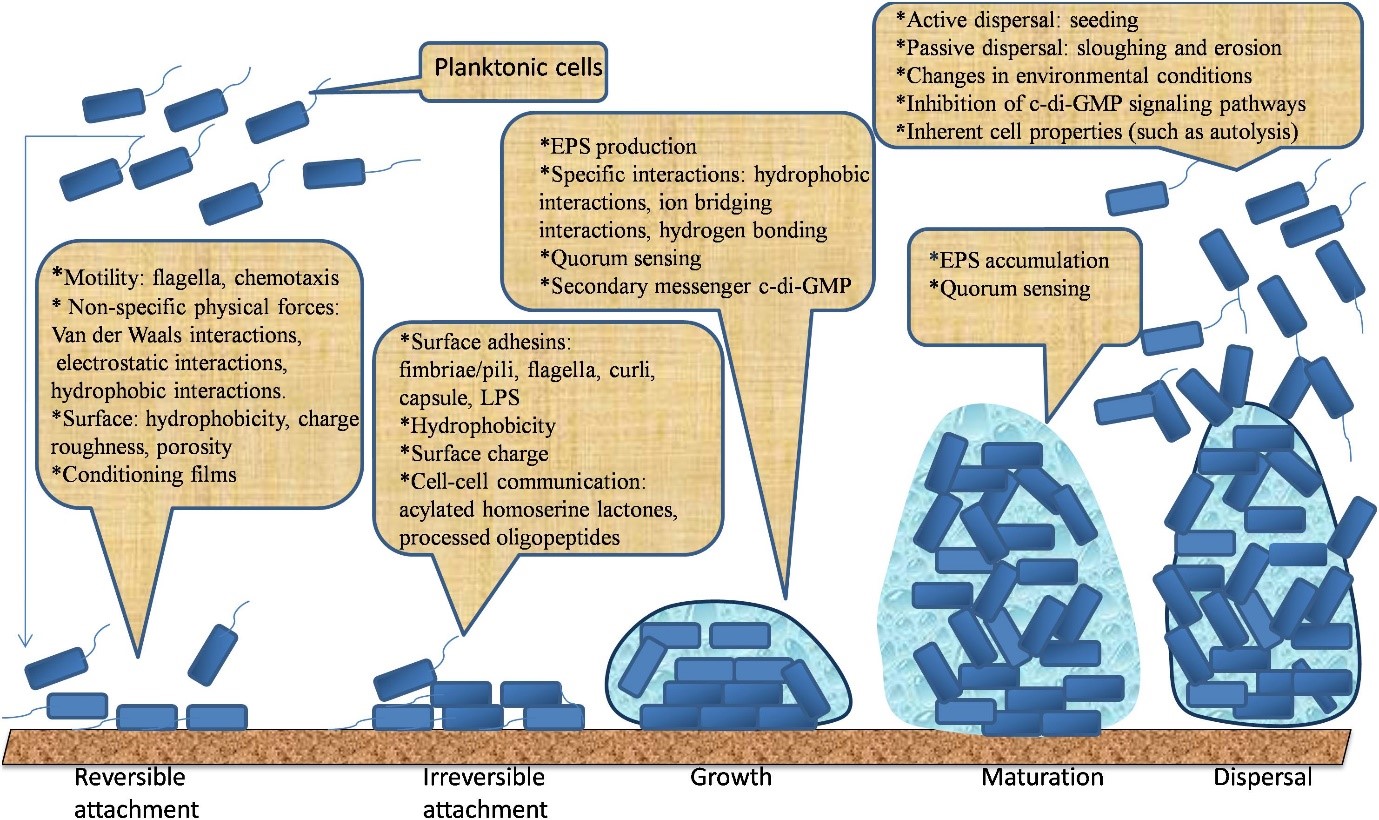
Hình 1: Năm giai đoạn chính dẫn đến sự phát triển và phân tán của biofilm.
6/ Liên kết thuận nghịch
Sự liên kết của vi khuẩn là bước đầu của quá trình hình thành biofilm. Nó bắt đầu với sự liên kết thuận nghịch giữa một vài tế bào sinh vật phù du và bề mặt chất nền. Vi khuẩn phải được vận chuyển đến các bề mặt bằng chuyển động Brown, lắng đọng hoặc đối lưu (Palmer và cộng sự, 2007). Chemotaxis là sự di chuyển có hướng của các tế bào vi khuẩn về phía nguồn dinh dưỡng hoặc các chất hóa trị (ví dụ, axit amin và đường) dọc theo nồng độ gradient trong chất lỏng. Nó xảy ra ở hầu hết tất cả các vi sinh vật và có thể tạo điều kiện cho vi khuẩn phát triển trên bề mặt bằng cách cho phép tương tác với các bề mặt tế bào (Vladimirov và Sourjik, 2009; Porter và cộng sự, 2011). Khi các tế bào tiếp cận một bề mặt, tương tác giữa bề mặt tế bào và bề mặt phụ thuộc vào tổng lực đẩy hoặc lực hấp dẫn được tạo ra giữa hai bề mặt. Nếu lực hút lớn hơn lực đẩy, vi khuẩn sẽ bám vào bề mặt và ngược lại (Dunne, 2002; Carniello và cộng sự, 2018). Sự liên kết ban đầu này đạt được thông qua tác dụng của các lực vật lý không đặc hiệu như lực tĩnh điện, tương tác kỵ nước và tương tác Lifshitz– van der Waals (Dunne, 2002; Carniello và cộng sự, 2018). Sự liên kết của vi khuẩn đã được giải thích trong phạm vi của lý thuyết DVLO (Derjaguin, Verwey, Landau và Overbeek), mô hình DVLO mở rộng và các phương pháp tiếp cận nhiệt động lực học (Perni và cộng sự, 2014; Zhang và cộng sự, 2015; Carniello và cộng sự, 2018). Những lý thuyết mô tả sự liên kết là kết quả của sự cân bằng giữa tương tác hấp dẫn Lifshitz-van der Waals và lực đẩy, dựa trên lực tĩnh điện (Morra và Cassinelli, 1997; Rijnaarts và cộng sự, 1999), và lực hydrat hóa (Jucker và cộng sự, 1998; Hermansson, 1999). Nói chung, sự liên kết thuận nghịch của vi khuẩn vào một bề mặt liên quan đến sự lắng đọng của vi khuẩn vào chất nền theo cách mà vi khuẩn vẫn ở trong chuyển động Brown hai chiều và có thể dễ dàng tách ra khỏi bề mặt nhờ khả năng di chuyển của vi khuẩn hoặc lực cắt của chất lỏng chảy trên bề mặt (Li và Tang, 2009; Carniello và cộng sự, 2018).
Cả bề mặt trơ và bề mặt sinh học đều có thể được sử dụng để liên kết vi khuẩn vào lúc đầu. Trên thực tế, bất kỳ chất nào tiếp xúc với huyền phù vi khuẩn đều được coi là chất nền cho sự phát triển của biofilm (Donlan, 2002; Tuson và Weibel, 2013). Các đặc tính hóa lý của bề mặt chất nền có thể ảnh hưởng đến sự liên kết của vi khuẩn và tốc độ phát triển của biofilm, bao gồm độ nhám bề mặt, tính kỵ nước, điện tích bề mặt và sự hiện diện của màng dưỡng (Donlan, 2002; Srey và cộng sự, 2013).
Mối quan hệ giữa sự bám dính của vi khuẩn và độ nhám bề mặt đã được báo cáo trong nhiều năm qua. Tuy nhiên, có nhiều ý kiến khác nhau về ảnh hưởng của độ nhám đối với sự bám dính của vi khuẩn và sự hình thành biofilm. Một số nghiên cứu cho thấy sự bất thường của bề mặt phi sinh học thúc đẩy sự gắn kết của vi khuẩn và phát triển biofilm do lực cắt thấp hơn và diện tích bề mặt lớn hơn, mà tế bào vi khuẩn có thể bám trên bề mặt nhám hơn (Pedersen, 1990; Bollen và cộng sự, 1997; Donlan, 2002; Yu và cộng sự, 2016), trong khi một kết quả khác lại cho thấy độ nhám bề mặt không ảnh hưởng đến sự bám của vi khuẩn (Vanhaecke và cộng sự, 1990; Flint và cộng sự, 2000; Zhao và cộng sự, 2014). Kết quả khác này có thể là do các cấu trúc ngoại bào và các đặc tính hóa lý của các vi khuẩn khác nhau cũng như các đặc tính hóa lý đa dạng của bề mặt lớp nền với tính kỵ nước, điện tích bề mặt và màng dưỡng khác nhau.
Tính kỵ nước bề mặt, tương tác không cộng hóa trị trong các hệ thống sinh học, được cho là đóng một vai trò quan trọng trong sự bám dính của vi khuẩn. Các bề mặt kỵ nước dường như dễ dàng cho vi khuẩn cư trú hơn các vật liệu ưa nước (Teixeira và Oliveira, 1999; Donlan và Costerton, 2002; Sousa và cộng sự, 2011). Điều này có thể là do tính kỵ nước làm giảm lực đẩy giữa bề mặt vi khuẩn và chất nền của chúng. Yu và cộng sự (2016) cho rằng tính kỵ nước và độ nhám bề mặt của lớp nền là do vi khuẩn Streptococcus mutans bám vào trước. Teixeira và Oliveira (1999) cũng báo cáo mối tương quan thuận giữa mức độ kỵ nước của vật liệu nền polymer và số lượng các Alcaligenes denetrifican được bám vào. Tuy nhiên, điều đáng chú ý là L. monocytogenes có khả năng bám vào các chất nền ưa nước như thép không gỉ hơn là các bề mặt kỵ nước như polytetrafluoroethylene (PTFE; Chavant và cộng sự, 2002). Điều này có thể là do sự liên kết của các tế bào vi khuẩn cũng bị ảnh hưởng bởi tính kỵ nước của bề mặt, do đó phụ thuộc vào tốc độ phát triển của vi khuẩn, chủng vi khuẩn và môi trường phát triển (Vacheethasanee và cộng sự, 1998; Katsikogianni và Missirlis, 2004). Vacheethasanee và cộng sự (1998) quan sát thấy rằng các chủng S. epidermidis có tính kỵ nước bề mặt cao hơn với mức độ lớn hơn so với các chủng có tính kỵ nước bề mặt ít hơn với polyetylen (PE). Các nghiên cứu đã chỉ ra rằng tính kỵ nước ảnh hưởng đến sự bám của bào tử vào bề mặt, và bề mặt hoặc vi khuẩn càng kỵ nước thì sự bám dính càng mạnh (Husmark và Rönner, 1992; Faille và cộng sự, 2002). Husmark và Rönner (1992) báo cáo rằng tính kỵ nước của các bào tử B. cereus và các phần phụ giống như lông bao quanh chúng đã ảnh hưởng đến sự gắn kết với các bề mặt trơ. Tính kỵ nước của vi khuẩn có thể được xác định bằng sự bám dính của vi khuẩn với hydrocacbon (BATH), hay còn được gọi là sự bám dính của vi sinh vật với hydrocacbon (MATH), sắc ký tương tác kỵ nước (HIC) và phép đo góc tiếp xúc (Ukuku và Fett, 2002; Palmer và cộng sự, 2007). Việc lựa chọn vi khuẩn để bám vào bề mặt kỵ nước hoặc ưa nước phụ thuộc vào cấu trúc và các đặc điểm sinh lý, sinh hóa phức tạp của cả vi khuẩn và bề mặt tiếp xúc của chúng.
Điện tích bề mặt là một yếu tố vật lý khác ảnh hưởng đến sự bám dính của vi khuẩn với chất nền. Người ta tin rằng hầu hết các tế bào vi khuẩn đều có điện tích bề mặt âm do sự hiện diện đáng kể của nhóm carboxyl, amino và phosphate (Dziubakiewicz và cộng sự, 2013). Do đó, bề mặt điện tích dương thúc đẩy sự bám dính của vi khuẩn, trong khi bề mặt điện tích âm sẽ khuyến khích khả năng chống lại sự bám dính của vi khuẩn (Tuson và Weibel, 2013). Cần lưu ý thêm rằng điện tích bề mặt của vi khuẩn giữa các loài là khác nhau, chúng cũng bị ảnh hưởng bởi môi trường sinh trưởng, độ tuổi, pH và cường độ ion (Katsikogianni và Missirlis, 2004). Điện tích bề mặt vi khuẩn thường được mô tả bằng tiềm năng zeta (Palmer và cộng sự, 2007). Các nghiên cứu điều tra ảnh hưởng của điện tích bề mặt đến khả năng bám dính của vi khuẩn E. coli với các bề mặt trơ đã cho thấy mối tương quan thuận trong một số trường hợp (Dickson và Koohmaraie, 1989; Ukuku và Fett, 2002) và không có mối tương quan nào trong các trường hợp khác (Rivas và cộng sự, 2007). Sự khác biệt trong các nghiên cứu này có thể là do các phương pháp được sử dụng khác nhau, như các chất đệm và môi trường phát triển khác nhau, để khử điện tích bề mặt vi khuẩn. Tương tự, QS ở E. coli gây ra sự gia tăng điện tích âm trên bề mặt tế bào, do đó thúc đẩy sự bám dính của vi khuẩn với bề mặt trong giai đoạn đầu của quá trình hình thành biofilm (Tuson và Weibel, 2013). Sắc ký tương tác tĩnh điện (ESIC) đã được sử dụng rộng rãi để đo điện tích bề mặt vi khuẩn (Ukuku và Fett, 2002).
Gần như tất cả các vi khuẩn di chuyển từ môi trường lỏng sang các bề mặt đều tiếp xúc với màng dưỡng trước. Các màng này rất cần thiết trong quá trình bám dính của vi khuẩn và được hình thành do sự hấp phụ của các phân tử dinh dưỡng lên bề mặt vật liệu, dẫn đến những thay đổi về đặc tính hóa lý của bề mặt và do đó ảnh hưởng đến sự bám dính của vi khuẩn (Lorite và cộng sự, 2011). Những màng này được hình thành trong vòng vài phút sau khi tiếp xúc với vi khuẩn trong vài giờ (Donlan, 2002).
7/ Sự bám dính chặt chẽ
Sự bám dính chặt chẽ đạt được thông qua tác động của các tương tác trong phạm vi ngắn như tương tác lưỡng cực-lưỡng cực, hydro, liên kết ion và cộng hóa trị, và tương tác kỵ nước với sự bám dính cấu trúc vi khuẩn (Bos và cộng sự, 1999). Bề mặt của vi khuẩn có các chất kết dính khác nhau nhô ra khỏi bề mặt tế bào vào môi trường ngoại bào (Berne và cộng sự, 2015). Cho đến nay, các cấu trúc kết dính của vi khuẩn, bao gồm flagella, pili / fimbriae và sự bám dính không phải sợi, được xác định là có liên quan đến sự phát triển của biofilm (Berne và cộng sự, 2015). Sự hiện diện của các bề mặt này giúp tế bào vi khuẩn tiếp xúc vật lý với chất nền đầu tiên (Petrova và cộng sự, 2012; Berne và cộng sự, 2015; Carniello và cộng sự, 2018). Flagellum (tiên mao) là một phần phụ dạng sợi giống roi có liên quan đến sự di chuyển của vi khuẩn (Haiko và Westerlund-Wikstrom, 2013). Flagella có thể bơi (trong chất lỏng) hoặc thành bầy (trên bề mặt chất rắn ẩm). Các loài vi khuẩn khác nhau thể hiện cả hai kiểu di chuyển để điều hướng các tế bào vi khuẩn hướng tới môi trường thuận lợi và bám vào bề mặt (Kearns, 2010; Hintsche và cộng sự, 2017). Nhiều nghiên cứu đã báo cáo tầm quan trọng về khả năng di chuyển của flagella trong việc bám vào chất nền và hình thành biofilm. Flagella có thể bắt đầu sự bám dính của tế bào với bề mặt bằng cách vượt qua lực đẩy có thể cản trở tương tác giữa tế bào với bề mặt (Van Houdt và Michiels, 2005; Terashima và cộng sự, 2008; Lemon và cộng sự, 2007; Haiko và Westerlund-Wikstrom, 2013; Wood, 2013). Các thể đột biến không có roi của L. monocytogenes bị suy giảm khả năng bám dính bề mặt so với các loài hoang dã có thời gian ủ bệnh ngắn. Tuy nhiên, với thời gian ủ bệnh lâu hơn, độ che phủ bề mặt của các tế bào đột biến không có flagella gần như đạt đến mức độ tương đương với các tế bào có flagella, điều này cho thấy rằng sự hiện diện của flagella là rất quan trọng đối với sự bám dính ban đầu (Vatanyoopaisarn và cộng sự, 2000).
Pili / fimbriae cũng là các phần phụ dạng sợi được sử dụng để vi khuẩn bám vào nhau và bám vào bề mặt tế bào một cách nhanh chóng (Konto-Ghiorghi và cộng sự, 2009; Maldarelli và cộng sự, 2016). Ví dụ, P. aeruginosa có thể sử dụng một dạng di chuyển bề mặt vi khuẩn qua trung gian tiêm mao gọi là chuyển động co (Alarcon và cộng sự, 2009). Ở K. pneumoniae, Streptococcus agalactiae, Clostridium difficile và Acinetobacter baumannii, pili đóng vai trò quan trọng trong quá trình bám vào bề mặt lúc ban đầu (Konto- Ghiorghi và cộng sự, 2009; Maldarelli và cộng sự, 2016; Pakharukova và cộng sự, 2018). Các fimbriae loại 1 và loại 3 trên bề mặt của K. pneumoniae tạo điều kiện bám dính trên các bề mặt phi sinh học và hình thành biofilm trưởng thành, trong khi chỉ có các fimbriae loại 1 bắt đầu bám E. amylovora trên bề mặt phi sinh học và hình thành biofilm (Di Martino và cộng sự, 2003; Murphy và cộng sự, 2013). Loài E. amylovora hoang dã bám với số lượng nhiều hơn trên các bề mặt so với loại đột biến có sự xóa bỏ ở fimbriae loại I, điều này cho thấy tầm quan trọng của cấu trúc bám dính trong việc hình thành biofilm trưởng thành (Koczan và cộng sự, 2011). Ngoài ra, fimbriae tập hợp ít, còn được gọi là curli fimbriae và kháng nguyên 43, được tìm thấy để tăng cường khả năng bám dính của vi khuẩn lên bề mặt ban đầu (Heras và cộng sự, 2014; Carter và cộng sự, 2016). Hơn nữa, các chất bám dính riêng biệt ở một số vi khuẩn có thể được sử dụng để làm trung gian chuyển đổi từ bám dính bề mặt tạm thời sang chặt chẽ. Ví dụ, sự hình thành đơn lớp ở Caulobacter crescentus được trung gian bởi một polysaccharide bám dính mạnh được gọi là chất giữ (Karatan và Watnick, 2009). Một ví dụ khác là chất bám dính giữa các tế bào polysaccharide (PIA) do S. epidermidis tạo ra, là chất cần thiết cho sự liên kết tế bào với tế bào và sự phát triển biofilm sau đó (Rohde và cộng sự, 2010).
Vi khuẩn gây bệnh cũng tạo ra sự bám dính cho phép chúng không chỉ bám vào các thụ thể trên bề mặt tế bào nhân thực, mà còn tạo điều kiện thuận lợi cho sự xâm nhập của chúng. Ví dụ, Yersinia pseudotuber tuberculosis và Yersinia enterocolitica tạo ra một loại protein xâm nhập, bám vào các tích phân β1 trên bề mặt của tế bào M và gây ra sự lai Yersinia vào tế bào M. (Bonazzi và cộng sự, 2009; Karatan và Watnick, 2009).
Một cơ chế truyền tín hiệu từ tế bào này sang tế bào khác được gọi là QS cũng điều phối các tế bào riêng lẻ để bắt đầu hình thành biofilm của vi khuẩn (Abraham, 2016). Việc sử dụng QS, vi khuẩn tổng hợp và giải phóng các tín hiệu đầu tiên như tín hiệu hóa học (đầu dò tự động, AI) cho phép tương tác giữa tế bào với tế bào trong quần thể vi khuẩn (Li và Tian, 2012; Papenfort và Bassler, 2016). Cả vi khuẩn Gram âm và Gram dương đều sử dụng cơ chế truyền tín hiệu từ tế bào này sang tế bào khác để điều chỉnh sự hình thành biofilm. Vi khuẩn Gram âm chủ yếu sử dụng acyl homoserine lacton (AHL), trong khi vi khuẩn Gram dương sử dụng oligopeptide, đây là những AI phổ biến có thể được sử dụng bởi cả vi khuẩn Gram âm và Gram dương (Miller và Bassler, 2001; Sperandio và cộng sự, 2001; Sun và cộng sự, 2004).
Nhóm tác giả: Musa Hassan Muhammad, Aisha Lawan Idris, Xiao Fan, Yachong Guo, Yiyan Yu, Xu Jin,
Junzhi Qiu, Xiong Guan and Tianpei Huang*
Biên dịch: Đoàn Thị Huyền Thoại – Hồ Diễm My – Công ty TNHH Bình Minh Capital.
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Biofilm và các biện pháp kiểm soát chúng (Phần 1)
- Biofilm Và Các Biện Pháp Kiểm Soát Chúng (Phần 2)
- Những tác động khác nhau của tia UVA đối với tôm thẻ chân trắng

 English
English 中文 (中国)
中文 (中国)