Tóm tắt
Nghiên cứu này đánh giá hiệu quả của tannin thủy phân (HT) từ cây hạt dẻ ngọt (Castanea sativa) đối với tôm thẻ chân trắng (Penaeus vannamei). HT được bổ sung trực tiếp vào thức ăn hoặc bón thúc vào ao nuôi trong 90 ngày. Tôm được nuôi trong lưới hapa được lắp đặt trong các ao thương mại ngoài trời. 8 khẩu phần ăn thử nghiệm bao gồm khẩu phần ăn cơ bản (BD) với các mức độ bao gồm HT khác nhau (BD-0%, BD-0,1%, BD-0,2% và BD0,3%), khẩu phần ăn ít bột cá (FM) với mức giảm về mức độ bao gồm FM từ 10% đến 7,5% và được dán nhãn là LFM 0,3% HT, bổ sung HT trực tiếp vào thức ăn cơ bản (BDTD-0,4% HT) và khẩu phần ăn thương mại (CDTD-0% HT và CDTD -0,4%HT). Tôm ăn thức ăn có 0,3% HT (BD-0,3%) có trọng lượng cuối cùng, tăng trưởng, hệ số tăng trưởng nhiệt, tăng trưởng hàng ngày và tỷ lệ chuyển đổi thức ăn tốt hơn so với tôm ăn thức ăn không có HT (BD-0%). Bổ sung 0,4% HT vào thức ăn thương mại (CDTD-0,4% HT) cũng cải thiện hiệu suất tăng trưởng so với thức ăn không có HT (BD-0% HT và CD). Tôm ăn thức ăn có HT có hàm lượng protein và chất béo trong cơ thể cao hơn. Bổ sung HT trực tiếp hoặc bón thúc làm tăng số lượng tế bào máu và hoạt động lysozyme của tôm Thức ăn BDTD-0,4% HT và CDTD-0,4% HT giúp cải thiện tình trạng gan tụy của tôm. Những kết quả này cho thấy bổ sung 0,3% HT vào thức ăn có thể cải thiện hiệu suất tăng trưởng và sức khỏe của tôm thẻ chân trắng nuôi trong ao thương mại, nhưng cũng có thể bổ sung 0,4% HT có thể sử dụng để bón thúc ao nuôi.
Giới thiệu
Sản lượng tôm thẻ chân trắng (Penaeus vannamei) toàn cầu đã tăng mạnh từ 2,64 triệu tấn năm 2010 lên 4,96 triệu tấn năm 2018. Nhu cầu tiêu dùng cao và sự mở rộng hệ thống sản xuất sang các nước châu Á cùng với áp dụng công nghệ là những yếu tố thúc đẩy sự tăng trưởng này. Thức ăn đóng vai trò then chốt trong việc duy trì sản xuất tôm thẻ chân trắng. Cung cấp đầy đủ dinh dưỡng giúp tối ưu hóa sự tăng trưởng, sức khỏe và giảm thiểu tác động môi trường. Do chi phí thức ăn chiếm phần lớn trong tổng chi phí nuôi trồng, việc lựa chọn nguyên liệu, chất phụ gia và chất bổ sung cần được cân nhắc kỹ lưỡng.
Ngành công nghiệp thức ăn tôm đang hướng đến sử dụng ít bột cá (FM) hơn do giá thành cao và nguồn cung hạn chế. Các thành phần thay thế như bột đậu nành (SBM), ngũ cốc chưng cất khô có chất hòa tan (DDGS) và protein hạt bông khử phenol đậm đặc (CDCP) đã được sử dụng, nhưng cần lưu ý đến khả năng gây căng thẳng cho tôm nếu sử dụng quá nhiều. Do đó, cần có chiến lược thay thế FM hiệu quả bằng cách kết hợp các nguồn protein thực vật với chất bổ sung chức năng hoặc chất phụ gia để đảm bảo dinh dưỡng đầy đủ và ngăn ngừa stress cho tôm. Việc bổ sung thức ăn bằng các chất tự nhiên có nguồn gốc thực vật được đề xuất để cải thiện hiệu suất tăng trưởng, khả năng hấp thu dinh dưỡng và bảo vệ tôm khỏi các tác nhân gây bệnh.
Phụ gia thức ăn thực vật được chia thành nhiều nhóm, bao gồm phụ gia cảm quan, công nghệ, kỹ thuật chăn nuôi và dinh dưỡng. Trong số đó, tannin thủy phân (HT) được sử dụng như một chất phụ gia dinh dưỡng. Nghiên cứu trước đây cho thấy bổ sung 0,15% HT vào thức ăn có thể cải thiện hiệu suất tăng trưởng, khả năng chống oxy hóa, hệ vi sinh đường ruột và khả năng chống lại Vibrio parahaemolyticus ở tôm. Nghiên cứu này nhằm xác minh chức năng của HT ở tôm thẻ chân trắng Thái Bình Dương (Penaeus vannamei) được nuôi trong ao thương mại ngoài trời. Ngoài ra, chưa có nghiên cứu nào được công bố về sự tăng trưởng và tình trạng sức khỏe của tôm thẻ P. vannamei được cho ăn HT như một chất phụ gia phủ trên cùng như một phương pháp phổ biến được áp dụng trong các trang trại nuôi tôm thâm canh.
Do đó, để xác nhận chức năng của HT ở tôm thẻ chân trắng, mục tiêu của nghiên cứu này là đánh giá ảnh hưởng của việc bổ sung HT vào thức ăn và phương pháp bón thúc lên sự tăng trưởng, thành phần cơ thể, tổng số lượng tế bào máu (THC), hoạt động lysozyme và hình thái đường ruột của tôm. Ngoài ra, ảnh hưởng của quá trình bón thúc bằng chất kết dính cụ thể đến tính toàn vẹn của HT trong thức ăn cơ bản và thức ăn công thức cũng được nghiên cứu.
Chuẩn bị nghiên cứu
2.1. Khẩu phần ăn thử nghiệm. HT (độ tinh khiết> 65%) được cung cấp bởi Tanin Sevnica (Slovenia). Tám khẩu phần ăn thử nghiệm đã được chuẩn bị, với khẩu phần ăn cơ bản (BD) được xây dựng có chứa hỗn hợp 10% FM, 8% bột gluten ngô (CGM), 44,9% SBM và 15% sản phẩm lúa mì (WP) làm chất kết dính và chất độn, và không bổ sung HT (BD-0% HT). Ba khẩu phần ăn thử nghiệm tiếp theo có mức FM, CGM, SBM và WP tương tự và được bổ sung với mức độ HT ngày càng tăng: 0,1%, 0,2% và 0,3% được dán nhãn lần lượt là BD0,1% HT, BD-0,2% HT, và BD-0,3% HT. Khẩu phần thứ 5 được chuẩn bị bằng cách giảm lượng FM từ 10% xuống 7,5% và bổ sung 0,3% HT (gọi là LFM 0,3% HT). Khẩu phần thứ 6 là khẩu phần cơ bản bón thúc với 0,4% HT (BDTD-0,4% HT). Khẩu phần thứ 7 là khẩu phần thương mại thường được sử dụng trong các hệ thống sản xuất tôm của Indonesia (có tên CD, Code SA, CJ Feed, Serang, Banten, Indonesia). Khẩu phần ăn cuối cùng là khẩu phần ăn thương mại được bổ sung 0,4% HT (được đặt tên là CDTD-0,4% HT). Công thức chi tiết của các khẩu phần thử nghiệm được trình bày trong Bảng 1. Về quy trình sản xuất khẩu phần, tất cả các thành phần đều được nghiền và đi qua sàng < 200 lưới (Jinan Shengrun, Trung Quốc) trước khi sản xuất và được cân phân tích rồi trộn trong máy trộn cánh khuấy ( Marion Mixers, Inc., Marion, IA, USA) để đồng nhất. Hỗn hợp nguyên liệu được ép đùn ở nhiệt độ 110°C trong 14 giây (chiếm 5/6 chiều dài máy) và giữ ở 62°C trong phần còn lại của máy. Kích thước viên thức ăn sau khi ép đùn: đường kính 1-2 mm, chiều dài 2-4 mm. Khẩu phần được sấy khô trong không khí trong máy sấy tầng xung (Jinan Shengrun, Trung Quốc) và bảo quản ở 4°C trong hộp kín cho đến khi sử dụng tiếp. Thành phần dinh dưỡng và axit amin của thức ăn được phân tích tại Phòng thí nghiệm Công nghệ gen Saraswanti Indo (Bogor, Tây Java, Indonesia) và được trình bày trong Bảng 2.
BẢNG 1: Thành phần (%) của khẩu phần thí nghiệm.

Ghi chú: 1PT FKS Multi Agro. Tbk, Jakarta, Indonesia. 2Farmatan AquaTM (Tanin Sevnica d.d., Slovenia). 3PT. Pundi Kencana, Cilegon, Banten, Indonesia. 4PT. Fenanza Putra Perkasa, Jakarta Selatan, Indonesia. 5Premix khoáng vi lượng (g/100 g premix): coban clorua: 0,004; pentahydrat cupric sunfat: 0,550; sắt sunfat: 2.000; magie sunfat khan: 13,862; mangan sunfat monohydrat: 0,650; kali iodua: 0,067; natri selenit: 0,010; kẽm sulfat heptahydrat: 13,193; alpha-cellulose: 69,664. 6Premix vitamin (g/kg premix): thiamine·HCl: 4,95; riboflavin: 3,83; pyridoxine·HCl: 4,00; Ca-pantothenate: 10,00; axit nicotinic: 10,00; biotin: 0,50; axit folic: 4,00; cyanocobalamin: 0,05; inositol: 25,00; vitamin A axetat (500.000 IU/g): 0,32; vitamin D3 (1.000.000 IU/g): 80,00; menadione: 0,50; alpha-cellulose: 856,81.
BẢNG 2: Thành phần dinh dưỡng và axit amin (AA) (% tính theo trọng lượng ướt) của khẩu phần thí nghiệm.
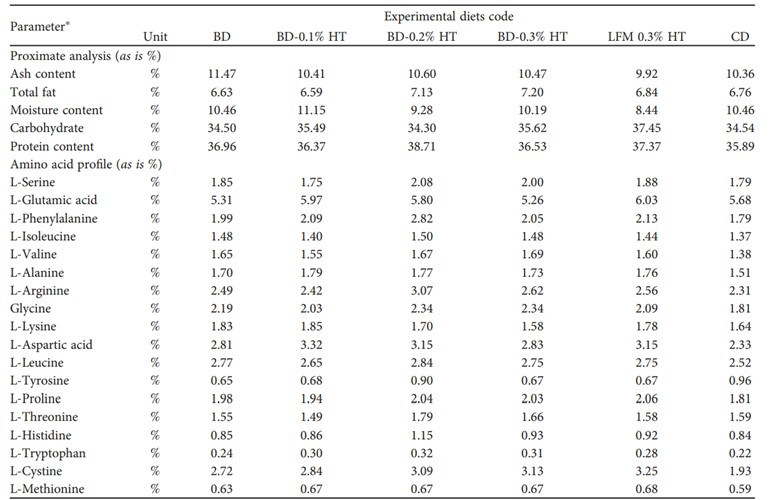
Lưu ý: ∗Phân tích được thực hiện bởi Phòng thí nghiệm Công nghệ gen Saraswanti Indo (Bogor, Tây Java, Indonesia. Trang web: https://www.siglaboratory.com)
2.2. Thử nghiệm cho ăn. Tôm thẻ chân trắng P. vannamei (trọng lượng trung bình ban đầu 0,87 ± 0,02 g) được lấy từ trại giống Salira Teknik Benur ở Serang, Banten, Indonesia. Tôm được vận chuyển đến địa điểm ao nuôi tại Trung tâm Dịch vụ Kinh doanh Sản xuất Nuôi trồng Thủy sản Karawang, Tây Java, Indonesia, theo hướng dẫn của ủy ban đạo đức của Đại học Kỹ thuật Thủy sản Jakarta. Tôm được kiểm tra không có mầm bệnh trước khi vận chuyển và được nuôi trong bể ương với điều kiện nước tương tự như trong thử nghiệm cho ăn. Sau đó, 8.000 con tôm được phân ngẫu nhiên vào 40 lưới hapa (50 con tôm/ m2 hoặc 200 con tôm trên mỗi lưới hapa). Kích thước mỗi lưới hapa là 2 × 2 × 1 m, được lắp đặt trong các ao ngoài trời. Mỗi khẩu phần ăn được lặp lại 5 lần Tôm được cho ăn thủ công bằng khẩu phần ăn thử nghiệm 4 lần mỗi ngày (07:00, 11:00, 15:00 và 20:00 giờ) trong 90 ngày. Lượng thức ăn hàng ngày được tính toán dựa trên giả định tôm tăng trưởng bình thường và tỷ lệ chuyển hóa thức ăn dự kiến là 1,5. Lượng thức ăn được điều chỉnh dựa trên mức tiêu thụ thức ăn và tỷ lệ chết được quan sát hàng ngày. Quy trình bón thúc được thực hiện theo quy trình chuẩn cho ứng dụng tại trang trại bằng cách chuẩn bị 10 g kẹo cao su xanthan làm chất kết dính, 100 mL nước nóng, 1 kg thức ăn và 4 g HT. Quy trình được bắt đầu bằng cách trộn 100 L nước nóng với kẹo cao su xanthan cho đến khi đạt đến trạng thái bùn. Sau đó, 4 g HT được thêm vào dung dịch bùn và trộn đều. Rải đều dung dịch bùn chứa HT lên thức ăn đã pha chế cho đến khi phủ đều bề mặt thức ăn. Để thức ăn 10–15 phút ở nhiệt độ phòng trước khi sử dụng.
2.3. Phân tích chất lượng nước và lấy mẫu. Độ pH, oxy hòa tan (DO), nhiệt độ nước (T), độ mặn, tổng chất rắn hòa tan (TDS) và khả năng oxy hóa-khử (ORP) được đo bốn lần mỗi ngày bằng hệ thống đo lường thời gian thực (thiết bị Aqua TROLL 500 Multiparameter Sonde) trong suốt 90 ngày thử nghiệm cho ăn. Dữ liệu được lưu trữ vào ứng dụng AquaEasy (Bosch, Singapore) để truy xuất nguồn gốc và ghi lại dữ liệu. Nồng độ nitơ amoniac (NH3–N), nitơ nitrit (NO2–N) và nitơ nitrat (NO3–N) được đo mỗi tuần một lần bằng phương pháp đo quang phổ hấp thụ (DR890, HACH, Hoa Kỳ). Sau 90 ngày, tôm được nhịn ăn trong 24 giờ. Sau đó, tôm trong mỗi lưới hapa được đếm theo nhóm và cân khối lượng lớn để tính trọng lượng cơ thể cuối cùng, phần trăm tăng trọng (PWG), tỷ lệ chuyển hóa thức ăn (FCR), tỷ lệ sống (SR) , tăng trưởng trung bình hàng ngày (ADG) và hệ số tăng trưởng nhiệt (TGC) như sau:

trong đó FBW là trọng lượng cơ thể cuối cùng, IBW là trọng lượng cơ thể ban đầu, T là nhiệt độ (°C) và D là số ngày cho ăn.
2.4. Phân tích sinh hóa toàn bộ cơ thể tôm. Ba con tôm từ mỗi lưới hapa (tổng cộng 15 con tôm cho mỗi khẩu phần ăn) được thu thập ngẫu nhiên và gộp lại sau khi kết thúc thử nghiệm để đánh giá thành phần dinh dưỡng và axit amin trong toàn bộ cơ thể tôm. Tôm khô nguyên con được trộn và cắt nhỏ trong máy trộn theo các phương pháp được mô tả bởi Helrich. Tất cả các thông số được phân tích tại Phòng thí nghiệm công nghệ gen Saraswanti Indo (Bogor, Tây Java, Indonesia).
2.5. Tổng số lượng tế bào máu. Khi kết thúc thử nghiệm cho ăn, hemolymp được lấy mẫu từ ba con tôm riêng lẻ trên mỗi lưới hapa, hoặc 15 con tôm trong mỗi khẩu phần ăn, để xác định THC. Hemolymp (100 μL) của từng con tôm được rút ra khỏi đáy của phần bụng thứ hai bằng ống tiêm 1 mL vô trùng (kim 25 G × 13 mm). Trước khi tách hemolymp, ống tiêm đã được nạp dung dịch đã làm lạnh trước (4°C) (10% EDTA, Na2) được sử dụng làm chất chống đông máu. Dung dịch hemolymp với dung dịch chống đông máu được pha loãng trong 150 μL formaldehyde (4%) và sau đó 20 μL được đặt trên máy đo huyết sắc tố (Neubauer) để đo THC bằng kính hiển vi quang học (Olympus, DP72).
2.6. Phân tích hoạt tính lysozyme. Hoạt tính lysozyme của tôm được đo bằng cách sử dụng bộ kit thương mại (SigmaAldrich, Cat. No. LY0100). Trong thời gian kết thúc thử nghiệm tăng trưởng, 5 con tôm trong mỗi khẩu phần ăn được thu thập ngẫu nhiên và sử dụng để phân tích hoạt động lysozyme. Kết quả được xác định bằng quá trình ly giải tế bào Micrococcus lysodeikticus. Các phản ứng được tiến hành ở nhiệt độ phòng và độ hấp thụ của mẫu được đo ở bước sóng 450 nm bằng máy quang phổ tử ngoại/nhìn thấy (PerkinElmer, Lambda XLS, USA):

trong đó df là hệ số pha loãng, 0,001 là ΔA450 theo định nghĩa đơn vị và 0,03 là thể tích (tính bằng mL) của dung dịch enzyme.
2.7. Mô hình học của gan tụy. Mẫu gan tụy từ hai con tôm trong mỗi lưới hapa (hoặc 10 con tôm cho mỗi khẩu phần ăn) được bảo quản trong dung dịch cố định Davidson ở nhiệt độ phòng trong 48 giờ. Sau đó, mẫu được chuyển sang dung dịch ethanol 50% (VWR, Radnor, PA, USA) và lưu trữ cho đến khi xử lý theo quy trình phân tích mô học tiêu chuẩn. Các mẫu được khử nước thông qua loạt etanol tiêu chuẩn đến 100%, nhúng vào sáp parafin và được cắt ở các khoảng cách 4 µm để nhuộm bằng hematoxylin và eosin (H&E) (Merck, Darmstadt, Đức). Để ước tính, đánh giá mù đôi với thang điểm 1–5 đã được sử dụng. Điểm 1 được coi là tình trạng bình thường và các điểm tiếp theo chiếm mức độ thay đổi mô bệnh học ngày càng tăng so với tình trạng bình thường. Hình ảnh được thu được bằng cách sử dụng kính hiển vi hình ảnh kỹ thuật số (Olympus BX41, Olympus Optical Co., Ltd., Tokyo, Nhật Bản).
2.8. Phân tích thống kê. Dữ liệu về các thông số tăng trưởng, THC và hoạt động lysozyme đã được kiểm tra tính bình thường của phân phối (thử nghiệm Lilliefors) và tính đồng nhất của phương sai (thử nghiệm Bartlett). Dữ liệu bình thường và dữ liệu đồng nhất được phân tích bằng cách sử dụng phân tích phương sai một chiều (ANOVA) để xác định sự khác biệt đáng kể giữa các nghiệm thức, sau đó là các xét nghiệm so sánh nhiều lần của Tukey để xác định sự khác biệt giữa các giá trị trung bình giữa các nghiệm thức. Dữ liệu điểm số về mô hình học của gan tụy tôm được coi là dữ liệu phân loại, được kiểm tra tính quy chuẩn và tính đồng nhất, sau đó được phân tích bằng cách sử dụng thử nghiệm không tham số. Tất cả các phân tích thống kê được thực hiện bằng hệ thống SAS (phiên bản 9.4, Viện SAS, Cary, NC, Hoa Kỳ).
Kết quả
3.1. Thông số chất lượng nước. Bảng 3 tóm tắt các điều kiện chất lượng nước được đo trong 90 ngày thử nghiệm cho ăn ở các ao ngoài trời được sử dụng cho nghiên cứu. Các thông số được đo bằng thiết bị đo thời gian thực là DO, T, pH, độ mặn, TDS và ORP nằm trong khoảng 7,96 ± 3,77 mg/ L, 29,86 ± 1,85°C, 8,25 ± 0,24, 29,72 ± 1,44‰, 29,29 ± 2,15 mg/ L và 192,59 ± 105,73 mg/ L, tương ứng. Amoniac–nitơ (NH3–N), nitrit (NO2–N) và nitrat (NO3–N) nằm trong khoảng 0,11± 0,05 mg/ L, 0,08± 0,04 mg/ L và 22,79 ± 6,44 mg/ L. Nhìn chung, các thông số chất lượng nước nằm trong phạm vi chấp nhận được để hỗ trợ sự phát triển và tỷ lệ sống bình thường của tôm.
BẢNG 3: Các phép đo chất lượng nước tổng thể trong giai đoạn nuôi thương phẩm của thí nghiệm.
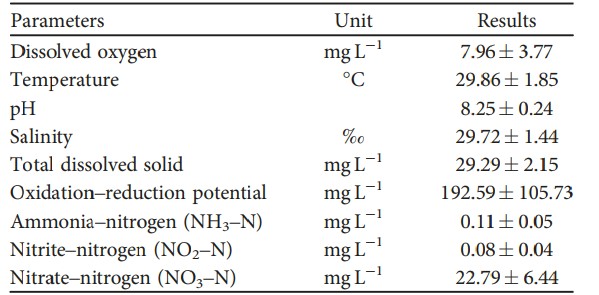
Lưu ý: Dữ liệu được trình bày dưới dạng trung bình ± độ lệch chuẩn (phạm vi).
3.2. Hiệu suất tăng trưởng. Bảng 4 cho thấy ảnh hưởng của các mức bổ sung HT khác nhau đến các thông số hiệu suất tăng trưởng của tôm P. vannamei sau 90 ngày cho ăn thử nghiệm. Khẩu phần ăn BD-0,3% HT cho thấy sự gia tăng đáng kể về FBW, PWG, TGC và ADG so với các khẩu phần ăn khác. Khẩu phần BD-0,1% HT và BD-0,2% HT không có sự khác biệt đáng kể về FBW, PWG, TGC và ADG so với khẩu phần BD. Bổ sung 0,4% HT vào khẩu phần cơ bản (BDTD-0,4% HT) không ảnh hưởng đến các thông số tăng trưởng so với BD. Hiệu suất tăng trưởng của tôm ăn khẩu phần CD tương tự như BD, nhưng thấp hơn đáng kể so với BD-0,3% HT. Bổ sung 0,4% HT vào CD (CDTD-0,4% HT) làm tăng hiệu suất tăng trưởng, nhưng không khác biệt so với BD-0,1% HT và BD-0,2% HT. Khẩu phần BD-0,3% HT có FCR thấp hơn đáng kể so với các khẩu phần khác. Nhìn chung, không có sự khác biệt đáng kể về tỷ lệ sống giữa các nhóm tôm.
BẢNG 4: Hiệu suất tăng trưởng của tôm thẻ chân trắng (Litopenaeus vannamei) (trọng lượng ban đầu trung bình 0,87 ± 0,02 g) được cho ăn khẩu phần thử nghiệm trong 90 ngày.
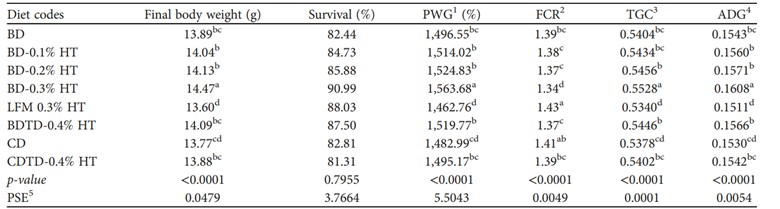
Ghi chú: 1 PWG, phần trăm tăng trọng; 2 FCR, hệ số chuyển đổi thức ăn; 3 TGC, hệ số tăng trưởng nhiệt; 4ADG, mức tăng trưởng trung bình hàng ngày; 5 PSE, lỗi tiêu chuẩn gộp. Các kết quả trong cùng một hàng với các chữ cái chỉ số trên khác nhau có sự khác biệt đáng kể (P< 0:05) dựa trên phân tích phương sai sau đó là thử nghiệm so sánh nhiều lần của Tukey.
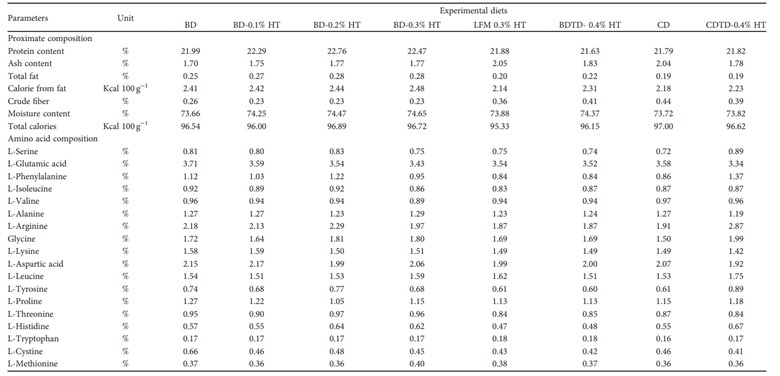
3.3. Thành phần toàn bộ cơ thể. Bảng 5 cho thấy thành phần dinh dưỡng và axit amin của toàn bộ cơ thể tôm P. vannamei (được biểu thị bằng phần trăm trọng lượng ướt) sau khi được cho ăn bằng khẩu phần ăn thử nghiệm trong 90 ngày. Về mặt số lượng, hàm lượng protein và chất béo cao nhất được tìm thấy ở khẩu phần ăn cho tôm ăn BD-0,1% HT, BD-0,2% HT và BD-0,3% HT so với khẩu phần ăn cho tôm ăn BD và CD. Mức độ tro cao hơn ở khẩu phần cho tôm ăn LFM 0,3% HT và CD so với các khẩu phần ăn khác. Quá trình bón thúc vào CD có thể làm giảm lượng tro và tăng nhẹ hàm lượng protein của tôm so với nhóm tôm chỉ được nuôi bằng CD.
BẢNG 5: Thành phần dinh dưỡng và axit amin (AA) (% tính theo chất khô) của toàn bộ cơ thể tôm thẻ chân trắng (Penaeus vannamei) được cho ăn khẩu phần thử nghiệm trong 90 ngày.
3.4. Tổng số lượng tế bào máu (THC) và hoạt tính của Lysozyme. Các khẩu phần thử nghiệm không ảnh hưởng đáng kể đến hoạt tính THC và lysozyme của tôm sau 90 ngày cho ăn thử nghiệm (Hình 1). Tuy nhiên, về mặt số lượng, Nhóm tôm được cho ăn BD-0,1% HT, BD-0,2% HT và BD-0,3% HT có xu hướng có THC cao hơn. Về mặt số lượng, hoạt tính lysozyme tăng dần khi mức bổ sung HT tăng (Hình 2). Bổ sung 0,4% HT vào BD và CD (BDTD-0,4% HT và CDTD-0,4% HT) làm tăng đáng kể THC và lysozyme.

HÌNH 1: Tổng số lượng tế bào máu của tôm thẻ chân trắng (Penaeus vannamei) (106 tế bào/ mL) vào cuối thử nghiệm cho ăn 90 ngày. Giá trị đại diện cho giá trị trung bình của 15 lần lặp lại (giá trị p=0,8989)

HÌNH 2: Hoạt tính lysozyme của tôm thẻ chân trắng (Penaeus vannamei) (U/ mL) khi kết thúc thử nghiệm cho ăn 90 ngày. Giá trị đại diện cho giá trị trung bình của năm lần lặp (giá trị p=0,4954).
3.5. Tình trạng mô hình học của gan tụy tôm. Việc bổ sung HT ảnh hưởng đến tình trạng mô học của gan tụy tôm (Hình 3). Trong nhóm BD, quan sát thấy sự biến mất của nhân tế bào, cấu trúc cơ quan vô tổ chức, sự giãn nở của lòng ống và nhiều tế bào hoại tử và phá hủy. Trong nhóm khẩu phần ăn cho tôm được bổ sung HT theo mức độ, có ít không bào lipid và tế bào không hoàn chỉnh hơn so với BD cho tôm ăn. Khi mức độ HT tăng, sự hình thành của tế bào R. Tuy nhiên, các cơ quan và nhân tế bào trở nên nhìn thấy được với sự xuất hiện của lòng ống hình ngôi sao. Ở nhóm tôm được cho ăn thức ăn bón thúc (0,4% HT), số lượng tế bào R và tế bào B thể hiện rõ. Lớp phủ HT trong khẩu phần thương mại (CDTD-0,4% HT) cũng cải thiện tính toàn vẹn của gan tụy tôm với số lượng tế bào R và B cao hơn và cấu trúc hình ống được tổ chức tốt và lòng hình sao so với tình trạng gan tụy của tôm chỉ được cho ăn bằng thức ăn thương mại.
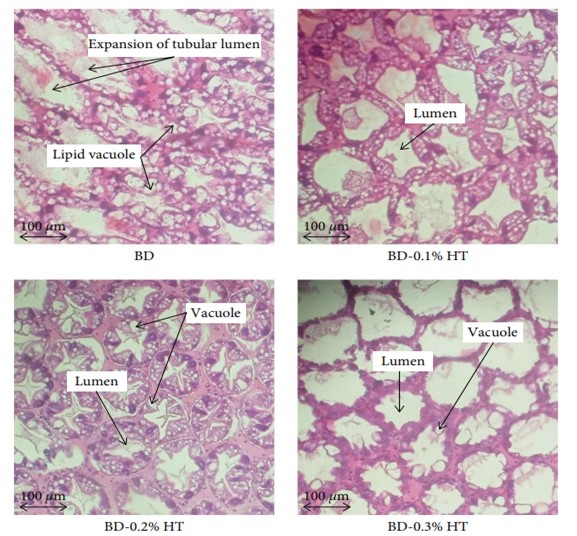

HÌNH 3: Hình ảnh mô bệnh học đại diện của các phần gan tụy được nhuộm hematoxylin và eosin của tôm thẻ chân trắng (Penaeus vannamei) được cho ăn khẩu phần thử nghiệm trong 90 ngày.
Thảo luận
Nghiên cứu này đánh giá tác động của thức ăn bổ sung HT (bổ sung trực tiếp và bón thúc) đối với tôm P. vannamei. Các chỉ tiêu đánh giá bao gồm tăng trưởng, thành phần cơ thể, THC, hoạt động lysozyme và mô học gan tụy. Từ một nghiên cứu có kiểm soát trước đây sử dụng bể thủy sinh, Novriadi và cộng sự đã báo cáo rằng việc sử dụng BD-0,2% hoặc BD-0,3% HT trong khẩu phần ăn có chứa 10% FM có thể thúc đẩy sự tăng trưởng và các thông số miễn dịch huyết học ở tôm P. vannamei. Trong nghiên cứu này, kết quả cho thấy sự gia tăng đáng kể về FBW, PWG, TGC và ADG khi sử dụng hàm lượng HT từ 0,1% đến 0,3% so với BD. Một nghiên cứu của Zhu và cộng sự đã chứng minh rằng sau thử nghiệm cho ăn 60 ngày, FBW của tôm P. vannamei được cho ăn 0,05%–0,15% HT cao hơn đáng kể so với khẩu phần ăn không có HT. Khả năng HT tạo ra hoạt tính của trypsin (TRY), một loại enzyme tiêu hóa cung cấp lượng protein sẵn có và tạo điều kiện cho sự hấp thụ chất dinh dưỡng tốt hơn. Cho đến nay, nghiên cứu này là một trong những nghiên cứu đầu tiên về tác động của HT đối với tôm thẻ chân trắng P. vannamei nuôi trong ao trong thời gian dài (90 ngày).
Các nghiên cứu thương mại về thức ăn cho tôm chứa 30%–35% protein thô có thể bao gồm 7,5%–12,5% bột cá (FM) mà không ảnh hưởng đến hiệu suất tăng trưởng. Trong nghiên cứu này, giảm lượng FM từ 10% xuống 7,5% và bổ sung 0,3% Hematococcus (HT) không ảnh hưởng đến hiệu suất tăng trưởng. Tôm không thể hiện sự tăng trưởng tốt hơn khi cho ăn thức ăn có HT so với thức ăn cơ bản (BD) trong điều kiện được kiểm soát. Nhiều nghiên cứu đã được tiến hành để thay thế FM bằng các thành phần khác trong thức ăn cho tôm sú (P. vannamei). Các tác giả này kết luận rằng giảm FM trong khẩu phần có thể dẫn đến giảm lượng thức ăn ăn vào và khả năng tiêu hóa các chất dinh dưỡng thay thế thấp hơn. Do đó, cần nghiên cứu thêm để xác định mức độ HT thích hợp để bù đắp cho việc giảm FM.
Ngày nay, kỹ thuật bón thúc cung cấp các chất dinh dưỡng chức năng cho sinh vật dưới nước. Kỹ thuật này có thể giúp tăng cường hệ thống miễn dịch và hiệu suất tăng trưởng. Một nghiên cứu cho thấy chiết xuất từ Ulva gutis có thể thúc đẩy tăng trưởng, hệ thống miễn dịch và bảo vệ tôm khỏi virus đầu vàng (YHV). Nghiên cứu này sử dụng kẹo cao su xanthan làm chất kết dính để bón thúc thức ăn cho tôm. Tôm được cho ăn thức ăn bón thúc có tốc độ tăng trưởng và hiệu quả sử dụng thức ăn tốt hơn so với tôm chỉ ăn thức ăn cơ bản. Tuy nhiên, việc bổ sung trực tiếp 0,3% Hematococcus (HT) vào thức ăn cho kết quả tốt hơn so với bón thúc. Có một mối lo ngại liên quan đến phương pháp bón thúc là chất bón thúc có thể phân tán trong nước trước khi tôm ăn, dẫn đến giảm hiệu quả. Ngoài ra, Khả năng cung cấp liều lượng chính xác cho từng cá thể có thể gặp khó khăn vì khả năng thiếu tính đồng nhất trong quá trình bón thúc có thể ảnh hưởng đến hiệu quả.
Khẩu phần ăn HT dường như có tác động tích cực đến sự tích lũy protein và lipid trong cơ thể tôm. Đối với protein, hoạt tính trypsin tăng lên khi có HT. Do đó, khả năng tiêu hóa protein tăng lên, dẫn đến sự đồng hóa và lưu giữ protein được cải thiện. Một nghiên cứu khác sử dụng HT ở cá trắm cỏ Ctenopharyngodon idellus làm tăng biểu hiện mục tiêu của rapamycin (TOR) mRNA trong ruột, kích thích tổng hợp protein. Điều thú vị là đối với quá trình chuyển hóa lipid, Yao và cộng sự báo cáo rằng việc đưa HT từ 0,75% đến 1,75% vào công thức khẩu phần làm giảm hàm lượng lipid cơ của cá trắm cỏ do hoạt tính của lipase thấp. Theo Nyman và Bjorck và Bell, do cấu trúc của lipase, độ bền liên kết giữa tannin và lipase rất lớn và khó biến đổi in vivo, và điều này một phần giải thích cho hoạt tính lipase thấp. Do thông tin về mô hình tích tụ chất dinh dưỡng ở tôm nuôi trong điều kiện nuôi trồng thủy sản rất hạn chế, nên việc tích lũy chất dinh dưỡng tốt hơn trong khẩu phần ăn của tôm với HT có thể là do tác động tích cực của HT đối với chức năng tiêu hóa và hấp thu của sinh vật.
Ở tôm, gan tụy là tuyến tiêu hóa chính có cấu trúc phức tạp và cũng là cơ quan nhạy cảm với sự thay đổi thành phần thức ăn, do đó là một chỉ số quan trọng cho quá trình trao đổi chất. Có báo cáo cho rằng liều lượng tannin thấp có tác động tích cực đến quá trình tiêu hóa và hấp thu ở tôm. Trong nghiên cứu này, khẩu phần ăn cơ bản cho thấy cấu trúc cơ quan vô tổ chức và không có tế bào B và R. Việc bổ sung HT, bao gồm trong khẩu phần ăn công thức hoặc bón thúc, có thể cải thiện tình trạng gan tụy của tôm bằng cách tăng số lượng tế bào R và B, cải thiện cấu trúc hình ống và hình thái hình sao trong lòng tôm. Các tế bào R có vai trò thiết yếu là điều hòa quá trình tiêu hóa, hấp thu, lưu trữ và có thể là bài tiết và giải độc. Thiếu tế bào R và thay đổi cấu trúc gan tụy do hàm lượng SBM cao (44,9%). Việc bổ sung HT trực tiếp hoặc sử dụng quy trình bón thúc vào khẩu phần ăn có thể đã cải thiện tình trạng dinh dưỡng ở tôm thẻ chân trắng.
Ở tôm, khả năng miễn dịch không đặc hiệu đóng vai trò quan trọng để bảo vệ tôm khỏi các vi sinh vật gây hại và stress môi trường. Tế bào máu (tế bào hemocyte) là tác nhân chính bảo vệ cơ thể tôm, tham gia vào nhiều phản ứng miễn dịch: thực bào, tạo hắc tố, bao bọc và đông máu. Nghiên cứu này có xu hướng tăng số lượng tế bào hemocyte (THC) khi bổ sung HT vào thức ăn (0,1% – 0,3%). Ngoài ra, bón thúc HT cũng làm tăng THC. THC cao hơn ở tôm ăn thức ăn có HT so với thức ăn cơ bản hoặc thương mại. Nghiên cứu trước đây cho thấy THC cao nhất ở tôm ăn 0,2% và 0,3% HT trong 60 ngày. Tác động của HT có thể do stress môi trường trong suốt thời gian nuôi. Theo Guo và cộng sự, stress môi trường làm tăng tỷ lệ tế bào hemocyte chết theo chương trình (apoptosis). Nitrite-N là một tác nhân gây stress môi trường phổ biến trong nuôi tôm.
Chúng tôi cũng kiểm tra hoạt động của lysozyme trong mô tôm khi kết thúc thử nghiệm cho ăn. Lysozyme là một enzyme có đặc tính tốt và có khả năng chống lại nhiều loại vi khuẩn. Nồng độ lysozyme cao sẽ xuất hiện tại vị trí bị nhiễm bệnh để chống lại bệnh tật. Trong nghiên cứu này, hoạt tính lysozyme cao hơn ở tôm ăn thức ăn có HT so với thức ăn cơ bản. Việc giảm lượng bột cá (FM) làm giảm hoạt động lysozyme. Hoạt tính lysozyme cao hơn ở tôm ăn thức ăn thương mại có HT, cho thấy mối quan hệ trực tiếp giữa HT và sự điều chỉnh hệ thống miễn dịch không đặc hiệu ở tôm. Các cơ chế khác liên quan đến hệ thống miễn dịch phức tạp của tôm, chẳng hạn như các enzyme chống oxy hóa khác nhau, cũng như penaeidins, là những peptide kháng khuẩn quan trọng trong việc bảo vệ tôm chống lại mầm bệnh vi khuẩn. Khả năng kích thích của hệ thống này sẽ bổ sung cho các cơ chế khác đã được thảo luận và bổ sung thêm kiến thức về cách thức hoạt động của HT.
Kết luận
Kết quả nghiên cứu này cho thấy việc bổ sung HT hoặc kết hợp trực tiếp hoặc sử dụng lớp phủ trên thức ăn, đã nâng cao hiệu suất tăng trưởng và ngăn ngừa sự thay đổi về sức khỏe và tình trạng mô hình thái của tôm thẻ chân trắng P. vannamei. Điều này có thể mang lại những kết quả tích cực trong sản xuất tôm thực tế theo thời gian thực, nhằm thúc đẩy khả năng phục hồi của tôm. Tuy nhiên, phân tích chi phí-lợi ích cần được xác minh.
Theo Romi Novriadi, Otie Dylan Soebhakti Hasan, Khanh Nguyen, Simon Davies, Zahid Gozali Panjaitan, Sinar Pagi Sektiana, Giridhar Rahul Gaddipati, Clara Trullàs
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ảnh Hưởng Của Nồng Độ Kẽm Đến Hiệu Suất Tăng Trưởng Của Tôm Thẻ Chân Trắng Litopenaeus vannamei
- Khai Thác Đất Nước Lợ Thông Qua Hệ Thống Nuôi Tôm Sú
- Nâng Cao Tỷ Lệ Sống Và Biến Thái Của Ấu Trùng Penaeus monodon Bằng Cách Cho Ăn Tảo Cát Thalassiosira weissflogii

 English
English 中文 (中国)
中文 (中国)