TỔNG QUAN
Giun nhiều tơ Perinereis Nuntia được ưa chuộng hơn thức ăn viên công nghiệp trong việc sử dụng để thúc đẩy sự trưởng thành buồng trứng của tôm sú cái Penaeus monodon. Hàm lượng prostaglandin cao trong giun nhiều tơ được cho là có tác dụng tăng cường sự phát triển buồng trứng của tôm.
Tuy nhiên, ảnh hưởng của việc cho ăn giun nhiều tơ đối với quá trình sinh tổng hợp prostaglandin và quá trình điều hòa axit béo của tôm vẫn chưa được nghiên cứu. Vì giun nhiều tơ chứa hàm lượng axit arachidonic (ARA), axit eicosapentaenoic (EPA), prostaglandin E2 (PGE2) và prostaglandin F2α (PGF2α) cao hơn so với thức ăn viên, chúng tôi đã kiểm tra tác động của việc chỉ cho ăn giun nhiều tơ và kết hợp với việc cắt bỏ cuống mắt đối với gan tụy và buồng trứng của tôm. Tôm được nuôi bằng giun nhiều tơ chứa hàm lượng EPA, PGE2 và PGF2α trong gan tụy cao hơn so với tôm được cho ăn thức ăn viên. Tương tự, nồng độ ARA cao hơn và mức độ phiên mã cao hơn của cyclooxygenase (COX) và prostaglandin F synthase (PGFS) được phát hiện trong buồng trứng của tôm được cho ăn bằng giun nhiều tơ so với tôm được cho ăn thức ăn viên. Sự kết hợp giữa việc cho ăn giun nhiều tơ và cắt bỏ cuống mắt, thường được thực hiện để kích thích sự phát triển buồng trứng, làm tăng mức độ ARA và EPA cũng như mức độ phiên mã của COX trong gan tụy và buồng trứng của tôm hơn so với tôm được cho ăn thức ăn viên. Ở buồng trứng, các bản phiên mã gen sinh tổng hợp prostaglandin được tạo ra bằng cách cho ăn giun nhiều tơ, trong khi mức độ phiên mã của các gen điều hòa axit béo được điều chỉnh bằng cách kết hợp thức ăn tôm và cắt bỏ cuống mắt. Những phát hiện của chúng tôi không chỉ làm sáng tỏ tác động của việc tiêu thụ giun nhiều tơ lên quá trình sinh tổng hợp prostaglandin của tôm và con đường điều hòa axit béo trong quá trình sản xuất ấu trùng, mà còn gợi ý rằng hàm lượng ARA, EPA và prostaglandin cao trong chế độ ăn là rất cần thiết trong quá trình phát triển buồng trứng của tôm sú P. monodon.
GIỚI THIỆU
Việc thuần hóa tôm sú Penaeus monodon luôn bị cản trở bởi tỷ lệ trưởng thành buồng trứng ở tôm bố mẹ thấp (Benzie 1997). Hàm lượng prostaglandin được cho là yếu tố quan trọng, vai trò của chúng đối với sự trưởng thành của buồng trứng ở một số loài giáp xác đang được nghiên cứu. Lượng prostaglandin E2 (PGE2) trong buồng trứng đã được quan sát thấy tăng lên trong quá trình phát triển buồng trứng ở tôm càng Florida Procambarus paeninsulanus, cua đồng nước ngọt Oziotelphusa senex senex và tôm sú P. monodon (Spaziani và cộng sự 1993, Reddy và cộng sự 2004, Meunpol và cộng sự 2010, Wimuttisuk và cộng sự 2013). Ngược lại, lượng PGE2 giảm khi tế bào trứng trưởng thành ở tôm nước ngọt Macrobrachium rosenbergii và tôm kuruma Marsupenaeus japonicus (Tahara & Yano 2004, Sumpownon và cộng sự 2015). Mối tương quan giữa nồng độ prostaglandin và sự trưởng thành của tế bào trứng đã được chứng minh trong điều kiện in vitro, với việc ủ tế bào trứng tôm sú P. monodon trong môi trường nuôi cấy tế bào được bổ sung PGE2 tổng hợp hoặc chiết xuất giun nhiều tơ giàu prostaglandin làm tăng số lượng tế bào trứng trưởng thành và vitellogen (Meunpol và cộng sự 2010). Tương tự, việc tiêm PGE2 hoặc prostaglandin F2α (PGF2α) vào cua O. senex senex và PGE2 vào tôm M. rosenbergii đã làm tăng giá trị chỉ số sinh dục (GSI) ở các loài giáp xác này (Reddy và cộng sự 2004, Sumpownon và cộng sự 2015).
Mặc dù prostaglandin đã được chứng minh là cải thiện sự phát triển buồng trứng của loài giáp xác, nhưng những prostaglandin này được sử dụng nhân tạo. Trong các trại sản xuất giống và trang trại nuôi tôm, prostaglandin có thể được cung cấp thông qua việc cho ăn giun nhiều tơ, với các chất dinh dưỡng ăn vào sẽ được lưu trữ và chuyển hóa ở gan tụy (Vogt 1994, Wen và cộng sự 2001). Việc sử dụng giun nhiều tơ Perinereis nuttia làm thức ăn cho tôm được ưa chuộng hơn vì nó chứa lượng PGE2 cao nhất trong số các loại thức ăn sống khác, bao gồm giun nhiều tơ trong bùn, trai biển lớn, mực và nghêu (Meunpol và cộng sự 2010). Giun nhiều tơ cũng chứa lượng axit arachidonic (ARA), tiền chất lipid của prostaglandin, cao hơn so với các loại thức ăn sống khác (Meunpol và cộng sự 2010, Chimsung 2014). Việc tiêu thụ giun nhiều tơ đã được chứng minh là làm tăng lượng ARA trong gan tụy của tôm M. japonicus (Binh và cộng sự 2008). Việc tăng hàm lượng lipid trong gan tụy giáp xác có tương quan với những thay đổi phiên mã trong con đường điều hòa axit béo, bao gồm quá trình oxy hóa beta, chuyển hóa, tổng hợp và vận chuyển ở cua lông Trung Quốc Eriocheir sinensis, cua bơi xanh Portunus trituberculatus, tôm thẻ chân trắng Penaeus vannamei và tôm sú P. monodon (Chen và cộng sự 2015, Wei và cộng sự 2017, Deenarn và cộng sự 2018, Yuan và cộng sự 2019).
Trong nghiên cứu này, phân tích so sánh đã được thực hiện để kiểm tra những thay đổi trong quá trình sinh tổng hợp prostaglandin và con đường điều hòa axit béo do thức ăn cho tôm. Những thay đổi này được theo dõi ở tôm trước và sau khi thực hiện quá trình cắt bỏ cuống mắt, kết quả là tôm có các giai đoạn phát triển buồng trứng khác nhau. Ngoài ra, nghiên cứu cung cấp những hiểu biết mới về những thay đổi trong quá trình trao đổi chất và phiên mã xảy ra ở tôm mẹ trong bối cảnh các trại sản xuất giống và trang trại nuôi tôm.
NGUYÊN LIỆU VÀ PHƯƠNG PHÁP
Tuyên bố về đạo đức
Các thử nghiệm và thí nghiệm đối với tôm trong nghiên cứu này đã được phê duyệt bởi Ủy ban Chăm sóc và Sử dụng Động vật của Trung tâm Kỹ thuật Di truyền và Công nghệ sinh học Quốc gia, Thái Lan. Tất cả các thí nghiệm được thực hiện theo Nghiên cứu Động vật: Báo cáo Thí nghiệm trong điều kiện In Vivo (ARRIVE) và tuân thủ các yêu cầu pháp lý và đạo đức quốc tế và quốc gia (Elwood và cộng sự 2009, Kilkenny và cộng sự 2010). Tôm được gây mê bằng cách hạ thân nhiệt để tránh sự đau đớn trước khi thực hiện mổ xẻ.
Thí nghiệm nuôi và cho ăn
Tôm sú cái P. monodon gia hóa, 11 tháng tuổi với trọng lượng cơ thể trung bình 65,8 ± 14,0g được chuyển từ ao đất và thuần trong sáu bể bê tông (n = 32 con/bể) trong 11 ngày trước khi bắt đầu thí nghiệm. Mật độ tôm được duy trì ở mức 2,5 con/m2. Tôm được cho ăn thức ăn viên thương mại B2 (Charoen Pokphand Food Public Company, Ltd., Bangkok, Thái Lan) và duy trì trong nước biển độ mặn 30ppt và nhiệt độ 27 độ C. Nồng độ amoni, nitrit và nitrat, độ kiềm và pH được theo dõi và điều chỉnh 2 lần/tuần như mô tả trước đây (Deenarn và cộng sự 2018).
Tôm trong 3 bể bê tông được cho ăn thức ăn viên thương mại B2 và số còn lại được cho ăn giun nhiều tơ P. nutia trưởng thành hoàn toàn với tỷ lệ 2–10% trọng lượng cơ thể tôm trong 4 tuần, tùy thuộc vào tỷ lệ tiêu thụ. Tôm với phụ bộ đầy đủ được thu thập vào tuần 0 (W0, n = 3 con/bể) và vào cuối tuần 4 (W4, n = 3 mỗi bể). Việc cắt bỏ một bên cuống mắt được thực hiện vào cuối tuần thứ 4 và tôm bố mẹ được duy trì trong 9 ngày. Việc lấy mẫu diễn ra vào các ngày 1, 4, 7 và 9 (Hình bổ sung 1, xem phần tài liệu bổ sung ở cuối bài viết này). Trọng lượng và chiều dài cơ thể tôm được đo và ghi lại. Gan tụy và buồng trứng được mổ, cân và cấp đông nhanh trong dung dịch N2.
GSI của từng cá thể tôm bố mẹ được tính theo phương trình sau:
GSI = (trọng lượng buồng trứng/trọng lượng cơ thể) x 100
Giai đoạn phát triển buồng trứng của từng cá thể tôm bố mẹ được xác định dựa trên giá trị GSI: giai đoạn 1 (GSI < 2), giai đoạn 2 (GSI = 2–3,99), giai đoạn 3 (GSI = 4–6) và giai đoạn 4 (GSI > 6). Chỉ số gan (HSI) được tính theo phương trình sau:
HSI = (trọng lượng gan tụy/trọng lượng cơ thể) x 100
Phân tích dinh dưỡng trong thức ăn tôm
50g thức ăn viên và giun nhiều tơ được lấy mẫu hàng ngày. Các mẫu thức ăn được gộp lại theo mẻ hàng tuần và gửi đi để thực hiện phân tích gần đúng và phân tích thành phần axit béo bằng cách sử dụng máy dò ion hóa ngọn lửa sắc ký khí (GC-FID) tại Công ty TNHH Phòng thí nghiệm Trung tâm (Thái Lan) (Songkla, Thái Lan). Phân tích gần đúng được thực hiện theo hướng dẫn của Hiệp hội các nhà hóa học nông nghiệp chính thức (AOAC). Phân tích GC được thực hiện bằng Agilent 6890N GC-FID (Agilent) được trang bị cột mao quản (100m × 0,25mm id, 0,2µm, Supelco, Pennsylvania, Hoa Kỳ). Nhiệt độ phát hiện và tiêm được đặt ở 250°C. Tốc độ dòng khí mang (He) được đặt ở mức 1,1 mL/phút. Các mẫu được so sánh với hỗn hợp metyl este metyl axit béo thành phần Supelco 37 tiêu chuẩn bằng phương pháp nội bộ TE-CH-208 dựa trên hướng dẫn AOAC 996.06 (DeVries và cộng sự 1999).
Chiết xuất axit béo không bão hòa đa (PUFA) từ mô tôm
Buồng trứng và gan tụy của tôm được đồng nhất hóa và điều chỉnh ở mức 0,2g mô/mL trong dung dịch muối cân bằng Hank (HBSS) ở nồng độ thẩm thấu 720 mmol/kg (Sigma-Aldrich). Các chất đồng nhất mô được chiết hai lần với một thể tích bằng etyl axetat. Các pha dung môi được gộp lại, làm khô trong chân không và hòa tan trong metanol 5%. Dịch chiết được nạp vào hộp mực C18 SPE 6mL (VertiPakTM, Vertical Chromatography, Co., Ltd., Thái Lan), được rửa trước bằng 10mL metanol và 10mL nước. Sau đó rửa cột bằng 10mL nước, 4mL hexan và rửa lại bằng 10mL nước. Các mẫu được rửa giải bằng 10mL etyl axetat. Dịch rửa giải được làm khô trong chân không và hòa tan trong etanol để phân tích HPLC pha đảo (RP-HPLC).
Phân tích thành phần lipid của dịch chiết nội tạng bằng RP-HPLC
Dịch chiết nội tạng được phân tích bằng RP-HPLC trên cột Acclaim® 120 C18 (3μm, 4,6mm × 150mm) (DIONEX, Surrey, UK). Pha động bao gồm 0,01% axit axetic trong nước (dung môi A) và 0,01% axit axetic trong acetonitril (dung môi B). Chương trình gradient bắt đầu với 30% dung môi B và tăng lên 100% dung môi B trong vòng 35 phút. ARA, axit eicosapentaenoic (EPA) và axit docosahexaenoic (DHA) đã được phát hiện bằng máy dò mảng đi-ốt DIONEX Ultimate 3000 (DIONEX) và lượng ARA, EPA và DHA được tính toán bằng phương pháp đường chuẩn như đã mô tả trước đây (Wimuttisuk và cộng sự 2013, 2017).
Xét nghiệm miễn dịch enzyme
Giun nhiều tơ, thức ăn viên, buồng trứng và gan tụy tôm được đồng nhất hóa trong HBSS. Các chất đồng nhất được ly tâm ở tốc độ 12.000g trong 2 phút ở 4°C để loại bỏ các mảnh vụn của tế bào. Lượng PGE2 và PGF2α trong phần nổi phía trên được ước tính bằng cách sử dụng bộ xét nghiệm miễn dịch enzyme (EIA) PGE2 và PGF2α (Cayman Chemical), tương ứng. Đường cong liều lượng -phản ứng được tạo ra với các tiêu chuẩn PGE2 và PGF2α ở các nồng độ tương ứng nằm trong khoảng từ 15,63–250,00 pg/mL đến 7,80–250,00 pg/mL. Giới hạn định lượng của PGE2 và PGF2α lần lượt là 15,63 pg/mL và 7,80 pg/mL. Hệ số phương sai (CV) trung bình trong ngày của tất cả các nhóm đối chứng là 6,41% đối với PGE2 và 7,69% đối với PGF2α. CV trung bình giữa các ngày của tất cả các nhóm đối chứng là 7,57% đối với PGE2 và 10,50% đối với PGF2α. Đối với bộ PGE2 EIA, PGF2α có phần trăm phản ứng chéo là 0,07% và nhỏ hơn 0,001% đối với prostaglandin D2 (PGD2) và ARA. Đối với bộ PGF2α EIA, PGE2 có phần trăm phản ứng chéo là 0,66% và nhỏ hơn 0,001% đối với PGD2 và ARA.
Chiết tách RNA và tổng hợp cDNA
Gan tụy và buồng trứng được tách chiết RNA tổng số bằng thuốc thử Trizol (Invitrogen) và xử lý DNase bằng DNase không chứa RNase (Promega). RNA tổng số được sao chép ngược bằng cách sử dụng Bộ tổng hợp cDNA chuỗi đầu tiên RevertAidTM với đoạn mồi oligo (dT)18 (Thermo Scientific).
Phân tích real-time PCR định lượng
Phân tích real-time PCR định lượng (qPCR) được thực hiện trên từng mẫu cDNA riêng lẻ bằng cách sử dụng SsoFast EvaGreen Supermix (Bio-Rad) theo hướng dẫn của nhà sản xuất. Trình tự mồi cho quá trình sinh tổng hợp prostaglandin và gen điều hòa axit béo được cung cấp trong Bảng bổ sung 1. Phân tích đường cong nóng chảy cho từng cặp mồi được thực hiện như mô tả trước đây (Deenarn và cộng sự 2018). Số lượng bản sao gen mục tiêu liên quan đến yếu tố kéo dài 1α (EF1A) thu được bằng phương pháp đường cong tiêu chuẩn. 9 bản sao sinh học đã được sử dụng cho từng thời điểm và giai đoạn trưởng thành của buồng trứng (n = 9), ngoại trừ tôm được cho ăn thức ăn viên và được cắt bỏ cuống mắt với buồng trứng giai đoạn 2 (n = 5).
Phân tích thống kê
Sự khác biệt đáng kể giữa giá trị trung bình của các mẫu độc lập từ hai nhóm thức ăn được đánh giá bằng cách sử dụng thử nghiệm t với ngưỡng ý nghĩa được đặt tại P < 0,05 (*) hoặc P < 0,01 (**). Các phân tích thống kê khác đã được thực hiện bằng kiểm tra Dunnett để xác định sự khác biệt đáng kể giữa giá trị trung bình của các mẫu được chỉ định. Ngưỡng ý nghĩa của thử nghiệm Dunnett được đặt tại P < 0,05 (#, † và $) và P < 0.01 (##, †† và $$).
KẾT QUẢ
Phân tích dinh dưỡng thức ăn tôm
Phân tích gần đúng về thức ăn cho tôm cho thấy giun nhiều tơ chứa lượng chất béo lớn hơn nhưng ít tro hơn thức ăn viên (Hình 1A). Độ ẩm, protein và chất xơ tương đương nhau giữa hai loại thức ăn. Phân tích GC-FID cho thấy thức ăn viên chứa hàm lượng cao hơn 6 axit béo bão hòa (C12:0, C14:0, C20:0, C22:0, C23:0 và C24:0), 2 axit béo không bão hòa đơn (C22:1n9 và C24:1n9) và 3 axit béo không bão hòa đa (C18:3n6, C20:3n3 và C22:6n3) so với giun nhiều tơ (Bảng bổ sung 2). Ngược lại, giun nhiều tơ chứa hàm lượng 13 axit béo cao hơn, bao gồm ARA (C20:4n6) và EPA (C20:5n3), so với thức ăn viên (Hình 1B). Hàm lượng PGE2 và PGF2α, là sản phẩm của ARA, trong giun nhiều tơ cũng cao hơn so với thức ăn viên (Hình 1C).
Ảnh hưởng của thức ăn tôm đến trọng lượng cơ thể, chỉ số gan và sự phát triển buồng trứng của tôm
Tôm với phụ bộ đầy đủ được thu thập ở W0 và W4 chứa buồng trứng giai đoạn 1 bất kể loại thức ăn nào (Hình 1D và E). Sau khi thực hiện cắt bỏ cuống mắt, tôm được cho ăn thức ăn viên cho thấy buồng trứng đạt giai đoạn 1 và 2, trong khi tôm được cho ăn bằng giun nhiều tơ cho thấy buồng trứng có thể đạt đến cả 4 giai đoạn trưởng thành. Trọng lượng cơ thể tôm có thể so sánh được giữa nhóm ăn giun nhiều tơ và nhóm ăn thức ăn viên ở mọi thời điểm (Hình 1F). Mặt khác, màu sắc và kích thước của gan tụy khác nhau giữa tôm được nuôi bằng thức ăn viên và giun nhiều tơ (Hình 1G). Chỉ số gan trung bình (HSI) của tôm được nuôi bằng giun nhiều tơ cũng cao hơn tôm được nuôi bằng thức ăn viên sau 4 tuần cho ăn và trong các mẫu đã cắt bỏ cuống mắt (Hình 1H).
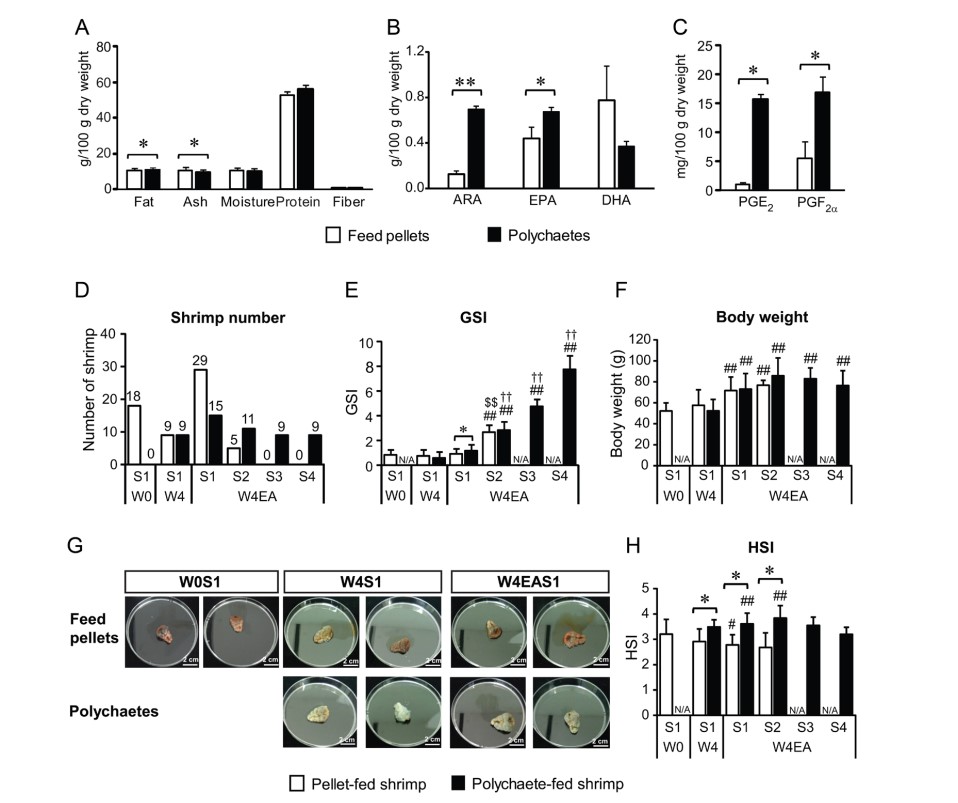
Hình 1. Đánh giá dinh dưỡng trong thức ăn cho tôm và ảnh hưởng của chúng đến trọng lượng cơ thể tôm, GSI và HSI. (A, B và C) 50g thức ăn viên và giun nhiều tơ được thu thập hàng ngày trong quá trình thử nghiệm thức ăn và gộp lại thành nhóm hàng tuần để phân tích (n = 5). (A) Phân tích dinh dưỡng của thức ăn viên và giun nhiều tơ được thực hiện để xác định lượng chất béo, tro, độ ẩm, protein và chất xơ. (B) Mức ARA, EPA và DHA trong thức ăn nuôi tôm đã được xác định. (C) Mức PGE2 và PGF2α trong thức ăn tôm được xác định bằng xét nghiệm miễn dịch enzyme. (D) Số lượng tôm, (E) giá trị GSI trung bình và (F) trọng lượng cơ thể trung bình của tôm được phân tích theo nhóm thức ăn, thời điểm và giai đoạn trưởng thành của buồng trứng. (G) Gan tụy được thu thập từ tôm có buồng trứng giai đoạn 1 được cho ăn thức ăn viên (bảng trên) và giun nhiều tơ (bảng dưới) ở tuần 0 (W0S1), sau 4 tuần cho ăn (W4S1) và sau khi cắt bỏ cuống mắt (W4EAS1). (H) Giá trị HSI trung bình của tôm từ các nhóm thức ăn khác nhau, các thời điểm và giai đoạn trưởng thành khác nhau của buồng trứng. Thanh lỗi cho biết độ lệch chuẩn. Dấu hoa thị * cho thấy sự khác biệt đáng kể giữa thức ăn viên và giun nhiều tơ ở mức P < 0,05. Dấu #, ## cho thấy sự khác biệt đáng kể giữa điều kiện chỉ định và điều kiện đối chứng ở W0 tại P < 0,05 và P < 0,01 tương ứng. Dấu $$ cho thấy sự khác biệt đáng kể giữa điều kiện được đánh dấu và tôm được cho ăn thức ăn viên ở W4EAS1 với P < 0,01. Dấu †† cho thấy sự khác biệt đáng kể giữa điều kiện được đánh dấu và tôm được cho ăn bằng giun nhiều tơ ở W4EAS1 với P < 0,01. N/A chỉ ra rằng mẫu tôm không có sẵn trong giai đoạn được đánh dấu. Các giai đoạn trưởng thành khác nhau của buồng trứng được thể hiện là S1 cho giai đoạn 1, S2 cho giai đoạn 2, S3 cho giai đoạn 3 và S4 cho giai đoạn 4.
Những thay đổi ở gan tụy của tôm còn đầy đủ phụ bộ
Để xác định xem lượng ARA, EPA và DHA trong gan tụy tôm có bị ảnh hưởng bởi thức ăn cho tôm hay không, phân tích RP-HPLC được thực hiện trên gan tụy của tôm còn đầy đủ phụ bộ được thu thập ở W0 và W4. Ở W4, nồng độ EPA trong gan tụy của tôm được cho ăn bằng giun nhiều tơ cao hơn so với tôm được cho ăn thức ăn viên (Hình 2B). Ngoài ra, hàm lượng ARA, EPA và DHA trong gan tụy của tôm được nuôi bằng giun nhiều tơ ở W4 cũng cao hơn so với W0 (Hình 2A, B và C). Phân tích RT-qPCR cũng được thực hiện trên các mẫu này, cho thấy gan tụy của tôm được nuôi bằng giun nhiều tơ ở W4 cho thấy mức độ phiên mã của cytosolic phospholipase A2 (cPLA2) và prostaglandin F synthase (PGFS) tăng lên, nhưng mức độ phiên mã của cyclooxygenase (COX) lại giảm khi so sánh với tôm được cho ăn thức ăn viên ở W4 (Hình 2D, E và I). Không có sự khác biệt đáng kể nào được quan sát đối với các gen liên quan đến sản xuất PGE2, cụ thể là prostaglandin E synthase 1 (PGES1), prostaglandin E synthase 2 (PGES2) và prostaglandin E synthase 3 (PGES3) (Hình 2F, G và H). Tuy nhiên, hàm lượng PGE2 và PGF2α trong gan tụy của tôm được cho ăn bằng giun nhiều tơ cao hơn lần lượt là 15 và 12 lần so với tôm được cho ăn thức ăn viên (Hình 2J và K).
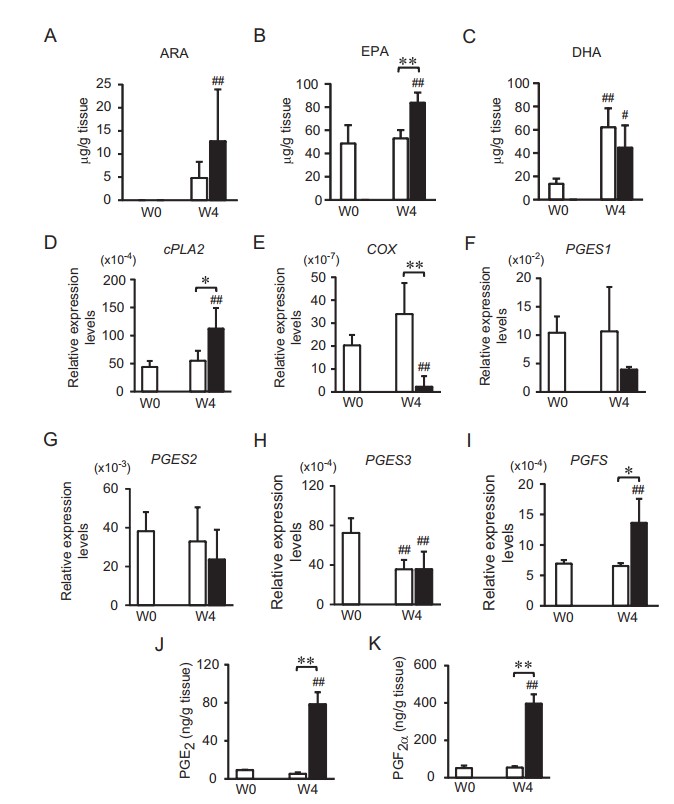
Hình 2: Ảnh hưởng của thức ăn tôm đến con đường sinh tổng hợp prostaglandin ở gan tụy tôm. Gan tụy tôm được thu thập khi bắt đầu thí nghiệm cho ăn, khi tôm chỉ được cho ăn thức ăn viên (W0, n = 18) và sau khi tôm được cho ăn thức ăn viên (thanh màu trắng, n = 9) hoặc giun nhiều tơ (thanh màu đen, n = 9) trong 4 tuần (W4). Tất cả các mẫu tôm đều có buồng trứng giai đoạn 1. Mức độ (A) ARA, (B) EPA và (C) DHA trong gan tụy đã được xác định. Mức độ biểu hiện của (D) cPLA2, (E) COX, (F) PGES1, (G) PGES2, (H) PGES3 và (I) PGFS trong gan tụy tôm được xác định bằng RT-qPCR và được biểu thị so với EF1A. Mức độ (J) PGE2 và (K) PGF2α trong gan tụy tôm được xác định bằng cách sử dụng xét nghiệm miễn dịch enzyme. Thanh lỗi cho biết độ lệch chuẩn. Dấu *, ** cho thấy sự khác biệt đáng kể giữa thức ăn viên và giun nhiều tơ ở mức P < 0,05 và P < 0,01, tương ứng. Dấu #, ## cho thấy sự khác biệt đáng kể giữa điều kiện được chỉ định và điều kiện đối chứng ở W0 với P < 0,05 và P < 0,01, tương ứng.
Do cấu trúc axit béo khác nhau trong thức ăn tôm, nên những thay đổi trong biểu hiện gen điều hòa axit béo đã được kiểm tra ở gan tụy tôm sau 4 tuần cho ăn. Gan tụy của tôm được cho ăn bằng giun nhiều tơ chứa mức độ phiên mã stearoyl-CoA desaturase (SCD) cao hơn và mức độ phiên mã của enoyl-CoA hydratase (ECH) thấp hơn so với tôm được cho ăn thức ăn viên (Hình 3A và I). Ngoài ra, mức độ phiên mã của hai gen vận chuyển axit béo, protein vận chuyển axit béo chuỗi dài 4 (FATP4) và protein liên kết với axit béo (FABP), cũng tăng lên khi thời gian cho ăn tăng từ W0 lên W4 trong gan tụy của tôm được nuôi bằng giun nhiều tơ (Hình 3E và F).

Hình 3: Ảnh hưởng của thức ăn tôm đến mức độ biểu hiện tương đối của gen điều hòa axit béo trong gan tụy tôm. Gan tụy tôm được thu thập khi bắt đầu thí nghiệm cho ăn, khi tôm chỉ được cho ăn thức ăn viên (W0, n=18) và và sau khi tôm được cho ăn thức ăn viên (thanh màu trắng, n=9) hoặc giun nhiều tơ (thanh màu đen, n=9) trong 4 tuần (W4). Tất cả các mẫu tôm đều có buồng trứng giai đoạn 1. Mức độ biểu hiện của gen điều hòa axit béo trong gan tụy tôm thu thập ở W0 và W4 được xác định bằng RT-qPCR và được biểu thị so với EF1A. Các gen điều hòa axit béo bao gồm (A) SCD và (B) FASN trong quá trình sinh tổng hợp axit béo; (C) LPR, (D) FATP1, (E) FATP4 và (F) FABP trong con đường vận chuyển axit béo; và (G) ACAT, (H) ACAD và (I) ECH trong con đường oxy hóa beta axit béo. Thanh lỗi cho biết độ lệch chuẩn. Dấu *, ** cho thấy khác biệt đáng kể giữa thức ăn viên và giun nhiều tơ ở mức P < 0,05 và P < 0,01, tương ứng. Dấu #, ## cho thấy sự khác biệt đáng kể giữa điều kiện được chỉ định và điều kiện đối chứng ở W0 với P < 0,05 và P < 0,01, tương ứng.
Theo Pacharawan Deenarn, Punsa Tobwor, Vanicha Vichai, Suwanchai Phomklad, Panomkorn Chaitongsakul, Rungnapa Leelatanawit và Wananit Wimuttisuk
Nguồn: https://doi.org/10.1530/REP-20-0217
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Probiotic Trong Nuôi Trồng Thủy Sản: Tầm Quan Trọng Và Triển Vọng Tương Lai
- Ảnh Hưởng Của Chế Phẩm Sinh Học Loài Bacillus (Bacillus subtilis Và B. licheniformis) Đến Chất Lượng Nước, Phản Ứng Miễn Dịch Và Sức Đề Kháng Của Tôm Chân Trắng (Litopenaeus vannamei) Chống Lại Nhiễm Nấm Fusarium solani
- Tôm Sạch Mầm Bệnh: Tiến Bộ Của Ngành Nuôi Tôm

 English
English