Tóm tắt
Hormone terpenoid methyl farnesoate (MF) được chứng minh là đóng vai trò quan trọng trong việc kiểm soát quá trình sinh sản ở động vật giáp xác. Để có thêm thông tin về vai trò và cơ chế hoạt động có thể có của nó, MF được bổ sung qua đường miệng cho Penaeus monodon đã cắt mắt với nồng độ 5,5 μg/ gram khẩu phần ăn và tiến hành đo các tiêu chí hiệu suất sinh sản. Kết quả xác nhận MF đóng một vai trò trong quá trình sinh sản của loài này. Cụ thể, trong các điều kiện của nghiên cứu này, MF ức chế sự phát triển buồng trứng giai đoạn cuối và giảm khả năng sinh sản ở tôm bị cắt mắt. Tác động của khẩu phần ăn nhân tạo (không bổ sung MF) so với khẩu phần ăn mực-vẹm, cũng được đánh giá trong nghiên cứu này và mặc dù nó làm tăng chất lượng ấu trùng được sản xuất, nhưng nó cũng làm tăng ức chế sự phát triển buồng trứng giai đoạn cuối. Do đó, trong khi nghiên cứu này đã nâng cao kiến thức về MF bằng cách tách biệt giai đoạn phát triển buồng trứng mà tại đó MF điều chỉnh sinh sản ở P. monodon, nhưng các yếu tố xác định mức độ ảnh hưởng và liệu nó có tác dụng kích thích hay ức chế vẫn chưa được biết rõ. Cho đến khi các yếu tố này được xác định, việc áp dụng MF như một phương tiện kiểm soát việc sản xuất trứng trong tôm nuôi nhốt vẫn còn phát sinh nhiều vấn đề.
1. Giới thiệu
Kiểm soát sinh sản của các loài thủy sản nuôi là điều kiện tiên quyết cho khả năng tồn tại và mở rộng ngành. Điều này chỉ đạt được một phần ở tôm sú Penaeus monodon, một loài nuôi trồng thủy sản phổ biến ở Đông Nam Á (Coman và cộng sự, 2006). Cần phải kiểm soát sinh sản tốt hơn để cho phép sử dụng tôm bố mẹ đánh bắt tự nhiên hiệu quả hơn và cuối cùng, để đạt được sự thuần hóa hoàn toàn (vòng đời khép kín ở quy mô thương mại trong điều kiện nuôi nhốt) của loài này. Việc thuần hóa sẽ cung cấp các cơ hội để cải thiện di truyền và kiểm soát tình trạng mầm bệnh trong tương lai (xem lại ở Browdy, 1998).
Tôm sú P. monodon là một trong những loài tôm He khó sinh sản nhất trong điều kiện nuôi nhốt, cho thấy nó nhạy cảm với điều kiện môi trường. Việc cắt bỏ một bên cuống mắt được các nhà sản xuất giống sử dụng thường xuyên để thúc đẩy sự phát triển buồng trứng (Primavera 1984). Tuy nhiên, phương pháp thô sơ này nhằm giảm mức độ ức chế neuropeptide (cụ thể là hormone ức chế vitellogenesis (VIH); xem lại ở Keller 1992 và Huberman 2000) không phải lúc nào cũng hiệu quả trong việc thúc đẩy sự phát triển và sinh sản buồng trứng tôm (Aquacop, 1977, 1979; Beard và Wickens, 1980; Arnstein và Beard, 1975; Hansford và Marsden, 1995; Marsden và cộng sự, 2007). Ngoài yêu cầu giảm nồng độ VIH được đề xuất, cần có hormone kích thích để thúc đẩy sự phát triển buồng trứng (CharniauxCotton, 1985; Quackenbush, 1986; Huberman, 2000) và chúng hoạt động để đáp ứng với các tín hiệu môi trường mà P. monodon thiếu trong môi trường nuôi nhốt (Tsutsui và cộng sự, 2005).
Nhiều hormone kích thích đã được đề xuất làm chất điều chỉnh sinh sản ở giáp xác (Huberman, 2000) bao gồm methyl farnesoate (MF), một hormone terpenoid được tổng hợp trong cơ quan hàm dưới (MO). MF tham gia vào các quá trình điều hòa nội tiết tố ở động vật giáp xác (Kuballa và cộng sự, 2007; Nagaraju và cộng sự, 2004; Lovett và cộng sự, 2001; Soroka và cộng sự, 1993; Sagi và cộng sự, 1994; Freeman và Costlow, 1980) và có nhiều bằng chứng cho thấy MF kích thích hoặc tăng cường các khía cạnh khác nhau của sinh sản ở giáp xác (Nagaraju và cộng sự, 2004, để xem xét lại Laufer và Biggers, 1992). Ví dụ, sự gia tăng mức độ MF in vitro có tương quan với đường kính noãn bào tăng ở tôm (Tsukimura và Kamemoto, 1991; Laufer và cộng sự, 1997) và với biểu hiện gen Vg (vitellogenin) tăng trong gan tụy và buồng trứng của tôm Metapenaeus ensis (Tiu và cộng sự, 2006) và cua đỏ Charybdis feriatus (Mak và cộng sự, 2005). Ngoài ra, kích thước tuyến sinh dục đực và tỷ lệ giao phối đã được chứng minh là tăng lên ở các loài giáp xác khác nhau sau khi dùng MF in vivo (Homola và cộng sự, 1991; Sagi và cộng sự, 1994; Laufer và cộng sự, 1993; Nagaraju và cộng sự, 2004).
Đặc biệt quan trọng là kết quả của các nghiên cứu in vivo trước đây đã chứng minh rằng việc đưa MF vào khẩu phần ăn tôm bố mẹ làm tăng liều lượng phụ thuộc trong khả năng sinh sản (Laufer, 1992; Laufer và cộng sự, 1997), tần suất sinh sản và tỷ lệ sống của ấu trùng (Laufer, 1992) ở tôm thẻ chân trắng L. vannamei bị cắt mắt và tăng khả năng sinh sản, tỷ lệ nở và khả năng sinh sản ở P. monodon bị cắt mắt (Hall và cộng sự, 1999). Những phát hiện này cho thấy rằng sự kết hợp cắt bỏ cuống mắt với MF qua đường miệng có thể có khả năng cải thiện số lượng và chất lượng ấu trùng được sản xuất trong các trại giống tôm sú P. monodon thương mại.
Về mặt ứng dụng thực tế, có rất ít thông tin về cơ chế mà MF điều chỉnh các khía cạnh cụ thể của sinh sản như phát triển buồng trứng, khả năng sinh sản và tốc độ nở. Giai đoạn phát triển buồng trứng mà tại đó MF có tác dụng điều tiết đáng kể nhất cũng chưa được biết rõ (Wainwright và cộng sự, 1998; Nagaraju và cộng sự, 2004, 2006). Ví dụ, mặc dù MO trong tôm tiết ra MF cao nhất trong giai đoạn phát triển buồng trứng (Laufer và cộng sự, 1986, 1987), các tế bào trứng chưa trưởng thành đã được chứng minh là tăng kích thước khi sử dụng MF (Tsukimura và Kamemoto, 1991). Tương tự, nồng độ MF trong haemolymph ở cua được chứng minh là cao nhất trong quá trình hình thành noãn hoàng trước và sớm (Nagaraju và cộng sự, 2004; Ruddell và cộng sự, 2003).
Các kết quả không nhất quán đạt được cho đến nay trong và giữa các loài tôm (Laufer, 1992; Hall và cộng sự, 1999) nhấn mạnh sự cần thiết phải nghiên cứu sâu hơn để đánh giá tiềm năng của MF qua đường miệng như một giải pháp thiết thực để cải thiện sản xuất trứng và ấu trùng ở tôm sú tôm sú bố mẹ. Mức độ dự đoán cao sẽ rất cần thiết cho bất kỳ ứng dụng thương mại MF trong nuôi cấy loài này.
Nghiên cứu hiện tại nhằm kiểm tra xem việc đưa MF vào khẩu phần ăn của tôm bố mẹ (đực và cái), kết hợp với cắt bỏ cuống mắt, có cung cấp một phương pháp để tăng sản lượng ấu trùng từ tôm bố mẹ P. monodon hay không.
2. Vật liệu và phương pháp
Nghiên cứu này so sánh ảnh hưởng của ba khẩu phần ăn đối với hiệu suất sinh sản của tôm bị cắt mắt. Một khẩu phần ăn tổng hợp (BIARC) đã được sử dụng như một vectơ khi sử dụng MF qua đường miệng. Bao gồm 2 khẩu phần ăn đối chứng; khẩu phần ăn BIARC không có MF và khẩu phần ăn tự nhiên có hải sản tươi sống đông lạnh (như được mô tả dưới đây). Khẩu phần ăn tự nhiên đã được bao gồm để tách biệt tác dụng của khẩu phần ăn nhân tạo.
2.1. Tôm và điều kiện bảo quản
Sau khi đến Trung tâm Nuôi trồng Thủy sản Đảo Bribie (BIARC), từng con tôm đều được cân, đánh dấu mắt và vỏ (để theo dõi khoảng thời gian lột xác). Sau đó, tôm được chia thành các nhóm trọng lượng (60 ± 5 g, 70± 5 g, v.v.) và đại diện từ mỗi nhóm trọng lượng sau đó được phân bổ ngẫu nhiên cho từng nhóm khẩu phần ăn.
Sau 14 ngày, sự phát triển của buồng trứng được đánh giá trực quan theo mô tả của Marsden và cộng sự (2007), để đảm bảo buồng trứng có dấu hiệu phát triển tại thời điểm đánh bắt đã thoái hóa trong giai đoạn này. Vì tất cả tôm được phát hiện đang ở giai đoạn phát triển bằng 0 theo phân loại của Primavera (1985), những con tôm vừa lột xác được cắt mắt ngay lập tức, trong khi những con tôm còn lại bị cắt mắt trong vòng vài ngày tới. Sự phát triển buồng trứng, theo dõi trứng và ấu trùng được thực hiện theo các phương pháp được mô tả trong Marsden và cộng sự (1997) trong 42 ngày sau khi cắt mắt. Hai ngày sau khi lột xác, các mẫu vỏ tôm đã đánh dấu được thay thế theo số mắt lượng mẫu mắt đã đánh dấu.
Có 28 con tôm cái và 14 con tôm đực mỗi nhóm khẩu phần ăn (tự nhiên, BIARC, BIARC + MF), chia đều cho các bể lặp lại (đường kính 4 m, độ sâu nước 0,8 m) cho mật độ bể là 1,75 con tôm/ m2. Nước được duy trì ở 28°C, được lọc đến 25 μm và thay nước ở mức 200% mỗi ngày. Ánh sáng được cung cấp bởi các phụ kiện huỳnh quang lơ lửng được bọc trong 70% ‘vải bóng râm’ màu xanh lá cây (Dindas Lew Cat No. 5c7036 BL) để giảm cường độ ánh sáng xuống 0,5 μ/ Em2 /s. Độ dài ngày được đặt lúc 14 giờ với thời gian dốc 20 phút.
2.2. Khẩu phần ăn
Ba khẩu phần ăn đã được đánh giá: khẩu phần ăn uống tự nhiên, khẩu phần ăn trưởng thành theo công thức (có tên BIARC) và khẩu phần ăn BIARC + MF. Khẩu phần ăn tự nhiên bao gồm vẹm xanh tươi đông lạnh (Perna canaliculus) và lớp phủ mực (Loligo sp) được cho ăn thay thế (để ước tính phân tích sinh hóa, xem Marsden và cộng sự, 1992). Khẩu phần ăn công thức (BIARC) được chế biến thành các sợi ẩm, ‘giống như mì spaghetti’ (đường kính 4 mm). Phân tích gần của khẩu phần ăn này đã được mô tả trước đây (Marsden và cộng sự, 1997). Điều quan trọng cần lưu ý là trong các nghiên cứu trước đây, tôm sú bố mẹ cho ăn khẩu phần ăn nhân tạo này đã chứng minh hiệu suất sinh sản tương đương hoặc vượt trội so với những cá thể được cho ăn khẩu phần ăn tự nhiên (Marsden và cộng sự, 1997). Đối với khẩu phần ăn BIARC + MF, MF (2E6E) hòa tan trong acetone đã được thêm vào thành phần lipid của các thành phần BIARC trong quá trình chuẩn bị khẩu phần ăn để đạt được nồng độ cuối cùng là 5,5 μg MF/ gram khẩu phần ăn ướt. Thể tích acetone tương đương cũng được đưa vào khẩu phần ăn BIARC mà không có MF. Nồng độ MF này được chọn để duy trì tính nhất quán với nghiên cứu của Hall và cộng sự (1999) và Laufer (1992). Tôm được cho ăn quá mức vào lúc 09:00 giờ và 17:00 giờ hàng ngày.
2.3. Phân tích thống kê
Sự khác biệt trong tiêu chí hiệu suất sinh sản đã được phân tích bằng cách sử dụng ANOVA một chiều với lần lặp lại (bể). Sự khác biệt giữa các nghiệm thức đã được phân tích bằng cách sử dụng phương pháp so sánh từng cặp LSD. Mức độ quan trọng đối với kết quả được đặt ở mức p < 0.05.
3. Kết quả
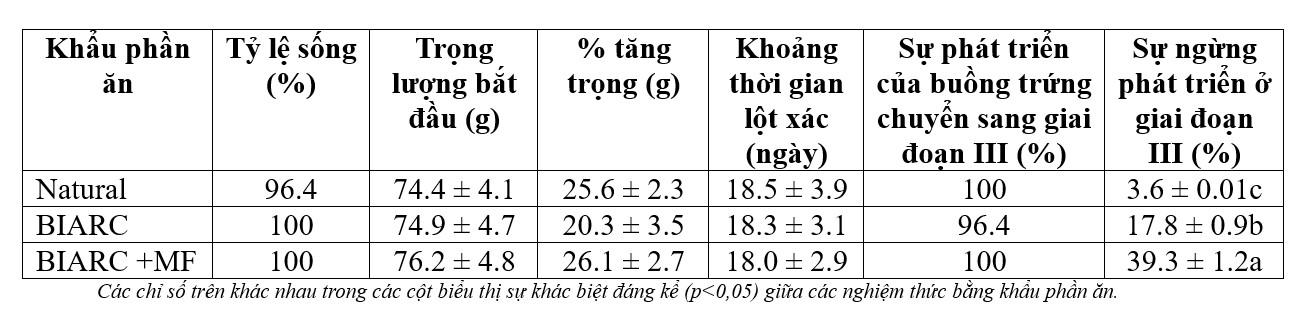
Như thể hiện trong Bảng 1, không có sự khác biệt đáng kể (p>0,05) về mức tăng trọng trung bình hoặc khoảng thời gian lột xác của tôm cái để đáp ứng với bất kỳ khẩu phần ăn thử nghiệm nào. Tỷ lệ sống rất cao ở tất cả các khẩu phần ăn, dao động từ 96% đến 100%. Ngược lại, cả khẩu phần ăn và bổ sung MF vào khẩu phần ăn nhân tạo đều ảnh hưởng đến sự phát triển buồng trứng giai đoạn cuối. Cụ thể, số lượng tôm bị ngừng phát triển buồng trứng ở giai đoạn III cao gấp 5 lần khi khẩu phần ăn BIARC thay thế khẩu phần ăn tự nhiên. Việc đưa MF vào khẩu phần ăn BIARC nhân tạo đã làm tăng gấp đôi số lượng tôm bị ngừng phát triển buồng trứng ở giai đoạn III.
Bảng 1. Tỷ lệ sống trung bình (±SE), trọng lượng ban đầu, phần trăm tăng trọng (tăng trọng trung bình (g)/trọng lượng ban đầu × 100), khoảng thời gian lột xác, tỷ lệ tôm phát triển đến giai đoạn III và tỷ lệ không sinh sản của tôm cái P. monodon (n= 28 mỗi nghiệm thức) 42 ngày sau khi cắt mắt ở mỗi nghiệm thức trong 3 khẩu phần ăn.
Hình 1 cho thấy các tiêu chí hiệu suất sinh sản được đo của nhóm tôm được cho ăn ba khẩu phần ăn. Việc bổ sung MF vào khẩu phần ăn nhân tạo làm giảm đáng kể số lần sinh sản trên mỗi con tôm từ trung bình 3 ± 0,4 (BIARC) xuống 1,8 ± 0,3 (BIARC + MF) (Hình 1A). Việc bổ sung MF trong khẩu phần ăn BIARC cũng làm giảm đáng kể khả năng sinh sản trung bình của ba lần sinh sản đầu tiên từ 4,1 nghìn xuống còn 3,2 nghìn trứng/ gram tôm (Hình 1C). Tuy nhiên, MF trong khẩu phần ăn không có ảnh hưởng đáng kể đến tỷ lệ nở trứng trung bình hoặc tỷ lệ sống của ấu trùng (trung bình trong ba lần sinh sản đầu tiên), khả năng sinh sản của lần sinh sản đầu tiên và số lượng protozoea 1 (zoea 1, Z1) trên mỗi gram tôm hoặc mỗi lần sinh sản (Hình 1D, E, B, F, G).
Phân tích dữ liệu cũng cho thấy sự khác biệt đáng kể về hiệu suất sinh sản của tôm được cho ăn khẩu phần ăn tự nhiên hoặc nhân tạo. Ví dụ, số lần sinh sản trên mỗi con tôm thu được bằng khẩu phần ăn tự nhiên cao hơn đáng kể so với thu được bằng khẩu phần ăn BIARC (Hình 1A). Ngược lại, tỷ lệ sống của ấu trùng Z1 thu được bằng khẩu phần ăn BIARC cao hơn đáng kể so với tỷ lệ sống bằng khẩu phần ăn tự nhiên (Hình 1E).
Hình 1H cho thấy tổng sản lượng Z1 trên mỗi con tôm được cho ăn khẩu phần ăn BIARC (3,0 ±0,4 triệu) không khác biệt đáng kể so với khẩu phần ăn tự nhiên (4±0,5 triệu). Tuy nhiên, sản lượng Z1 từ tôm được cho ăn khẩu phần ăn BIARC + MF (1,9±0,4 triệu), thấp hơn đáng kể so với tôm được cho ăn khẩu phần ăn tự nhiên mặc dù không khác biệt đáng kể so với tôm được cho ăn khẩu phần ăn BIARC.
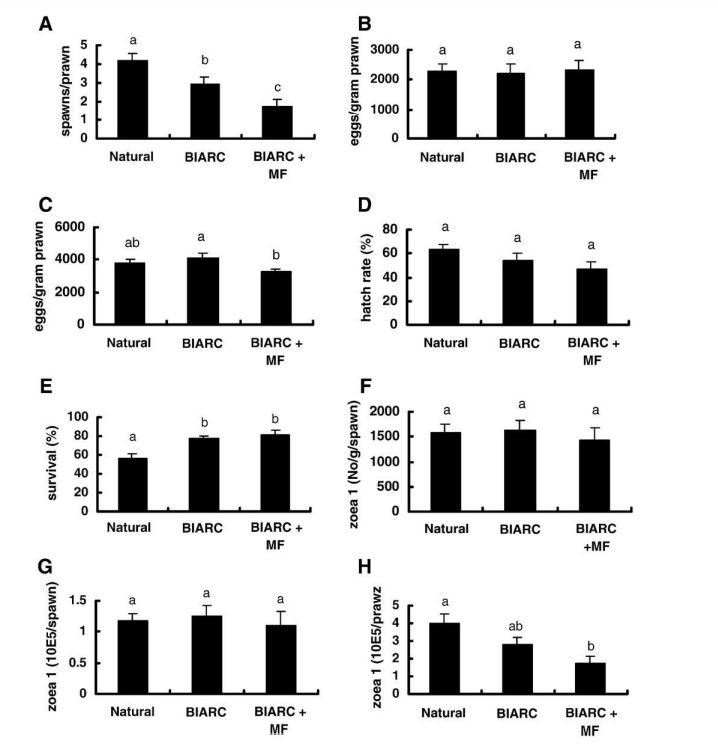
Hình 1. Tiêu chí năng suất sinh sản của tôm bố mẹ Penaeus monodon được cho ăn thức ăn tự nhiên (mực và vẹm), nhân tạo (BIARC) hoặc khẩu phần nhân tạo bổ sung methyl farnesoate (BIARC+MF). (A) số lần sinh sản trên mỗi con tôm; (B) sản lượng trứng trên mỗi gam tôm, lần sinh sản đầu tiên; (C) sản lượng trứng trên mỗi gram tôm, ba lần sinh sản đầu tiên; (D) tỷ lệ nở trung bình của trứng trong ba lần sinh sản đầu tiên; (E) tỷ lệ sống trung bình đến zoea 1 trong ba lần sinh sản đầu tiên; (F) sản lượng trung bình là 1 zoea trên mỗi gram tôm trong ba lần sinh sản đầu tiên; (G) đầu ra zoea 1 trung bình cho ba đầu tiên sinh sản; (H) tổng sản lượng zoea trung bình trên mỗi con tôm. Sai số trung bình và sai số chuẩn (n= 28) có cùng chỉ số trên thì khác biệt không đáng kể (p<0,05).
4. Thảo luận
Nghiên cứu này đã cho thấy rằng MF có thể ức chế các khía cạnh của sinh sản tôm He in vivo. Cụ thể, sử dụng MF qua đường miệng làm giảm số lần sinh sản trên mỗi con tôm và khả năng sinh sản tương đối (trung bình trong ba lần sinh sản đầu tiên) ở P. monodon bị cắt mắt. Xem xét kỹ hơn cho thấy tần suất sinh sản giảm là kết quả của MF ức chế sự phát triển buồng trứng trong quá trình sinh sản muộn hoặc trong giai đoạn cuối, được Yano gọi là ‘tiền trưởng thành’ và ‘trưởng thành’ (1988, 1995). Mặc dù có bằng chứng đáng kể rằng MF là một hormone kích thích (xem lại ở Borst và cộng sự, 1987; Huberman, 2000; Laufer và Biggers, 2001 và Tsukimura, 2001), các nghiên cứu gần đây ủng hộ những phát hiện ở đây và xác nhận rằng MF cũng có thể hoạt động để ức chế một số khía cạnh của sinh sản giáp xác (Tiu và cộng sự, 2006; Tsukimura và cộng sự, 2006; Mak và cộng sự, 2005).
Các nghiên cứu trước đây đã chỉ ra rằng MF dùng đường uống có thể kích thích các khía cạnh sinh sản của tôm. Ví dụ, ở mức độ bao gồm khẩu phần ăn tương tự như những cá thể được quản lý trong nghiên cứu này, MF đã được chứng minh là làm tăng sức sinh sản, khả năng sinh sản của trứng và tỷ lệ nở ở P. monodon bị cắt mắt (Hall và cộng sự, 1999) và tỷ lệ sinh sản, khả năng sinh sản và tỷ lệ nở ở Litopenaeus vannamei bị cắt mắt (Laufer, 1992). Ngày càng có nhiều bằng chứng về sự phức tạp của các hệ thống nội tiết giáp xác (xem xét ở Okumura 2004), nhiều yếu tố khác nhau có thể góp phần tạo nên những kết quả khác nhau giữa các nghiên cứu. Ví dụ, sự khác biệt cụ thể về loài trong chức năng hoặc cơ chế hoạt động MF có thể góp phần vào kết quả mâu thuẫn của nghiên cứu này về P. monodon và nghiên cứu về tôm thẻ chân trắng L. vannamei (Laufer, 1992). Ngoài ra, nồng độ MF trong hemolymph cho thấy sự khác biệt rõ ràng trong phản ứng của động vật giáp xác với hormone này. Ví dụ, Mak và cộng sự (2005) cho thấy rằng trong các giai đoạn cụ thể của buồng trứng và sự phát triển của trứng cua, mức độ MF thấp kích thích biểu hiện gen Vg gan tụy trong khi mức độ MF cao ức chế biểu hiện. Trong trường hợp MF dùng đường miệng, có thể có sự khác biệt về tính nhất quán của khẩu phần ăn, công thức, ăn và thời gian thích nghi trước khi cắt mắt (ví dụ, 3 tuần đối với Hall và cộng sự (1999) và 2 tuần đối với nghiên cứu này) có thể ảnh hưởng đến nồng độ MF trong hemolymph. Hơn nữa, chu kỳ bán rã của MF trong hemolymph nhỏ hơn 1 giờ (Tsukimura, 2001) cho thấy nồng độ có thể dao động theo tần suất cho ăn. Do đó, thông qua tác động của chúng đối với nồng độ MF haemolymph, các phương pháp thí nghiệm có thể rất quan trọng đối với phản ứng sinh lý cụ thể được tạo ra khi tiếp xúc với MF.
Ngoài ra, ngoài nồng độ MF trong hemolymph, kích thước tôm hoặc giai đoạn thành thục và tình trạng trước khi bắt tôm (Primavera, 1984; Marsden và cộng sự, 2007) có thể đã góp phần vào sự khác biệt quan sát được trong kết quả. Những yếu tố này có thể ảnh hưởng đến vai trò tích cực của MF có phải là điều hòa sinh sản, lột xác (Abdu và cộng sự, 1998; Chang, 1997; Tamone và Chang, 1993) hoặc phát triển giai đoạn chưa trưởng thành (giai đoạn juvenile) (Borst và Laufer, 1990; Rotllant và cộng sự, 2000; Tsukimura, 2001). Tuy nhiên, sự ức chế sự phát triển buồng trứng muộn hoặc sinh sản bằng MF thông qua kích thích bệnh ecdysis dường như không xảy ra trong nghiên cứu này vì tôm được cho ăn ba khẩu phần ăn cho thấy không có sự khác biệt về tỷ lệ phần trăm tăng trọng hoặc khoảng thời gian lột xác trong 8 tuần thử nghiệm. Ngoài ra, trong khi tôm cái trong nghiên cứu này nhỏ hơn đáng kể so với nghiên cứu Hall và cộng sự (1999) (trung bình lần lượt là 75 và 120 g (Hall pers.com)), tỷ lệ phát triển buồng trứng cao ở tất cả các loài tôm trong nghiên cứu này, xác nhận rằng tổ hợp đã trưởng thành về mặt tình dục (Primavera, 1985). Do đó, sự ức chế sự phát triển và khả năng sinh sản của buồng trứng dường như không phải là do tác dụng MF đến giai đoạn chưa trưởng thành như đã được tìm thấy gần đây ở tôm nước ngọt chưa trưởng thành, trong đó MF làm giảm trọng lượng buồng trứng và đường kính noãn bào (Tsukimura và cộng sự, 2006). Do đó, sự ức chế của MF đối với sự phát triển buồng trứng giai đoạn cuối (và / hoặc sinh sản) và khả năng sinh sản có thể không phải do hoạt động như một hormone giai đoạn chưa trưởng thành hoặc lột xác.
Mặc dù các nghiên cứu khác đã chỉ ra rằng MF điều chỉnh sự phát triển ở buồng trứng giai đoạn đầu (Tsukimura và Kamemoto, 1991; Nagaraju và cộng sự, 2004, 2006), nghiên cứu này cho thấy MF có thể điều chỉnh sự phát triển buồng trứng giai đoạn cuối trực tiếp hoặc gián tiếp. Cơ chế hoạt động của MF ở giai đoạn phát triển này có thể thông qua việc kiểm soát (các) gen chịu trách nhiệm tổng hợp Vg trong buồng trứng và gan tụy (Tiu và cộng sự, 2006; Mak và cộng sự, 2005). Vì cả hai mô này đều tổng hợp Vg trong P. monodon (Tseng và cộng sự, 2001; Thurn và Hall, 1999), ức chế tổng hợp ở một trong hai mô có thể ngăn chặn sự phát triển buồng trứng. Tuy nhiên, nếu cơ chế hoạt động này đang hoạt động, điều thú vị là hiệu ứng của MF không rõ ràng cho đến khi quá trình sinh noãn hoàng gần hoàn thành hoặc có thể hoàn thành. Ngoài ra, cơ chế hoạt động của MF có thể thông qua kiểm soát sự hấp thụ Vg thay vì hoặc ngoài tổng hợp. Cụ thể, MF đã được chứng minh là kích hoạt protein kinase C (PKC), một isoenzyme liên quan đến sự hấp thu Vg của tế bào trứng và tế bào nang, có các kiểu đồng vị khác nhau trong quá trình phát triển buồng trứng ở tôm càng nước ngọt Cherax quadricarinatus (Soroka và cộng sự, 2000). Con đường điều hòa này sẽ hoạt động ở giai đoạn sau của sự phát triển buồng trứng ở P. monodon khi các thành phần Vg đang được tích lũy tích cực (Thurn và Hall, 1999; Tseng và cộng sự, 2001).
Bất kể cơ chế hoạt động nào, kết quả của nghiên cứu này cung cấp thêm bằng chứng cho thấy một điểm kiểm soát quan trọng trong sản xuất trứng xảy ra trong quá trình phát triển buồng trứng giai đoạn cuối. Các nghiên cứu trước đây đã ghi nhận sự xuất hiện của sự phát triển buồng trứng bị bắt giữ và sinh sản sớm hoặc một phần ở giai đoạn III của sự phát triển buồng trứng (Tan-Fermin và Pudadera, 1989) đặc biệt là ở tôm thuần hóa (Yamano và cộng sự, 2004; Makinouchi và Hirata, 1995). Các sự kiện diễn ra trong giai đoạn này cần được điều tra thêm. Các nghiên cứu tế bào học liên quan đến các giai đoạn của bệnh teo cơ (Anderson và cộng sự, 1984; Cledon, 1986; Yano, 1988, 1995) với sự phát triển bị ngừng lại có thể giúp tách biệt các quy trình đang được điều hòa. Nồng độ MF trong hemolymph trước đây đã được chứng minh giảm trước khi giải phóng trứng (Laufer và Biggers, 2001) và MF không chỉ ảnh hưởng đến sự tổng hợp và hấp thu Vg, mà còn ảnh hưởng đến giai đoạn vỡ túi nhân (GVBD: germinal vesicle break-down) hoặc rụng trứng (Laufer và Biggers, 2001). Ngoài ra, có ý kiến cho rằng việc ngừng phát triển có liên quan đến sự hình thành que vỏ não (CR) không hoàn chỉnh (Yano, 1988). Việc điều chỉnh các quá trình này cũng có thể ảnh hưởng đến khả năng sinh sản, nhưng điều trị MF trong nghiên cứu này đã giảm sau lần sinh sản đầu tiên. Tuy nhiên, nếu không kiểm tra siêu âm buồng trứng, thì vẫn còn phải xác định quá trình nào trong số các quá trình này bị ức chế do MF trong khẩu phần ăn của P. monodon.
Một phát hiện bổ sung của nghiên cứu này là khẩu phần ăn tôm bố mẹ nhân tạo (BIARC) mang lại hiệu suất tăng trưởng tương tự như khẩu phần ăn tự nhiên dựa trên tăng trọng, tỷ lệ sống và khoảng thời gian lột xác của tôm cái. Tuy nhiên, sự khác biệt đáng kể trong sự phát triển buồng trứng và hiệu suất sinh sản xảy ra với khẩu phần ăn. Như đã báo cáo trước đây (Marsden và cộng sự, 1997), khẩu phần ăn BIARC mang lại tỷ lệ sống trung bình cao hơn cho ấu trùng đến giai đoạn phát triển Zoea 1 (trung bình trong ba lần sinh sản đầu tiên) so với khẩu phần ăn mực-vẹm. Tuy nhiên, trái ngược với các so sánh trước đây, tần suất sinh sản của tôm được cho ăn khẩu phần ăn BIARC thấp hơn so với mực-vẹm. Điều này chủ yếu là do khẩu phần ăn mực-vẹm trong nghiên cứu này dẫn đến số lần sinh sản trên mỗi con tôm cao hơn mức trung bình (Marsden và cộng sự, 1997; Hansford và Marsden, 1995). Những khác biệt này giữa các nghiên cứu có thể là do chất lượng của mực và vẹm ăn, tuy nhiên sự khác biệt trong kết quả cũng có liên quan đến sự thay đổi theo mùa và các điều kiện trước khi bắt (bao gồm cả tình trạng dinh dưỡng) của tôm (Hansford và Marsden, 1995).
Mặc dù hiệu suất sinh sản của tôm sú P. monodon bị ảnh hưởng bởi điều kiện trước khi bắt (Marsden và cộng sự, 2007), khẩu phần ăn trưởng thành sau khi bắt đã được chứng minh là có ảnh hưởng lớn đến một số tiêu chí hiệu suất của tôm (để xem xét Harrison, 1990). Tuy nhiên, có thể sự khác biệt trong sự phát triển buồng trứng của tôm được cho ăn hai khẩu phần ăn đối chứng (mực-vẹm và nhân tạo) có thể là do một yếu tố khẩu phần ăn không phải là chất dinh dưỡng mà là một thành phần trong khẩu phần ăn (như tiền chất hormone hoặc hormone) có thể ảnh hưởng đến sự phát triển/ sinh sản buồng trứng ở các giai đoạn quan trọng (như hình thành que vỏ não hoặc giải phóng trứng). Điều này trước đây đã được đề xuất; ví dụ, một peptide có trọng lượng phân tử thấp chiết xuất từ con ngao sống có hiệu quả trong việc kích thích sự trưởng thành buồng trứng ở tôm (Kanazawa, 1990). Tương tự, chiết xuất mực có hiệu quả trong việc gây ra sự hình thành noãn hoàng thứ cấp ở L. vannamei (Mendoza và Revol, 1997). Do đó, ở tôm được sử dụng trong nghiên cứu này, các yếu tố kích thích có thể hiên diện ở mức độ cao hơn trong khẩu phần ăn mực-vẹm so với khẩu phần ăn nhân tạo. Rõ ràng, MF (được thực hiện trong nghiên cứu này) không phải là yếu tố kích thích còn thiếu.
Do đó, kết quả của nghiên cứu này kết hợp với các nghiên cứu trước đây trên tôm sú P. monodon (Hall và cộng sự,1999) và các loài khác (Laufer,1992; Tsukimura và Kamemoto, 1991; Mak và cộng sự, 2005, Tiu và cộng sự, 2006), đã xác nhận rằng MF có thể đóng một vai trò trong việc điều hòa quá trình sinh sản của tôm. Hơn nữa, họ chỉ ra rằng MF có thể hoạt động trong quá trình phát triển buồng trứng giai đoạn cuối ở P. monodon. Tuy nhiên, trái ngược với kết quả của các nghiên cứu khác (Hall và cộng sự, 1999), MF đã được chứng minh là ức chế một số khía cạnh sinh sản cho thấy vai trò của nó có thể phức tạp và đa dạng. Để đạt được kết quả có thể dự đoán được, đòi hỏi sự hiểu biết nhiều hơn về các mô đích của MF và sự tương tác với các hormone khác trong việc điều chỉnh các quá trình sinh lý cụ thể (Gunawardene và cộng sự, 2002; Kuballa và cộng sự, 2007; Rodriguez và cộng sự, 2001, 2002; Mak và cộng sự, 2005; Tiu và cộng sự, 2006; Huberman, 2000). Cho đến khi sự tương tác giữa hormone, mô và môi trường được hiểu rõ hơn, ứng dụng thực tế của các hormone đơn lẻ để điều hòa sinh sản ở động vật giáp xác có thể vẫn còn là vấn đề cần tìm hiểu sâu hơn.
Theo Gay Marsden, David Hewitt, Eric Boglio, Peter Mather, Neil Richardson
Nguồn: https://sci-hub.hkvisa.net/10.1016/j.aquaculture.2008.04.031
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ảnh Hưởng Của Việc Bổ Sung Piperine Vào Khẩu Phần Đến Năng Suất Và Sức Khỏe Của Tôm Thẻ Chân Trắng Giai Đoạn Tôm Post
- Ảnh Hưởng Của Nguồn Protein Đơn Bào Đến Tăng Trưởng Và Sức Khỏe Của Tôm Thẻ Chân Trắng
- Ảnh Hưởng Của 3 Loại Phân Hữu Cơ Lỏng Kết Hợp Với Lá Mắm Ổi Avicennia marina Đến Sinh Trưởng Và Tỷ Lệ Sống Của Tôm Sú (Penaeus monodon)

 English
English