TÓM TẮT
Mục đích của nghiên cứu này là đánh giá tác động của probiotic thương mại Sanolife PRO-F đến chất lượng nước, hiệu suất tăng trưởng, thông số máu và hình thái đường ruột của cá rô phi sông Nile đơn tính. Một thử nghiệm thực tế được tiến hành trong 10 tuần, trong đó cá rô phi giống (20 ± 1,26 g) được chia ngẫu nhiên vào 3 ao, thành 3 nhóm nghiệm thức, nhận Sanolife PRO-F ở mức 0 (B0), 0,1 (B1) và 0,2 (B2) g/kg khẩu phần tương ứng. Kết quả cho thấy sự cải thiện đáng kể về hiệu suất tăng trưởng, tỷ lệ chuyển đổi thức ăn và thông số máu ở cá rô phi được cho ăn chế độ ăn được xử lý. Chiều dài toàn bộ ruột, chiều cao nhung mao ruột trước và cuối, cũng như số lượng tế bào hình đài (goblet cell) ở ruột trước đều cao hơn khi cá rô phi được cho ăn chế độ ăn được xử lý. Không có sự khác biệt đáng kể về tốc độ tăng trưởng và hình thái đường ruột giữa cá rô phi được nuôi bằng chế độ ăn B1 và B2. Nồng độ amoniac trong nước thấp hơn ở chế độ ăn B1, trong khi độ dẫn điện, độ mặn và tổng chất rắn hòa tan cao hơn ở chế độ ăn B2. Độ pH của nước ao được tăng cường ở cả hai chế độ ăn B1 và B2. Tóm lại, sử dụng Sanolife PRO-F ở mức 0,1–0,2 g/kg khẩu phần ăn có thể có tác dụng có lợi đối với sự tăng trưởng, khả năng miễn dịch, khả năng chống stress, sức khỏe và chức năng đường ruột cũng như chất lượng nước của cá rô phi sông Nile.
1. GIỚI THIỆU
Ai Cập là một trong mười quốc gia sản xuất thủy sản hàng đầu với sản lượng hàng năm trên một triệu tấn (1.137.000) (FAO, 2016). Năm 2014, nuôi trồng thủy sản chiếm khoảng 77% tổng sản lượng cá ở Ai Cập, trong đó 85% đến từ việc sản xuất thủy sản trong các ao được xây dựng quanh các hồ ở đồng bằng sông Nile (GAFRD, 2016). Cá rô phi là loài được nuôi phổ biến nhất, chiếm hơn 65% tổng sản lượng nuôi trồng thủy sản (Dickson, Nasr-Allah, Kenawy, & Kruijssen, 2016). Trong vài năm gần đây, tỷ suất lợi nhuận giảm do chi phí sản xuất đầu vào cao, đặc biệt là thức ăn chăn nuôi, chiếm 70% tổng chi phí, bên cạnh những thách thức sản xuất khác (El-Sayed, Dickson, & El-Naggar, 2015; Eltholth, Fornace, Grace, Rushton, & Häsler, 2015; Macfadyen và cộng sự, 2011, 2012). Probiotic đã được sử dụng để cải thiện hiệu suất tăng trưởng và giảm chi phí sản xuất cá rô phi nuôi trong nhiều nghiên cứu (Hai, 2015; Ibrahem, 2015; Taoka và cộng sự, 2006; Welker & Lim, 2011). Probiotic được coi là lựa chọn thay thế an toàn cho thuốc kháng sinh, với một số tác dụng có lợi cho ngành nuôi trồng thủy sản (Banerjee & Ray, 2017; Dawood & Koshio, 2016; Dawood và cộng sự, 2016; Pérez-Sánchez, Ruiz-Zarzuela, de Blas, & Balcázar , 2014; Zorriehzahra và cộng sự, 2016) thông qua các cơ chế khác nhau như ức chế sự cạnh tranh của vi khuẩn gây bệnh bằng cách sản xuất các hợp chất ức chế, tăng cường hoạt động của các enzyme tiêu hóa làm tăng khả năng cung cấp chất dinh dưỡng cho vật chủ, cải thiện chất lượng nước và tăng cường khả năng miễn dịch và khả năng chống stress ở cá (Balcázar và cộng sự, 2006; Ibrahem, 2015; Kesarcodi-Watson, Kaspar, Lategan, & Gibson, 2008; Martínez Cruz, Ibáñez, Monroy Hermosillo, & Ramírez Saad, 2012).
Cá liên tục tương tác với các hệ sinh thái xung quanh và do đó, hệ vi sinh vật đường ruột cá và môi trường nước bị ảnh hưởng bởi thành phần quần thể vi sinh vật khác (Cahill, 1990; Giatsis, Sipkema, Smidt, Verreth, & Verdegem, 2014; Giatsis và cộng sự, 2015). Mối lo ngại của công chúng về việc sử dụng kháng sinh và chất khử trùng trong nuôi trồng thủy sản ngày càng gia tăng do nguy cơ phát triển vi khuẩn kháng thuốc, đây là một vấn đề bất lợi không chỉ đối với ngành nuôi trồng thủy sản mà còn đối với người tiêu dùng, động vật trên cạn và môi trường (Cabello, 2006; Cabello, Godfrey, Buschmann, & Dölz, 2016; Watts, Schreier, Lanska, & Hale, 2017). Do đó, cần triển khai các biện pháp dự phòng thích hợp thay thế thuốc kháng sinh trong nuôi trồng thủy sản để duy trì hệ sinh thái khỏe mạnh, sức khỏe và khả năng miễn dịch của cá đồng thời nâng cao lợi nhuận (Defoirdt, Sorgeloos, & Bossier, 2011; Romero, Feijoó, & Navarrete, 2012).
Các nghiên cứu trước đây đã báo cáo rằng các chủng Bacillus phân lập là “ứng cử viên” đầy hứa hẹn cho cá (Avella và cộng sự, 2010; Banerjee & Ray, 2017; Zorriehzahra và cộng sự, 2016). Probiotic chứa Bacillus đã cải thiện sự tăng trưởng và sức khỏe, hoạt động của các enzyme tiêu hóa cũng như hệ vi sinh vật và hình thái đường ruột của cá rô phi. Những tác dụng có lợi này đã được chứng minh là của Bacillus subtilis (Addo và cộng sự, 2017; Liu và cộng sự, 2017; Standen và cộng sự, 2015, 2016; Taoka, Maeda, Jo, & Sakata, 2007) và Bacillus polyfermenticus ở cá rô phi bố mẹ và cá bột (Lukkana, Jantrakajorn, & Wongtavatchai, 2015). Tác dụng có lợi của Bacillus amyloliquefaciens ở cá rô phi nuôi trong lồng (Silva và cộng sự, 2015) và Bacillus pumilus ở cá rô phi sông Nile nuôi và trong tự nhiên (Srisapoome & Areechon, 2017) cũng đã được chứng minh. Tác động của sự kết hợp các enzyme tiêu hóa và probiotic dựa trên Bacillus (Adeoye và cộng sự, 2016) và hỗn hợp probiotic của Bacillus với các vi khuẩn sống khác (Ramos và cộng sự, 2017) ở cá rô phi giống cũng đã được đánh giá. Ngoài ra, một số báo cáo đã nhấn mạnh rằng probiotic, bao gồm Bacillus, cung cấp môi trường thuận lợi hơn cho cá thông qua việc giảm sự phát triển của vi khuẩn gây bệnh và thực vật phù du có hại cũng như thông qua việc xử lý sinh học chất thải hữu cơ trong nước nuôi (Banerjee & Ray, 2017; Fukami, Nishijima, & Ishida, 1997; Ibrahem, 2015; Martínez Cruz và cộng sự, 2012; Zorriehzahra và cộng sự, 2016). Tuy nhiên, có rất ít sự hiểu biết về tác động của probiotic thương mại bao gồm hỗn hợp các chủng Bacillus đối với cá rô phi được nuôi trong điều kiện môi trường của các trang trại nuôi cá rô phi ở Ai Cập. Do đó, mục đích của nghiên cứu này là điều tra tác động của probiotic hỗn hợp các chủng Bacillus (Bacillus subtilis, Bacillus licheniformis và Bacillus pumilus) đến chất lượng nước, hiệu suất tăng trưởng, các thông số sinh hóa máu và hình thái đường ruột của cá rô phi sông Nile (Oreochromis niloticus) nuôi trong ao đất ở Ai Cập.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1 Thiết kế thử nghiệm và quản lý cá
Nghiên cứu này được thực hiện tại một trang trại cá rô phi tư nhân ở tỉnh Kafrelsheikh, Ai Cập. Sau 2 tuần thích nghi với điều kiện trang trại, cá rô phi đơn tính Oreochromis niloticus (trọng lượng trung bình 20 ± 1,26g, n = 900) được thả ngẫu nhiên vào ba ao đất riêng biệt, mỗi ao có diện tích 267m2 và thuộc cùng một trang trại. Mỗi ao được chia thành ba phần bằng nhau bằng lưới hapa, mỗi phần chứa 100 con cá. Cá được cho ăn chế độ ăn thương mại (300 g/kg protein thô và 12,6 MJ/kg năng lượng tiêu hóa) do nhà máy thức ăn chăn nuôi ALEKHWA® (Kafrelsheikh, Ai Cập) sản xuất. Probiotic hỗn hợp các chủng Bacillus (Bacillus subtilis 3,25 × 109 CFU/g, Bacillus licheniformis 3,50 × 109 CFU/g và Bacillus pumilus 3,25 × 109 CFU/g; Sanolife PRO-F, INVE Aquaculture, Bỉ, với tổng nồng độ là 1,0 × 1010 CFU/g) được trộn hàng ngày với khẩu phần cơ bản, sử dụng dầu hướng dương (20 ml/kg khẩu phần), ở mức 0 g (B0: đối chứng), 0,1 g (B1) và 0,2 g (B2) trên mỗi kg khẩu phần, tương ứng. Cá được cho ăn khẩu phần thí nghiệm trong 10 tuần, với tỷ lệ cho ăn lần lượt là 4% trọng lượng cơ thể trong 2 tuần đầu và 3% trọng lượng cơ thể trong 8 tuần cuối.
2.2 Năng suất cá, hiệu quả sử dụng thức ăn và chỉ số sinh trắc học
Lượng thức ăn tiêu thụ (FI) được ghi lại hàng ngày và sự tăng trưởng của cá được theo dõi 2 tuần/lần trong 10 tuần. Vào cuối thử nghiệm, 6 con cá được lấy mẫu ngẫu nhiên từ mỗi lưới hapa, tức là 18 con cho mỗi nghiệm thức. Cá được thu hoạch bằng lưới có cỡ mắt lưới 0,5 cm, cho vào các thùng chứa polypropylen riêng biệt và sau đó vận chuyển đến phòng thí nghiệm. Mẫu cá được làm khô bằng giấy lọc sạch và vô trùng để loại bỏ lượng nước dư thừa trước khi cân. Cá được cân bằng cân kỹ thuật số (PW Balance, ADAM Equipment Co., USA). Chiều dài và chiều rộng của cá được đo bằng thước đo theo mô tả của Lagler (1978). Chiều dài được đo bằng khoảng cách từ mõm đến điểm bắt đầu của vây đuôi. Chiều dài của cá được ghi lại với độ chính xác gần nhất là milimét và trọng lượng của cá được ghi lại với độ chính xác gần nhất là 0,1g. Mối quan hệ chiều dài và trọng lượng (LWR) được tính bằng công thức hồi quy logarit:
W = a × Lb
Trong khi hệ số điều kiện (K) được tính là K = 100 × W/L3
trong đó, W là tổng trọng lượng (g) và L là tổng chiều dài (cm), a và b lần lượt là độ dốc hồi quy và điểm chặn (hệ số hồi quy), như Froese (2006) đã xem xét.
Các biến số đánh giá tăng trưởng khác được tính như sau:
Tăng trọng cơ thể (BWG) = (Wt–W0)
Tốc độ tăng trưởng cụ thể (SGR, % trọng lượng cơ thể/ngày) = 100[(ln Wt–ln W0)/t]
Tỷ lệ tăng trọng (%) = (Wt – W0)/W0 × 100, trong đó W0 và Wt lần lượt là trọng lượng ban đầu và trọng lượng cuối cùng của cá sống (g) và (t) là thời gian cho ăn tính bằng ngày.
Tỷ lệ chuyển đổi thức ăn (FCR) = FI (g)/BWG (g).
2.3 Phân tích chất lượng nước
Oxy hòa tan (DO) được xác định trong mỗi ao ở độ sâu 50 cm dưới mặt nước ao bằng máy đo oxy hòa tan (AQ 600 Milwaukee, Romania). Ba mẫu nước được thu thập từ mỗi ao bằng cách đảo ngược chai thủy tinh tiệt trùng 250 ml dưới mặt nước ao 15 cm. Phân tích hóa lý các mẫu nước được thực hiện để xác định tổng amoniac (NH3) bằng máy đo màu cầm tay (Martini MI 405), pH, nhiệt độ, độ mặn, độ dẫn điện (EC) và tổng chất rắn hòa tan (TDS) bằng thiết bị đầu dò đa thông số theo Eaton, Clesceri, Rice, Greenberg và Franson (2005).
2.4 Lấy mẫu máu và tách huyết thanh
Các mẫu máu được lấy từ các mạch máu đuôi (v. caudalis) của 18 con cá trong mỗi nghiệm thức bằng cách sử dụng ống tiêm vô trùng. Mỗi mẫu được chia thành hai phần: Phần đầu tiên được chuyển vào ống nghiệm vô trùng 2 ml có EDTA để xét nghiệm huyết học và phần thứ hai được giữ trong ống Eppendorf trơn 2 ml để tách huyết thanh. Máu được để đông ở nhiệt độ 4°C trong 60 phút. Sau đó, các ống được ly tâm ở mức 1008 g bằng máy ly tâm Eppendorf trong 10 phút để tách huyết thanh. Huyết thanh được thu thập trong các ống Eppendorf và được bảo quản ở -40°C cho đến khi phân tích.
2.5 Phân tích huyết học
Các thông số máu bao gồm: hồng cầu (RBC), huyết sắc tố, hematocrit và tổng số bạch cầu được đo bằng máy đếm tế bào máu tự động (Exigo-Vet., Boule Medical AB Inc., Stockholm, Thụy Điển). Số lượng bạch cầu khác nhau để tính tỷ lệ tế bào dị hợp với tế bào lympho (H/L) và bạch cầu đơn nhân được thực hiện theo Anderson và Siwicki (1995).
2.6 Phân tích sinh hóa
Protein toàn phần trong huyết thanh được xác định bằng phương pháp đo màu bằng bộ dụng cụ thương mại (TP0100, Sigma-Aldrich, Hoa Kỳ). Albumin được đo bằng phương pháp liên kết xanh bromocresol (Doumas, Watson, & Biggs, 1971). Globulin được tính bằng cách trừ đi giá trị albumin từ protein toàn phần. Tỷ lệ Albumin/globulin (A/G) được tính bằng cách chia giá trị albumin cho giá trị globulin. Các xét nghiệm phosphatase kiềm trong huyết thanh (ALP), glutamic pyruvic transaminase (GPT), glutamic oxaloacetic transaminase (GOT) và xét nghiệm creatinine đã được thực hiện theo mô tả của Palti và cộng sự (1999).
2.7 Hình thái ruột
Mười con cá được chọn ngẫu nhiên từ mỗi nghiệm thức. Sau khi gây mê sâu bằng cồn ethyl 40%, cá được mổ bụng để đo tổng chiều dài của ruột và lấy mẫu từ phần trước, phần giữa và phần cuối của ruột. Các mẫu được cố định trong dung dịch Bouin trong 18–24 giờ, khử nước ở nồng độ ethanol tăng dần và chuẩn bị cho nghiên cứu mô học. Các phần có độ dày 4–5 μm được nhuộm bằng haematoxylin và eosin để đo hình thái tổng quát và bằng axit tuần hoàn Schiff (PAS) để nhuộm tế bào đài theo Bancroft, Stevens và Turner (1996). Chiều dài của nhung mao ruột được đo bằng phần mềm phân tích hình ảnh (NIH, Bethesda, MD).
2.8 Phân tích thống kê
Sau khi xác minh tính chuẩn, dữ liệu được phân tích bằng ANOVA một chiều, sau đó là thử nghiệm đa phạm vi của Duncan bằng cách sử dụng GLM PROC của SAS (v. 9.4, SAS Institute Inc., Cary, NC, USA). Kết quả được trình bày dưới dạng giá trị trung bình ± SE. LWR được tính toán bằng phân tích hồi quy tuyến tính của SAS bằng cách sử dụng dữ liệu trọng lượng và chiều dài được chuyển đổi log. Mức ý nghĩa và xu hướng được đặt tương ứng là p < 0,05 và p < 0,1.
3. KẾT QUẢ
3.1 Chất lượng nước
Các thông số chất lượng nước được thể hiện trong Bảng 1. Nồng độ NH3 ở ao B1 thấp hơn đáng kể (p < 0,05) so với ao B2 và ao đối chứng, trong khi pH ở cả 2 ao B1 và B2 đều cao hơn (p < 0,05) so với ao đối chứng. EC, TDS và độ mặn cao hơn đáng kể (p < 0,05) ở B2 so với B0 và B1.
Bảng 1. Ảnh hưởng của probiotic hỗn hợp các chủng Bacillus đến chất lượng nước ao nuôi cá rô phi
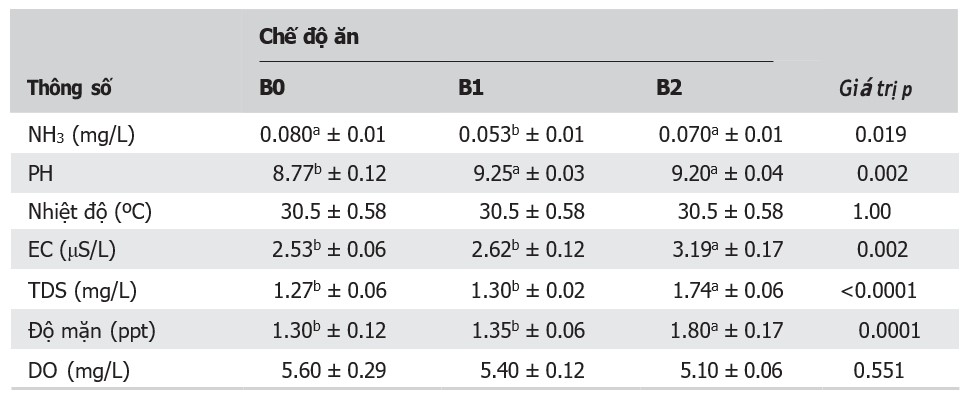
Ghi chú: B0, B1 và B2 là ao nuôi cá rô phi bằng probiotic hỗn hợp các chủng Bacillus với liều lượng tương ứng là 0, 0,1 và 0,2 g/kg thức ăn; EC, độ dẫn điện; TDS, tổng chất rắn hòa tan; DO, oxy hòa tan. Kết quả được trình bày dưới dạng giá trị trung bình ± sai số chuẩn, n = 3. Các giá trị trung bình trong cùng một hàng và có các chỉ số trên khác nhau biểu thị sự khác biệt đáng kể ở mức p ˂ 0,05.
3.2 Hiệu suất tăng trưởng, hiệu quả sử dụng thức ăn và chỉ số sinh trắc học
Nhìn chung, tất cả các thông số về hiệu suất tăng trưởng (trọng lượng cuối cùng, BWG, SGR, WGR, chiều dài và chiều rộng của cá) đều được cải thiện khi cho ăn chế độ ăn B1 và B2 so với chế độ ăn B0 (Bảng 2). Có sự khác biệt đáng kể (p < 0,05) đối với tất cả các thông số ngoại trừ chiều dài (p < 0,1). Không có sự khác biệt đáng kể giữa chế độ ăn B1 và B2. Đối với tất cả các thông số về hiệu suất tăng trưởng, nhóm B2 cho thấy các giá trị cao nhất, tiếp theo là B1 và cuối cùng là B0, ngoại trừ FCR, trong đó B0 cho thấy giá trị FCR cao nhất, theo sau là B1 và cuối cùng là B2. Không có sự khác biệt đáng kể giữa các nghiệm thức về lượng thức ăn tiêu thụ và hệ số điều kiện (p > 0,1). Hồi quy logarit của LWR và các giá trị hệ số xác định (R2) được thể hiện trên Hình 1. Có mối tương quan đáng kể (p < 0,05) giữa chiều dài và trọng lượng giữa tất cả các nhóm thử nghiệm với giá trị R2 là 0,48, 0,63 và 0,77 và hồi quy độ dốc lần lượt là 2,17, 2,55 và 2,96 đối với nghiệm thức B0, B1 và B2.
Bảng 2. Hiệu suất tăng trưởng, hiệu quả sử dụng thức ăn và chỉ số sinh trắc học của cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus
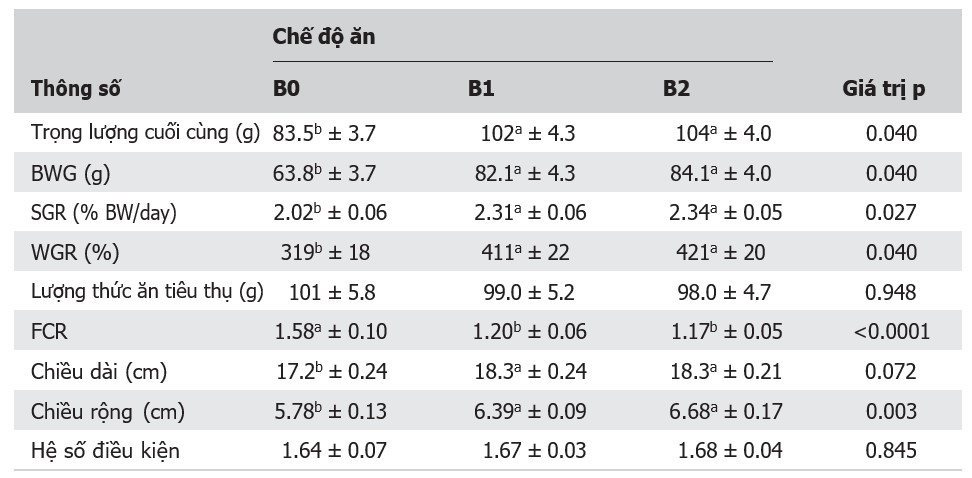
Ghi chú: B0, B1 và B2 là ao nuôi cá rô phi bằng probiotic hỗn hợp các chủng Bacillus với liều lượng tương ứng là 0, 0,1 và 0,2 g/kg thức ăn; SGR, tốc độ tăng trưởng cụ thể; FCR, tỷ lệ chuyển đổi thức ăn. Kết quả được trình bày dưới dạng giá trị trung bình ± sai số chuẩn, n = 3. Các giá trị trung bình trong cùng một hàng và có các chỉ số trên khác nhau biểu thị sự khác biệt đáng kể ở mức p ˂ 0,05.
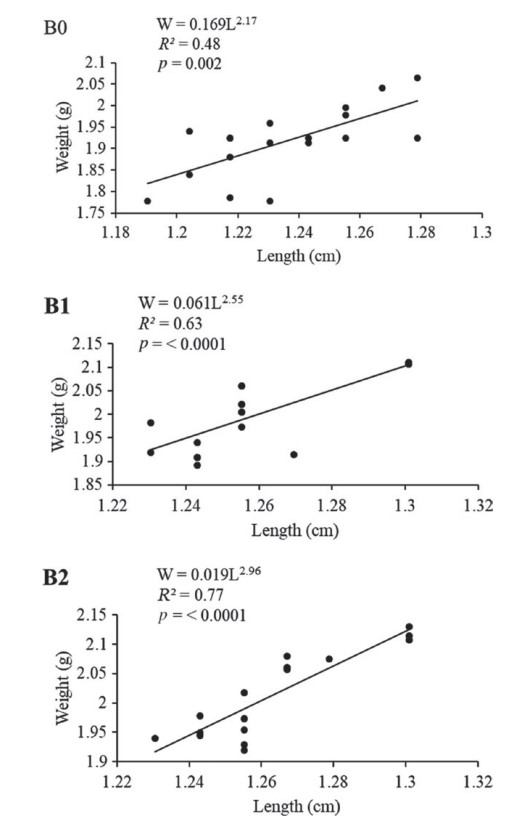
Hình 1. Dữ liệu hồi quy logarit về trọng lượng (W) và chiều dài (L) của cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus với tỷ lệ 0, 0,1 và 0,2 g/kg khẩu phần; nghiệm thức B0, B1 và B2, tương ứng.
3.3 Các thông số huyết học và sinh hóa
Kết quả phân tích huyết học được tóm tắt trong Bảng 3. Tổng số lượng bạch cầu cao hơn đáng kể (p < 0,05) ở cá được cho ăn chế độ ăn B1 và B2 so với cá được cho ăn chế độ ăn B0, nhưng không có sự khác biệt đáng kể giữa chế độ ăn B1 và B2. RBCs (p < 0,1), hematocrit (p < 0,05) và bạch cầu đơn nhân (p < 0,1) cao hơn ở cá được cho ăn chế độ ăn B2 so với cá được cho ăn chế độ ăn B0 và B1. Hemoglobin cao hơn, nhưng chất dị dưỡng và tỷ lệ H/L ở cá được cho ăn chế độ ăn B1 và B2 lại thấp hơn so với cá được cho ăn chế độ ăn B0. Globulin cao hơn (p = 0,054), nhưng tỷ lệ A/G lại thấp hơn (p < 0,05) ở cá được cho ăn chế độ ăn B1 và B2 so với cá được cho ăn chế độ ăn B0 (Bảng 3).
Bảng 3. Các thông số huyết học và sinh hóa của cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus
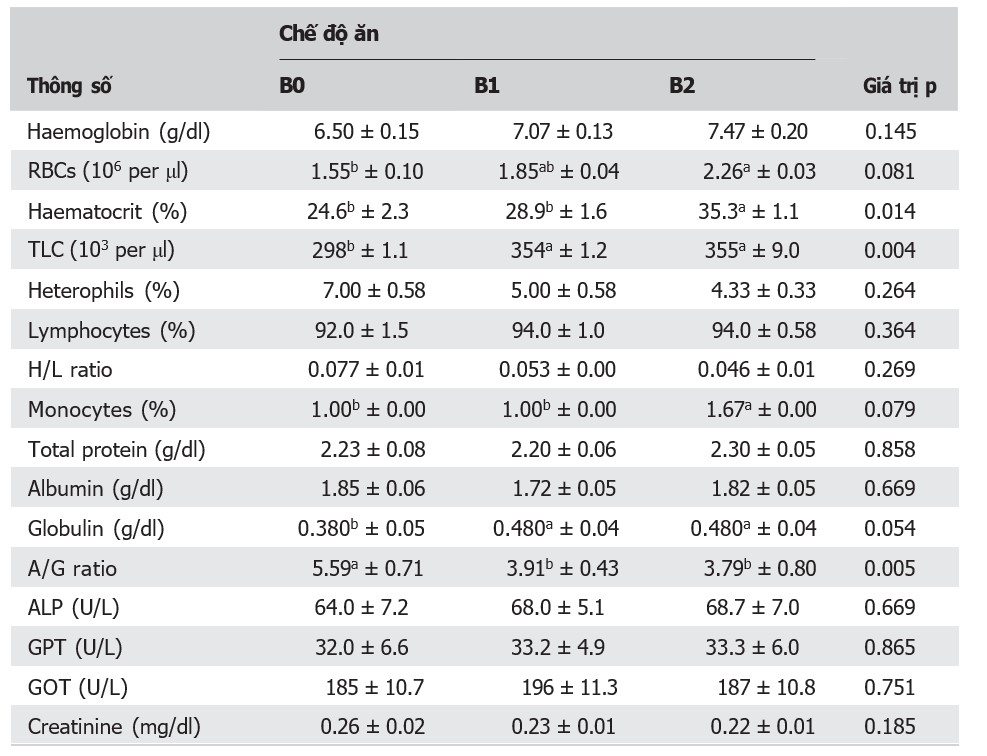
Ghi chú: B0, B1 và B2 là ao nuôi cá rô phi bằng probiotic hỗn hợp các chủng Bacillus với liều lượng tương ứng là 0, 0,1 và 0,2 g/kg thức ăn; RBC, hồng cầu; TLC, tổng số bạch cầu; Tỷ lệ H/L, tỷ lệ dị thể-tế bào lympho; Tỷ lệ A/G, tỷ lệ albumin-globulin; ALP, phosphatase kiềm; GPT, transaminase pyruvic glutamic; GOT, transaminase oxaloacetic glutamic. Kết quả được trình bày dưới dạng giá trị trung bình ± sai số chuẩn, n = 3. Các giá trị trung bình trong cùng một hàng và có các chỉ số trên khác nhau biểu thị sự khác biệt đáng kể ở mức p ˂ 0,05.
3.4 Phân tích hình thái đường ruột
Kết quả phân tích hình thái đường ruột được tóm tắt trong Bảng 4, Hình 2 và 3. Tổng chiều dài của ruột tăng đáng kể (p < 0,05) khi cho ăn chế độ ăn B1 (95 cm) và B2 (93 cm) so với chế độ ăn B0 (65 cm), nhưng không có sự khác biệt đáng kể giữa chế độ ăn B1 và B2. Biểu mô lót của ruột là các tế bào hình trụ đơn giản, chứa các tế bào ruột, tế bào đài và các tế bào có lông chuyển rải rác. Chiều dài của nhung mao ruột ở phần trước và phần cuối của ruột tăng lên đáng kể (p < 0,05) khi bổ sung probiotic, nhưng không nhận thấy sự thay đổi đáng kể nào ở phần giữa của ruột. Số lượng tế bào đài dương tính với PAS tăng lên đáng kể (p < 0,05) ở phần trước ruột của cá được cho ăn chế độ ăn B1 và B2 so với chế độ ăn B0.
Bảng 4. Hình thái đường ruột của cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus
Ghi chú: B0, B1 và B2 là ao nuôi cá rô phi bằng probiotic hỗn hợp các chủng Bacillus với liều lượng tương ứng là 0, 0,1 và 0,2 g/kg thức ăn. Kết quả được trình bày dưới dạng giá trị trung bình ± sai số chuẩn, n = 3. Các giá trị trung bình trong cùng một hàng và có các chỉ số trên khác nhau biểu thị sự khác biệt đáng kể ở mức p ˂ 0,05.

Hình 2. Ảnh vi mô nhuộm Haematoxylin-eosin của phần trước, phần giữa và phần cuối của ruột cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus với tỷ lệ 0, 0,1 và 0,2 g/kg khẩu phần; nghiệm thức B0, B1 và B2 tương ứng
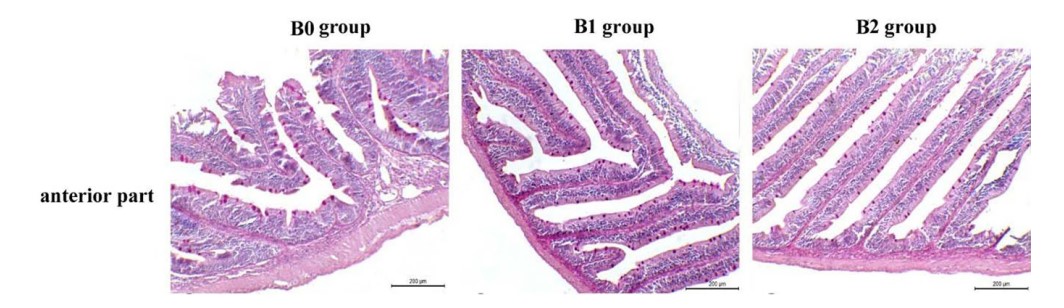
Hình 3. Ảnh hiển vi nhuộm axit-Schiff định kỳ của phần trước ruột cho thấy sự khác biệt về số lượng tế bào đài trong nhung mao ruột của cá rô phi sông Nile được cho ăn probiotic hỗn hợp các chủng Bacillus với tỷ lệ 0, 0,1 và 0,2 g/kg khẩu phần; nghiệm thức B0, B1 và B2 tương ứng
4. THẢO LUẬN
Tại Ai Cập, ngành nuôi trồng thủy sản, đặc biệt là nuôi cá rô phi, đang phát triển ổn định, đóng góp đáng kể vào thu nhập và an ninh lương thực. Việc nuôi cá thâm canh có liên quan đến tỷ lệ mắc các bệnh do stress, có thể dẫn đến việc sử dụng kháng sinh. Điều này có thể gây ra sự phát triển tình trạng kháng kháng sinh và/hoặc các mối nguy hiểm cho sức khỏe cộng đồng. Probiotic được coi là giải pháp thay thế an toàn cho kháng sinh. Theo thông tin của chúng tôi, đây là thử nghiệm đầu tiên đánh giá hiệu quả của probiotic dựa trên Bacillus đối với sản xuất cá rô phi ở Ai Cập.
Giá trị của các thông số chất lượng nước được báo cáo trong nghiên cứu này nằm trong phạm vi mong muốn đối với việc nuôi cá rô phi (Boyd & Tucker, 1998). Amoniac đã giảm khi ăn chế độ ăn B1, trong khi EC, TDS và độ mặn tăng lên khi ăn chế độ ăn B2 và pH được tăng cường trong cả hai chế độ ăn B1 và B2. Những thay đổi này có thể góp phần cải thiện chất lượng nước, từ đó cải thiện sức khỏe và năng suất của cá, điều này có thể là do sự tăng trưởng của vi khuẩn có lợi và sinh vật phù du trong những ao cá rô phi được cho ăn chế độ ăn bổ sung Bacillus (El- Haroun, Goda, & Chowdhury, 2006; Fukami và cộng sự, 1997). Gần đây, có thông tin cho rằng Bacillus có thể thay thế Vibrio và xâm chiếm ruột tôm (Hostins, Laraa, Decampc, Cesarb, & Wasielesky, 2017). Theo đó, vi khuẩn thải ra từ phân cá có thể thay đổi quần thể vi khuẩn theo hướng cải thiện chất lượng nước (Balcázar và cộng sự, 2006; Verschuere, Rombaut, Sorgeloos, & Verstraete, 2000). Tuy nhiên, probiotic Sanolife được cung cấp qua thức ăn, không phải bổ sung trực tiếp vào nước ao và chúng tôi không có bằng chứng nào về sự phong phú của probiotic Sanolife trong nước ao trong nghiên cứu của chúng tôi. Tác dụng của probiotic Bacillus đối với chất lượng nước, quần thể vi khuẩn và quần thể sinh vật phù du trong nước ao cần được nghiên cứu sâu hơn bằng phương pháp so sánh, khi probiotic Sanolife được bổ sung vào thức ăn và/hoặc bổ sung vào nước.
Hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn được cải thiện đáng kể bằng cách cho ăn chế độ ăn có bổ sung Bacillus, điều này cho thấy vai trò tiềm năng của probiotic Bacillus trong việc giảm thiểu các yếu tố căng thẳng và thúc đẩy phúc lợi cá. Những phát hiện tương tự cũng được quan sát thấy ở cá rô phi (Adeoye và cộng sự, 2016; Liu và cộng sự, 2017; Lukkana và cộng sự, 2015; Silva và cộng sự, 2015), cá tráp đầu vàng (Sparus aurata) (Avella và cộng sự, 2010) và cá pecca châu Âu (perca fluviatilis) (Mandiki và cộng sự, 2011) được cho ăn probiotic dựa trên Bacillus. Nhiều nghiên cứu (Adeoye và cộng sự, 2016; Avella và cộng sự, 2010; El-Haroun và cộng sự, 2006; Liu và cộng sự, 2017; Lukkana và cộng sự, 2015; Mandiki và cộng sự, 2011; Silva và cộng sự ., 2015; Taoka và cộng sự, 2007) đã chứng minh khả năng của Bacillus trong việc xâm chiếm ruột cá và từ đó tăng cường sản xuất axit hữu cơ, kích hoạt các enzyme tiêu hóa và giải độc tố các thành phần có hại trong thức ăn, đồng thời duy trì hệ thống đường ruột khỏe mạnh với sự cải thiện sau đó về khả năng tiêu hóa và hấp thu chất dinh dưỡng. Gần đây, người ta đã chứng minh rằng Bacillus có thể thay thế vi khuẩn gây bệnh trong ruột và từ đó tăng cường khả năng kháng bệnh và cải thiện năng suất của cá (Addo và cộng sự, 2017; Hostins và cộng sự, 2017; Srisapoome & Areechon, 2017).
Điều quan trọng là, chế độ ăn B2 dẫn đến mô hình tăng trưởng đẳng cự (tức là, tăng tỷ lệ về trọng lượng và chiều dài tạo ra hình dạng lý tưởng cho cá) như được biểu thị bằng giá trị độ dốc của hồi quy logarit của dữ liệu trọng lượng – chiều dài (2.96), tiệm cận giá trị tăng trưởng lý tưởng (3.0) do Froese (2006) đề xuất. Giá trị độ dốc của chế độ ăn B1 thấp hơn (2,55) so với giá trị tăng trưởng lý tưởng nhưng vẫn nằm trong khoảng 2,5–3,5 được Froese (2006) ước tính đối với một số loài cá. Ngược lại, giá trị ước tính của chế độ ăn B0 là 2,17, thấp hơn rõ rệt so với giá trị trung bình của mức tăng trưởng lý tưởng, biểu thị tốc độ tăng trưởng thấp của cá ở nhóm B0; tức là chiều dài tăng nhiều hơn trọng lượng. Những phát hiện này tiếp tục chỉ ra tác dụng có lợi của probiotic đối với hình thức tăng trưởng thuận lợi hơn ở các trang trại nuôi cá (Froese, 2006).
Sự cải thiện tổng thể về các đặc điểm huyết học được báo cáo trong nghiên cứu này thông qua việc bổ sung probiotic Bacillus vào thức ăn cho cá có thể cho thấy vai trò của Bacillus trong việc kích thích một số phản ứng miễn dịch và tăng khả năng phản ứng với stress ở cá (Nayak, 2010). Tương tự, số lượng bạch cầu, hematocrit và huyết sắc tố đã tăng lên ở cá rô phi sông Nile được bổ sung Bacillus amyloliquefaciens (Reda & Selim, 2015) và bạch cầu đơn nhân đã tăng lên ở cá Labeo ro-hita (Ham.) được bổ sung Bacillus subtilis (Kumar, Mukherjee, Ranjan, & Nayak, 2008). Hơn nữa, việc sử dụng probiotic có liên quan đến việc tăng số lượng hồng cầu và bạch cầu ở cá hồi vân (Irianto & Austin, 2002) và tăng số lượng hồng cầu, bạch cầu và huyết sắc tố với việc giảm các dị thể ở cá Oscar, Astronotus ocellatus (Firouzbakhsh, Noori, Khalesi, & Jani-Khalili, 2011). Ngoài việc tăng cường khả năng miễn dịch và đối phó với căng thẳng ở cá thông qua việc cải thiện các thông số huyết học, probiotic cũng đã được báo cáo là cải thiện chất lượng môi trường của cá bằng cách tương tác với thực vật phù du có hại, dẫn đến tăng cường phúc lợi cho cá (Fukami và cộng sự, 1997).
Kết quả phân tích sinh hóa huyết thanh cá trong nghiên cứu này phản ánh sự gia tăng đáng kể về globulin kèm theo sự giảm đáng kể tỷ lệ A/G ở nhóm B1 và B2, có khả năng cho thấy sự đóng góp của việc sử dụng probiotic trong việc thúc đẩy phản ứng miễn dịch của cá rô phi sông Nile. Sự gia tăng tương tự về globulin cũng được chứng minh ở cá rô phi sông Nile khi bổ sung probitic dựa trên Bacillus (Reda & Selim, 2015; Zhou, Tian, Wang, & Li, 2010). Việc không có sự thay đổi về ALP, GPT và GOT cho thấy rằng probiotic được sử dụng là an toàn cho quá trình trao đổi chất ở cá. Vai trò của probitic dựa trên Bacillus trong việc tăng cường tình trạng miễn dịch của cá rô phi sông Nile đã được mô tả chi tiết ở nghiên cứu khác (Addo và cộng sự, 2017; Liu và cộng sự, 2017; Srisapoome & Areechon, 2017; Wang và cộng sự, 2017).
Nghiên cứu hiện tại cho thấy chiều cao của nhung mao ruột ở phần trước và phần cuối của ruột, cũng như số lượng tế bào đài dương tính với PAS ở phần trước của ruột, đã tăng đáng kể ở các nhóm được bổ sung probiotic so với nhóm đối chứng. Những phát hiện tương tự đã được mô tả trước đây ở cá rô phi sông Nile (Mello và cộng sự, 2013; Ramos và cộng sự, 2017; Reda & Selim, 2015). Các tế bào hình đài tiết ra chất nhầy có tác dụng diệt khuẩn và tạo điều kiện thuận lợi cho việc vận chuyển qua biểu mô ruột (Smirnov, Perez, Amit-Romach, Sklan, & Uni, 2005). Số lượng tế bào đài dương tính với PAS cao hơn tạo thành lớp chất nhầy bảo vệ duy trì tính toàn vẹn của biểu mô ruột bên cạnh việc ngăn chặn sự xâm nhập của mầm bệnh vào đường ruột (Ellis, 2001). Mặc dù thực tế là không có bằng chứng về dấu hiệu sản xuất chất nhầy trong nghiên cứu hiện tại, nhưng việc tăng cường tiết chất nhầy cùng với việc tăng hoạt động miễn dịch niêm mạc ruột có liên quan đến việc sử dụng probiotic ở cá (Lazado & Caipang, 2014; Nayak, 2010). Vai trò của ruột trong quá trình tiêu hóa và hấp thu chất dinh dưỡng cũng đã được biết nhiều ở cá (Grosell, Farrell, & Colin, 2010). Ngoài ra, chiều cao nhung mao ruột, độ dày lớp cơ và số lượng tế bào hình đài là những chỉ số tốt cho thấy ruột khỏe mạnh (Khojasteh, 2012). Do đó, diện tích hấp thu của ruột tăng lên, cùng với sự gia tăng khả năng hấp thụ và lưu giữ chất dinh dưỡng sau đó, cũng như số lượng tế bào hình đài tăng cường làm nổi bật sự cải thiện được quan sát thấy về hiệu suất tăng trưởng, phản ứng miễn dịch và khả năng chống stress ở cá rô phi sông Nile trong nghiên cứu của chúng tôi.
Tóm lại, kết quả đã chứng minh rằng việc bổ sung probiotic chủng Bacillus vào chế độ ăn đã cải thiện hiệu suất tăng trưởng và hiệu quả sử dụng thức ăn của cá rô phi nuôi. Nó cũng tăng cường một số dấu hiệu nhất định về phản ứng miễn dịch và khả năng chống stress, đặc biệt là hematocrit, RBC, tổng số bạch cầu, bạch cầu đơn nhân và globulin. Hơn nữa, tổng chiều dài của ruột, chiều cao của nhung mao ruột và số lượng tế bào đài ở ruột được cải thiện, môi trường của cá cũng thuận lợi hơn khi sử dụng probiotic Bacillus.
Theo Mabrouk Elsabagh, Radi Mohamed, Eman M. Moustafa, Ahmad Hamza, Foad Farrag, Olivier Decamp, Mahmoud A.O. Dawood, Mahmoud Eltholth
Nguồn: https://onlinelibrary.wiley.com/doi/10.1111/anu.12797
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Phần 1: Virus Gây Hội Chứng Đốm Trắng Kích Hoạt Con Đường Glycolytic Trong Các Tế Bào Miễn Dịch Của Tôm (Tế Bào Máu) Để Có Lợi Cho Sự Nhân Lên Của Nó
- Phần 2: Virus Gây Hội Chứng Đốm Trắng Kích Hoạt Con Đường Glycolytic Trong Các Tế Bào Miễn Dịch Của Tôm (Tế Bào Máu) Để Có Lợi Cho Sự Nhân Lên Của Nó
- Cải Thiện Sức Khỏe Và Khả Năng Kháng Nấm Fusarium Của Tôm Thẻ Chân Trắng Thông Qua Việc Thức Ăn Bổ Sung

 English
English