Tóm tắt
Nghiên cứu đã đánh giá tác động của vỏ chanh lên men với Lactobacillus plantarum (FLP) đối với hiệu suất tăng trưởng, các chỉ số miễn dịch không đặc hiệu và khả năng kháng bệnh của tôm chân trắng (Litopenaeus vannamei). Kết quả cho thấy FLP không ảnh hưởng đến hiệu suất tăng trưởng của tôm thẻ chân trắng. FLP làm tăng tổng số lượng tế bào máu (THC) và hoạt động của phenoloxidase (PO) ở tôm thẻ chân trắng. FLP làm tăng khả năng kháng bệnh của tôm thẻ chân trắng đối với vi khuẩn Vibrio alginolyticus. Tỷ lệ bổ sung 2% FLP được đề xuất cho tôm thẻ chân trắng để tối đa hóa hoạt động THC và PO cũng như khả năng kháng V. alginolyticus.
Giới thiệu
Cây chanh là một nguồn nguyên liệu dồi dào, nhưng quá trình chế biến chanh tạo ra một lượng lớn chất thải vỏ chanh. Việc xử lý chất thải vỏ chanh có thể gây gánh nặng cho môi trường và tốn kém. Các nghiên cứu đã chỉ ra rằng vỏ chanh có nhiều chất phytochemical có lợi cho sức khỏe động vật thủy sinh. Tuy nhiên, hiệu suất tăng trưởng của cá có thể bị giảm khi bổ sung vỏ chanh khô ở mức độ cao.
Lên men vỏ chanh với men vi sinh có thể làm giảm hàm lượng chất xơ, từ đó cải thiện hiệu suất tăng trưởng của cá. Nghiên cứu đã chỉ ra rằng bổ sung vỏ chanh lên men với tỷ lệ 1% – 3% có thể cải thiện khả năng miễn dịch và kháng bệnh của cá, đồng thời không ảnh hưởng đến hiệu suất tăng trưởng của cá.
Tôm thẻ chân trắng là loài tôm nuôi phổ biến nhất thế giới, nhưng lại dễ bị tấn công bởi các bệnh truyền nhiễm. Theo truyền thống, người nuôi tôm sử dụng kháng sinh hoặc hóa chất để kiểm soát bệnh tôm, nhưng những phương pháp này có thể gây ra các vấn đề như an toàn thực phẩm, siêu vi khuẩn hoặc ô nhiễm môi trường. Trong nuôi trồng thủy sản hiện đại, phụ gia thức ăn chức năng đã được đề xuất như một phương pháp tiềm năng để kiểm soát các bệnh truyền nhiễm. Do đó, nghiên cứu này nhằm đánh giá ảnh hưởng đến hiệu suất tăng trưởng, các chỉ số miễn dịch không đặc hiệu, hình thái gan tụy và khả năng kháng bệnh của tôm.
Chuẩn bị nghiên cứu
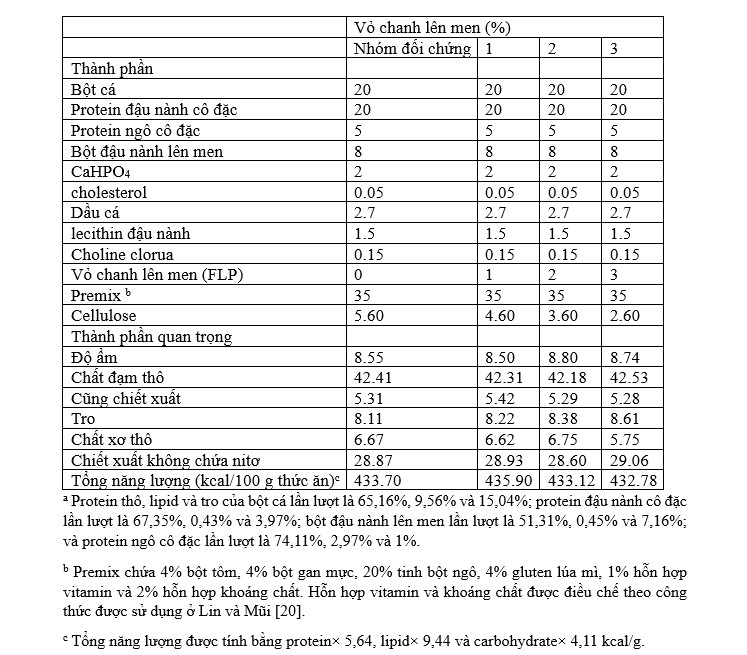
Vỏ chanh lên men (FLP) được chuẩn bị trong phòng thí nghiệm bằng cách lên men vỏ chanh với Lactobacillus plantarum trong 24 giờ ở 35 ℃ trong điều kiện yếm khí. Thành phần hóa học của FLP là: độ ẩm 7,66%; đạm thô 7,31%; lipid 1,39%; và xơ thô lần lượt là 13,55%.
Các khẩu phần ăn thử nghiệm được thiết kế theo dạng iso-nitrogen và isolipid để đáp ứng nhu cầu dinh dưỡng cho tôm thẻ chân trắng. Bốn mức FLP ở mức 0%, 1%, 2% và 3% được đưa vào khẩu phần đối chứng. Các thành phần được nghiền đến kích thước hạt nhỏ hơn 200 lưới, trộn và thêm nước để tạo thành bột nhào. Sau đó, trong thiết bị có khuôn, bột được xử lý thành dạng viên và sấy khô bằng quạt ở nhiệt độ phòng để đạt độ ẩm lên tới 10%. Viên được nghiền và sàng lọc đến kích thước 2,0 mm và đông lạnh ở -20 ℃ cho đến khi thử nghiệm cho ăn bắt đầu. Các thành phần gần đúng, bao gồm độ ẩm, protein thô, chiết xuất ete (lipid) và tro, đã được phân tích (AOAC, 1995) và cũng được thể hiện trong Bảng 1.
Bảng 1 Công thức thức ăn và thành phần gần đúng (% dưới dạng thức ăn)
Tôm post Litopenaeus vannamei (PL 15) sạch mầm bệnh (SPF) được cung cấp bởi 886 Apex Aquaculture Co., Ltd. (Cao Hùng, Đài Loan). Tôm L. vannamei được thích nghi với điều kiện phòng thí nghiệm ẩm ướt trong bể nhựa gia cố sợi thủy tinh (FRP) 3500 L trong một tháng và được cho ăn thức ăn tôm thương mại (Grobest Group Limited, nhà máy thức ăn chăn nuôi ở Cao Hùng, Đài Loan). Tôm giai đoạn C (lột xác) được chọn làm thí nghiệm. Trong thử nghiệm cho ăn đầu tiên, tổng số 240 con tôm con (trọng lượng cơ thể 2,37 ± 0,01 g) được phân bổ vào 16 bể FRP (70 L) trong hệ thống tuần hoàn. Tất cả các nghiệm thức được thiết lập thành 4 lần lặp lại (4 khẩu phần ăn × 4 bể). Mỗi bể là một phần của hệ thống tuần hoàn được trang bị miếng bọt biển, bộ lọc sinh học, đèn UV và bộ điều khiển nhiệt độ (29 ± 1 ◦C). Sục khí liên tục để kiểm soát lượng oxy hòa tan (≥ 6 mg/L). Các tạp chất trong nước biển (độ mặn 28–30 g/L) được loại bỏ bằng túi lọc và khử trùng bằng tia UV trước khi thay nước. 12 giờ sáng và 12 giờ tối trong phòng thí nghiệm ẩm ướt được duy trì bằng bộ điều khiển tự động. Nồng độ amoniac và nitrit trong nước nuôi được theo dõi hàng tuần, giá trị lần lượt là < 0,02 mg/L và 0,05–0,12 mg/L.
Tôm được cho ăn thức ăn thí nghiệm 4 lần/ngày vào lúc 08:00, 12:00, 16:00 và 20:00. Tỷ lệ cho ăn được đặt ở mức 6% trọng lượng cơ thể và gần đạt đến mức no rõ ràng. Thức ăn thừa được lấy ra sau một giờ cho ăn, sau đó sấy khô trong lò quạt nóng 60℃ và được ghi lại để tính toán tổng lượng thức ăn tiêu thụ trong quá trình cho ăn thử nghiệm. Tôm trong mỗi bể được cân số lượng lớn 2 tuần/ lần và lượng thức ăn được điều chỉnh tương ứng. Thời gian cho ăn được ấn định là 56 ngày. Thử nghiệm cho ăn thứ hai được tiến hành để thử nghiệm cảm nhiễm Vibrio alginolyticus cùng lúc với thử nghiệm đầu tiên. Thể trọng tôm và quy trình nuôi tương tự như thử nghiệm cho ăn đầu tiên. Tôm được cho ăn 4 khẩu phần ăn thử nghiệm trong các nhóm ba lần (15 con mỗi bể). Đối với nhóm trống, 3 bể bổ sung được sử dụng và tôm được thả vào bể và được cho ăn với khẩu phần ăn kiểm soát FLP 0%. Thời gian cho ăn cũng kéo dài trong 56 ngày.
Trước khi cân và lấy mẫu lần cuối, tất cả tôm đều được nhịn ăn trong 24 giờ. Số lượng tôm sống sót trong mỗi bể được đếm và mỗi con tôm được ghi lại trọng lượng ướt cuối cùng riêng biệt. Việc tính toán hiệu suất tăng trưởng được thực hiện và được liệt kê như sau:
Tăng cân (%) = [trọng lượng cơ thể cuối cùng – trọng lượng cơ thể ban đầu]/trọng lượng cơ thể ban đầu × 100;
Tỷ lệ chuyển hóa thức ăn = lượng ăn vào/(trọng lượng cơ thể cuối cùng – trọng lượng cơ thể ban đầu);
Tỷ lệ hiệu quả sử dụng protein = (trọng lượng cơ thể cuối cùng – trọng lượng cơ thể ban đầu)/lượng protein ăn vào;
Tỷ lệ sống (%) = 100 × (số tôm sống sót/số tôm ban đầu).
Sau khi cân, hai con tôm được thu thập ngẫu nhiên từ các bể tương ứng, gộp lại và đồng nhất để đo thành phần hóa học. Hàm lượng protein thô (N × 6,25), độ ẩm và tro được xác định bằng các quy trình được mô tả trong AOAC (1995), trong khi hàm lượng lipid tổng được phân tích bằng cách chiết bằng cloroform/metanol (2:1). 3 con tôm khác được thu thập từ mỗi bể, 0,1 mL hemolymp được lấy ra từ xoang bụng bằng ống tiêm vô trùng (0,5 mm × 25 mm, 25 g) và trộn với 0,9 mL chất chống đông máu (chứa NaCl 0,34 M, natri citrat 530 mM, và 10 mM EDTA; giá trị pH và độ thẩm thấu được điều chỉnh lần lượt là 7,5 và 780 mOsm/kg). Tổng số lượng tế bào máu (THC) được đo bằng máy đo huyết cầu với kính hiển vi tương phản pha ngược (Nikon Co., Nhật Bản). Sự hình thành dopachrome bởi phenoloxidase (PO) trong hemolymp của tôm được đo bằng máy đo quang phổ (Hitachi, Nhật Bản).
Sau khi lấy mẫu máu, một lượng nhỏ dung dịch cố định (10% formaldehyde, Sigma Chemical, Hoa Kỳ) được tiêm vào gan tụy trong 2 phút để ngăn chặn quá trình tự phân hủy của gan tụy. Một mảnh gan tụy được cắt ra và cho vào dung dịch formaldehyde 10% trong 48 giờ. Sau khi khử nước với tỷ lệ ethanol tăng dần lên đến 100% (Merck Co., Đức), mẫu được nhúng parafin, cắt lát thành các phần 5 µm và nhuộm bằng eosin và hematoxylin (Leica, Wetzlar, Đức). Sự thay đổi hình thái của các phần gan tụy được quan sát bằng kính hiển vi (Nikon Co., Nhật Bản).
Thử nghiệm cảm nhiễm vi khuẩn Vibrio alginolyticus
Vi khuẩn V. alginolyticus, được cung cấp từ phòng thí nghiệm của Giáo sư Chin-Chyuan Chang, được phân lập từ tôm thẻ chân trắng L. vannamei bị nhiễm bệnh tại một trang trại nuôi tôm địa phương ở Đài Loan. Tác nhân gây bệnh được xác định bằng phản ứng chuỗi polymerase (PCR).
Trong thử nghiệm cho ăn thứ hai, sau lần cho ăn cuối cùng, 10 con tôm từ tất cả các bể được thu thập ngẫu nhiên và 20 μL huyền phù V. alginolyticus [1,0 × 108 đơn vị hình thành khuẩn lạc (CFU)/mL] được cấy vào xoang bụng của tôm. Mỗi con tôm nhận được liều lượng 1,3 × 106 CFU/g trọng lượng cơ thể. Liều lượng tương tự như liều gây chết 50% (LD50) (1,15 × 106 CFU/g trọng lượng cơ thể) thu được trong thử nghiệm trước (dữ liệu không được hiển thị). Hơn nữa, 10 con tôm được đánh bắt từ 3 bể bổ sung (cho ăn thức ăn đối chứng), sau đó được tiêm 20 µL nước muối vô trùng (NaCl 0,85%) là nhóm không cảm nhiễm. Mỗi thử nghiệm bao gồm ba lần lặp lại (n = 3). Tôm được tiêm nước muối hoặc mầm bệnh được đưa trở lại bể tương ứng và cho ăn thức ăn tương ứng trong 3 ngày. Ngoài ra, 20% lượng nước biển nuôi được thay đổi mỗi ngày. Tôm chết được loại bỏ và những con còn sống được theo dõi hàng ngày.
Kết quả và thảo luận
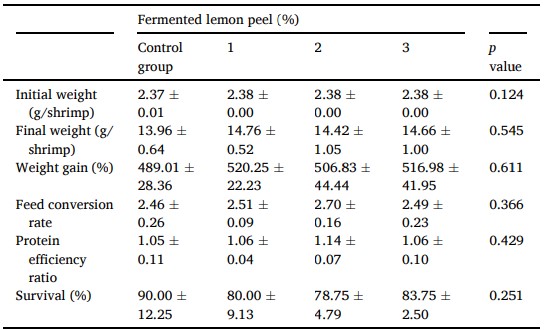
Trọng lượng cơ thể cuối cùng, tỷ lệ tăng trọng, tỷ lệ chuyển đổi thức ăn, tỷ lệ hiệu quả sử dụng protein và tỷ lệ sống không khác biệt đáng kể (p > 0,05) ở tất cả các nhóm khẩu phần (Bảng 2). Nghiên cứu này nhấn mạnh rằng hiệu suất tăng trưởng của L. vannamei không bị ảnh hưởng bởi khẩu phần ăn có vỏ chanh lên men lên đến 3%. Các nghiên cứu trước đây chỉ ra rằng sự suy giảm tăng trưởng đã được quan sát thấy ở cá tráp vàng (Sparus aurata), cá da trơn châu Phi (Clarias gariepinus) và cá rô phi sông Nile (Oreochromis niloticus) và cá hồi (Oncorhynchus mykiss) cho ăn 1%− 3% vỏ chanh khô. Nghiên cứu này cùng với các nghiên cứu trước đây về cá chẽm châu Á và cá mú đốm cam đã chứng minh rõ ràng rằng vỏ chanh lên men bằng Lactobacillus plantarum có thể được sử dụng làm phụ gia thức ăn chăn nuôi mà không cần bất kỳ tác động tiêu cực nào đến hiệu suất tăng trưởng lên tới 3% được đưa vào thức ăn. FLP phù hợp để áp dụng để nghiên cứu sâu hơn về các chức năng có lợi của nó đối với tôm thẻ chân trắng.
Bảng 2 Trọng lượng ban đầu, trọng lượng cuối cùng, tỷ lệ tăng trọng, tỷ lệ chuyển đổi thức ăn và tỷ lệ sống của tôm thẻ Litopenaeus vannamei được cho ăn thức ăn có chứa vỏ chanh lên men khác nhau trong 56 ngày.
Các giá trị được trình bày dưới dạng phương tiện ± độ lệch chuẩn (n = 4).
Harikrishnan và cộng sự (2020) chỉ ra rằng bổ sung vỏ chanh khô 0,25%− 0,5% trong thức ăn có thể cải thiện hiệu suất tăng trưởng của cá chép Ấn Độ (Labeo rohita). Hàm lượng vỏ chanh trong nghiên cứu này thấp hơn mức (1%− 3%) được sử dụng trong các nghiên cứu khác trên cá tráp vàng, cá rô phi sông Nile và cá da trơn châu Phi, cá hồi vân, cá chẽm châu Á và cá mú đốm cam. Khi xem xét sự hình thành thức ăn trong nghiên cứu cá chép lớn ở Ấn Độ, mức protein trong khẩu phần là 45% đã được sử dụng. Có thể sự tăng trưởng được cải thiện là kết quả của mức protein trong khẩu phần là 45%, cao hơn mức protein khuyến nghị 35% cho loài cá này. Thành phần dinh dưỡng không đầy đủ của khẩu phần thử nghiệm có thể ảnh hưởng đến kết quả cuối cùng trong thử nghiệm cho ăn.
Tôm tiêu thụ thức ăn 1% FLP có độ ẩm toàn cơ thể cao hơn tôm được nuôi bằng thức ăn 2% FLP (Bảng 3). Tôm được cho ăn thức ăn có 2% và 3% FLP cho thấy hàm lượng tro cao hơn tôm được nuôi bằng thức ăn có 1% FLP. Hàm lượng protein thô trong toàn bộ cơ thể cao hơn ở nhóm đối chứng so với tôm được nuôi bằng thức ăn FLP 1% và 3%. Kết quả cho thấy hàm lượng protein thô, độ ẩm và tro trong toàn bộ cơ thể có giá trị tương tự nhau: ví dụ độ ẩm là 74,47%− 76,88%, hàm lượng tro là 2,31%− 3,17% và hàm lượng protein thô là 18,21%− 19,18%. Ngoài ra, không thu được xu hướng nhất quán hoặc tác dụng phụ thuộc vào liều lượng. Do đó, điều này cho thấy việc bổ sung FLP trong thức ăn có thể không ảnh hưởng đến thành phần cơ thể.
Các giá trị được trình bày dưới dạng phương tiện ± độ lệch chuẩn (n = 4). Chỉ số trên a, b trong mỗi hàng có ý nghĩa khác nhau đáng kể (p < 0,05) giữa các nhóm khác nhau.
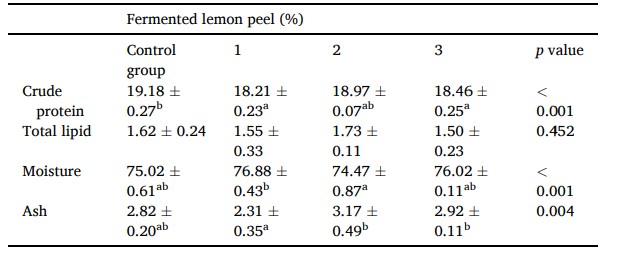
Các giá trị được trình bày dưới dạng phương tiện ± độ lệch chuẩn (n = 4). Chỉ số trên a, b trong mỗi hàng có ý nghĩa khác biệt đáng kể (p < 0,05) giữa các nhóm khác nhau.
Tổng số lượng tế bào máu (THC) cao hơn ở tôm được nuôi với 1% và 2% FLP trong khi hoạt động của phenoloxidase (PO) cao hơn ở tôm được nuôi với 2% FLP so với nhóm đối chứng (Hình 1). Là động vật tương đối nguyên thủy, tế bào máu trong hệ tuần hoàn đóng vai trò cốt lõi trong các phản ứng miễn dịch không đặc hiệu ở động vật giáp xác. Trong quá trình lây nhiễm sớm, các mầm bệnh xâm nhập có thể phá hủy các tế bào máu tròn và dẫn đến mất tế bào máu nghiêm trọng trong hemolymp. Các tế bào máu mới sinh của tôm có thể thực hiện các phản ứng miễn dịch bao gồm hệ thống PO, quá trình thực bào, đóng gói và đông máu để ngăn ngừa tổn thương thêm. Hệ thống PO là hệ thống không tự nhận biết và là một trong những cơ chế miễn dịch quan trọng nhất ở giáp xác để ngăn chặn mầm bệnh xâm nhập. Số lượng tế bào máu và hoạt động PO được áp dụng phổ biến trong đánh giá khả năng miễn dịch của tôm thẻ chân trắng L. vannamei. Kết quả của chúng tôi cho thấy rằng tôm được cho ăn thức ăn có chứa FLP cho thấy tổng số lượng tế bào máu và hoạt động PO được cải thiện so với nhóm đối chứng, cho thấy rằng Lactobacillus plantarum FLP mang lại tác dụng có lợi giúp cải thiện các thông số miễn dịch không đặc hiệu ở L. vannamei.
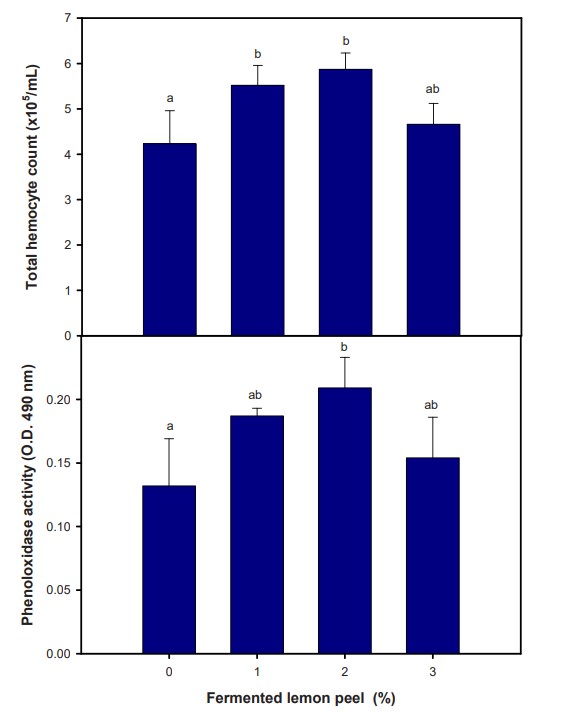
Hình 1. Tổng số lượng tế bào máu và hoạt tính phenoloxidase của tôm thẻ chân trắng Litopenaeus vannamei được cho ăn với các tỷ lệ vỏ chanh lên men khác nhau trong 56 ngày. Mỗi thanh báo cáo giá trị trung bình của 4 lần lặp lại các bể nuôi tôm (n = 4). Các chỉ số trên khác nhau trên các thanh cho thấy sự khác biệt đáng kể (p < 0,05).
Kết quả này phù hợp với các nghiên cứu trước đây về việc cung cấp vỏ chanh khô trong thức ăn chăn nuôi hoặc nghiên cứu trước đây của chúng tôi về cung cấp FLP trong thức ăn chăn nuôi. Tác dụng kích thích miễn dịch có thể liên quan đến các thành phần sinh học trong vỏ chanh. Hơn nữa, một khả năng khác là các chất chuyển hóa có nguồn gốc từ quá trình lên men men vi sinh. Mặc dù nghiên cứu này không xác định được chất hóa chất thực vật và chất chuyển hóa nào cung cấp các chức năng trong hệ thống miễn dịch của tôm, nhưng chắc chắn nghiên cứu này chứng minh việc bổ sung FLP cho thấy lợi ích đối với sức khỏe tôm.
Sau 72 giờ, tất cả tôm được tiêm nước muối vô trùng (để trống) đều sống sót. Tỷ lệ sống cao hơn ở tôm được cho ăn 2% và 3% FLP so với nhóm đối chứng sau khi tiêm V. alginolyticus (Hình 2). Các nghiệm thức với 2% và 3% FLP mang lại tỷ lệ sống tốt hơn so với tôm được cho ăn thức ăn kiểm soát FLP 0%. Điều này chỉ ra rõ ràng rằng việc tăng cường các phản ứng miễn dịch không đặc hiệu ở tôm phản ứng với khả năng đề kháng cao chống lại mầm bệnh. Dựa trên phản ứng miễn dịch và khả năng kháng V. alginolyticus, nghiên cứu này có thể kết luận rằng L. plantarum FLP là một chất phụ gia thức ăn chức năng nhằm cải thiện khả năng miễn dịch chống lại bệnh tật, được khuyến nghị bổ sung vào khẩu phần ăn của tôm thẻ chân trắng ở mức 2%.
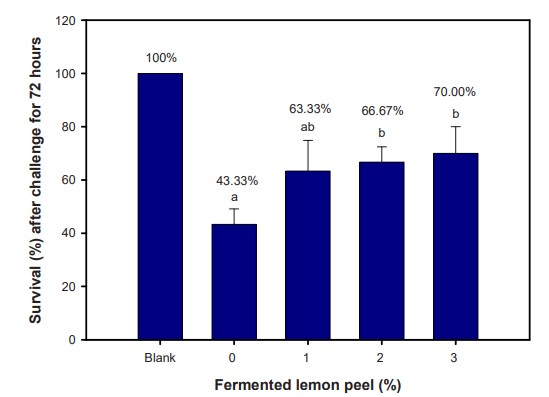
Hình 2. Tỷ lệ sống của tôm thẻ chân trắng Litopenaeus vannamei bị cảm nhiễm với Vibrio alginolyticus trong 72 giờ. Mỗi thanh báo cáo giá trị trung bình của ba lần (n = 3). Các chỉ số trên khác nhau trên các thanh cho thấy sự khác biệt đáng kể (p < 0,05).
Một nghiên cứu đã được thực hiện để đánh giá tác dụng của vỏ chanh lên men đối với sức khỏe gan tụy của tôm thẻ chân trắng (L. vannamei). Trong nghiên cứu này, tôm được chia thành ba nhóm: nhóm đối chứng, nhóm được cho ăn thức ăn bổ sung 2% vỏ chanh lên men (FLP) và nhóm được cho ăn thức ăn bổ sung 3% FLP. Kết quả cho thấy không có thay đổi về hình thái nào được quan sát thấy ở gan tụy của tôm trong tất cả các nghiệm thức ăn. Điều này có thể là do nguồn protein chính được sử dụng trong nghiên cứu này là protein đậu nành cô đặc (SPC), chứ không phải bột đậu nành (SBM). SPC được sản xuất bằng quá trình xử lý hóa học và vật lý, dẫn đến biến tính protein đối với glycinin và β-conglycinin, hai yếu tố kháng dưỡng có thể gây tổn thương gan tụy ở tôm. Do không có tổn thương gan tụy nào được quan sát thấy, các nhà nghiên cứu không thể đánh giá được tác dụng của FLP đối với sức khỏe gan tụy của tôm. Tuy nhiên, nghiên cứu trước đây của các nhà nghiên cứu này đã chứng minh rằng FLP cho thấy sự cải thiện sức khỏe đường ruột ở cá chẽm châu Á. Do đó, một nghiên cứu sâu hơn để xác nhận chức năng của FLP đối với sức khỏe gan tụy của tôm thẻ chân trắng là cần thiết.
Hình 3. Các phần gan tụy của tôm thẻ chân trắng Litopenaeus vannamei được cho ăn với tỷ lệ vỏ chanh lên men khác nhau trong 56 ngày. Độ phóng đại ×200. L: lòng ống gan tụy; R: tế bào phục hồi; B: Tế bào tiết tế bào B; F: tế bào sợi.
Kết luận
Nghiên cứu hiện tại nhấn mạnh rằng vỏ chanh lên men bằng L. plantarum có tiềm năng làm phụ gia thức ăn chức năng cho tôm thẻ chân trắng. Kết quả này rất hữu ích cho việc tái chế việc sử dụng chất thải/sản phẩm phụ nông nghiệp để đáp ứng mục tiêu SDG. Mức độ bao gồm FLP lên tới 3% không cho thấy bất kỳ tác động tiêu cực nào đến sự tăng trưởng và hình thái ở gan tụy của tôm. Mức FLP 2% được khuyến nghị đưa vào thức ăn cho tôm để tăng cường phản ứng miễn dịch không đặc hiệu và khả năng kháng V. alginolyticus trong môi trường phòng thí nghiệm được kiểm soát. Các nghiên cứu trong tương lai có thể tập trung vào việc xác định các thành phần chức năng của FLP và nghiên cứu thêm về các lợi ích của FLP đối với động vật thủy sinh khác.
Theo Yen-Chun Lee, Chin-Chyuan Chang, Yu-Hsuan Lin, Yu-Hung Lin
Nguồn: https://www.sciencedirect.com/science/article/pii/S2352513424000061
Biên dịch: Nguyễn Thị Quyên – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ngành Tôm Ecuador Thiệt Hại 1,5 Tỷ USD Vào Năm 2023
- Báo cáo của CSIRO FRDC cảnh báo – lỗ hổng nguy hiểm trong xét nghiệm bệnh tôm
- Methyl farnesoate Ức Chế Sự Phát Triển Buồng Trứng Giai Đoạn Cuối Và Giảm Khả Năng Sinh Sản Ở Tôm Sú Penaeus monodon

 English
English