TÓM TẮT
Thức ăn nuôi tôm đang được phát triển liên tục để tối đa hóa sự tăng trưởng, sức khỏe và hiệu quả sử dụng thức ăn của tôm. Có bằng chứng cho thấy rằng các thành phần thực vật có thể có khả năng cải thiện từng đặc điểm này ở các loài thủy sản. Tuy nhiên, tiềm năng đầy đủ của các thành phần này vẫn chưa được khám phá. Chúng tôi đã nghiên cứu ảnh hưởng của việc bổ sung chiết xuất mía giàu polyphenol (PRSE) vào khẩu phần ăn với tỷ lệ 0, 2, 4 hoặc 6 g/kg khẩu phần đối với sự tăng trưởng, tỷ lệ sống, tỷ lệ chuyển đổi thức ăn và mầm bệnh ở tôm sú (Penaeus monodon) trong thời gian cho ăn 10 tuần trong hệ thống RAS thâm canh quy mô nhỏ. Tôm được cho ăn mức PRSE cao nhất nặng hơn 54% (15,4 so với 10,0g; p < 0,05), có hệ số chuyển đổi thức ăn thấp hơn 39% (1,9 so với 3,1; p < 0,05), tỷ lệ sống cao hơn (50 so với 26%) và chiều dài giáp đầu ngực tăng lên (27,5 so với 23,3mm; p > 0,05) so với nhóm đối chứng. Những phát hiện này chứng minh rằng chiết xuất mía giàu polyphenol có khả năng cải thiện sự tăng trưởng của tôm và FCR khi được thêm vào công thức thức ăn. Cần tiến hành những nghiên cứu sâu hơn trong điều kiện nuôi thương phẩm để xác nhận vấn đề này.
1. Giới thiệu
Tôm biển là loài nuôi trồng thủy sản quan trọng, với tổng sản lượng toàn cầu của hai loài nuôi chính là tôm thẻ chân trắng (Litopenaeus vannamei) và tôm sú (Penaeus monodon), đạt gần 5 triệu tấn vào năm 2016 [1]. Vì thức ăn là chi phí kinh tế lớn nhất trong nuôi tôm nên nhiều biện pháp đã liên tục được thực hiện với mục đích cải thiện chi phí thức thức ăn [2]. Đối với thức ăn nuôi trồng thủy sản, mục tiêu cuối cùng là tạo ra khẩu phần có tốc độ tăng trưởng, sức khỏe động vật và hiệu quả sử dụng thức ăn tốt nhằm mang lại sản phẩm có trách nhiệm xã hội và giá cả phải chăng cho người tiêu dùng. Do đó, các thành phần bền vững hơn về mặt kinh tế và môi trường như hoạt chất sinh học từ thực vật đang được sử dụng ngày càng nhiều trong công thức thức ăn thủy sản [3].
Nghề nuôi tôm đang phải đối mặt với một loạt thách thức về phúc lợi động vật, gây ảnh hưởng tiêu cực đến năng suất trên toàn thế giới. Các yếu tố góp phần gây nên hiện trạng này bao gồm dịch bệnh và sự lây lan nhanh chóng, mật độ thả giống cao hơn và chất lượng nước dưới mức tối ưu [4]. Yếu tố chung hiện diện trong các tình trạng này là sự gia tăng stress oxy hóa. Ví dụ, một loạt các enzyme chống oxy hóa có liên quan đến phản ứng miễn dịch ở tôm và nhiễm virus như virus gây hội chứng đốm trắng hoặc sử dụng kháng sinh như enrofloxacin, tất cả đều được chứng minh là có tác dụng kích thích sản xuất các loại oxy phản ứng [5–7]. Việc gia tăng stress oxy hóa làm ảnh hưởng đến phản ứng miễn dịch và cuối cùng làm giảm kết quả sản xuất và tổng sản lượng sinh khối [7].
Trong nỗ lực tăng sản lượng sinh khối, việc sử dụng kháng sinh để kích thích tăng trưởng đã được áp dụng trong nuôi trồng thủy sản tương tự như cách được sử dụng trong nông nghiệp [8]. Sự phụ thuộc vào kháng sinh cho cả nông nghiệp và nuôi trồng thủy sản này thúc đẩy tình trạng kháng kháng sinh đối với các mầm bệnh do vi khuẩn [9]. Kết quả là áp lực từ phía cơ quan quản lý và người tiêu dùng ngày càng tăng, đang khuyến khích ngành hạn chế sử dụng kháng sinh để kích thích tăng trưởng. Ngoài ra, một số loại kháng sinh cũng đã được chứng minh là làm tăng sản xuất các loại oxy phản ứng ở tôm, gây thêm áp lực lên hệ thống miễn dịch [5]. Hiện nay cần phải xác định các thành phần và chất phụ gia mới giúp tối đa hóa sự tăng trưởng và sức khỏe của tôm, đồng thời hỗ trợ việc mở rộng bền vững nghề nuôi tôm toàn cầu.
Các hợp chất chống oxy hóa tự nhiên, như polyphenol, là một lựa chọn tiềm năng để nâng cao hiệu quả sản xuất vì chúng có nhiều trong thực vật và đã được tiêu thụ trong suốt một lịch sử tiến hóa lâu dài bởi các loài ăn tạp/ăn cỏ. Polyphenol từ thực vật là một loạt các chất chuyển hóa thứ cấp có chứa một hoặc nhiều vòng thơm và ít nhất hai nhóm hydroxyl [10]. Polyphenol có liên quan đến nhiều tác động tích cực đến sức khỏe, thông qua nhiều cơ chế được đề xuất. Các cơ chế này bao gồm điều chỉnh quá trình trao đổi chất, tương tác với vi khuẩn đường ruột và đóng vai trò là chất loại bỏ các gốc tự do [11]. Hơn nữa, bằng chứng được thu thập các nghiên cứu trên động vật và con người cho thấy các đặc tính chống oxy hóa, chống viêm và kháng khuẩn [12–14] của polyphenol có thể có lợi như tác nhân phòng ngừa nhiều bệnh không lây nhiễm ở động vật, bao gồm cả các loài thủy sản [15].
Việc đưa nhiều loại thành phần giàu polyphenol vào chế độ ăn tiêu chuẩn đã được nghiên cứu về dinh dưỡng tôm với những tác động khác nhau, kết quả cho thấy rằng phản ứng của tôm có thể đặc trưng đối với thành phần polyphenol cụ thể của chế độ ăn [16–23]. Nhiều nghiên cứu đã liên kết lượng polyphenol thực vật hấp thụ với khả năng tăng khả năng chống lại bệnh truyền nhiễm [24–28]. Tuy nhiên, tác dụng cụ thể của các hợp chất có nguồn gốc từ mía chưa được khám phá ở tôm sú. Một chiết xuất từ mía (Saccharum officinarum), được biết đến với tên thương mại là Polygain™, đã cho thấy kết quả tăng trưởng đầy hứa hẹn ở tôm càng xanh (Macrobrachium rosenbergii) [29], điều này đã làm cơ sở cho việc nghiên cứu sâu hơn về tác động của chiết xuất này đến kết quả năng suất ở tôm sú.
Trong thử nghiệm này, hiệu quả của việc bổ sung chiết xuất mía giàu polyphenol (PRSE) Polygain™ thu được từ mía vào chế độ ăn đã được đánh giá về sự tăng trưởng, tỷ lệ sống, tỷ lệ chuyển hóa thức ăn và tải lượng mầm bệnh ở tôm sú (Penaeus monodon) trong hệ thống nuôi thâm canh quy mô nhỏ.
2. Vật liệu và phương pháp
2.1. Chuẩn bị chiết xuất mía giàu polyphenol
Chiết xuất mía giàu polyphenol (PRSE) được sử dụng trong nghiên cứu này (Polygain™, The Product Makers, Melbourne, Australia) có nguồn gốc từ mía (Saccharum officinarum) và được sản xuất bằng quy trình đã được cấp bằng sáng chế. Tóm lại, nước mía trong được làm bay hơi trong chân không và kết tinh để tạo ra mật đường. Mật đường sau đó được lên men với sự có mặt của nấm men Saccharomyces cerevisiae, và ethanol được loại bỏ bằng cách bay hơi chân không và ngưng tụ. Phần vinasse còn lại được pha loãng trong nước và sàng qua một loạt bộ lọc (5, 1, 0,5 và 0,1 µm). Sau đó, vinasse được cô đặc thêm trong điều kiện chân không và chiết rót nóng (80°C) vào thùng nhựa.
PRSE thu được có các thông số kỹ thuật sau do nhà sản xuất cung cấp: 55° brix, pH 4,4, mật độ 1,28 g/cm3, ≥38.000 mg polyphenol tổng số/L (tương đương với axit gallic), ≥10.000 mg flavonoid/L (tương đương catechin), 20-40g K/kg, 30-50g Mg/kg, 3-5g Ca/kg, 0,5-2g Na/kg, 100-150mg Fe/kg, tổng 40-46g axit amin/kg (≈20% là axit amin thiết yếu) và axit hữu cơ ở mức 4-5% w/w lượng đường.
Theo thông số kỹ thuật được cung cấp, các polyphenol và flavonoid sau đây đã được xác định trong PRSE: axit chlorogen, axit caffeic, axit sinapic, axit syringic, vanillin, homoorientin, orientin, vitexin, swertisin, diosmin, apigenin, tricin và diosmetin. Phân tích LC-MS cho phép xác định tạm thời 7 apigenin-C-glycoside, 3 methoxyluteolin-C-glycoside và 3 tricin-O-glycoside.
2.2. Chế độ ăn
4 chế độ ăn chứa 0, 2, 4 hoặc 6g/kg PRSE (Phần 2.1) đã được xây dựng (Bảng 1). Khẩu phần ăn được thực hiện bằng cách sử dụng tôm khô nghiền (Ridley Aquafeeds, Narangba, QLD, Australia). Hỗn hợp bột khô này là hỗn hợp bột khô có công thức độc quyền gồm nhiều thành phần và phụ gia có nguồn gốc từ thực vật, động vật và biển. PRSE và/hoặc sucrose (Chem- Supply, Port Adelaide, SA, Australia) được cân trọng lượng và sau đó hòa tan trong nước để sử dụng làm thức ăn. Dung dịch này sau đó được thêm vào hỗn hợp nghiền khô. Hỗn hợp ướt được trộn trong Máy trộn hành tinh Hobart (Model A200-B1HE, Hobart Food, Silverwater, Australia) trong 10 phút ở tốc độ cao nhất. Hỗn hợp ẩm sau đó được ép đùn qua khuôn 3mm trên phụ kiện máy xay thịt Hobart. Các sợi ép đùn được lấy ra khỏi máy xay thịt khi đạt độ dài khoảng 20 cm, tách rời khỏi nhau và hấp trong 5 phút. Các sợi đã hấp được đặt vào khay nhôm và sấy khô trong lò ở nhiệt độ 60°C trong 20 giờ. Các sợi khô được đặt trong máy xay (Vitamix model VM0109, Vita-Mix Corp., Cleveland, OH, USA) và trộn theo từng xung cho đến khi các sợi được bẻ thành từng viên có chiều dài từ 2 đến 6 mm. Khẩu phần sau đó được sàng (cỡ mắt lưới 1 mm) để loại bỏ bụi và bảo quản ở -20°C cho đến khi sử dụng. Tỷ lệ bổ sung PRSE được sử dụng trong nghiên cứu này vì các tỷ lệ này trước đây đã được báo cáo là có tác dụng có lợi đối với sự tăng trưởng và sức khỏe của tôm càng xanh Macrobrachium rosenbergii (Rubel, Shimul & Nahid, 2018). Sucrose được chọn để thay thế PRSE trong khẩu phần có PRSE <0,6% để duy trì nồng độ chất dinh dưỡng đồng nhất trong các khẩu phần được tạo ra. Phân tích gần đúng được thực hiện bởi Viện Đo lường Quốc gia. Kết quả phân tích gần đúng chỉ ra rằng khẩu phần bao gồm 40,6% protein, 6,2% chất béo, 28% carbohydrate, 9,4% tro và 15,9% độ ẩm.
Bảng 1. Thành phần khẩu phần thử nghiệm được sử dụng để đánh giá hiệu quả của việc bổ sung chiết xuất mía giàu polyphenol (Polygain™) vào khẩu phần ăn của tôm sú, Penaeus monodon.
1 The Product Makers, Melbourne, Vic, Úc. Chất bổ sung Polygain là chất lỏng không biến đổi do nhà sản xuất cung cấp;
2 Chem- supply, Cảng Adelaide, SA, Úc. Việc bổ sung Sucrose làm chất độn cho Polygain dựa trên hàm lượng DM ước tính 60% theo trọng lượng của Polygain;
3 Tôm khô nghiền, Ridley Aquafeeds Ltd., Narangba, QLD, Australia.
2.3. Quản lý tôm nuôi
Hậu ấu trùng (PL15) được thu thập từ một trang trại thương mại ở phía bắc Queensland. Tôm (khoảng 220-250 con, mật độ khoảng 15 con/L) được vận chuyển trong 2 giờ trong nước biển có độ mặn khoảng 35 ppt trong túi nhựa (thể tích 15L) giàu oxy. Túi được đựng trong hộp polystyrene để ổn định nhiệt độ nước. Khi đến cơ sở thí nghiệm, tôm và nước vận chuyển được xử lý bằng formalin (0,2 g/L trong 1 giờ trong thùng sục khí) như một yêu cầu kiểm dịch. Vào thời điểm thử nghiệm, không cần có sự phê duyệt về đạo đức động vật cho thử nghiệm tôm ở Úc.
Tôm được nuôi trong bể nhựa hình chữ nhật trong hệ thống nuôi trồng thủy sản tuần hoàn được kiểm soát môi trường (RAS). Hệ thống này bao gồm tổng cộng 40 bể nhựa hình chữ nhật (thể tích ≈ 43L), 2 bộ lọc sinh học (mỗi bộ ≈100 L), 2 bộ lọc UV (bộ lọc Emperor Aquatics 25 W UVC, Pentair, Florida, USA) và 2 bể chứa (≈350 L mỗi bể). Tổng thể tích hệ thống là ≈ 2600 L. Chế độ ánh sáng 12:12 giờ được sử dụng trong suốt thử nghiệm, với 4 ống huỳnh quang màu đỏ được sử dụng để chiếu sáng mờ căn phòng trong suốt thời gian chiếu sáng 12 giờ. Các thông số chất lượng nước được đo hàng ngày bằng cách sử dụng bộ dụng cụ thương mại đo NH3/NH4+, NO2–, NO3– (Aquasonic Pty Ltd., Wauchope, NSW, Australia) và pH (bộ dụng cụ kiểm tra pH dải cao API, Mars Fishcare North America Inc., Chalfont, PA, USA) hoặc đầu dò (YSI 556 MPS, Yellow Springs, OH, USA) để đo DO, độ mặn và nhiệt độ. Các thông số nước trong suốt thời gian thử nghiệm nằm trong phạm vi tối ưu cho tôm sú P. monodon; 29,2 ± 0,04°C, pH 8,2 ± 0,02, 96,5 ± 6,3 DO (% bão hòa), <0,01 mg NH3/NH4+/L, <0,05 mg NO2–/L, 10,5 ± 4,4 mg mg NO3–/L (trung bình ± SEM, n = 75). Độ mặn giảm dần từ 31 xuống 20 g/L trong khoảng thời gian 10 ngày sau khi đưa tôm vào hệ thống, từ đó độ mặn được duy trì ở mức 20,1 ± 0,02 g/L (trung bình ± SEM, n = 75) trong thời gian thử nghiệm. Nước biển đã lọc (1 µm) được lấy từ biển khơi (AIMS, Townsville, QLD, Australia), trong khi nước ngọt được sử dụng để giảm độ mặn là nước máy được lọc bằng carbon. Một hỗn hợp thương mại của vi khuẩn (Stability, Seachem Lab Laboratory Inc., Madison, GA, USA; Batch 77.975 4/20) đã được thêm vào hệ thống với tốc độ 250 mL/ngày (0,1 mL/L) trong hai ngày liên tiếp bắt đầu từ ngày tôm được thêm vào hệ thống. Tôm được thả với mật độ 25–30 con mỗi bể (≈0,6 con/L). Mật độ đã giảm xuống ≈ 15 con tôm mỗi bể khi tôm đạt kích cỡ PL40 để giảm thiểu tình trạng ăn thịt đồng loại trong quá trình lột xác. Tôm được cho ăn với tỷ lệ >10% trọng lượng cơ thể/ngày, với vụn tôm thương mại (Shrimp MR SRT #0, Ridley Aquafeeds Ltd.) từ PL15 – PL50 và với khẩu phần thử nghiệm đối chứng từ PL-51 – PL57. Không quan sát thấy bất kỳ mối lo ngại nào về sức khỏe hoặc dịch bệnh trong thời gian cách ly 2 tuần bắt buộc (PL15 – PL28).
Thử nghiệm cho ăn bắt đầu khi tôm (PL58) đạt kích cỡ 1,04 ± 0,02g (trung bình ± SEM, n = 80). 20 con tôm được chọn ngẫu nhiên và đo chiều dài giáp đầu ngực. 5 con tôm được chọn ngẫu nhiên, cân từng nhóm rồi thả vào từng bể thí nghiệm. Các nghiệm thức được chỉ định ngẫu nhiên cho mỗi bể (4 bể/nghiệm thức, tổng cộng 16 bể cho thử nghiệm). Khẩu phần ăn hàng ngày được chia thành 3 lần ăn (chia ≈ 25:25:50%) vào lúc ≈ 09:30, 13:00 và 16:30h. Lượng thức ăn cho mỗi bể được cân và ghi chép hàng ngày. Mỗi ngày, lượng thức ăn thừa được hút ra, sấy khô trong lò và cân. Tỷ lệ cho ăn sau đó được điều chỉnh cho từng bể dựa trên lượng thức ăn thừa, với mục đích cho tất cả tôm ăn no. Tỷ lệ chết được ghi nhận hàng ngày.
2.4. Lấy mẫu
Từng con tôm được lấy mẫu về trọng lượng và chiều dài giáp đầu ngực sau 0 (Phần 2.2), 35 và 70 ngày trong chế độ ăn thử nghiệm. Vào ngày 0 và ngày 35, tất cả tôm đều được cân và sau đó thả lại vào bể tương ứng. Ngoài ra, sau 70 ngày, các cặp chân bơi từ mỗi con tôm được lấy mẫu để phân tích tải lượng virus (xem Phần 2.6). Để lấy mẫu, tôm được thu bằng lưới, thấm khô bằng khăn giấy, đo kích thước và sau đó đưa trở lại bể tương ứng.
Việc phát hiện và định lượng mầm bệnh và dicer-1 mRNA của tôm được thực hiện bằng phản ứng chuỗi polymerase định lượng phiên mã ngược (RT-qPCR) và PCR.
Các mẫu được thu thập để sàng lọc mầm bệnh vào ngày thứ 70 của thử nghiệm. Cặp chân chân bơi gần phần đầu ngực của tôm sú P. monodon (n = 31, 128 DOC) được cắt bỏ bằng kéo y tế. Các cặp chân bơi ngay lập tức được đặt vào các ống matrix-D 2mL (MP Biomedicals™, Thermo Fisher Scientific, Foster City, CA, USA) chứa 350µL MagMAX™ CORE Lysis Solution (Applied Biosystems, Thermo Fisher Scientific, Foster City, CA, USA). Sau đó, các ống được duy trì ở nhiệt độ phòng (≈28°C) trong 24 giờ. Tổng số axit nucleic (TNA) được chiết xuất bằng Bộ lọc axit nucleic MagMAX™ CORE (Hệ thống sinh học ứng dụng) trên bộ xử lý hạt từ tính Thermo Scientific KingFisher Flex theo hướng dẫn của nhà sản xuất.
Vì tôm không có mầm bệnh cụ thể (SPF), nên có khả năng chúng sẽ mang mức độ nhiễm virus và/hoặc vi khuẩn cơ bản. Để phát hiện tải lượng mầm bệnh, parvovirus gây bệnh gan tụy (HDV/HPV), hoại tử cơ quan tạo máu và cơ quan lập biểu mô/Penaeus stylirostris densovirus (IHHNV/PstDV), một gen độc tố vi khuẩn, thành phần gen giống độc tố liên quan đến côn trùng Photorhabdus-A (Pir-A), virus gây hội chứng đốm trắng (WSSV), virus gây hội chứng liên quan đến mang (GAV), Whenzhou virus 2 (When-2), virus đầu vàng 1 và 7 (YHV-1 và YHV-7), và gen dicer-1 trên tôm sú P.monodon, xét nghiệm qPCR đã được tiến hành trên mỗi dịch chiết axit nucleic. Trình tự mồi và mẫu dò của từng xét nghiệm được trình bày trong Bảng 2. Các xét nghiệm nhắm mục tiêu DNA được phân tích bằng Bộ công cụ SensiFAST™ Probe Lo-ROX (Bioline, Meridian Bioscience, Cincinnati, OH, USA). Các xét nghiệm nhắm mục tiêu RNA được chuẩn bị bằng cách sử dụng Bộ RT-PCR một bước AgPATH-ID™ (Thermo Fisher Scientific). Tất cả qPCR bao gồm 17,5 µL hỗn hợp chính chứa thuốc thử do nhà sản xuất cung cấp, mồi (800 nM mỗi loại), đầu dò (250 nM) và 2,5 µL dịch rửa giải. Phân tích RT-PCR được thực hiện bằng máy PCR thời gian thực Quant Studio 5 (Hệ thống sinh học ứng dụng) trong 40 chu kỳ. Các điều kiện chu kỳ của xét nghiệm nhắm mục tiêu DNA bao gồm 95°C × 10 phút; 45 × 95°C × 15 giây, 60°C × 30 giây. Các điều kiện chu kỳ của xét nghiệm nhắm mục tiêu RNA bao gồm 45°C × 10 phút; 95 ◦C × 4 phút; 40 × 95°C × 15 giây, 60°C × 30 giây. Dữ liệu qPCR thô được xử lý trong Phần mềm phân tích và thiết kế QuantStudio™ (Hệ thống sinh học ứng dụng) và được chuyển đổi thành số lượng bản sao được tính toán của các phát hiện dương tính trước khi phân tích trong Excel bằng hồi quy tuyến tính so với các đường cong chuẩn đối chứng dương của xét nghiệm.
Bảng 2. Trình tự mồi và Probe được sử dụng trong nghiên cứu này.

2.5. Tính toán
Tỷ lệ chuyển đổi thức ăn được tính toán trong thời gian thử nghiệm bằng cách sử dụng công thức:
FCR = thức ăn cho ăn (g)/tăng trọng lượng vật nuôi (g)
Hệ số điều kiện được tính bằng công thức:
K = khối lượng ướt (g)/(chiều dài (cm))3
Tốc độ tăng trưởng cụ thể được tính bằng công thức:
SGR = (loge(trọng lượng cuối cùng) – loge(trọng lượng ban đầu))/lần (d) × 100
2.6. Phân tích dữ liệu
Kết quả được phân tích như một hàm của mức PRSE trong chế độ ăn bằng cách sử dụng phân tích hồi quy trong Graphpad Prism (GraphPad Software, San Diego, CA, USA, V. 7.03). Dữ liệu đã được kiểm tra dựa trên các mô hình hồi quy ngày càng phức tạp, bắt đầu với giả thuyết khống rằng PRSE không ảnh hưởng đến kết quả (đường ngang). Các mô hình đã được kiểm tra bằng các tùy chọn sẵn có về tính quy tắc của phần dư bằng cách sử dụng thử nghiệm omnibus D’Agnostino và Pearson, về độ lệch đường cong so với các điểm dữ liệu bằng cách sử dụng thử nghiệm lặp lại và về tính đồng nhất. Các mô hình không đạt được một hoặc nhiều bước kiểm tra này sẽ bị từ chối để chuyển sang các mô hình phức tạp hơn. Các mô hình có R2 điều chỉnh < 0,2 đã bị loại bỏ và thay vào đó là các mô hình đơn giản hơn.
3. Kết quả
3.1. Tăng trưởng, tỷ lệ sống và FCR của tôm sau 35 ngày
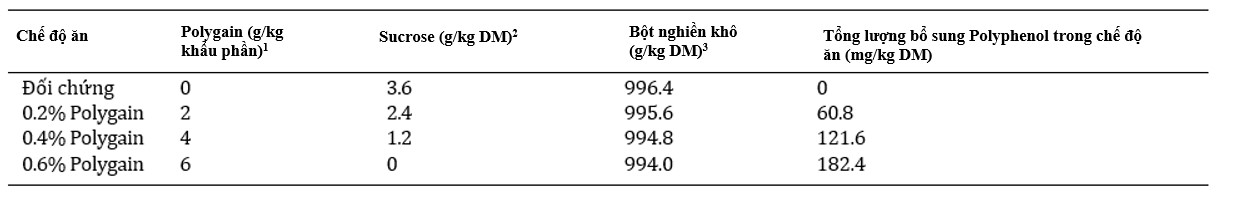
Trọng lượng tôm, chiều dài giáp đầu ngực và tốc độ tăng trưởng cụ thể tăng tuyến tính để đáp ứng với mức PRSE trong khẩu phần ăn trong 35 ngày đầu tiên cho ăn khẩu phần thử nghiệm (Hình 1a-c). FCR của tôm giảm tuyến tính để đáp ứng với việc tăng mức PRSE trong chế độ ăn trong cùng thời điểm (Hình 1f). Không tìm thấy mối tương quan giữa các yếu tố bao gồm tình trạng tôm, tỷ lệ sống và mức PRSE trong chế độ ăn sau 35 ngày (Hình 1d, e). Nhìn chung, các mô hình tuyến tính cho thấy tôm được cho ăn mức PRSE cao nhất (6 g/kg khẩu phần) nặng hơn 65% (6,1 so với 3,7g), dài hơn 11% (23,4 so với 21,0 mm), có SGR cao hơn 32% (5,0 so với 3,8%/ngày) và FCR thấp hơn 39% (1,9 so với 3,1) so với tôm được cho ăn chế độ ăn đối chứng không có PRSE.

Hình 1. (a) Trọng lượng; (b) chiều dài giáp đầu ngực; (c) tốc độ tăng trưởng cụ thể; (d) hệ số điều kiện; (e) tỷ lệ sống; và (f) tỷ lệ chuyển đổi thức ăn của tôm sú Penaeus monodon giai đoạn juvenile được cho ăn khẩu phần có hàm lượng chiết xuất mía giàu polyphenol (PRSE) (PolygainTM) ngày càng tăng trong 35 ngày. Các đường đứt nét biểu thị các mô hình phù hợp nhất cho dữ liệu. Các phương trình và giá trị R2 được điều chỉnh thể hiện mối tương quan giữa thông số đo được và mức PRSE trong chế độ ăn. Các đường ngang cho thấy không có mối tương quan nào hiện diện. Dữ liệu được hiển thị dưới dạng giá trị trung bình ± SEM, n = 4.
3.2. Tăng trưởng, tỷ lệ sống và FCR của tôm sau 70 ngày
Sau 70 ngày áp dụng chế độ ăn, trọng lượng, chiều dài giáp đầu ngực và tỷ lệ sống của tôm tiếp tục tăng tuyến tính để đáp ứng với mức PRSE trong chế độ ăn (Hình 2a, b, e). FCR của tôm giảm tuyến tính để đáp ứng với việc tăng mức PRSE trong chế độ ăn trong cùng thời kỳ (Hình 2f). Không tìm thấy mối quan hệ giữa SGR của tôm, yếu tố tình trạng và mức PRSE trong khẩu phần sau 70 ngày cho ăn khẩu phần (Hình 2c, d). Nhìn chung, các mô hình tuyến tính được trang bị cho thấy tôm được cho ăn mức PRSE cao nhất (6 g kg-1 khẩu phần) nặng hơn 54% (15,4 so với 10,0-g), dài hơn 18% (23,3 so với 27,5 mm), có đường kính 92. % tỷ lệ sống cao hơn (50 so với 26%) và FCR thấp hơn 39% (1,9 so với 3,1) so với tôm được cho ăn chế độ ăn đối chứng.
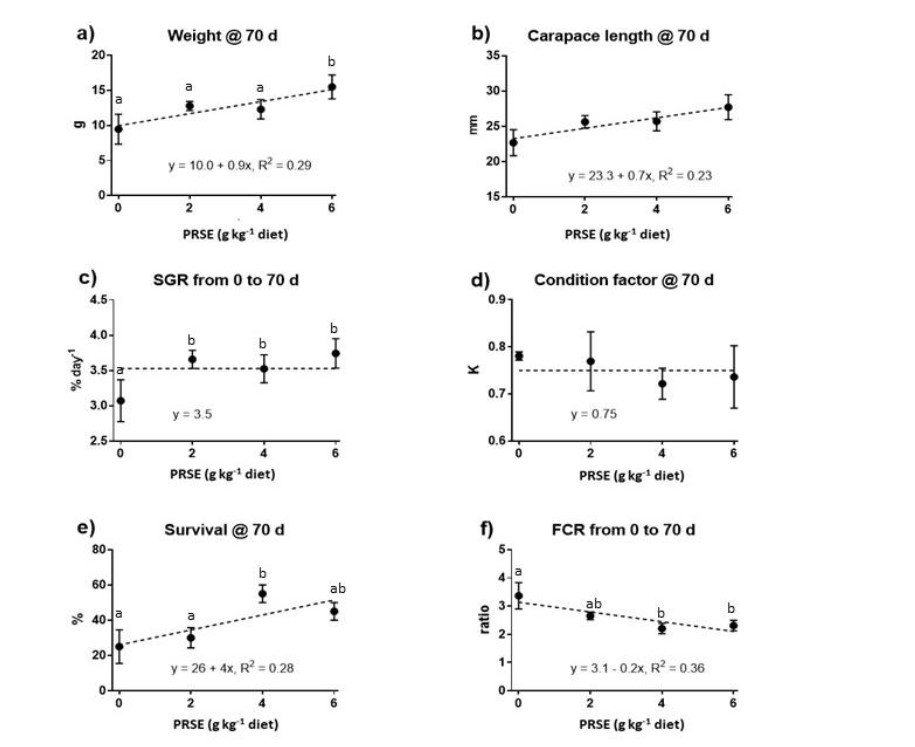
Hình 2. (a) Trọng lượng; (b) chiều dài giáp đầu ngực; (c) tốc độ tăng trưởng cụ thể; (d) hệ số điều kiện; (e) tỷ lệ sống; và (f) tỷ lệ chuyển đổi thức ăn của tôm sú Penaeus monodon giai đoạn juvenile được cho ăn khẩu phần có hàm lượng chiết xuất mía giàu polyphenol (PRSE) (PolygainTM) ngày càng tăng trong 70 ngày. Các đường đứt nét biểu thị các mô hình phù hợp nhất cho dữ liệu. Các phương trình và giá trị R2 được điều chỉnh thể hiện mối tương quan giữa thông số đo được và mức PRSE trong chế độ ăn. Các đường ngang cho thấy không có mối tương quan nào hiện diện. Dữ liệu được hiển thị dưới dạng giá trị trung bình ± SEM, n = 4 (hoặc 3 đối với dữ liệu của nhóm đối chứng trừ tỷ lệ sống, do mất một bản sao).
3.3. Biểu hiện mRNA dcr1 và mức độ mầm bệnh sau 70 ngày
Sau 70 ngày cho ăn khẩu phần thử nghiệm có chứa PRSE, không tìm thấy sự khác biệt giữa các nghiệm thức về biểu hiện dcr1 (biểu hiện trung bình là 6,6 × 105 bản sao) hoặc số lượng bản sao của parvovirus gây bệnh gan tụy hoặc virus gây hội chứng liên quan đến mang (Hình 3). Các mầm bệnh khác không được phát hiện ở bất kỳ con tôm nào được phân tích (tham khảo chú thích ở Hình 3).
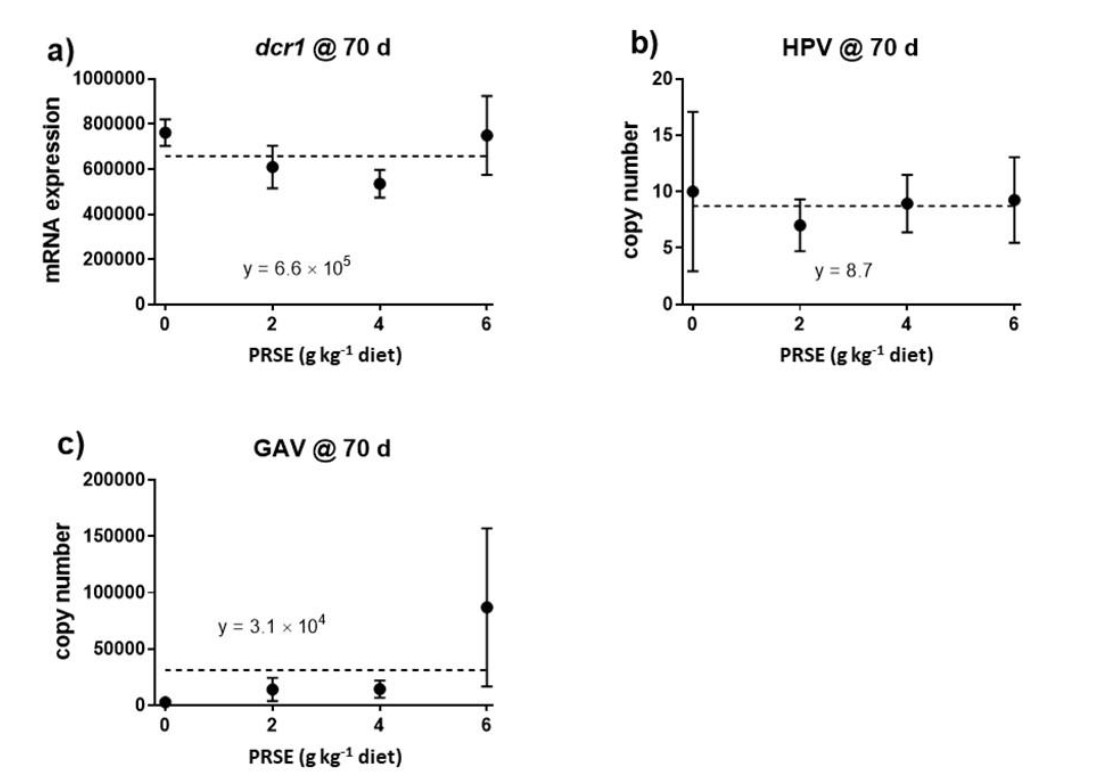
Hình 3. (a) Biểu hiện của dcr1 và (b) tải lượng virus (bản sao virus/µL chiết xuất pleopod) của parvovirus gây bệnh gan tụy (HPV) và (c) virus gây hội chứng liên quan đến mang (GAV) ở tôm sú giai đoạn juvenile được cho ăn chế độ ăn có tăng mức độ chiết xuất giàu polyphenol có nguồn gốc từ mía (PPE) trong 70 ngày. Các đường ngang cho thấy không có mối tương quan nào hiện diện. Các tác nhân gây bệnh khác trên tôm đã được thử nghiệm, bao gồm virus gây hoại tử cơ quan tạo máu và cơ quan lập biểu mô (IHHNV), virus gây bệnh đầu vàng kiểu gen 7 (YHV7) và kiểu gen 1 (YHV1), virus gây hội chứng đốm trắng (WSSV), virus Whenzhou ở tôm (When-2), và Vibrio parahaemolyticus (Pir-A) – không được phát hiện. Dữ liệu được hiển thị dưới dạng giá trị trung bình ± SEM, n = 4 (hoặc 3 đối với nhóm đối chứng, do mất một bản sao), trong đó kết quả của tất cả tôm được gộp lại cho mỗi bể.
4.Thảo luận
Dữ liệu chứng minh rằng PRSE có tác động tích cực đến tốc độ tăng trưởng, tỷ lệ sống và hiệu quả sử dụng thức ăn ở tôm sú giai đoạn juvenile. Tác động này đối với sự tăng trưởng dường như bắt đầu từ giai đoạn rất sớm của thử nghiệm (từ 0 đến 35 ngày cho ăn, từ 58 đến 93 con tôm PL), với sự khác biệt về trọng lượng tôm giữa các nhóm thí nghiệm giảm dần trong 35 ngày cho ăn tiếp theo (35–70 ngày cho ăn, 94 đến 128 PL). Tuy nhiên, trọng lượng và chiều dài tổng thể của tôm vẫn lớn hơn ở tất cả các nghiệm thức có bổ sung PRSE. Điều này cho thấy rằng tôm được cho ăn chế độ ăn chứa PRSE sẽ có khả năng đạt trọng lượng thu hoạch nhanh hơn, cải thiện lợi nhuận và hiệu suất tôm trong điều kiện nuôi thực tế.
Một trong những phát hiện quan trọng nhất của thử nghiệm là sự cải thiện FCR. Xu hướng phụ thuộc vào liều lượng này có thể quan sát được ở cả thời điểm 35 và 70 ngày của thử nghiệm. Hơn nữa, những cải thiện so với chế độ ăn đối chứng cũng được quan sát thấy ở tất cả liều bổ sung PRSE được nghiên cứu ở cả hai thời điểm này, với sự khác biệt rõ rệt nhất được quan sát thấy ở liều 6 g/kg. Do FCR tiếp tục cho thấy sự hồi quy tuyến tính cùng với việc tăng cường sử dụng PRSE, nên có thể liều lượng tối ưu để cải thiện FCR vẫn chưa đạt được trong thử nghiệm này. Tuy nhiên, sự cải thiện về FCR sau một thay đổi tương đối nhỏ trong công thức thức ăn là một kết quả đầy hứa hẹn, điều này cho thấy rằng cần có những nghiên cứu sâu hơn về các cơ chế tiềm năng góp phần vào phát hiện này.
Tác dụng của PRSE đối với tỷ lệ sống là một trong những phát hiện chính của thử nghiệm này. Trong 35 ngày đầu tiên, không có xu hướng rõ ràng về tỷ lệ sống do lượng PRSE có trong chế độ ăn. Điều này có thể là do sự can thiệp bắt nguồn từ việc ăn thịt đồng loại và sự hung hăng giữa các cá thể trong giai đoạn lột xác sớm. Tuy nhiên, trong toàn bộ khung thời gian 70 ngày của thử nghiệm, có mối tương quan tích cực giữa mức PRSE có trong chế độ ăn và tỷ lệ sống tăng lên trên toàn bộ quần thể. Do những khác biệt đáng kể về tỷ lệ sống tương quan với lượng chiết xuất được tiêu thụ, nên dự kiến tổng sản lượng sinh khối sẽ tăng hơn nữa ngoài những cải thiện về FCR và tốc độ tăng trưởng đã được thảo luận. Tuy nhiên, cần lưu ý rằng các điều kiện thử nghiệm của nghiên cứu này có mật độ tôm khá cao, điều này có thể gây ra căng thẳng quá mức và có thể ảnh hưởng đến khả năng sống trong suốt nghiên cứu. Trên thực tế, tôm có chế độ ăn không bổ sung PRSE có tỷ lệ sống thấp hơn so với nhiều thử nghiệm phụ gia thức ăn (ví dụ: [37]), mặc dù tỷ lệ sống trong hệ thống bể thí nghiệm cho các thử nghiệm cho thức ăn có thể khác nhau đáng kể giữa các nghiên cứu [38], nhưng để có một biểu hiện đáng kể hơn về tác động của PRSE đối với khả năng sống, cần mở rộng nghiên cứu trong điều kiện nuôi thương phẩm.
Thử nghiệm này chứng minh rằng việc bổ sung chiết xuất mía PRSE vào thức ăn có nhiều lợi ích, nhưng rất khó để đưa ra giả thuyết về cơ chế chính xác đã tạo ra những kết quả này và các cơ chế phân tử cần được kiểm tra thêm. Một trong những polyphenol chính được xác định trong chiết xuất mía là axit chlorogen. Axit phenolic này đã được đưa vào công thức chế độ ăn của tôm trước đây, với những cải thiện đáng kể về tỷ lệ sống và FCR tương tự như những gì đã được quan sát trong thử nghiệm hiện tại [39]. Trong khi thử nghiệm axit chlorogen được thực hiện trên một loài tôm nước mặn khác (Litopenaeus vannamei), những điểm tương đồng về tác dụng đã bổ sung thêm bằng chứng cho thấy khả năng axit chlorogen là một trong những thành phần hoạt tính có trong chiết xuất mía. Vương và cộng sự (2015) đưa ra giả thuyết rằng khả năng chống oxy hóa tăng lên và sự phiên mã của các enzyme chống oxy hóa được quan sát là cơ chế có khả năng dẫn đến kết quả sản xuất được cải thiện, bao gồm khả năng chống stress và tăng tổng sản lượng sinh khối. Axit chlorogen đã được quan sát thấy có liên quan đến sự điều hòa yếu tố liên quan đến yếu tố hạt nhân erythroid 2 (Nrf-2) và các dấu hiệu viêm như yếu tố hạt nhân kappa-chất tăng cường chuỗi nhẹ của tế bào B hoạt hóa (NF-κB) ở động vật có xương sống [40]. Tuy nhiên, việc kích hoạt Nrf-2 hoặc điều chỉnh NF-κB chưa được nghiên cứu trực tiếp với chế độ ăn giàu axit chlorogen ở tôm.
Chiết xuất Polygain™ (PRSE) chứa nhiều loại hợp chất khác nhau ngoài polyphenol, như axit hữu cơ, khoáng chất, phytosterol, axit béo và axit amin. Một số trong số này đã được định lượng, như axit chlorogen, nhưng nhiều loại khác chỉ được xác định chính thức trong chiết xuất hoặc được biết là có nhiều trong mía và các sản phẩm lên men, như axit hữu cơ. Một số hợp chất đã được xác định chất lượng hoặc thậm chí chưa được xác định có thể có vai trò chính trong cơ chế hoạt động của chiết xuất này. Ví dụ, axit hữu cơ có nhiều trong các dòng sản xuất mía [41]. Axit Succinic đã được chứng minh là có tác động tích cực đến sự tăng trưởng và chức năng miễn dịch ở tôm thẻ chân trắng Litopenaeus vannamei [42]. Do sự đa dạng của các hợp chất có trong chiết xuất mía PRSE, không nên bỏ qua tiềm năng của các thành phần không phenolic đóng vai trò tích cực trong việc cải thiện hiệu suất. Giả thuyết phù hợp nhất ở giai đoạn này là một loạt các thành phần này hoạt động phối hợp để tạo ra những kết quả có lợi được quan sát thấy trong thử nghiệm này.
Các nghiên cứu khác về việc bổ sung chiết xuất thực vật giàu polyphenol vào chế độ ăn của tôm tập trung vào tác động lên khả năng kháng bệnh cụ thể của tôm. Ví dụ, một chiết xuất nước có chứa polyphenol từ lá của cây rừng ngập mặn (Ceriops tagal) đã ngăn ngừa nhiễm virus hội chứng đốm trắng (WSSV), khi được đưa vào chế độ ăn với tỷ lệ 10 g/kg, đối với tôm thẻ chân trắng [28]; trong khi chiết xuất từ cỏ Bermuda (Cynodon dactylon) được bổ sung ở mức 20 g/kg vào khẩu phần ăn giúp ngăn ngừa nhiễm WSSV ở tôm sú [25]. Tuy nhiên, tôm được sử dụng trong nghiên cứu này không có WSSV và hầu hết các mầm bệnh khác. Các mầm bệnh hiện diện, parvovirus gây bệnh gan tụy (HPV) và virus gây hội chứng liên quan đến mang (GAV), hiện diện ở mức độ thấp và không có sự khác biệt giữa các nghiệm thức (Hình 3). Biểu hiện mRNA của dcr1, mã hóa protein endoribonuclease Dicer-1 có vai trò bảo vệ chống virus ở tôm sú P. monodon [36], cũng không có sự khác biệt giữa các nghiệm thức. Mặc dù không thể loại trừ sự hiện diện của các mầm bệnh chưa biết, nhưng về tổng thể, dữ liệu về mầm bệnh trong nghiên cứu này cho thấy sự khác biệt về tốc độ tăng trưởng và tỷ lệ sống của tôm không chỉ giới hạn ở việc ức chế bệnh truyền nhiễm do PRSE gây ra. Nghiên cứu sâu hơn về các mầm bệnh gây hại khác cho ngành tôm, như Enterocytozoon hepatopenaei, và trong các điều kiện đầy thách thức sẽ giúp hiểu rõ tác động mà chiết xuất này có thể có đối với khả năng phòng ngừa dịch bệnh.
Polyphenol trong chế độ ăn có liên quan đến tác động tích cực đến sức khỏe vật nuôi và hiệu suất tăng trưởng, thông qua một loạt các cơ chế khác không được nhắm mục tiêu trong thiết kế thử nghiệm này, bao gồm tương tác với vi khuẩn đường ruột, điều chỉnh quá trình trao đổi chất và như một chất điều hòa miễn dịch trực tiếp [43]. Tuy nhiên, đối với một số yếu tố này, như hệ vi sinh vật, có thể có những khác biệt về loài làm thay đổi những gì có thể quan sát được ở động vật có xương sống. Vì động vật có xương sống được sử dụng trong phần lớn nghiên cứu về sự tương tác giữa polyphenol và hệ vi sinh vật, nên cần phải xem xét những khác biệt chính về mặt sinh lý có thể ảnh hưởng đến sự phát triển của hệ vi sinh vật.
Đường tiêu hóa của tôm khác biệt đáng kể so với động vật có xương sống; do đó, sự tương tác với hệ vi sinh vật có thể khác nhau. Ví dụ, tôm tiết ra vỏ chitin ở ruột giữa bao quanh hệ tiêu hóa. Lớp vỏ này được cho là có tác dụng bảo vệ ruột sau khỏi vi khuẩn, nhưng nó cũng hạn chế sự hấp thu chất dinh dưỡng [44]. Hơn nữa, toàn bộ quá trình tiêu hóa ở tôm diễn ra ở độ pH trung tính và nhiệt độ thấp hơn ở động vật có vú. Ngoài ra, thời gian vận chuyển thức ăn tổng thể trong ruột là từ 2 đến 4 giờ đối với tôm he (được xem xét bởi [45]), so với khoảng 8 giờ ở động vật có vú như chuột [46]. Mặc dù dữ liệu còn hạn chế nhưng có một số bằng chứng cho thấy polyphenol từ thực vật có thể ảnh hưởng tích cực đến các vi khuẩn cụ thể ở tôm và có khả năng đóng vai trò điều chỉnh hệ vi sinh vật đường ruột. Ví dụ, polyphenol có trong chiết xuất trà xanh có thể ức chế sự phát triển và tiêu diệt vi khuẩn Vibrio harveyi gây bệnh ở tôm kuruma (Marsupenaeus japonicas) [47].
Một số nghiên cứu đã tìm thấy tác động trực tiếp đến phản ứng và chức năng miễn dịch khi bổ sung nhiều nguồn thực vật có liên quan đến tỷ lệ sống được cải thiện [43]. Với những tác động tích cực đến tỷ lệ sống, ngoài các kết quả sản xuất khác như tốc độ tăng trưởng và FCR, một nghiên cứu tiếp theo được thực hiện để điều tra bất kỳ tác động điều hòa miễn dịch nào cũng sẽ hữu ích. Một lĩnh vực chưa được khám phá nữa trong dinh dưỡng nuôi trồng thủy sản là khả năng của polyphenol tạo phức với sắt, điều này có thể có tác động tích cực đến cân bằng nội môi sắt và do đó giúp tăng trưởng và tỷ lệ sống. Một nghiên cứu theo dõi khả dụng sinh học của sắt khi có chiết xuất từ mía sẽ cung cấp thêm sự hiểu biết nếu cơ chế này có liên quan đến các quan sát thu thập được trong thử nghiệm này [48]. Điều quan trọng nữa là đánh giá hiệu quả của chiết xuất mía này trong các giai đoạn phát triển sau này của động vật.
Việc bổ sung một lượng nhỏ PRSE (~6 g/kg thức ăn) đã làm tăng tốc độ tăng trưởng, tỷ lệ sống và hiệu quả chuyển đổi thức ăn của tôm. Nhìn chung, nghiên cứu này chứng minh rằng polyphenol từ thực vật có tiềm năng làm chất phụ gia cho thức ăn tôm và xác nhận rằng cần có nghiên cứu sâu hơn trong lĩnh vực này, bao gồm nghiên cứu được thực hiện trong điều kiện nuôi thương phẩm thay vì điều kiện thử nghiệm. Do nguồn nguyên liệu thô từ ngành mía đường hiện tại, chiết xuất này mang đến cơ hội tiềm năng để mở rộng tính bền vững của ngành nuôi trồng thủy sản.
5. Kết luận
Thử nghiệm này cho thấy một số kết quả tích cực từ việc bổ sung chiết xuất mía vào chế độ ăn của tôm sú. Cần tiến hành những nghiên cứu tiếp theo để chuyển những kết quả ban đầu này thành các thử nghiệm trang trại quy mô đầy đủ và để hiểu rõ hơn về cơ chế hoạt động cơ bản. Tuy nhiên, kết quả thu thập được trong thử nghiệm này chứng minh rằng cần có thêm những cuộc khám phá sâu hơn đối với vấn đề này.
Theo Sam Penglase, Thomas Ackery, Barry Kitchen, Matthew Flavel và Kelly Condon
Nguồn: https://www.mdpi.com/2076-3417/12/16/8090
Biên dịch: Huyền Thoại – Tôm Giống Gia Hóa Bình Minh
TÔM GIỐNG GIA HÓA – CHÌA KHÓA THÀNH CÔNG
Xem thêm:
- Ảnh Hưởng Của Chế Phẩm Sinh Học Loài Bacillus (Bacillus subtilis Và B. licheniformis) Đến Chất Lượng Nước, Phản Ứng Miễn Dịch Và Sức Đề Kháng Của Tôm Chân Trắng (Litopenaeus vannamei) Chống Lại Nhiễm Nấm Fusarium solani
- Sự Phát Triển Trong Việc Sử Dụng Chế Phẩm Sinh Học Để Kiểm Soát Dịch Bệnh Trong Nuôi Trồng Thủy Sản
- Aeromonas hydrophila, Tác Nhân Gây Bệnh Trên Tôm Thẻ Chân Trắng Litopenaeus vannamei Nuôi Nước Ngọt

 English
English 中文 (中国)
中文 (中国)