Tóm tắt
Hội chứng phân trắng (WFS) là một vấn đề mới nổi đối với ngành nuôi tôm He ở các nước Đông Nam Á, Thái Lan, Malaysia, Việt Nam, Indonesia, Trung Quốc và ở Ấn Độ. Sự xuất hiện đầu tiên của hội chứng này thường được nhận biết qua sự xuất hiện của các chuỗi phân trắng nổi trên bề mặt ao nuôi tôm. Các dấu hiệu thường thấy của tôm bị ảnh hưởng bao gồm sự xuất hiện của ruột sau màu trắng và giáp đầu ngực lỏng lẻo, và nó có liên quan đến việc giảm ăn và chậm phát triển. Để điều tra bản chất của hội chứng phân trắng, các mẫu phân trắng và mô gan tụy của tôm đã được thu thập từ tôm thẻ Penaeus vannamei tại các trang trại bị ảnh hưởng ở Indonesia, và chúng đã được kiểm tra về mặt mô học. Trong các chuỗi phân trắng chứa số lượng lớn các bào tử của vi bào tử Enterocytozoon hepatopenaei (viết tắt là EHP) và một số ít vi khuẩn hình que. Từ các ao nhiễm WFS, các mẫu gan tụy của 30 cá thể tôm được phân tích bằng phương pháp mô học và lai tạo tại chỗ. Kết quả cho thấy tất cả tôm được kiểm tra đều bị nhiễm EHP kèm theo hoại tử gan tụy do nhiễm trùng (SHPN). Các tế bào biểu mô cũng bị nhiễm bệnh và điều này làm tăng số lượng các loại mô bị ảnh hưởng bởi EHP. Bằng PCR, EHP đã được phát hiện trong tất cả các mẫu được phân tích từ các ao nhiễm WFS, nhưng không phải trong các mẫu được lấy mẫu từ các ao nuôi tôm khỏe mạnh. Để xác định phương thức lây truyền của loài ký sinh trùng này, chúng tôi đã thực hiện thử nghiệm sinh học qua phương pháp cho ăn và cho sống chung, kết quả cho thấy EHP có thể lây truyền qua mỗi lần cho ăn mô gan tụy bị nhiễm EHP sang tôm khỏe mạnh và qua quá trình sống chung của tôm bị nhiễm bệnh và khỏe mạnh. Ngoài ra, chúng tôi nhận thấy việc sử dụng chất kháng khuẩn Fumagillin-B không hiệu quả trong việc làm giảm hoặc loại bỏ EHP trên tôm nhiễm bệnh.
1/ Giới thiệu
Ngày càng có nhiều đàn tôm có biểu hiện hội chứng phân trắng (WFS) tại các trang trại nuôi tôm biển ở châu Á với thiệt hại kinh tế kèm theo (Hà và cộng sự, 2010; Thitamadee và cộng sự, 2016). Tôm từ các ao bị ảnh hưởng tăng trưởng chậm và có tỷ lệ chuyển đổi thức ăn tăng. Không có dấu hiệu lâm sàng cụ thể nào trên tôm bị ảnh hưởng; và hiện tại, WFS thường được chẩn đoán đầu tiên thông qua sự xuất hiện của các chuỗi phân màu trắng nổi trên bề mặt ao. Người ta chưa xác định được liệu hội chứng này có phải do một tác nhân truyền nhiễm gây ra hay không; nhưng, dựa trên sự lây lan nhanh chóng của nó, thì đây là một điểm đáng nghi ngờ. Mặc dù nguyên nhân của WFS chưa được xác định, vi khuẩn Vibrio và Veriform (được hình thành do sự tróc ra, chuyển dạng và cuộn lại của các vi nhung mao của tế bào biểu mô ống gan tụy – ATM) khá tương đồng với ký sinh trùng Gregarines đã được báo cáo là có liên quan đến hội chứng này ở Thái Lan (Limsuwan, 2012; Sriurairatana và cộng sự, 2014). Vi khuẩn Enterocytozoon hepatopenaei (EHP) cũng được báo cáo từ tôm sú Penaeus monodon và P. vannamei với WFS ở Việt Nam, Thái Lan và Ấn Độ (Ha và cộng sự, 2010; Tangprasittipap và cộng sự, 2013; Rajendran và cộng sự, 2016).
EHP là một ký sinh trùng hình thành bào tử nội bào sao chép trong tế bào chất của các tế bào biểu mô ống gan tụy (Tourtip và cộng sự, 2009; Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2015), và nó đang nổi lên như một mối đe dọa nghiêm trọng đối với ngành nuôi tôm ở Đông Nam Á. Tại Indonesia, EHP đã được phát hiện trong các quần thể tôm thẻ chân trắng P. vannamei, bao gồm ở Đông Java, Tây Java, Bắc Sumatra, tỉnh Lampung ở mũi phía nam của Sumatra, Bali, Lombok và Sulawesi (thảo luận với các nhà sản xuất và các nhà nghiên cứu Indonesia). Có ý kiến cho rằng EHP không phải là tác nhân duy nhất gây ra WFS dựa trên các nghiên cứu cho thấy tôm bị nhiễm EHP (được xác định bằng phân tích PCR và lai tạo tại chỗ) không tạo ra phân trắng (Tangprasittipap và cộng sự, 2013). Trong nghiên cứu này, chúng tôi đã thu thập các mẫu (chuỗi phân và gan tụy tôm) từ các ao bị ảnh hưởng bởi WFS ở Indonesia để xác định sự hiện diện của EHP bằng PCR, mô học và lai tạo tại chỗ. Hơn nữa, chúng tôi đã thực hiện các thử nghiệm cảm nhiễm để chứng minh các con đường mà EHP có thể lây truyền.
2/ Vật liệu và phương pháp
2.1 Mẫu tôm và phân
Gan tụy và phân tôm được lấy mẫu từ 3 trang trại nuôi tôm nhiễm WFS ở Indonesia vào năm 2016. Từ mỗi trang trại số 1 và số 2 (cả hai đều nằm ở Lampung, Indonesia), các mẫu (tôm có trọng lượng 3-5 g khi nuôi 50-60 ngày) được thu thập từ một ao nhiễm WFS và một ao khác không có WFS. Từ trang trại số 3 (nằm ở Situbondo), chỉ có một ao WFS được lấy mẫu. Đối với các phân tích mô học, các mẫu gan tụy đã được cố định trong dung dịch cố định AFA của Davidson, các mẫu phân được ngâm trong ethanol 95%. Những mẫu này đã được xử lý để lai tạo mô học và lai tại chỗ tại Đại học Arizona. Đối với phân tích PCR, các mẫu gan tụy, ruột sau và phân được bảo quản trong ethanol 95%.
2.2 Phương pháp tách chiết DNA và kiểm tra EHP bằng PCR.
Từ gan tụy và mẫu phân, tổng số DNA được tách chiết bằng bộ kit tách chiết DNA (Roche Bioscience) và sau đó là phương pháp PCR để kiểm tra EHP. Ống PCR dùng trong xét nghiệm RTG được sử dụng. Các mồi để phát hiện EHP là EHP 510F (5GCCTGAGAGATGGCTCCCACGT) và EHP 510R (5’GCGTACTATCCCCAGAGCCCGA).
Khuếch đại được thực hiện với các thông số theo chu kỳ sau: biến tính ban đầu ở 95ºC trong 3 phút, tiếp theo là 35 chu kỳ 95ºC trong 30 giây, 60ºC trong 30 giây và 72ºC cho 30 giây và phần mở rộng cuối cùng ở 72ºC trong 5 phút (Tang và cộng sự, 2015).
2.3 Phương pháp ghi nhãn đầu dò DNA và lai tạo tại chỗ
DNA plasmid pEHP-1 được sử dụng để tạo ra một mẫu dò cho ISH. Đầu dò gen được đánh dấu digoxigenin-11-dUTP (Roche) trong phản ứng PCR theo mô tả của Tang và cộng sự. (2015). Sau phản ứng PCR, mẫu dò DNA có nhãn digoxigenin (1,1 kb) được kết tủa bằng ethanol, lơ lửng lại trong nước và được bảo quản ở -20ºC.
Tôm được cố định trong AFA của Davidson đã được chế biến, nhúng trong parafin và cắt khúc (dày 4 µm) theo các phương pháp tiêu chuẩn (Lightner, 1996). Sau khi khử muối, hydrat hóa, phân hủy enzim proteinaise K và sau khi cố định, các phần được phủ lên một dung dịch lai có chứa đầu dò EHP (0,2 µg / ml). Các thanh trượt được đặt trên bề mặt được nung nóng ở 90ºC trong 10 phút và lai qua đêm ở 37-42ºC. Phát hiện cuối cùng được thực hiện với kháng thể antidigoxigenin liên hợp với phosphatase kiềm (Roche) được hình dung bằng cách sử dụng nitroblue tetrazolium và 5-bromo-4-chloro-3-indolyl phosphate.
2.4 Cảm nhiễm EHP trong phòng thí nghiệm
2.4.1 Thử nghiệm sinh học qua đường miệng
30 con tôm thẻ Penaeus vannamei (trọng lượng trung bình: 1g) không có mầm bệnh cụ thể (SPF, được xác định bằng phân tích mô học và PCR để tìm các mầm bệnh chính của tôm bao gồm EHP) được cho ăn với gan tụy bị nhiễm EHP băm nhỏ với lượng bằng 10% trọng lượng cơ thể của chúng một lần trong 2 ngày (ngày 1 và ngày 2) trong bể kính 90 L. Sau đó, chúng được duy trì theo khẩu phần thức ăn viên, Rangen 35% (Rangen, ID). Các mẫu của 3 con tôm được lấy tại mỗi thời điểm (ngày 0, 5, 10, 15, 20 và 24) và được bảo quản ở -20ºC. Vào ngày 24, 3 con tôm đã được cố định trong dung dịch cố định AFA của Davidson để phân tích mô học. Mô cho ăn là từ một quần thể tôm bị nhiễm EHP (trọng lượng trung bình: 30 g) từ Thái Lan, những con tôm này đã được kiểm tra trong phòng thí nghiệm của chúng tôi như được mô tả trong Tang và cộng sự. (2015).
2.4.2 Thử nghiệm sinh học sống chung
30 P. vannamei SPF (trọng lượng trung bình: 1 g) được gắn thẻ với dấu phẩm màu có thể nhìn thấy (Công nghệ biển Tây Bắc, WA) và 24 con tôm bị nhiễm EHP (30 g, từ Thái Lan) được thả trong bể 1000L, sau đó những con tôm này được cho ăn với thức ăn Rangen 35% trong 90 ngày. Các mẫu của 3 con tôm được lấy ở mỗi thời điểm (ngày 35, 42 và 90), một mẫu phân được lấy mẫu vào ngày 35.
2.4.3 Điều trị bằng Fumagillin-B
Fumagillin-B (Glory Bee, Inc. OR; dùng cho thú y) đã được đưa vào thức ăn để tạo ra khẩu phần ăn với tỷ lệ 1g /kg. Liều lượng này được lựa chọn dựa trên các phương pháp đã được công bố được sử dụng để trị khi nhiễm bào tử sporidia và các bệnh nhiễm trùng khác ở cá và côn trùng.
0,6g Fumagillin-B được kết hợp với 240 ml nước đã được hâm ấm trước đến 30-35ºC và sau đó trộn kỹ. Sau khi trộn, dung dịch Fumagillin-B được thêm vào 600g thức ăn Rangen 35% (Rangen Inc., Idaho) và 18 g carboxymethyl cellulose (3%, được sử dụng làm chất kết dính) và được trộn đều trước khi ép đùn lạnh bằng máy xay thịt. Thức ăn ép đùn được sấy khô qua đêm ở 40ºC và sau đó được chia thành các viên có kích thước phù hợp.
Để thử nghiệm sinh học nhằm kiểm tra hiệu quả của Fumagillin-B chống lại sự lây nhiễm EHP, 25 con tôm nhiễm EHP (30 g, từ Thái Lan) đã được thả trong 4 bể , mỗi bể 1000L. Hai bể (mô phỏng) được cho ăn thức ăn tôm hỗn hợp chứa Fumagillin-B, 2 bể được cho ăn thức ăn viên Rangen 35%. Tất cả tôm trong các bể này được cho ăn theo khẩu phần tương ứng của chúng với trọng lượng cơ thể 1% mỗi ngày, một lần trong 30 ngày. Vào ngày thứ 30, 2 con tôm từ mỗi bể được lấy ra và gộp lại thành một mẫu để phân tích PCR để kiểm tra EHP.
Đối với các thử nghiệm sinh học này, tôm được giữ ở độ mặn 25 ppt và 28-29ºC trong suốt thời gian thí nghiệm.
3/ Kết quả
3.1 Các dấu hiệu lâm sàng của tôm liên quan đến hội chứng phân trắng
Các dấu hiệu lâm sàng của tôm nuôi nhiễm hội chứng phân trắng (WFS) không nhận biết rõ được bằng mắt thường, ngoài việc tạo ra phân trắng. Các triệu chứng bao gồm giảm cho ăn, chậm lớn và tăng tỷ lệ chuyển hóa thức ăn (FCR, khối lượng thức ăn so với khối lượng tôm sản xuất). Dựa trên dữ liệu thu được từ các ao WFS ở Indonesia ( liên kết cá nhân với nông dân địa phương), phân trắng xuất hiện lần đầu tiên sau 40-60 ngày kể từ khi thả tôm post vào ao. Sau khi xuất hiện phân trắng, sức khỏe tôm sẽ xấu đi nếu không được điều trị. Nhìn chung, tôm trong các ao WFS có FCR trên 2,5-3,0 so với khoảng 1,4-1,7 là điển hình cho tôm khỏe mạnh.
3.2 Phân trắng: kiểm tra bằng phương pháp mô học và Enterocytozoon Hepatopenaei (EHP) lai tạo tại chỗ
Kiểm tra mô học các mẫu phân trắng được thu thập từ 3 ao WFS khác nhau cho thấy sự hiện diện của các bào tử trưởng thành, ưa bazơ, mật độ bào tử dày đặc (Hình 1A, tổng độ phóng đại: 40x ; Hình 1B, tổng độ phóng đại: 600x ). Chúng tôi nghi ngờ đây là bào tử Enterocytozoon Hepatopenaei (EHP), vì tỷ lệ EHP cao được phát hiện trên tôm thẻ chân trắng nuôi ở Indonesia trong những năm gần đây. Do đó, chúng tôi đã thực hiện lai tạo tại chỗ (ISH) với đầu dò dành riêng cho EHP, đầu dò phản ứng mạnh với các bào tử (Hình 1C, tổng độ phóng đại: 40X, chèn: 600 ). Có những ống gan tụy bong tróc chứa đầy tạp chất EHP cũng như một lượng lớn bào tử EHP nằm trong các chất giống như chất nhầy trong phân trắng (Hình 1D). Ngoài ra, cũng có nhiều vi khuẩn ưa bazơ, hình que xuất hiện (Hình 1E). Các bào tử EHP không được tìm thấy trong các mẫu phân được thu thập từ các ao không có WFS được xác định bằng mô học và ISH (Hình 1G và H). Ngoài ra, bằng mô học và ISH, chúng tôi không tìm thấy EHP trong các mẫu phân bình thường của tôm nhiễm EHP được bảo quản trong phòng thí nghiệm; những mẫu phân này dương tính với EHP PCR tương tự như mô tả trong Tang và cộng sự (2015).
Trong quá trình chuẩn bị mô học của các mẫu phân, chúng tôi nhận thấy rằng phân trắng dễ cắt hơn so với phân bình thường. Điều này là do phân trắng không phải là phân thật (chứa thức ăn tôm không được tiêu hóa tốt). Thay vào đó, nó bao gồm các bào tử EHP, chất nhầy ruột và tế bào biểu mô ống hoại tử.
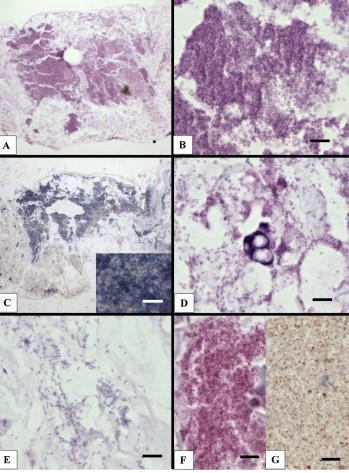
Hình 1. Mô học H&E (Mayer-Bennet haematoxylin và eosin-phloxine) và Enterocytozoon hepatopenaei (EHP) lai tại chỗ các của các mẫu phân Penaeus vannamei. (A) Nhuộm H&E các mẫu phân trắng được thu thập từ ao bị ảnh hưởng bởi hội chứng phân trắng, (B) dưới độ phóng đại cao hơn; (C) lai tại chỗ của phần liên tiếp với đầu dò EHP được đánh dấu digoxigen, sự hiện diện của kết tủa màu xanh đậm cho thấy sự hiện diện của EHP; (D) nhuộm H&E của ống gan tụy thoái hóa và bào tử trưởng thành, (E) nhuộm H&E của vi khuẩn hình que; (F) nhuộm H&E các mẫu phân từ tôm khỏe mạnh, (G) EHP lai tại chỗ của các mẫu phân từ tôm khỏe mạnh (một phần liên tiếp). Thanh tỷ lệ = 25 µm. (Để giải thích các tham chiếu đến màu sắc trong chú giải hình này, người đọc được tham khảo phiên bản web của bài viết này.)
3.3 Gan tụy và ruột giữa của tôm: Mô học và EHP ISH
Các mẫu bệnh gan tụy từ các ao nuôi WFS đã được kiểm tra EHP bằng mô học, kết quả cho thấy sự hiện diện của các thể bạch cầu ái kiềm trong tất cả 30 mẫu (20 con tôm từ ao WFS số 1, 10 con từ ao WFS số 3) được kiểm tra. Các tế bào biểu mô của ống gan tụy được mở rộng, có lẽ chứa đầy một số lượng lớn bào tử EHP, và tách ra khỏi màng đáy (Hình 2A, một mẫu đại diện cho thấy nhiễm trùng nặng). Các tế bào bị nhiễm bệnh vỡ ra và thải các bào tử trưởng thành đến lumen (Hình 2B, lai tại chỗ Hình S1). Chúng tôi đã thực hiện EHP ISH với 20 con tôm gan tụy từ ao WFS số 1, kết quả cho thấy tất cả 20 trong số đó đều dương tính. Đầu dò phản ứng mạnh mẽ với các thể ưa bazơ trong tế bào chất (Hình 2C), kết tủa màu xanh tím từ ISH tương ứng với các thể chất được quan sát thấy bằng kiểm tra mô học H&E. Ngoài ra, tất cả 20 con tôm đều bị bệnh hoại tử gan tụy do nhiễm trùng (SHPN), nơi mà một số lượng lớn vi khuẩn hình que được tìm thấy trong lòng ống bị viêm. Các tổn thương viêm khu trú đã xuất hiện, lõi của các tổn thương này bao gồm các tế bào bị nhiễm EHP (dương tính với ISH, Hình. S2) và chúng được bao quanh bởi các tế bào máu (Hình 2D). Các mẫu từ ao WFS số 3 bị nhiễm EHP ít nghiêm trọng hơn và cứ 10 con tôm thì có 4 con bị ảnh hưởng bởi SHPN. EHP cũng được phát hiện trong các tế bào biểu mô giữa từ một mẫu từ ao WFS số 3 bằng mô học và ISH (Hình 2E và F). Điều này là bất thường vì EHP được biết là chỉ lây nhiễm cho gan tụy.
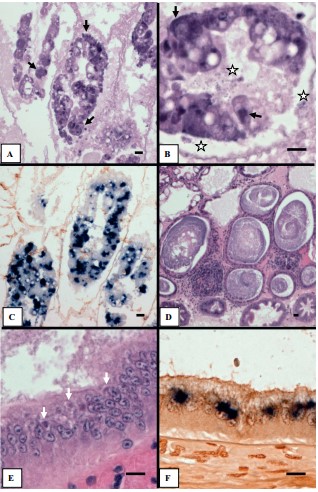
Hình 2. Mô học H&E và EHP lai tạo tại chỗ của các mẫu gan tụy được thu thập từ tôm thẻ chân trắng P. Vannamei có biểu hiện hội chứng phân trắng. (A) Nhuộm H&E của mô gan tụy, (B) dưới độ phóng đại cao hơn. Mũi tên chỉ các thể vùi, các ngôi sao chỉ các bào tử trưởng thành; (C) lai tạo tại chỗ phần liên tiếp với đầu dò EHP được đánh dấu digoxigen; (D) Nhuộm H&E của gan tụy có biểu hiện hoại tử gan tụy nhiễm trùng (SHPN), mảng bám vi khuẩn basophilic cư trú trong lòng của các ống hoại tử, bị viêm, ống; (E) nhuộm H&E của các tế bào biểu mô giữa cho thấy có EHP, (F) lai tạo tại chỗ với đầu dò EHP đến phần liên tiếp. Thanh tỷ lệ = 25 µm.
3.4 EHP PCR
PCR được thực hiện với DNA được chiết xuất từ các mẫu phân và gan tụy được thu thập từ trang trại số 1 và số 2, từ mỗi ao (ao WFS và không có WFS), 5-10 tuyến gan tụy tôm được gộp lại thành một mẫu. Kết quả cho thấy EHP được phát hiện trong phân trắng và gan tụy của tôm, không được phát hiện trong các mẫu từ các ao nuôi khỏe mạnh, không có WFS (Hình 3A, trang trại số 1). Từ ao WFS số 3 (trang trại số 3), EHP đã được phát hiện trong tất cả 18 cá thể gan tụy, một mẫu ruột sau và mẫu phân trắng (Hình 3B).
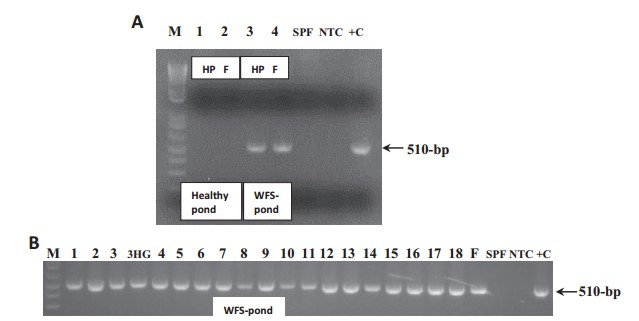
Hình 3. Phát hiện PCR EHP trong các mẫu gan tụy và phân. (A) PCR phân tích gan tụy (làn 1) và mẫu phân (làn 2) từ một ao khỏe mạnh, không WFS. Gan tụy (làn 3) và mẫu phân (làn 4) được thu thập từ ao WFS. (B) Phân tích PCR của 18 cá thể gan tụy, một chân sau (HG, từ tôm số 3), và một mẫu phân (F) được thu thập từ một ao WFS. M: 1 kb cộng với điểm đánh dấu trọng lượng phân tử bậc thang; HP: gan tụy; F: mẫu phân; SPF: DNA từ P. vannamei không có mầm bệnh cụ thể (SPF); NTC: kiểm soát không theo mẫu; +C: kiểm soát tích cực.
3.4.1 Thử nghiệm sinh học cho ăn
Để xác định xem EHP có thể truyền sang tôm thẻ chân trắng khỏe mạnh bằng cách ăn qua đường miệng hay không, tôm không có mầm bệnh cụ thể (SPF) đã được cho ăn bằng mô bị nhiễm EHP băm nhỏ trong 2 ngày và sau đó duy trì theo khẩu phần thức ăn viên thêm 22 ngày. Tôm được lấy mẫu tại nhiều thời điểm khác nhau, sau đó là phân tích PCR EHP. Kết quả cho thấy EHP không được phát hiện trong các mẫu được thu thập vào ngày thứ 5 và ngày thứ 10 sau khi cho ăn. EHP được phát hiện trong tôm được thu thập vào ngày thứ 15 và sau đó (Hình 4A). Thử thách EHP không gây ra bất kỳ tỷ lệ chết nào ở những con tôm này. Phân tích mô học cho thấy 3 con tôm được thu thập vào ngày thứ 24 đã bị nhiễm EHP, khi các thể bao ưa bazơ và bào tử trưởng thành được tìm thấy trong mô gan tụy của chúng (dữ liệu không được hiển thị).
3.5 Thử nghiệm sinh học sống chung
Trong qua trình kiểm tra sinh học kéo dài 90 ngày, chúng tôi đã nuôi chung một nhóm tôm SPF với một nhóm tôm bị nhiễm EHP để xác định xem EHP có lây truyền sang tôm khỏe mạnh hay không. Các mẫu tôm và phân từ nhóm SPF được thu thập vào các ngày 35, 42 và 90 sau khi hai nhóm này sống chung. Các mẫu này đã được phân tích PCR và kết quả cho thấy EHP được phát hiện trong cả mẫu gan tụy của tôm SPF và phân được lấy mẫu vào ngày 35 và kể từ ngày đó trở đi (Hình 4B).
3.6 Điều trị bằng Fumagillin-B
Để xác định xem Fumagillin, một hóa chất được sử dụng để kiểm soát nhiễm ký sinh trùng Nosema sp. ở ong mật, có thể sử dụng để điều trị EHP hay không, chúng tôi đã áp dụng Fumagillin-B trong tôm thẻ chân trắng P. vannamei bị nhiễm EHP trong một tháng, sau đó lấy mẫu để phân tích PCR. Kết quả cho thấy mức độ EHP không giảm ở tôm đã qua xử lý Fumagillin-B so với các nhóm đối chứng (Hình 4C). Ngược lại, mức độ nhiễm trùng dường như tăng lên ở các nhóm có xử lý bằng Fumagillin-B dựa trên cường độ băng tần mạnh hơn như trên hình.
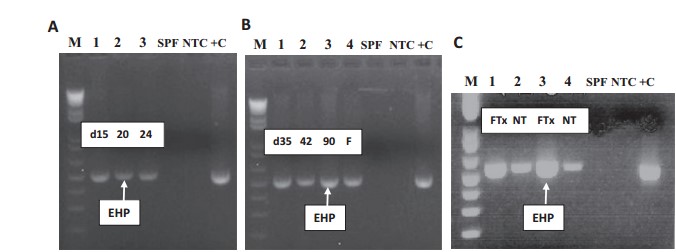
Hình 4. Phát hiện PCR EHP trong các mẫu gan tụy do nhiễm trùng trong phòng thí nghiệm. (A) Mỗi lần cho ăn, làn 1-3 đại diện cho các ngày 15, 20 và 24 sau khi cho ăn bằng gan tụy nhiễm EHP. (B) Thử nghiệm sinh học sống chung, các làn 1-3 đại diện cho các ngày 35, 42 và 90 sau khi tôm không có mầm bệnh cụ thể sống chung với tôm bị nhiễm EHP, làn 4: mẫu phân (F) được thu thập vào ngày thứ 35. (C) Xử lý Fumagillin-B, làn 1 và 3: Tôm nhiễm EHP được cho ăn thức ăn cho tôm trộn Fumagillin-B (FTX: đã được xử lý bằng Fumagillin), làn 2 và 4: Tôm nhiễm EHP được cho ăn thức ăn cho tôm Rangen 35% (NT: không được xử lý). M: 1 kb cộng với điểm đánh dấu trọng lượng phân tử bậc thang; SPF: kiểm soát DNA tôm không có mầm bệnh cụ thể; NTC: kiểm soát không theo mẫu; +C: kiểm soát tích cực.
Kết luận
Hội chứng phân trắng đã gây ra thiệt hại kinh tế đáng kể cho người nuôi tôm, bởi vì các quần thể bị ảnh hưởng thể hiện tỷ lệ chuyển đổi thức ăn (FCR) tăng cao, chậm phát triển và kích thước rất khác nhau của từng con tôm khi thu hoạch. Chúng tôi đã thực hiện phân tích trực tiếp các mẫu phân trắng và thấy rằng chúng không phải là phân thật. Phân trắng, gần như hoàn toàn gồm lượng lớn bào tử EHP, chất nhầy đường ruột, tàn dư của các mô bị bong tróc từ ống gan tụy bị nhiễm EHP và vi khuẩn hình que (có thể là Vibrio spp.). Có thể hội chứng phân trắng là kết quả của nhiễm EHP nặng, EHP đã nhân lên nhanh chóng trong các tế bào biểu mô ống gan tụy, sau đó các tế bào biểu mô thoái hóa và số lượng lớn bào tử EHP được giải phóng vào phân.
Tất cả tôm được lấy mẫu từ các ao có hội chứng phân trắng đều có kết quả dương tính với EHP, cho thấy EHP có khả năng lây nhiễm cao. Các thử nghiệm sinh học cho ăn và sống chung cho thấy việc lây truyền EHP không yêu cầu sự tham gia của một vectơ như đã thấy trong một số loài microsporidia như Thelohania duorara (Roth và Iversen, 1971) hoặc Perezia sp. (dữ liệu chưa được công bố) gây bệnh tôm bông. Trong các ao, EHP có thể dễ dàng lây truyền giữa các cá thể thông qua việc chung sống và cũng như thông qua việc tôm khỏe mạnh ăn thịt những con đã chết hoặc ốm yếu. Kết quả nghiên cứu của chúng tôi phù hợp với báo cáo của Tangprasittipap và cộng sự (2013) rằng EHP có thể được truyền theo chiều ngang giữa những con tôm trong các ao nuôi.
EHP, vào thời điểm đó là một loài mới, không được đặt tên, lần đầu tiên được báo cáo trên tôm nuôi vào năm 2004 (Chayaburakul và cộng sự, 2004). Báo cáo ban đầu này liên quan đến sự lây nhiễm vào quần thể tôm sú Penaeus monodon được nuôi ở Thái Lan. Sau đó, ký sinh trùng này được đặt tên là EHP (Tourtip và cộng sự, 2009). Chúng tôi đã tìm thấy ký sinh trùng này trong tôm xanh P. stylirostris được nuôi ở Brunei trong năm 2006 (Tang và cộng sự, 2015). Vào thời điểm đó, các tác động của EHP phần lớn bị bỏ qua vì EHP không phải là mối đe dọa lớn đối với sản lượng tôm, mặc dù nó được cho là nguyên nhân làm giảm sự tăng trưởng của quần thể bị nhiễm bệnh. Gần đây, các trường hợp nhiễm EHP nghiêm trọng trong các trang trại nuôi tôm đã trở nên phổ biến và những trường hợp nhiễm trùng này đang dẫn đến thiệt hại kinh tế đáng kể cho người nuôi tôm. Những phát hiện của chúng tôi về số lượng lớn bào tử EHP trong ” phân trắng ” của các ao bị ảnh hưởng bởi WFS, không phải trong phân bình thường từ các ao không có WFS, cho thấy EHP có liên quan đến WFS. Có vẻ như EHP đã trở nên nguy hiểm hơn trong 12 năm qua (2004 đến nay). Vì các bào tử có thể tồn tại trong môi trường và trong các ao nuôi tôm mật độ thả cao, các vật chủ có sẵn, các chủng độc lực có thể sẽ tăng lên vì sẽ không có áp lực chọn lọc chống lại độc lực gia tăng (Dunn và Smith, 2001). Ngoài ra, tôm thẻ chân trắng P. vannamei có thể là vật chủ mới của EHP, và nguồn tôm giống được cung cấp từ tôm bố mẹ sạch trong các trại giống, thay vì sinh sản của những con sống sót sau khi nhiễm EHP, dẫn đến việc vật chủ không có cơ hội phát triển khả năng đề kháng ký sinh trùng này.
EHP là một ký sinh trùng đường ruột. Microsporidia, loại ký sinh trùng nội bào, liên quan đến nấm, chúng lây nhiễm nhiều loại động vật có xương sống và động vật không xương sống (Wittner và Weiss, 1999). Một tỷ lệ lớn các loài microsporidian lây nhiễm sang vật chủ dưới nước, chẳng hạn như động vật giáp xác và cá (Stentiford và cộng sự, 2013). Nguyên nhân của sự xuất hiện gần đây của EHP như một mầm bệnh đáng lo ngại trong ngành nuôi tôm toàn cầu vẫn chưa được biết, mặc dù bệnh nhiễm vi bào tử microsporidiosis, nói chung, thường liên quan đến căng thẳng môi trường hoặc ức chế miễn dịch quần thể liên quan đến giao phối cận huyết, rằng những yếu tố này có thể đã đóng một vai trò quan trọng (Doyle, 2016; Stentiford và cộng sự, 2015). Tuy nhiên, không chắc rằng một trong hai yếu tố này, đặc biệt là khi tôm chỉ có hệ thống miễn dịch thô sơ, đồng thời sẽ ảnh hưởng đến một số lượng lớn các cơ sở sản xuất trên phạm vi địa lý rộng và nhận được con post từ nhiều nguồn khác nhau. Một khả năng khác là những thay đổi di truyền cho phép các chủng ký sinh trùng mới không chỉ lây nhiễm tôm thẻ Penaeus vannamei mà còn hoạt động tốt trong các ao nuôi tôm, nơi có cả mật độ vật chủ cao và xác suất nhiễm trùng hàng loạt của các cá thể là cao.
WFS được báo cáo là có liên quan đến Veriform (ATM) giống như gregarines trên tôm thẻ chân trắng được nuôi ở Thái Lan (Sriurairatana và cộng sự, 2014). ATM không phải là một gregarine và chưa bao giờ được công nhận – theo Sriurairatana và cộng sự (2014). Mặc dù vậy, nghiên cứu của họ đã dẫn đến các cuộc thảo luận trong một số ấn phẩm liên quan đến sự liên kết giữa gregarines và WFS (ví dụ: Mastan, 2015; Chaweepack và cộng sự, 2015; Srinivas và cộng sự, 2017). Báo cáo (Sriurairatana và cộng sự), mặc dù không cung cấp dữ liệu về sự liên quan của gregarines, dường như đã thúc đẩy các nhà nghiên cứu bệnh tôm tìm kiếm gregarines ở tôm bị ảnh hưởng bởi WFS. Gregarines, và đặc biệt là Nematopsis spp., Cephalolobus spp. và Paraophioidina spp., đã được tìm thấy trong nhiều quần thể nuôi tôm He trên khắp thế giới trong một thời gian (Lightner, 1996), sự phá hoại của gregarines trong quần thể tôm nuôi chưa bao giờ được chứng minh là có bất kỳ mối liên hệ nào với WFS. Do đó, hoàn toàn không có bằng chứng về bất kỳ mối liên hệ nào của gregarines với WFS.
Cần phải phát triển các biện pháp kiểm soát để giải quyết các vấn đề WFS trong quần thể tôm nuôi. Fumagillin ức chế sự tái hấp thụ của bào tử microsporidia, vì vậy nó đã được sử dụng rộng rãi trong nuôi ong để kiểm soát Nosema sp. (Katznelson và Jamieson, 1952; Bailey, 1953). Tuy nhiên, dựa trên thử nghiệm sinh học tôm và phân tích PCR, nó được phát hiện là không hiệu quả trong việc ngăn chặn sự lây nhiễm EHP ở tôm. Một số người nuôi tôm đang áp dụng các phương pháp mà họ tự nghĩ ra. Ví dụ, chúng tôi đã tìm thấy thông qua các cuộc thảo luận với các nhà nuôi tôm địa phương, những người ở Indonesia, nông dân có hai chiến lược chính: (1) cố gắng giảm quần thể Vibrio spp. trong ao thông qua việc bổ sung thường xuyên các chế phẩm sinh học như Bacillus spp. hoặc Lactobacillus spp. vào nước; và (2) cố gắng giảm mầm bệnh trong hệ tiêu hóa tôm thông qua việc sử dụng các chất phụ gia thức ăn chăn nuôi. Các chất phụ gia thức ăn đang được thử bao gồm: tỏi, ở dạng bột tươi hoặc bột chế biến (thức ăn 10–30 g / kg thức ăn); Allicin (một thành phần hoạt chất chính của tỏi); vitamin C (2 g/kg thức ăn); và thuốc kháng sinh, chẳng hạn như metronidazole. Chúng tôi khuyến nghị nên loại bỏ phân trắng từ các ao nuôi tôm bị ảnh hưởng, phân trắng chứa một lượng lớn EHP và vì chúng có thể bị phân hủy và chìm xuống đáy ao. Tôm có thể ăn phải EHP, dẫn đến tái nhiễm và cuối cùng sẽ làm tăng mức độ nghiêm trọng của nhiễm trùng.
Theo Kathy F.J. Tang , Jee Eun Han , Luis Fernando Aranguren , Brenda White-Noble ,Margeaux M. Schmidt , Patharapol Piamsomboon , Eris Risdiana , Bambang Hanggono.
Biên dịch: Nguyễn Thị Quyên – Tôm giống gia hóa Bình Minh
Từ khóa: Bệnh tôm, Enterocytozoon hepatopenaei (EHP), Hội chứng phân trắng, Lai giống tại chỗ ISH, PCR
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Phần 1 – BIỂU HIỆN LÂM SÀNG CỦA HỘI CHỨNG PHÂN TRẮNG White feces syndrome (WFS) VÀ MỐI LIÊN QUAN CỦA NÓ VỚI VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) TRONG CÁC TRANG TRẠI NUÔI TÔM THẺ CHÂN TRẮNG THƯƠNG PHẨM: MỘT CUỘC ĐIỀU TRA BỆNH HỌC
- Phần 2 – BIỂU HIỆN LÂM SÀNG CỦA HỘI CHỨNG PHÂN TRẮNG White feces syndrome (WFS) VÀ MỐI LIÊN QUAN CỦA NÓ VỚI VI BÀO TỬ TRÙNG Enterocytozoon hepatopenaei (EHP) TRONG CÁC TRANG TRẠI NUÔI TÔM THẺ CHÂN TRẮNG THƯƠNG PHẨM: MỘT CUỘC ĐIỀU TRA BỆNH HỌC
- Cập Nhật Về Bệnh Do Vi Khuẩn Vibrio – Vi Khuẩn Chính Mà Người Nuôi Tôm Phải Đối Mặt

 English
English 中文 (中国)
中文 (中国)