Tóm tắt
Dịch bệnh là một vấn đề nan giải chính trong lĩnh vực sản xuất tôm trên toàn cầu. Vi bào tử trùng (microsporidian) Enterocytozoon hepatopenaei (EHP) được chính thức xác định vào năm 2009 như một bệnh lây nhiễm hiếm gặp ở tôm sú Penaeus monodon. Nó vẫn tương đối ổn định cho đến giữa năm 2010, sau đó sự lây nhiễm EHP ngày càng trở nên phổ biến ở tôm thẻ chân trắng Thái Bình Dương Penaeus vannamei – loài tôm phổ biến nhất loài được nuôi ở Châu Á. EHP lây nhiễm vào gan tụy của vật chủ, gây ra bệnh vi bào tử trùng (microsporidiosis) ở gan tụy (HPM), một tình trạng có liên quan đến sự tăng trưởng chậm của vật chủ trong môi trường nuôi trồng thủy sản. Không giống những tác nhân gây bệnh lây nhiễm gây thiệt hại kinh tế trong nuôi tôm toàn cầu, EHP đem đến nhiều thách thức hơn vì vẫn còn rất ít thông tin về các môi trường sinh sống và các phương thức lây truyền của nó trong quá trình quy trình sản xuất tôm công nghiệp.
Đánh giá này tóm tắt kiến thức hiện tại của chúng tôi về vòng đời của EHP và các con đường mà nó sử dụng như một dạng ký sinh nội bào bắt buộc. Bài viết này cũng cung cấp một phân tích về các phương pháp hiện có và phương pháp mới để chẩn đoán vì hầu hết các tài liệu hiện tại về EHP đều tập trung vào chủ đề đó. Chúng tôi tóm tắt kiến thức hiện tại về lây nhiễm EHP, các phương thức lây truyền và những khuyến cáo hiện nay, các biện pháp kiểm soát thực tế đang được áp dụng để hạn chế tác động tiêu cực của nó đối với việc nuôi tôm. Chúng tôi cũng chỉ tìm ra những lỗ hổng kiến thức lớn cần nhanh chóng được giải quyết để cải thiện các biện pháp kiểm soát loại vi bào tử này.
Từ khóa: Enterocytozoon hepatopenaei, EHP, Vi bào tử trùng, Tôm, Nhiễm vi bào tử trùng.
1/ Giới thiệu
1.1 Lịch sử bệnh
Bệnh vi bào tử trùng (HPM) là một bệnh ảnh hưởng lên gan tụy của ba loài tôm He nuôi [gồm P. monodon, P. vannamei (Thitamadee và cộng sự, 2016) và P. stylirostris (Tang và cộng sự, 2015 )] và một loài nghi ngờ (P. japonicus). Căn bệnh này do nhiễm Enterocytozoon hepatopenaei (EHP), một mầm bệnh vi bào tử được báo cáo lần đầu tiên trên gan tụy (HP) của cả tôm sú (P. monodon) bình thường và chậm phát triển ở Thái Lan năm 2004 (Chayaburakul và cộng sự, 2004). Sau đó nó được chính thức mô tả là EHP vào năm 2009 dựa trên dữ liệu mô học, cấu trúc siêu vi và phát sinh loài (Tourtip và cộng sự, 2009). Cấu trúc siêu vi bào tử (Hình 1) của loài ký sinh trùng này cũng giống với một loại vi khuẩn HP không đặc trưng khác được báo cáo trước đây trên P. monodon ở Malaysia vào năm 1989 (Anderson và cộng sự, 1989) và từ PL của P. japonicus ở Úc năm 2001 (Hudson và cộng sự, 2001). Những nghiên cứu ban đầu này chỉ ra khả năng lây nhiễm (hiện đã biết) với vi bào tử giống loài EHP ở một số loài tôm He, dẫn đến đề xuất (Thitamadee và cộng sự, 2016) rằng các vi bào tử gần giống loài EHP là loài đặc hữu trong khu vực Châu Úc Thái Bình Dương trước khi mở rộng việc nuôi tôm trong những năm 1990.
1.2 Ảnh hưởng của EHP lên nuôi tôm
Mặc dù quan sát thấy tỷ lệ và cường độ nhiễm EHP thấp trong các mô tả ban đầu (Tourtip và cộng sự, 2009), HPM do EHP gây ra hiện đã đạt đến mức độ trở thành đại dịch ở tôm He châu Á. Trong khi được coi là mối quan tâm tối thiểu trên P. monodon so với các mầm bệnh phổ biến khác trên tôm trong giai đoạn những năm 1990 và đầu những năm 2000 (Flegel, 2012), sự thành công trong việc nuôi được mật độ cao hơn ở tôm thẻ chân trắng sau khi được nuôi phổ biến ở Châu Á từ khoảng năm 2002 trở đi có thể đã tạo ra một điều kiện dẫn đến sự xuất hiện của EHP như một tác nhân gây bệnh đáng kể (Thitamadee và cộng sự, 2016). Sau đó, xu hướng EHP làm chậm tăng trưởng được chứng minh khi phân tích PCR định lượng các trường hợp nhiễm EHP ở P. Vannamei. Kết quả cho thấy sự hiện diện hơn 1 × 103 bản sao EHP trên mỗi ng tổng số chiết xuất HP-DNA có tương quan với tình trạng rối loạn tăng trưởng tăng dần (Liu và cộng sự, 2016; Rajendran và cộng sự, 2016). Sự chậm phát triển được chỉ ra dựa trên hiệu suất ao kém, bao gồm mức tăng trưởng trung bình hằng ngày (ADG) giảm và trọng lượng cơ thể trung bình (ABW) kèm kích cỡ biến thiên cao, tức là hệ số% phương sai cao (% CV). Hơn nữa, nó còn thường xuyên được báo cáo rằng nhiễm EHP có thể liên quan đến hội chứng phân trắng (WFS) ở tôm thẻ chân trắng nuôi (Ha và cộng sự, 2010). Tuy nhiên, một báo cáo sau đó chỉ ra rằng đây có thể là gián tiếp thay vì liên quan trực tiếp (xem Phần 3) (Tangprasittipap và cộng sự, 2013).
Bằng chứng đầu tiên cho thấy tỷ lệ nhiễm EHP cao trong canh tác P. vannamei đến từ một nghiên cứu toàn diện về 196 ao canh tác ở Thái Lan. Nó được thực hiện trong giai đoạn 2013–2014 để xác định các yếu tố nguy cơ liên quan đến một tình trạng khác được gọi là hội chứng chết sớm (EMS) (Sanguanrut và cộng sự, 2018). Là một phần của cuộc khảo sát này, tôm HP cũng được kiểm tra sự hiện diện của EHP bằng PCR, cho thấy 60% số ao trong toàn bộ nghiên cứu dương tính với EHP bất kể tình trạng nhiễm EMS của chúng như thế nào.
Kết quả này dẫn đến một sự leo thang về tầm quan trọng của EHP được nhận thức như một mối đe dọa đối với toàn cầu ngành nuôi tôm, bao gồm cả việc đăng cảnh báo về khả năng lây lan của EHP bởi Mạng lưới các Trung tâm Nuôi trồng Thủy sản ở Châu Á Thái Bình Dương (NACA, https://enaca.org/) vào năm 2015. Điều này xảy ra trước khi công bố chính thức kết quả nghiên cứu thuần tập năm 2018 (Sritunyalucksana và cộng sự, 2015). Trong nghiên cứu thuần tập, hầu hết các mẫu đều dương tính với EHP thông qua phản ứng nested PCR chứ không phải PCR 1 bước và việc lấy mẫu được thực hiện sau 35 ngày nuôi mà không theo dõi, vì vậy bất kỳ ảnh hưởng nào đến sự chậm phát triển đều không được xác định.
Tuy nhiên, theo kinh nghiệm thực tế, sự chậm lớn bởi EHP thường không được nhìn thấy rõ ràng cho đến khi bước sang tháng thứ 2 trong ao nuôi, ngay cả trong ao được thả tôm giống có kết quả PCR dương tính. Điều này có thể là do giai đoạn Lag trong tốc độ lây nhiễm theo hàm mũ ở các giai đoạn tôm rất nhỏ và do thời gian cần để từ mức độ nghiêm trọng chung trở thành mức độ gây ra sự phát triển chậm. Việc công bố những kết quả này nhấn mạnh sự xuất hiện nhanh chóng của EHP kể từ khi được mô tả chính thức vào năm 2009 (Tourtip và cộng sự, 2009).
2/ Sinh thái học của EHP.
2.1 Nguyên tắc phân loại và phân bố địa lý.
EHP thuộc Họ Enterocytozoonidae, Ngành Microsporidia, bao gồm các ký sinh trùng đơn bào, dạng bào tử trêm động vật, kể cả người, côn trùng và động vật giáp xác (Vavra và Lukes, 2013). Ít nhất một nửa sự đa dạng về sự có mặt của Microsporidia trên các vật chủ dưới nước đã được biết đến (Stentiford và cộng sự, 2013b), với những loài lây nhiễm trên động vật giáp xác, đôi khi lây nhiễm trên cá như một vật chủ thay thế [ví dụ: Agmasoma penaei, nguyên nhân gây ra bệnh tôm bông (Laisutisan và cộng sự, 2009; Pasharawipas và Flegel, 1994)]. Họ của loài này có quan hệ gần với Họ nguyên sinh Cryptomycota (chứa loài Rozella), phân tách như một nhánh bên dưới vương quốc Mycota hoặc Fungi (James và cộng sự, 2013; Stentiford và cộng sự, 2019). Họ Microsporidia đôi khi được bao gồm với các loại nấm trong một nhóm lớn hơn được gọi là Holomycota (Liu và cộng sự, 2009; Sebe-Pedros và Ruiz-Trillo, Năm 2017; Torruella và cộng sự, 2015).
Kể từ khi có mô tả chính thức về E. hepatopenaei vào năm 2009, sự hiểu biết của chúng tôi về vi bào tử nhóm Enterocytozoon (EGM) đã mở rộng nhanh chóng và nhóm này có chứa ký sinh trùng từ một số chi khác nhau (bao gồm Enterospora, Nucleospora, Desmozoon, Obruspora và Hepatospora). Chúng ảnh hưởng đến nhiều loài động vật chủ không xương sống và có xương sống, bao gồm cả con người và sống trong các quần xã sinh vật đa dạng (Stentiford và cộng sự, 2019). Các chi có quan hệ gần (ảnh hưởng đến vật chủ giáp xác nhưng không thể hiện các tính năng phát triển đặc trưng của EGM) cũng được phân loại gần với nhánh EGM [ví dụ: Parahepatospora, (Bojko và cộng sự, 2017)]. Với lượng kiến thức về sự đa dạng và phạm vi vật chủ ngày càng tăng, nhu cầu áp dụng cẩn thận và phù hợp các công cụ phân loại nhằm xác định sự hiện diện của mầm bệnh trong một bối cảnh cụ thể (Stentiford và cộng sự, 2014) cũng tăng theo. Trong trường hợp EHP (và nói chung là Microsporidia), hiện đã công nhận rằng các phương pháp như PCR dựa trên SSU và giải trình tự amplicon có độ phân giải hạn chế để xác định loài. Vì vậy, cần phải áp dụng các công cụ thích hợp để xác định phạm vi địa lý và vật chủ của bất kỳ loài cụ thể nào.
Với ý nghĩa này, tại thời điểm viết bài, chúng tôi nhìn nhận rằng EHP đã được xác nhận ở Thái Lan (Tourtip và cộng sự, 2009), Ấn Độ (Rajendran và cộng sự, 2016), Việt Nam (Ha và cộng sự, 2010; Tang và cộng sự, 2015), Brunei (Tang và cộng sự, 2015), Indonesia (Tang và cộng sự, 2016) và Trung Quốc (Liu và cộng sự, 2018). Ngược lại, một báo cáo rằng EHP được tìm thấy trong gan tụy của P. vannamei được nuôi ở Venezuela (Tang và cộng sự, 2017) là vẫn đang là một vấn đề đáng ngờ. Sự tương đồng thấp về trình tự gen của β-tubulin (93%) và các gene chứa protein vách bào tử (91%) của EHP từ Thái Lan (Tourtip và cộng sự, 2009; Wiredu Boakye và cộng sự, 2017) cho thấy có thể họ đã phát hiện ra một loài (không xác định) trong nhóm EGM. Những nghiên cứu thêm về các đặc điểm dòng phân lập Mỹ Latinh này được đề xuất.
2.2 Chu kì sống so với những loài vi bào tử trùng khác.
Vòng đời của các vi bào tử trùng có thể đơn giản hoặc rất phức tạp. Các giai đoạn sống có thể liên quan đến một, hai hoặc nhiều loài vật chủ khác nhau. Vì vậy, một bản tóm tắt tổng thể của tất cả các biến thể có thể có là không khả thi trong việc đánh giá cụ thể về EHP. Người quan tâm có thể tham khảo các đánh giá gần đây và xem chúng như một sự mở đầu cho những bài viết sau này (Cali và cộng sự, 2017; Vavra ´ và Lukeˇs, 2013). Sau đây, chúng tôi sẽ đưa ra thông tin chi tiết về các giai đoạn sống cụ thể của EHP hiện được biết đến, với một số nhận xét về việc chúng có thể giống nhau hoặc khác với của các microsporidians khác như thế nào. Mục đích chính là cho biết rằng chúng tôi vẫn có thông tin tương đối sơ bộ về sự phát triển và lây nhiễm của EHP.
Giống như tất cả các microsporidians khác, EHP có các pha: bào tử ngoại bào, lây nhiễm (trưởng thành) và nhiều giai đoạn sống nội bào (Hình 2) (Han và Weiss, 2017; Vavra và Luke, 2013).
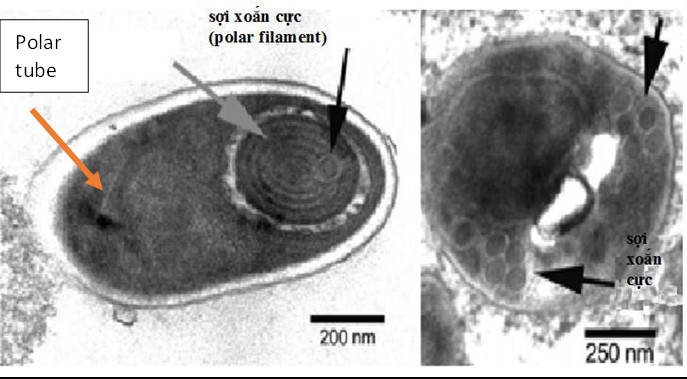
Hình 1. Hình ảnh của bào tử EHP trên kính hiển vi điện tử theo mặt cắt ngang và dọc cho thấy vòi phân cực với 5-6 vòng xoắn.
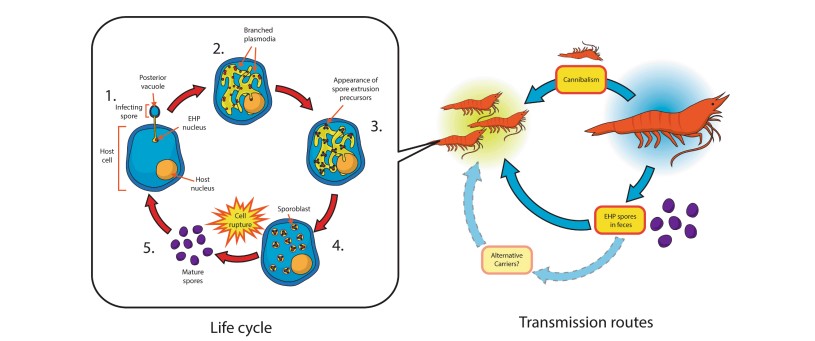
Hình 2. Hình vẽ mô tả chu kì sống và những phương thức truyền nhiễm của EHP. Các giai đoạn trong chu kì sống bao gồm: (1) Bào tử nảy mầm, khi đó vòi phân cực của bào tử chọc thủng màng tế bào vật chủ và chuyển bào chất của nó vào tế bào chất của vật chủ. (2) Tế bào chất trải qua quá trình phân chia nhân để tạo ra một nhánh plasmodium. (3) Tiền chất đùn bào tử được hình thành trong plasmodium. (4) Plasmodium bị phân cắt tạo ra bào tử nguyên bào. (5) Tế bào chủ bị vỡ, phóng thích bào tử trưởng thành. Sự lây truyền EHP có thể xảy ra do phân và ăn thịt đồng loại. Các vật chủ thay thế cũng có thể đóng vai trò là vật mang EHP, nhưng điều này chưa được xác định bằng thực nghiệm. Đường truyền trên hình được tô màu nhạt hơn để thể hiện điều này.
Trong hầu hết tất cả các ký sinh trùng dạng vi bào tử trùng, sự lây nhiễm vào tế bào chủ được bắt đầu khi bào tử đẩy vòi phân cực (polar tube) của nó ra, làm thủng màng plasma của tế bào chủ đích và cho phép các thành phần của bào tử (chất nguyên sinh bào tử – sporoplasm) được đưa thẳng vào tế bào chất (cytoclasm) của tế bào vật chủ.
Ở đó, với màng plasma tiếp xúc trực tiếp với tế bào chất của tế bào chủ, chất nguyên sinh bào tử tăng trưởng thông qua tăng trưởng vật lý và phân chia hạt nhân (nguyên phân hoặc giai đoạn merigony tuần tự, theo cấp số nhân) dẫn đến tạo ra một plasmodium phân nhánh. Duy nhất đối với EGM, giai đoạn phát triển của bào tử (sporogony) liên quan đến sự hình thành của tiền chất đùn bào tử (spore extrusion precursor) {chẳng hạn như sợi xoắn cực (polar filament) và đĩa gắn vào sợi cực (anchoring disk)} trước khi có sự phân cắt của tế bào chất plasmodium thành các sporoblasts và sau đó thành bào tử trưởng thành, vẫn tiếp xúc trực tiếp với tế bào chất của vật chủ. Suốt trong quá trình này, các tế bào biểu mô HP bị nhiễm sưng lên và cuối cùng vỡ ra để giải phóng các bào tử trưởng thành, tạo điều kiện cho việc lây nhiễm chủ động vào các tế bào HP khác, hoặc các bào tử trưởng thành phát tán ra môi trường thông qua phân, và sau đó ảnh hưởng đến những con tôm bình thường khác (Tourtip và cộng sự, 2009).
Vòng đời có vẻ đơn giản, trực tiếp này tương tự như vòng đời của một số các vi bào tử trùng khác. Tuy nhiên, nó trái ngược với chu kì sống phức tạp hơn của nhiều loài (Vavra ´ và Lukeˇs, 2013). Chúng có nhiều giai đoạn hơn. Mỗi giai đoạn tạo ra các dạng bào tử khác nhau trên vật chủ thay thế – các vật chủ thay thế này thường từ các phyla khác nhau. Trong một số trường hợp, bào tử giống nhau về mặt hình thái khi quan sát bằng kính hiển vi, nhưng lại khác nhau về chức năng, một loại lây nhiễm cho cùng một vật chủ (tức là, lây truyền theo phương ngang) trong khi loại khác chỉ lây nhiễm cho vật chủ thay thế (tức là chuyển vật chủ) (Stentiford và cộng sự, 2013a, 2013b). Các chu kỳ phức tạp có thể bao gồm sự chuyển tiếp giữa các giai đoạn sống chứa haploid – đơn bội (sinh vật đơn nhân-monokaryotic) và diplokaryotic nuclei – nhân lưỡng tính (tức là, các hạt nhân bao gồm hai nhân đơn bội mà màng nhân của chúng vẫn áp chặt vào nhau, Hình S1). Ở một số loài, nhân lưỡng bội có thể hợp nhất thành một nhân lưỡng bội cổ điển thông qua quá trình giảm phân (meiosis) để tạo ra 4 nhân đơn bội (Flegel và Pasharawipas, 1995).
Mặc dù bằng chứng hiện tại cho thấy rằng EHP có một vòng đời tương đối đơn giản (trực tiếp) với chỉ một loại bào tử lây truyền theo phương ngang giữa một số loài tôm He nhất định (Hình 2) (Tourtip và cộng sự, 2009), nhưng cũng không thể loại trừ khả năng tạo ra bào tử khác biệt về mặt sinh lý lây nhiễm cho các loài vật chủ thay thế.
Đây là đặc biệt quan trọng vì polychaetes, artemia, nhuyễn thể, mực, và các động vật khác được sử dụng làm thức ăn tươi sống cho tôm đã được báo cáo là có kết quả PCR dương tính với EHP và có khả năng gây ra HPM khi cho tôm ăn (Desrina và cộng sự, 2020; Karthikeyan và Sudhakaran, 2020; Kummari và cộng sự, 2018; Tang và cộng sự, 2015). Tuy nhiên, chỉ riêng kết quả PCR không đủ để kết luận liệu chúng là vật chủ thay thế hay chỉ là vật mang. Nếu chúng là các vật chủ thay thế, vòng đời của EHP sẽ phức tạp hơn theo hiểu biết hiện tại. Trong việc kiểm soát EHP, cần phải xác định khẩn cấp các động vật có vai trò là ổ chứa mầm bệnh tự nhiên lây truyền sang tôm, đặc biệt là trong ao nuôi trồng. Do đó, việc tìm kiếm các nguồn chứa của EHP nên được thực hiện với những khả năng này.
2.3 Bào tử
EHP tạo ra bào tử đơn nhân, hình bầu dục (1,1 ± 0,2 µm × 0,6 ± 0,2 µm) với 5–6 cuộn sợi xoắn cực ở một đầu và đĩa gắn vào đầu khác, như trong Hình 1 (Tourtip và cộng sự, 2009).
Tương ứng với kết quả PCR dương tính, các bào tử EHP đã được tìm thấy trong các mẫu phân tôm (Jaroenlak và cộng sự, 2016; Tang và cs., 2016), trong các phần mô học của tế bào chất của R (reserve), B (blister) và các tế bào F của HP và đôi khi trong các tế bào biểu mô của ruột giữa (midgut), trong khi các tế bào E (tế bào phôi- embryonic cells) ở xa khu vực trung tâm của HP hầu hết không bị nhiễm.
Giống như các vi bào tử trùng khác, bào tử của EHP được bao quanh bởi vách bào tử, lớp ngoài (exspore) dày 10 nm và lớp trong (endospore) dày 2 nm. Vách bào tử bảo vệ các thành phần bào tử khỏi các điều kiện khắc nghiệt, giúp chúng có khả năng chống chịu được với môi trường trong quá trình giải phóng/phát tán. Mặc dù đặc điểm này có lợi cho EHP, nhưng nó cũng trở thành một thách thức cho trang trại và quản lý chuỗi cung ứng trong ngành nuôi tôm khi chúng cần được loại bỏ hoặc bất hoạt tại vị trí lây nhiễm trước đó (Thitamadee và cộng sự, 2016).
Ngoài khả năng bảo vệ đặc biệt, vách bào tử còn chứa protein vách bào tử (SWP) đã được chứng minh là có liên quan đến quá trình gắn vào tế bào chủ (Chen và cộng sự, 2013; Jaroenlak và cộng sự, 2018; Li và cộng sự, 2009; Li và cộng sự, 2012; Peuvel-Fanget và cộng sự, 2006; Wang và cộng sự, Năm 2015; Wu và cộng sự, 2009; Yang và cộng sự, 2016, 2014a, 2014b). EhSWP1, protein thành bào tử EHP đầu tiên được báo cáo, được xác định bằng phân tích trình tự toàn bộ bộ gen từ EHP và đã được phân loại vào Nhóm SWP12 của protein vách bào tử microsporidian (Jaroenlak và cộng sự, 2016; Wiredu Boakye và cộng sự, 2017).
Phương pháp “Nhuộm” với kĩ thuật miễn dịch huỳnh quang (Immunofluorescence) và miễn dịch vàng (immunogold) trên kính hiển vi điện tử cho EhSWP1 ở cả hai lớp vách bào tử xác định nó là một protein vách bào tử. Phân tích trình tự của các thành viên trong nhóm SWP12 cho thấy rằng hầu hết các thành viên đã mã hóa miền Bin-amphiphysin-Rvs-2 (BAR2) và, ít nhất, một mô-típ liên kết với heparin (HBM). Loại thứ hai đã được cấy ghép trong phần đính kèm tế bào chủ đối với một số microsporidians và cho các ký sinh trùng nội bào, bao gồm Trypanosoma cruzi và Plasmodium falciparum (Kobayashi và cộng sự, 2010; Oliveira và cộng sự, 2012). EhSWP1 mang ba HBM trong miền đầu cuối N và một miền BAR2 trong C-terminus.
Thử nghiệm liên kết heparin trong ống nghiệm và thử nghiệm cạnh tranh được thực hiện trên EhSWP1 tự nhiên và đột biến đã xác nhận rằng những miền này có hoạt tính liên kết heparin thực sự (Jaroenlak và cộng sự, 2016). SWPs đã được đặc trưng rộng rãi cho các chi Nosema và Encephalitozoon. Protein nội bào tử Encephalitozoon cuniculi, EcEnP1 (Peuvel-Fanget và cộng sự, 2006) và protein vách bào tử Nosema bombycis 16 (NbSWP16) (Wang và cộng sự, 2015) đã được chứng minh là có liên quan đến việc kết dính vào các tế bào đích. Tuy nhiên, người ta không biết liệu có phải EhSWP1 tham gia trực tiếp vào quá trình như vậy là do không có sự lây nhiễm EHP trong tế bào gan tụy hay không.
Tuy nhiên, heparin đã được phân lập thành công từ vỏ đầu ngực của P. vannamei và các gen liên quan đến sinh tổng hợp glycosaminoglycan được thể hiện tích cực qua phân tích bộ phiên mã của gan tụy P. vannamei (Chen và công sự, 2015). Những phát hiện này dẫn đến khái niệm rằng EhSWP1 tạo điều kiện cho việc xâm nhập vào vật chủ bằng cách kết dính các bào tử với màng tế bào biểu mô gan tụy thông qua tương tác tĩnh điện giữa HBMs và heparin. Khi ở gần các tế bào gan tụy, các bào tử được cho là tiếp xúc với các yếu tố chưa được biết có thể kích hoạt đẩy vòi phân cực và cho phép EHP tiếp tục cuộc sống nội bào tiếp theo của nó. Trong khi điều kiện in vitro kích thích sự đẩy vòi phân cực đã được báo cáo và hiện đang được áp dụng trong các biện pháp kiểm soát EHP (Aldama-Cano và cộng sự, 2018), các yếu tố kích hoạt nội sinh nảy mầm và các cơ chế liên quan đến sự đẩy vòi phân cực vẫn khó nắm bắt.
2.4 Trao đổi chất
Điểm nổi bật của vi bào tử trùng là sự sắp xếp cực kỳ hợp lý của hệ gen và các bào quan. Phân tích so sánh bộ gen gần đây trên bộ gen 3,26- Mbp của EHP và những họ hàng của chúng trong họ Enterocytozoonidae cho thấy rằng, giống như các microsporidia khác, EHP không thể tạo ra ATP bằng quá trình đường phân (glycolysis) hoặc quá trình phosphoryl oxy hóa (hô hấp tế bào) (Wiredu Boakye và cộng sự, 2017; Stentiford và cộng sự. 2019). Trong số 10 enzym trong quá trình đường phân, EHP và E. bieneusi (thành viên khác duy nhất trong chi Enterocytozoon) chỉ sở hữu các gen hexokinase và glyceraldehyde 3-phosphate dehydrogenase nhưng thiếu hụt phosphofructokinase và pyruvate kinase, hai enzym đường phân có khả năng tạo ra ATP bằng cách phosphoryl hóa chất nền. Các enzym trong các con đường tạo ATP thay thế cũng đã được khảo sát và tìm thấy bị thiếu trong bộ gen của tất cả các loài trong họ Enterocytozoonidae. Xem xét mỗi bộ gen Enterocytozoonidae được so sánh, sự vắng mặt của những enzym này phản ánh sự mất mát thực sự trong quá trình tiến hóa, thay vì không lấy được các gen này trong quá trình giải trình tự.
Mặt khác, một số enzym tiêu thụ ATP được giữ lại. Chúng bao gồm một hexokinase có chức năng tiềm năng cũng như pyrimidine ATP và các con đường sinh tổng hợp purin. Người ta đã giả định rằng sự thiếu hụt khả năng tạo ATP đồng thời và sụ bảo toàn các tính năng tiêu thụ ATP có thể phục vụ cho việc thiết lập một “bồn chứa” ATP trong plasmodium. Nó “hút” ATP chủ thông qua các chất vận chuyển ATP / ADP trong bộ gen EHP, tương tự như một kết quả được báo cáo ở Chlamydiae (Trentmann và cộng sự, 2007). Mặc dù mô hình này có thể giải thích việc thu nhận ATP trong các giai đoạn nội bào, câu hỏi vẫn là làm thế nào bào tử EHP thu được ATP cần thiết cho quá trình nảy mầm của bào tử, khi thực sự được yêu cầu.
Điều tra so sánh bộ gen cũng cho thấy rằng glucose-6-phosphate dehydrogenase (G6PD) được bảo toàn trong họ Enterocytozoonidae. Nó chuyển đổi glucose-6-phosphate được tạo ra bởi hexokinase thành 6-phosphoglyconolate và trong quá trình này giải phóng chất khử tương đương, NADPH, có thể quét các gốc tự do có hại (ROS). Người ta đã phỏng đoán rằng việc bảo toàn G6PD có thể một phần là do sự bảo vệ mà nó cung cấp cho ký sinh trùng chống lại các tác động từ ROS mà vật chủ sử dụng như một cơ chế miễn dịch (Wiredu Boakye và cộng sự, 2017).
Ngược lại với EHP chỉ sở hữu một bản sao của hexokinase, các thành viên của họ Enterocytozoonidae sở hữu nhiều gen hexokinase đối với các isozyme dư thừa được tiết ra một cách có chủ đích vào cytosol của vật chủ để làm rối loạn chuyển hóa của vật chủ, có lợi cho sự phát triển của ký sinh trùng (Cuomo và cộng sự, 2012). Mặc dù thiếu các bản sao hexokinase bổ sung, EHP vẫn làm rối loạn sự trao đổi chất của vật chủ theo các cơ chế khác như được chỉ ra bởi các phân tích protein và chuyển hóa gần đây của HP được thu thập từ tôm nhiễm bệnh tự nhiên (Ning và cộng sự, 2019). Theo nghiên cứu, nhiều con đường sản xuất năng lượng đã được điều chỉnh và một số nguyên nhân liên quan đến khả năng miễn dịch của vật chủ tăng lên trong quá trình nhiễm bệnh của tôm, đặc biệt là ⍺2-macroglobulin (⍺2M), kích hoạt propnoloxidase enzyme (PPAE) và lysozyme. Người ta đề xuất rằng mức độ tăng cường của lysozyme có thể tạo điều kiện thuận lợi cho sự phân hủy chitin trong thành bào tử EHP. Mặt khác, một số nhánh miễn dịch của tôm đã bị ức chế, bao gồm ferritin và Rab11A. Trong khi cả hai dấu hiệu miễn dịch được điều chỉnh tăng và điều chỉnh giảm đều có liên quan đến việc tạo điều kiện cho hoặc ức chế sự lây nhiễm của mầm bệnh vi khuẩn và vi rút trên tôm, kết quả thử nghiệm là cần thiết để xác định xem chúng có thể ảnh hưởng như thế nào EHP.
Lý do chính khiến EHP là mối đe dọa đối với ngành tôm là khả năng làm chậm phát triển của tôm. Một phần, điều này có thể xảy ra bằng cách tạo ra một “bể chứa” ATP, nhưng các báo cáo về protein và chuyển hóa gợi ý rằng ít nhất hai cơ chế khác cũng có thể góp phần làm tăng trưởng kém (Ning và cộng sự, 2019). Một là sau khi nhiễm trùng, có sự gia tăng hormone methyl farnesoate (MF) do điều hòa axit farnesoic O-methyltransferase (FAMet), một chất enzyme chính trong con đường sinh tổng hợp hormone này. Điều này xảy ra bởi sự điều hòa giảm JHEC, loại enzyme phân hủy MF. Một cơ chế có thể khác là điều chỉnh ERP, điều này làm suy giảm ecdystreoid cần thiết để kích thích lọc sinh thái.
2.5 Phương thức lây truyền
Trong các ao nuôi tôm, EHP lây truyền theo chiều ngang khi bào tử được đào thải ra từ phân của tôm bị nhiễm bệnh hoặc do ăn thịt tôm bị nhiễm bệnh (tập tính ăn đồng loại) (Hình 2) (Tangprasittipap và cộng sự, 2013; Tang và cộng sự, 2016).
Sự lây truyền đã được chứng minh trong phòng thí nghiệm bằng cách sử dụng tôm bị nhiễm bệnh được ngăn cách bằng lồng lưới với những con tôm naive (Salachan và cộng sự, 2017). Cũng có thể cho nhiễm trùng hoàn toàn bằng cách sử dụng bào tử được tinh chế từ mô gan tụy bị nhiễm bệnh trong thử nghiệm cảm nhiễm bằng kĩ thuật reverse gavage (một dạng phương pháp cảm nhiễm để phân tích độc tố) và cho ăn (Aldama-Cano và cộng sự, chưa xuất bản).
Các cảm nhiễm đường miệng đã chứng minh rằng chỉ riêng các bào tử EHP là lây nhiễm qua đường ăn. Vì phương pháp reverse gavage được chấp nhận như một phương pháp cho phép HP của tôm tiếp xúc trực tiếp với vi khuẩn và độc tố (Sirikharin và cộng sự, 2015; Tran và cộng sự, 2013), nó đã chứng minh rằng bào tử được tạo ra trong HP (tương tự như vi khuẩn về mặt kích thước) có thể phát tán EHP từ bên trong đến các tế bào biểu mô ống HP không bị nhiễm (tự nhiễm – autoinfection).
Sự lây truyền theo chiều dọc đến PL cũng có thể đạt được bằng cách bổ sung mô nhiễm EHP đồng nhất vào nước nuôi (Karthikeyan và Sudha karan, 2019). Những kết quả này chỉ ra rằng EHP có thể lây lan nhanh chóng giữa các tôm bị nhiễm bệnh ở tất cả các giai đoạn sống qua bào tử hoặc do ăn thịt đồng loại. Như đã nêu trước (xem Phần 2.2), bể chứa hoặc chất mang cơ học cho EHP cũng có thể tồn tại, nhưng khả năng này chưa được xác nhận. Sự lây truyền EHP theo chiều dọc đã được đề xuất bởi Vu-Khac và cộng sự (2018), cho kết quả xét nghiệm PCR dương tính với EHP ở nauplii, zoeae 1 và zoeae 2 thu được từ tôm bố mẹ cái bị nhiễm EHP. Tuy nhiên, tuyên bố này không đi kèm với kiểm tra mô học rõ ràng. Giai đoạn của nauplii cũng không được báo cáo, làm cho nó có thể nhiễm trùng do ăn phải các bào tử thải ra trong phân từ động vật bố mẹ chứ không phải qua con đường truyền từ bố mẹ sang con.
Khả năng truyền theo chiều dọc của các vi bào tử trùng khác đã được báo cáo bởi chứng minh sự hiện diện của chúng trong mô tuyến sinh dục (Stentiford và cộng sự, 2013b). Tuy nhiên, kết quả thử nghiệm lai tại chỗ (ISH) với tôm giống và tôm bố mẹ bị nhiễm EHP đã cho thấy những tín hiệu khả quan đối với EHP trong mô HP nhưng không có trong buồng trứng hoặc tinh hoàn của cùng một mẫu vật, cho thấy việc lây truyền qua tuyến sinh dục khó xảy ra (Hình 3). Tuy nhiên, công việc này không được thực hiện một cách toàn diện bằng với số lượng mẫu lớn hơn và tất cả các giai đoạn sống nên không thể loại trừ khả năng lây truyền EHP theo chiều dọc tại giai đoạn này.
Tuy nhiên, thậm chí ngay cả khi không lây truyền dọc, tôm bố mẹ cái tôm bị nhiễm EHP vẫn có thể lây nhiễm theo chiều ngang sang con cái của chúng trong trại giống thông qua việc thải phân có chứa bào tử vào bể đẻ. Vì nauplii có thể bị nhiễm khi chúng bắt đầu ăn sinh vật phù du ở giai đoạn N6, việc rửa trứng hoặc nauplii giai đoạn đầu (N1-N5) với nước sạch trong trại giống có thể giúp giảm bớt sự lây nhiễm. Điều này đã thành công trong việc quản lý BMNV (Momoyama, 1992) và MBV (hiện nay được gọi là Penaeus monodon nudivirus hoặc PMNV; Yang và cộng sự, 2014a, 2014b; Chen và cộng sự, 1992). HP cũng được truyền sang N6 hoặc giai đoạn sau của ấu trùng qua phân của con cái đang đẻ trứng. Tất nhiên, nhiễm trùng trong trại giống cũng có thể phát sinh do không đạt được an toàn sinh học trong trại giống. Một số ấu trùng bị nhiễm trùng, chúng sẽ nhanh chóng truyền nhiễm trùng theo chiều ngang qua bào tử trong phân của chúng hoặc thông qua việc ăn thịt đồng loại.
Nhóm tác giả: Thawatchai Chaijarasphong a,b, Natthinee Munkongwongsiri c, Grant D. Stentiford d,e, Diva J. Aldama-Cano a,c, Kwanta Thansa c, Timothy W. Flegel a,f, Kallaya Sritunyalucksana c, Ornchuma Itsathitphaisarn a,g,*
Biên dịch: Thùy Linh – Công ty TNHH PTTS Bình Minh
“Tôm Giống Gia Hóa – Chìa Khóa Thành Công”
Xem thêm:
- Thực trạng nhiễm IHHNV trong ngành tôm ở Peru và Ecuador
- Quan hệ đối tác mới giữa AquaEasy và Grobest đem công nghệ AI về cho ngành tôm Việt Nam
- Gây nảy mầm nhân tạo bào tử Enterocytozoon hepatopenaei (EHP) bằng các ion thông qua kính hiển vi điện tử quét SEM.

 English
English 中文 (中国)
中文 (中国)